Az addikció idegélettani háttere
Contents
- Az addikció idegélettani háttere
- Addikció definíciója, jelentősége
- Az addikció szakaszai (1.ábra)
- Stressz szerepe, háttere
- Genetikai háttér
- Az addikció megnyilvánulási formái
- Az addikció kezelési lehetőségei
Addikció definíciója, jelentősége
Világszerte a különböző, az agyi jutalmazó rendszer működését befolyásoló „szerek” komoly, neurobiológiai alapokon nyugvó tünetegyüttest, az addikciót okozzák.
Az addikció krónikus neuropszichiátriai rendellenesség, mely absztinens és visszaeséses időszakok ciklikus váltakozásával jár. A beteg képessége csökken a sóvárgás-indukálta viselkedés gátlására (Torres-Berrio, 2018).
A World Drug Report 2017-es adatai szerint világszerte az emberek 3,4-6,6%-át érinti valamilyen függőség, és az éves halálesetek 0,4%-a köthető kannabisz, kokain, ópiátok és amfetamin használatához, melyek a legelterjedtebb addiktív drogok a világon.
Az USA területén a lakosság körében, mintegy 6% az aktív kábítószer fogyasztók aránya. Évente kb. 135 000 ember halála köthető a droghasználathoz és a krónikus alkohol fogyasztáshoz (Badiani és mtsai, 2018; Nechifor, 2011).
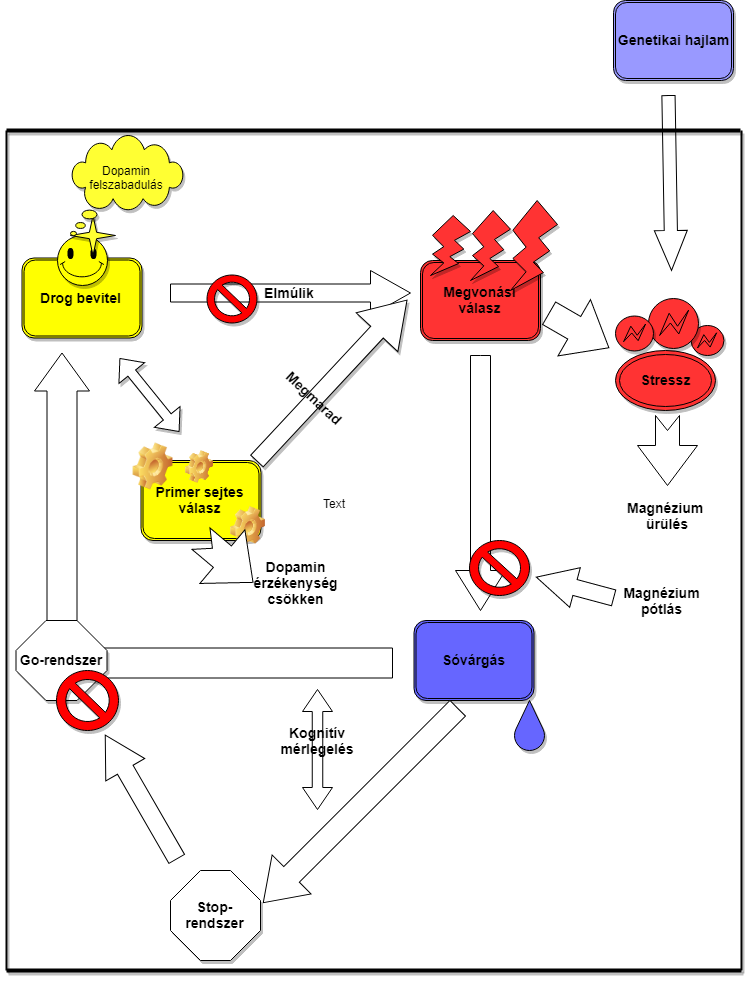
Az addikció szakaszai (1.ábra)
Az addikció neurobiológiai lefolyása három szakaszra bontható, melyek a szerhasználat, a megvonás és a belefeledkezés. Ez sóvárgással és újabb szerhasználattal jár, így addikciós ciklusról beszélhetünk. Idővel a függőség súlyosbodik, ennek oka, hogy tartós neuroplasztikus változások alakulnak ki, melyek az agy jutalmazási-, stressz-, és végrehajtó rendszerét érintik. A különböző szakaszok során eltérő folyamatok játszódnak le a központi idegrendszerben, a következőkben ezeket jellemezzük részletesebben (Koob és Volkow, 2016).
|
1. ábra: Addikcio szakaszai |
Szerhasználat
Hatás a jutalmazási rendszerre
A stria ventralisban dopamin és opioid peptidek szabadulnak fel. A nagy koncentráció aktiválja a kis affinitású D1 dopaminreceptorokat, melyek a pozitív emocionális hatásért felelnek. Ezzel szemben a nagy affinitású D2 dopaminreceptorok túl magas tüzelési frekvencia miatt adaptálódnak, így azok nem felelősek a hatás kialakulásáért, valószínűleg a hatás korlátozásában van szerepük.
A folyamat egyéb neurotranszmitterekre is hatással van, ilyenek a GABA, szerotonin, acetilkolin és a glutamát, így befolyásolja döntéshozást, motiváció kialakulását, a stresszrendszert, a memóriát és a közérzetet.
Kondícionált tanulás
A bevétel módja, mint semleges inger és a hatóanyag hatása megfelelő számú ismétlés során társul. Így nem csak a drog, hanem a hozzátartózó cselekvés is kialakítja az addikciót, tehát a szerhasználatra vonatkozó motiváció akkor is megmarad, amikor maga a hatóanyag már csökkent választ vált ki a szervezetben (Koob és Volkow, 2016).
Megvonás
A drog emocionális hatásának elmúlását stressz, hangulatzavar, rossz közérzet, szorongás követi. A szervezet érzékenysége csökken a természetes jutalmak iránt, így a pozitív emóciókért felelős dopaminhullámot csak a drog újabb bejuttatásával képes elérni.
Rendszeren belüli neuroadaptációk
A szervezet egyensúlyra törekszik, a drog hatását a központi idegrendszerben primer celluláris válasz próbálja semlegesíteni. A válasz viszont akkor is megmarad, amikor a hatóanyag hatása elmúlik, így ellentétes túlsúly alakul ki, ezt nevezzük megvonási válasznak. A celluláris válasz elsősorban a nucleus accumbens sejtjeiben alakul ki. A dopaminerg, serotonerg és GABAerg transzmisszió csökken, az NMDA glutamerg transzmisszió fokozódik. Ezek a változások a drog hatását csökkentik az első szakaszban, eltűnésük után pedig a negatív emóciókért felelősek. Változások figyelhetők meg a receptorexpresszióban is, például opioid megvonás során az opioid receptorok száma nő.
Rendszerek közötti neuroadaptációk
A hypothalamus nucleus paraventricularis CRF-termelése nő, ami ACTH-termelést serkent a hypophisisben, melynek hatására a mellékvesekéreg glükokortikoid-termelése fokozódik, így stressz alakul ki (Koob és Volkow, 2016).
Belefeledkezés
A belefeledkezés szakasza felelős a drogkereső viselkedésért, gyakran sóvárgással társul. A prefronalis cortex glutamerg projekciós pályákon keresztül dopaminfelszabadulást okoz a mezokortikális neuronokban, ami a bazális ganglionokra hat.
Két ellentétes rendszer működése határozza meg a szakaszt, a Go és a Stop rendszer. A Go rendszerért a bazális ganglionok felelősek, sóvárgást okoz, hatására a szokások rögzülnek. A Stop rendszer a választások kognitív értékelésén alapul, a Go rendszer és a stresszrendszer működését gátolja, tehát sikeres aktivációja csökkenti vagy megszünteti a sóvárgást (Koob és Volkow, 2016).
Stressz szerepe, háttere
Az addikció kialakulásának egyik fő kockázati tényezője a stressz, és a függőség alatti visszaesést is legtöbbször stressz okozza (Torres-Berrio, 2018). Stresszorok hatására a hypothalamus nucleus paraventricularisban nő a cAMP-koncentráció, amit CRF kibocsátás követ. A CRF a hypophisisre, az azáltal termelt ACTH a mellékvesekéregre hat, ahol glükokortikoidok felszabadulását okozza (Kovács és mtsai, 2013).
Addikció során a ’megvonás’ szakaszában a CRH mRNS transzkripciója nő, ami a teljes út serkentését okozza, kimutatták az ACTH és a corticosteron, valamint emellett a prolaktin szintjének emelkedését is (Kovács és mtsai, 2013).
A CRF kétféle receptorhoz kötődik, CRFR-1 található az agykéregben, a kisagyban, a medialis septumban és a hipofízisben, CRFR-2 a hypothalamus ventromedialis részén, a plexus chorioideusban és a sulcus lateralisban. Stressz esetén a CRF elsősorban a hipofízis CRFR-1 típusú receptoraihoz köt. Kokain és alkohol hatásainak vizsgálata során is megfigyelték a CRF és a CRFR-1 mRNS megnövekedett szintjét (Torres-Berrio, 2018).
Genetikai háttér
A D2 dopamin receptor polimorfizmusa megduplázza a függőség kialakulásának kockázatát (Bolloni és mtsai, 2018).
Bizonyos SNP-k a stresszhez kötött, elsősorban a CRF-t és a CRFR-1-et kódoló génekben növelik a stresszre való hajlamot, így közvetetten növelik az addikció kialakulásának kockázatát (Torres-Berrio, 2018).
Az addikció megnyilvánulási formái
Internetfüggőség
Kialakulása
Az internetfüggőség kialakulásához nagy mértékben hozzájárulnak a következő tényezők: a technikai eszközök fejlődése (internet-elérhetőség, elektronikus eszközök rohamos fejlődése), társadalmi konfliktusok, és ezen konfliktusok miatt kialakuló stresszhelyzetek. Ezen szituációk miatt az emberek körében elterjedtek az akár függőséget is okozó szerek használata, tevékenységek végzése, amelyek számukra feledtetik a mindennapok problémáit. A Gemius és az Ipsos kutatásaiból, továbbá a KSH adataiból következtetéseket vonhatunk le az internetaddikcióval kapcsolatban: Magyarországon az elmúlt 5 év adatait figyelembe véve, az internetet használó lakosok száma közel a kétszeresére nőtt, valamint a felhasználók körében az internet használattal töltött idő megnyolcszorozódott, ezek okán az internetfüggőség prevalenciája is nőtt (Galán, 2014).
Hatásai
Az internetfüggőség tényének megállapításhoz nem elég csupán a vizsgált alany internetezéssel töltött idejét megfigyelni, hanem fontos megvizsgálni a minőségi tényezőket is. Ez utóbbit vizsgálva, meg kell figyelni, hogy az internetezéssel töltött tevékenység milyen hatással van a személyes kapcsolatokra, szabadiős cselekvésekre. A kutatások alapján az alábbi következtetéseket vonhatjuk le az internetfüggőséggel kapcsolatban: az internethasználati problémákkal küzdő személy mindennapjaiban az internetezés jelentős időt tölt ki, és emiatt az egyén elhanyagolja mindennapi teendőket. Folyamatos, szűnni nem akaró internethasználat iránti vágy kontrollvesztést eredményez, a függő felhasználó az online, virtuális világot, a természetes valóság elé helyezi. Az internetfüggőség esetén – a többi függőséghez hasonlóan – tevékenység valami miatti hiánya vagy megvonása miatt jelentkezhetnek elvonási tünetek, mint például az ingerültté, feszültté válás. A túlzott internethasználat súlyos hatással lehet az egyén személyes kapcsolataira, végső során ezek elvesztése miatt a függő személy társadalomtól elzárkózottá, magányossá vállhat (Galán, 2014).
Előfordulása
Az internetfüggőség prevalenciájáról készült kutatásokat nehéz összehasonlítani, mivel kutatásonként eltérő az alkalmazott vizsgálatok rendszere, valamint a kutatásban részt vevő eltérő korosztályok miatt. Általánosságban azonban elmondható, hogy a Kelet-Ázsiában (Kína, Japán), az ifjúsági korosztályban mérték a legmagasabb gyakorisági értékeket. Ez az ezen országokra jellemző intenzív technikai megújulással magyarázható (Galán, 2014).
Kockázati tényezők
A leginkább függőséghez vezető internet felhasználási módok közé az online játékok és az új kapcsolatok kialakítására törekvő kommunikációs tevékenységek tartoznak, míg a korosztályokat tekintve – a függőségi gyakorisággal megegyezően – a fiatalok vannak kitéve az addikciónak (Galán, 2014).
Az elhízás addiktív modellje: pszichoneurobiológiai összefüggések
Étkezési szokások és addikció
Az addikció ténye az elhízással kapcsolatban is megfigyelhető. Az addiktív modell kulcslépései itt is tapasztalhatóak, mint például a visszatérő késztetés, a folyamat közben egyre növekvő belső feszültség, majd pedig a tevékenység bekövetkezte után a bűntudat. Mivel az evés folyamata rendkívül nagy mértékben függ az adott pillanatnyi érzelmi állapottól, utóbbi pedig szoros összefüggésben áll a függőséggel, így elmondható az étkezési szokások addiktív hatásnak vannak kitéve. A kutatások szerint elhízás okai közé tartoznak a következők: éhség-jóllakottság észlelésének a hiánya, nem kontrollált táplálkozás, továbbá az érzelmi hangulat táplálék által való befolyásoltsága. Vizsgálatok bebizonyították, hogy a jó ízű ételek elfogyasztása stresszoldó hatású, valamint javítja a közérzetet. Ezen tény ellenére, mégis inkább azoknak a száma a nagyobb – az érzelmi alapú evészavarokkal küzdők közül – akik örömükben vesznek magukhoz plusz táplálékot. Az elhízás további okai közt tartják számon az egyre inkább elkényelmesedő, mozgásszegény életmódot, egy másik fő okként pedig az általánosan jellemző nagy mennyiségű és kiváló minőségű ételek iránti pozitív vonzódás szerepel. Az elhízás ténye bizonyítottan súlyos problémát jelent, mind globálisan, mind Magyarországon, ugyanis továbbra is ez az egyik vezető népegészségügyi kérdés. Alátámasztja ezt a megállapítást, hogy Magyarország lakossága több kutatás szerint is a leginkább elhízott nemzetek közé tartozik (Resch, 2018).
Neurolobiológiai háttere
A táplálkozással és ez által az elhízással leginkább kapcsolatban álló két központi idegrendszeri működési egység a POMC-rendszer és a dopamin/jutalmazó rendszer. Az előbbi főleg az energiaháztartás egyensúlyának fenntartásában, míg utóbbi szabályozza a táplálkozási viselkedést, a jutalmazási viselkedést szabályozó funkciója van (Resch, 2018).
Az addikció kezelési lehetőségei
Magnézium alkalmazása a különböző „szerek” okozta függőség kezelésében
A magnézium és több kétértékű kation csökkentik a függőség klinikai tüneteit. A különböző függőséget kiváltó szereket fogyasztók plazma és intracelluláris Mg2+ ion koncentrációja alacsonyabb, mint a nem-fogyasztóké. A stressz tovább növeli a Mg2+ ion leadást, így növeli a visszaesés esélyét. A Mg2+ csökkenti az addiktív szerek fogyasztását a dopamin, glutamát leadás csökkentésével a preszinaptikus terminálisokban, a NO szintáz aktivitásának csökkentésével, a GABAerg rendszer serkentésével,a posztszinaptikus NMDA receptor aktivitás csökkentésével és néhány Ca2+ ion csatornára ható neuromediátor csökkentésével. Továbbá a Mg2+ ion csökkenti olyan speciális anyagok okozta függőség intenzitását, amelyek intenzív szerhasználatot eredményeznek és 3 fő jellemzőjük: a kontrollálatlan szerhasználat, vágyakozás és az elvonási szindróma. Ilyen anyagok például az ópiátok, a pszihostimulánsok, a kannabinoidok és az alkohol (Nechifor, 2011).
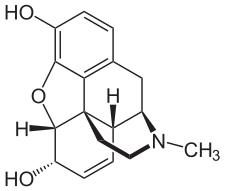
Ópiátok (2.ábra)
Az ópiátok, mint a morfin és a heroin, erős addikciót alakíthatnak ki. Röviden ezek a szerek a függőséget és az elvonási szindrómát a középagy területén, a dopamin koncentráció növelésével érik el. Azt is ismernünk kell, hogy melyek azok a molekuláris változások, amelyek növelik a dopamin koncentrációját. Hiszen a Mg2+ ion a dopamin koncentrációt csökkentve fejti ki hatását.
Az ópiát függőség intenzitásának csökkentését a Mg2+ számos folyamaton keresztül éri el. Csökkenti a dopamin szintézisét, szinaptikus felszabadulását, valamit az NMDA receptorok aktivitását. Az NMDA receptorok serkentése megemelkedett dopamin koncentrációt vált ki az agyban.
Gátolja a nitrogén-oxid-szintetázt (NOS), ezáltal csökkenti a nitrogén-oxid (NO) szintézisének aktivitását. Az NOS inhibitorok mérsékelik az opioidok addiktív hatását.
A glutamát-dekarboxiláz enzim serkentésével, növeli a glutamát anyagcserét. Illetve részt vesz a µ-receptorok opioid megkötésének szabályozásában is.
Intracerebroventricularis Ca2+ ion injekció emeli az agy dopamin koncentrációját. A Mg2+ ion, mint kalcium antagonista, csökkenti a kalcium indukálta dopamin felszabadulást, egyes dopaminerg szinapszisok preszinaptikus membránján.
Csökkenti a substance P neuropeptid szintézisét, amely az NMDA receptor glutamát ingerlésre adott válaszát szabályozza.
A glicin gátolja a katekolaminok preszinaptikus felszabadulását, így a glutamát serkentő hatásukat. Tehát a glutamát sem tudja kifejteni a dopamin felszabadulást serkentő hatását. Kísérletesen bizonyított a glicin dopamin-koncentráció csökkentő hatása. Glicin inhibitorok hatására megnövekedett dopamin-koncentráció tapasztalható. A magnézium serkenti a glicin szintézist és felszabadulást is.
A Mg2+ ion több vegyületének, mint a Mg-acetát, Mg-aszpartát, megfelelő adagolása sikeres terápiának bizonyult az ópiátok okozta függőség kezelésében (Nechifor, 2011).
|
2. ábra: Opioid |
Pszichostimulánsok
Olyan anyagok csoportja, amelyek számos kémiai szerkezettel, hatásmechanizmussal rendelkeznek. A függőséget egyes központi idegrendszeri folyamatok aktivitásának növelésével érik el. Pszichostimuláns például: a koffein, nikotin, amfetamin, kokain (Nechifor, 2011).
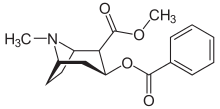
Kokain (3.ábra)
A magnézium kísérletesen csökkenti a kokain fogyasztást, a kokain iránti sóvárgást. A kokain, hatását az NMDA receptorok segítségével váltja ki. Így az NMDA antagonisták, NMDA receptor blokkolók, mint a Mg2+ ion mérséklik a pszichostimuláns hatását. A függőség kialakulásában, intenzitásában genetikai tényezők is szerepet játszanak (Nechifor, 2011).
|
3. ábra: Kokain |
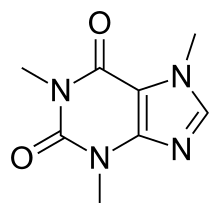
Koffein (4.ábra)
Széleskörben elterjedt pszichostimuláns, amely kis mértékű addiktív hatással rendelkezik. A CNS-ben legnagyobb mennyiségben jelenlevő adenozin receptorokon (A1, A2, A3) keresztül fejti ki hatását a koffein. Pontosan, mint adenozin receptor antagonista, blokkolja a glutamáterg neuronok preszinaptikus membránján elhelyezkedő A1 és A2 receptorokat. Növeli az intracelluláris kalcium csúcsot és az L-típusú kalcium csatornák számát. Így serkenti a glutamát szintézist és felszabadulást, ezáltal a dopamin-koncentrációt az agy egyes területein. A Mg2+ ion a kalcium csatorna blokkolásával, vagy a glutamát serkentés csökkentésével mérsékli a koffein függőséget (Nechifor, 2011).
|
4. ábra: Koffein |
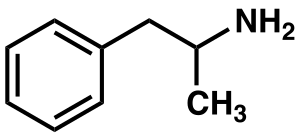
Amfetamin (5.ábra)
Nagyon erős szimpatomimetikum, amely viselkedési zavart, strukturális agyi rendellenességeket: csökkent agykérgi állományt, striatum térfogat növekedést okoz. Serkenti a dopamin, szerotonin felszabadulást a mezolimbikus rendszerben. Az intraneuronális magnézium csökkenti az amfetamin addiktív hatásait, mely Mg2+ ion szintet a Li+ ion, mint amfetamin antagonista növeli (Nechifor, 2011).
|
5. ábra: Amfetamin |
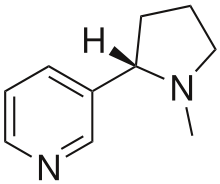
Nikotin (6.ábra)
A nikotin addikció elsősorban az aktív dohányzók körében alakulhat ki. Csökkent vérplazma Mg2+ ion koncentráció jellemzi.
A nikotin csökkenti a gamma-amino-vajsav (GABA), gátló neurotranszmitter, szintézisét. Ezáltal gátolja, a GABA NMDA receptorok glutamát közvetítette serkentő hatására kifejtett gátló hatását.
Illetve fokozza a substantia nigra és nucleus accumbens területén felszabaduló Ca2+ ion függő, DA glutamátra kifejtett stimulációját. A nikotinhoz hasonló acetil-kolin neurotranszmitter is serkenti a glutamáterg aktivitást.
A magnézium, mint kalcium antagonista, csökkenti a nikotin által serkentett glutamát felszabadulást, preszinaptikus dopamin és katekolamin felszabadulást. Valamint intraneuronálisan csökkenti a Na+ ion koncentrációt, ezáltal csökkenti a nikotin receptorra kifejtett hatását (Nechifor, 2011).
|
6. ábra: Nikotin |
Etanol
A leggyakoribb függőséget okozó pszichoaktív szer. Az etanol, és a belőle képződő acetaldehid a nucleus accumbensben, a ventralis tegmentalis terület (VTA)-en és a CNS egyéb területein fejtik ki hatásukat a dopaminerg rendszer aktivitásának serkentésével. Ezt a hatást az alkohol-dehidrogenáz a VTA-en gátolja. Továbbá az etanol növeli a ß-endorfin felszabadulást és serkenti az opioid receptorokat (µ-receptor).
Alkoholfogyasztás hatására az agyban alacsony intracelluláris Mg2+ ion koncentáció alakul ki. Továbbá a fokozott, vizelettel történő magnézium vesztés (2-3-szoros) hypomagnesemiát okoz, ami fokozza az etanol fogyasztás intenzitását, a függőség kifejlődésének kockázatát.
A krónikus alkohol bevitel fokozza az NMDA receptorokhoz való glutamát kötődést. Az alacsony etanol koncentráció pedig kimeríti az asztrociták Mg2+ ion raktárait.
Magnézium adagolása csökkenti a dopamin preszinaptikus felszabadulását, acetaldehid szintézisét és a morfin és µ-receptor agonisták receptorhoz való kötődését. Így csökkentve az etanol függőség tüneteit az elvonási szakaszban (Nechifor, 2011).
Hallucinogének
Hallucinációt, gondolkodási zavarokat és csalódás érzetét keltő anyagok csoportja, amelyek erős pszichikai-, de fizikai függőséget nem okoznak. Legismertebb hallucinogén az LSD vagy= lizergsav-dietilamid. Ide tartoznak az indolamin szerkezetű (pszilocin, dimetil-triptamin), és feniletilamin szerkezetű (meszkalin-2-etilamin) származékok is. Pontos hatásmechanizmusuk még nem ismert, de elsősorban a szerotoninerg rendszer receptoraihoz kapcsolódik az LSD. Krónikus adagolása hypomagnesemiát okoz (Nechifor, 2011).
Benzodiazepinek
A benzodiazepin függőség elvonási szakaszának intenzitását, és a fellépő erős szorongást a magnézium-L-aszpartát csökkenti. A szorongást az AMPA receptorok aktivitásának, és a receptorok, hippocampusban elhelyezkedő, piramissejtekben való potenciáljának fokozódása váltja ki. Tovább fokozza, a kalcium/kalmodulin-függő protein-kináz-II glutamáterg rendszer serkentésével (Nechifor, 2011).
Kannabinoidok
A leggyakoribb kannabinoid, a Cannabis nemzetségben található delta-9-tetrahidrokannabinol (THC), amely pszichika függőséget, de fizikai függőséget csak kis mértékben okoz. Állatkísérletek során megfigyelték, hogy a magnéziumhiány növelte az állatok THC okozta hiperagresszivitását (Nechifor, 2011).
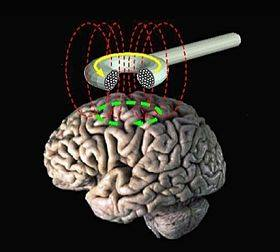
Transcranial Magnetic Stimulation (TMS) (7.ábra)
Fogalma, alkalmazása
A szerhasználati betegségek (SUD) világszerte jelentős társadalmi, közegészségügyi problémát okoznak. A SUD kezelésében a transzkraniális mágneses stimulációt, mint nem farmakológiai eszközt alkalmazzák. 1985-óta ismert, hatását addiktív zavarok, skizofrénia és súlyos depresszió esetén vizsgálják. A TMS egy olyan módszer, mely során a tekercsen keresztül haladó elektromos áram átmeneti, nagy intenzitású mágneses impulzust generál. Ez a fejbőrön keresztül az adott agykérgi területhez jut. A célzott agyterület aktiválását a tekercs geometriája határozza meg. Az általában használt „nyolcas tekercs” impulzusai felületesek maradnak, és gyorsan szétoszlanak a kérgi állományban. Ennél hatékonyabb a Hesed-tekercs, ami kétoldalról stimulálja a PfCx-t, így aktiválja a dopaminerg rendszert, a függőséget kialakító kortikális-, szubkortikális rendszert. Az ismétlődő ingerek frekvenciájától függően, vagy gátolja (alacsony frekvencia), vagy pedig serkenti (magas frekvencia) a kérgi ingerlékenységet. Az alkalmazott paraméterektől függnek a kialakult fiziológiai és viselkedési hatások. A TMS célja a diszfunkcionális neuronális hálózat helyreállítása. TMS terápiával csökkenthető az alkoholisták, nikotin-, heroin-, metamfetamin függők vágya és szerhasználata is (Bolloni és mtsai, 2018).
|
7. ábra: Transcranial Magnetic Stimulation (TMS) |
TMS a kokain függőség kezelésében
Az ismétlődő TMS (rTMS) kísérletesen igazolt módon csökkenti a kokain iránti vágyat, és a kokain fogyasztást. A vágy szabályozásában központi szerepet játszik a dorsolateralis-prefrontalis-cortex (DlPfCx). Ha a jobb DlPfCx-t stimuláljuk, akkor a kokain iránti vágy csupán átmenetileg csökken. Amennyiben a bal DlPfCx-t stimuláljuk, akkor hosszabb időre fennmarad a hatás (a kezelés kezdetétől számított 4. hétig). Valamint, ha kétoldali, mély rTMS-t alkalmazunk, a kokain bevitel jelentősen csökken, a kezelés kezdetétől számított 6. hónapban is (Bolloni és mtsai, 2018).
Irodalomjegyzék:
Badiani, A.; Berridge, K. C.; Heilig, M.; Nutt, D. J.; Robinson, T. E. (2018): Addiction research and theory: a commentary on the Surgeon General's Report on alcohol, drugs, and health. Addiction biology, 23: (1) 3-5
Bolloni, C.; Badas, P.; Corona, G.; Diana, M. (2018): Transcranial magnetic stimulation for the treatment of cocaine addiction: evidence to date. Substance abuse and rehabilitation, 9: 11-21
Darcq, E.; Kieffer, B. L. (2018): Opioid receptors: drivers to addiction?. Nature Reviews Neuroscience, 19: (8) 499-514
Galán, A. (2014): Az internetfüggőség kialakulása és prevalenciája. A hazai és a nemzetközi kutatási eredmények összefoglalása. Metszetek, 1: 316-327
Koob, G. F.; Volkow, N. D. (2016): Neurobiology of addiction: a neurocircuitry analysis. The Lancet Psychiatry, 3: (8) 760-773
Resch, M. (2018): The addictive model of obesity: psychoneurobiological relationships. Orvosi hetilap, 159: (27) 1095-1102
Torres-Berrio, A.; Cuesta, S.; Lopez-Guzman, S.; Nava-Mesa, M. O. (2018): Interaction between stress and addiction: Contributions from Latin-American Neuroscience. Frontiers in psychology, 9: 2639
Uhl, G. R.; Koob, G. F.; Cable, J. (2019): The neurobiology of addiction. Annals of the New York Academy of Sciences, [Epub ahead of print]
Egyéb felhasznált források:
Kovács, K.; Barna, I.; Dénes, Á.; Ferenczi, S.; Martín Sánchez, F.; Milanés Mayiulón, M. V.; Molnár, A.; Nunez Parra, C.; Pintér-Kübler, B.; Tóth, Zs. (2013): A stressz rendszer szerepe az ópiát függőség kialakulásában: idegi, sejtszintű és molekuláris mechanizmusok= Involvement of brain stress system in opiate addiction: neuronal substrates, cellular and molecular mechanisms. OTKA Kutatási Jelentések| OTKA Research Reports. http://real.mtak.hu/12472/
Nechifor, M. (2011): Magnesium in drug abuse and addiction. In Magnesium in the Central Nervous System [Internet]. University of Adelaide Press. https://www.ncbi.nlm.nih.gov/books/NBK507260/
Ábrajegyzék:
1. ábra: saját rajz (Készítette: Göcző Ágoston)
2. ábra: https://en.wikipedia.org/wiki/Opioid#/media/File:Morphin_-_Morphine.svg<<BR>> 3. ábra: https://upload.wikimedia.org/wikipedia/commons/6/66/Kokain_-_Cocaine.svg<<BR>> 4. ábra: https://upload.wikimedia.org/wikipedia/commons/8/8c/Caffeine_structure.svg<<BR>> 5. ábra: https://upload.wikimedia.org/wikipedia/commons/6/67/Racemic_amphetamine_2.svg<<BR>> 6. ábra: https://upload.wikimedia.org/wikipedia/commons/7/70/Nicotine.svg<<BR>> 7. ábra: https://en.wikipedia.org/wiki/Transcranial_magnetic_stimulation#/media/File:Transcranial_magnetic_stimulation.jpg<<BR>>