Die Folgen des Alterns auf das Kardiovaskuläre System
1. Kardiovaskuläres System
2. Alterungsprozess
2.1. morphologische Veränderungen
- 2.1.1. Das Herz
- 2.1.2. Das Gefäßsystem
2.2. physiologische Veränderungen
2.2.1. Das Herz
2.2.2. Das Gefäßsystem
3. Altersbedingte kardiovaskuläre Erkrankungen
3.1 Dilatative Kardiomyopathie
- 3.1.1 Einleitung
- 3.1.2 Histologie und Vererbung
- 3.1.3 Diagnostik
- 3.1.4 Symptomatik
- 3.1.5. Therapie
3.2 Hypertrophe Kardiomyopathie
- 3.2.1 Einleitung
- 3.2.2 Verlauf und Prognose
- 3.2.3 Diagnostik
- 3.2.4 Therapie
- 3.2.5 Gegenüberstellung HCM Mensch und Katze
3.3 Thrombose
- 3.3.1 Definition
- 3.3.2 Embolie
- 3.3.3 Therapie
- 3.3.4 Zusammenhang zu anderen kardiovaskulären Erkrankungen
- 3.3.5 weitere Risikofaktoren
3.4 Arterielle Hypertonie
- 3.4.1 Ursache
- 3.4.2 Definition
- 3.4.3 Pathophysiologie
- 3.4.4 Folgen
3.5 Aortenklappenstenose
- 3.5.1 Definition
- 3.5.2 Pathophysiologie
- 3.5.3 Pathohistologie
- 3.5.4 Zusammenhang mit dem Alter
- 3.5.5 Prophylaxe
4. Prävention?
5. Quellen/Literaturnachweis
1. Kardiovaskuläres System
Das kardiovaskuläre System ist das Transportsystem des menschlichen und tierischen Körpers und stellt den Blutkreislauf des Organismus dar.
Es setzt sich anatomisch aus dem Herzen und den Blutgefäßen zusammen. Das Niederdrucksystem umfasst alle postarteriolen Gefäße, dazu gehören das rechte Herz, die Venen, das Kapillarbett, der linke Vorhof und der Lungenkreislauf. Als Hochdruckgebiet versteht sich der Bereich zwischen Aortenklappen und dem Arteriolengebiet. Das Niederdrucksystem hat die Aufgabe der Beherbergung des Blutes, während das Hochdrucksystem die funktionelle Versorgung der Organe gewährleistet. Das Druckniveau zwischen beiden funktionellen Einheiten unterscheidet sich gravierend. Während im Niederdrucksystem ein Blutdruck von 5-15 mmHg herrscht, so beträgt der physiologische Blutdruck im Hochdrucksystem etwa das zehnfache (Arndt, 1983).
Der Blutkreislauf umfasst zwei hintereinander geschaltete Kreisläufe für diese das Herz die zentrale Pumpe darstellt. Im Körperkreislauf, auch großer Kreislauf genannt wird das mit Sauerstoff angereicherte Blut aus der linken Herzkammer über die Aorta bishin zum Kapillarbett im gesamten Körper verteilt. Nach der Versorgung der peripheren Geweben mit Sauerstoff und Nährstoffen gelangt das Blut über die V. Cava caudalis zurück zum rechten Vorhof. Von dort setzt sich der Lungenkreislauf (kleiner Kreislauf) fort, indem das sauerstoffarme Blut über die Aa. pulmonales im Kapillargebiet der Lungen wieder mit O2 angereicht wird. Das sauerstoffreiche Blut gelangt nun über die Vv. Pulmonales zurück zum linken Vorhof.
Funktionell wird zwischen einem Niederdruck- und ein Hochdrucksystem unterschieden.
2. Alterungsprozess
Definition des Altersbegriffs
Das biologische Altern beschreibt das Ungleichgewicht der kardiovaskulären Homöostase. Damit verbunden sind langsame und fortschreitende, strukturelle und funktionelle Veränderungen des Herzens und des Gefäßsystems. Diese Veränderungen erhöhen das Risiko für die Entwicklung verschiedener kardiovaskulärer Erkrankungen (z. B. Erkrankungen der Herzkranzgefäße, Schlaganfall, Bluthochdruck, Atherosklerose, Vorhofflimmern und Herzinsuffizienz) (Kroemer et al, 2018) . Für den Altersbegriff gibt es keine einheitliche Definition; internationale Empfehlungen klassifizieren Menschen über 65 Jahren als „älter“ sowie Menschen über 75 als „alt“. Die Kategorie „sehr alt“ umfasst demnach Menschen mit einem Alter über 85 Jahren (Müller-Werdan et al, 2007). Altern ist mit einem fortschreitenden Rückgang zahlreicher physiologischer Prozesse verbunden, was zu einem erhöhten Risiko für gesundheitliche Komplikationen und Krankheiten führt. Das Altern hat eine bemerkenswerte Auswirkung auf das Herz und das arterielle System und führt zu einer Zunahme der CVD, einschließlich Atherosklerose, Bluthochdruck, Myokardinfarkt und Schlaganfall (North und Sinclair, 2012).
2.1 Morphologische Veränderungen während des Alterns
2.1.1. Das Herz
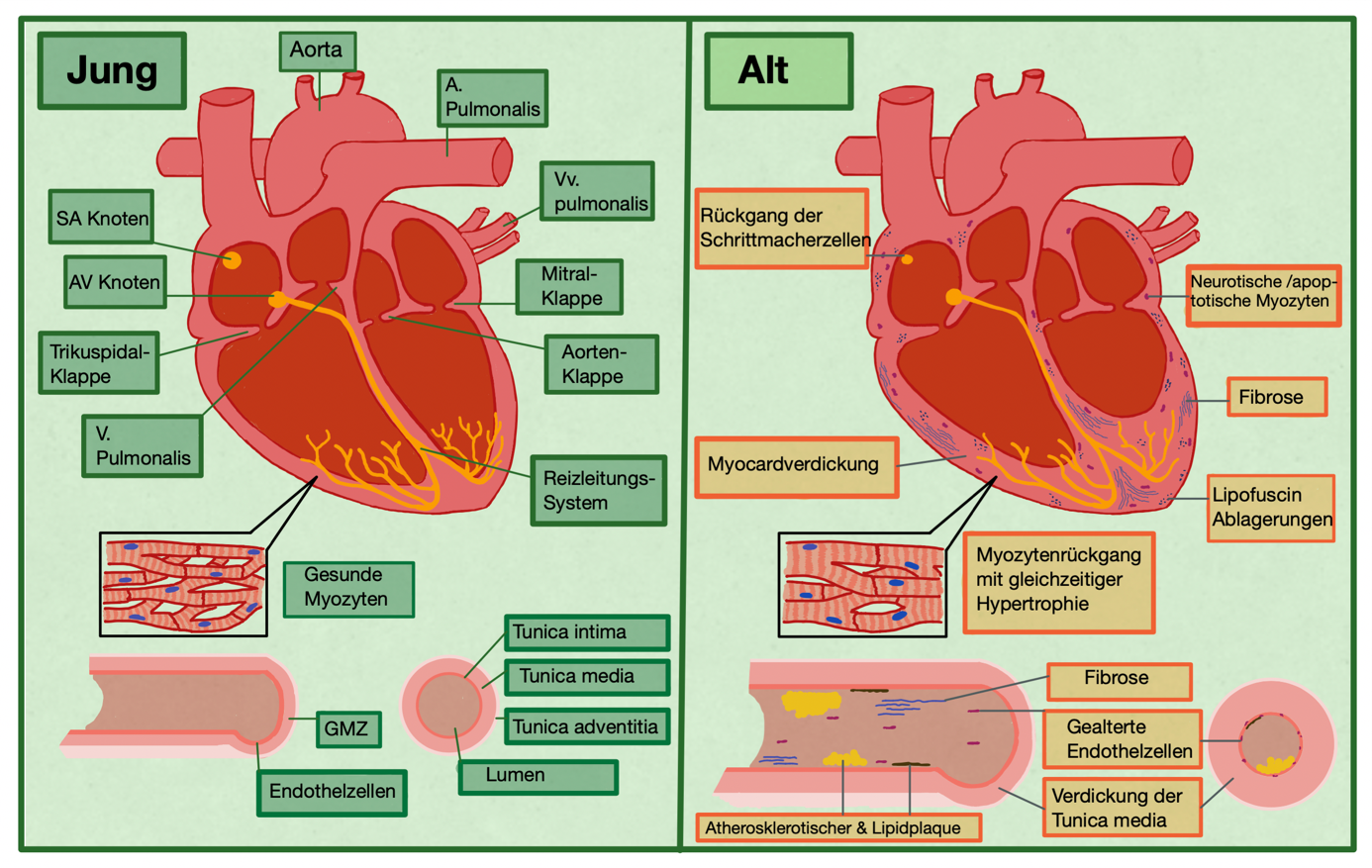
Altersbedingte Veränderungen der Strukturen des Myokards umfassen vor allem die Hyperplasie der Myozyten und einen Anstieg der Rate degenerativer Veränderungen wie Lipidablagerung, tubuläre Dilatation, Lipofuscinablagerung (Olivetti et al, 1991) und eine Abnahme der mitochondrialen oxidativen Phosphorylierung. Eine häufige degenerative Veränderung ist die Ablagerung von Lipofuscin-Granulat, dieses stellt wahrscheinlich oxidierte Lipidpigmente dar, die aus der peruoxidierten Mitochondrienmembran stammen.
Häufig verlangsamt sich die Proteinsyntheserate im alternden Myokard. Dies verzögert den Ersatz kontraktiler Fasern in Myozyten und anderen Proteinen. Diese sowie Veränderungen in der Expression von Herzgenen können darin resultieren, dass die Anpassungsfähigkeit des Herzens an die hämodynamische Belastung nachlässt (Isoyama et al, 1988 ; Takashashi et al, 1993). Dieser signifikante Verlust an Schrittmacherzellen ist wahrscheinlich Auslöser für atriale Dysrhythmien bei älteren Personen (Wei at al, 1987).Weiterhin kommt es zu einem geringen Verlust von Muskelzellen und einem ebenso leichten Anstieg des Fasergewebes im Internodulartrakt. Der atrioventrikuläre Knoten und das His-Bündel sind normalerweise von altersbedingten morphologischen Veränderungen ausgenommen.Ebenso häufig wie der Verlust an Myozyten, tritt eine Vergrößerung der linken Ventrikelwand auf und es kommt zum Anstieg von elastischem Gewebe, Fett, Kollagen, sowie Fibroseherde. Fibrosen und Verkalkungen sind häufige altersbedingte Erscheinungen, welche das Leitungssystems jedoch noch in extremen Fällen beeinträchtigen.
2.1.2.Das Gefäßsystem
Im Organismus besteht ein Hang dazu, zunächst Veränderungen in den proximalen Bereichen der Arterien zu entwickeln, die sich später auf das gesamte Gefäßsystem ausbreiten. So beispielsweise im Herzen, in dem Veränderungen erst die linke Koronararterie, später auch die rechten Koronargefäße betreffen. Im voranschreitenden Alter entwickeln große Leitungsarterien (z. B. Aorta und Karotis) vergrößerte Lumina und verdickte Wände (Kroemer et al, 2018).
Arterielle Veränderungen treten vor allem in der Intima des Gefäßes auf, diese umfassen die voranschreitende Heterogenität der Endothelzellen in Form, Größe und axialer Ausrichtung. Dies hat vermehrte Lipidablagerungen zur Folge. Zudem treten häufig laminäre Störungen des Blutflusses auf. Ebenso wie die Intima, unterliegen auch die subendothelialen Schichten altersbedingten Veränderungen, wie Verdickungen, Zunahme des Bindegewebs-, Kalzium- und Lipidgehalts (siehe Abbildung 1). Weitere Veränderungen erscheinen in Form von Verdickung der glatten Muskelschichten, der Fragmentierung des Elastins, sowie Verkalkungen der Gefäße (dargestellt in Abbildung 1). Die Summe dieser altersbedingten Modifikationen erhöhen tendenziell die Starrheit der Gefäßwände (Olivetti et al, 1991).
|
Die Abbildung 1 stellt einen schematischen Überblick über die morphologischen Veränderungen der Herz- und Gefäßstrukturen dar.
2.2 Physiologische / funktionelle Veränderungen während des Alterns
2.2.1. Das Herz
Mit der sich altersbedingt verändernden Morphologie gehen zahlreiche physiologische Anpassungen einher.
Aufgrund der veränderten Herzvorspannung kommt es vor, dass sich das linksventrikuläre enddiastolische Volumen und das Schlagvolumens verringern (Lipsitz et al, 1990; Shannon et al, 1991; Nixon et al, 1985). Wie et al, 1992 kamen zu den Erkenntnissen, dass „in den Vereinigten Staaten steigt der systolische arterielle Ruhedruck im Alter zwischen 20 und 60 Jahren tendenziell allmählich an (um ungefähr 20 mmHg), (...) der Druck steigt zwischen 60 und 80 Jahren um weitere 20 mm Hg. Die Ruheherzfrequenz ändert sich normalerweise nicht“ (Wei at al, 1992).
Die kompensatorischen kardiovaskulären Funktionen älterer Menschen und Tieren sind häufig nicht ausreichend gewährleistet. Somit treten aufgrund von körperlicher Stimuli häufig Synkopen auf (Lipsitz et al, 1983). Aufgrund der veränderten Herzvorspannung kommt es vor, dass sich das linksventrikuläre, enddiastolische Volumen und das Schlagvolumen verringern. Dies beeinträchtigt auch die Füllungseigenschaften des linken Vorhofs. Eine langsamere, frühe und passive Füllung, aufgrund von altersbedingter linksventrikulärer Steifheit, führt zu einer verstärkten, späten und aktiven Füllung durch das linke Atrium. Dies hat eine Umgestaltung des linken Vorhofs zu Folge, für die eine Abnahme der diastolischen Funktion charakteristisch ist. (Edward et al, 2003) (North und Sinclair, 2012)
Altersbedingt kommt es zum Rückgang der Autophagie, was einen natürlichen und zellulären Reinigungsprozess darstellt. Nach Kroemer et al, 2018: „stimuliert dies schädliche und zelluläre Prozesse, die mit einem nachteiligen Umbau, einer Versteifung und einem funktionellen Rückgang des Herzens und des arteriellen Systems einhergehen“. In den Kardiomyozyten herrscht ein altersbedingter Rückgang der Mitochondrienfunktion und -struktur. Es wird weniger ATP synthetisiert und es entstehen erhöhte Mengen an reaktiven Sauerstoffspezies (ROS), oft ungenau als Sauerstoffradikale bezeichnet, die die Zellen in oxidativen Stress versetzten (Lesnefsky et al, 2016). Die Akkumulation von Lipofuscin im Alter kann ebenso die Funktion der Mitochondrien negativ beeinflussen und sogar den Zelltod der Kardiomyozyten beschleunigen. Dies ist unter anderem Ursache für den altersbedingten Rückgang der Kardiomyozyten. Doch es kann ebenso zu einer Abnahme der Anzahl und Funktion von sinoatrialen Knotenschrittmacherzellen kommen. Dies führt zu einer damit einhergehenden Zunahme von Leitungsanomalien, welche starke Variabilität der Herzfrequenz zur Folge hat (Antelmi et al, 2004).
2.2.2. Das Gefäßsystem:
Eine Vielzahl altersbedingter Pathologien wie zum Beispiel der Verlust einer adäquaten Gewebedurchblutung, unzureichende Gewebewachstums-, Regenerations- und Regressionsraten, liegen Gefäßstörungen zugrunde. (North und Sinclair, 2012) Ebenso wie an den Kardiomyozyten, bringt der Alterungsprozess auch viele Dysfunktionen des endothelialen Gewebes mit sich. Dies äußert sich in Form einer beeinträchtigten eNOS-Aktivität (endotheliale Stickoxid [NO] -Synthase). Die eNOS katalysiert die Synthese von NO aus L-Arginin. Stickstoffmonoxid gilt als gefäßschützender Faktor, da er zahlreiche positive Auswirkungen auf das Endothel hat. Im Zuge des Rückgangs der eNOS Aktivität verringert sich die NO-abhängige Vasodilatation (Collins und Tzima, 2011). Aufgrund voranschreitenden Alters lässt darüber hinaus die Proliferations- und Migrationsrate der Endotehlzellen nach. Dies äußert sich vor allem in Folge von Verletzungen. Eine zunehmende Zerstörung der Barriere ermöglicht eine subendotheliale Migration glatter Gefäßmuskelzellen. Dies führt zur charakteristischen Intimaverdickung durch Ablagerung extrazellulärer Matrixbestandteile (Brandes et al, 2005). Vermehrte Kollageneinlagerungen und häufig auftretende Elastinfrakturen (Sawabe, 2010) tragen maßgeblich zur Versteifung der Gefäße und einer erhöhten Pulswellengeschwindigkeit bei (Nilsson et al, 2014). Durch die Versteifung der Gefäße werden die reflektierten Druckwellen während der Systole verschoben. Es kommt zu einem erhöhten systolischen und erniedrigten diastolischen zentralen Druck (Lakatta und Levy, 2003). Dies trägt zur Veränderung der Herzstrukturen bei, indem mehr Nachlast auf das Herz auferlegt wird.
3. Altersbedingte kardiovaskuläre Erkrankungen
Weitere morphologische Veränderungen sind altersbedingter Verlust von Myozyten, mit gleichzeitigem steigenden Myozytenvolumen pro Kern in beiden Ventrikeln (Olivetti et al, 1991). Es kommt zu einem Zellverlust im Sinusknoten, nachweislich kann es zu einem Verlust von 90% der Zellen kommen, die in jungen Jahren existierten (Wei at al, 1992). Die morphologischen und physiologischen Veränderungen des Herz-Kreislauf-Systems bei alten Menschen sorgen häufig für die Entwicklung einer manifesten Krankheit. Durch den fortschreitenden Alterungsprozess kommt es zu weiterführenden altersbedingten Transformationen, die gravierende Auswirkungen auf die gesamten Organsysteme des Körpers haben können (Abdellatif et al, 2018). Im Alter steigt die Wahrscheinlichkeit eine Erkrankung des Herzens zu erleiden stark an, so sind sie ab einem Alter von 65 Jahren für ein Drittel und ab 85 Jahren für die Hälfte der Fälle die häufigste Todesursache (Franke, 1982).
3.1 Dilatative Kardiomyopathie
3.1.1 Einleitung:
Der Begriff dilatative Kardiomyophathie (DCM) beschreibt eine Funktionsstörung des Herzens. Dilatativ bedeutet „erweiternd“ und bezieht sich somit besonders auf die linke Herzkammer. In Folge dessen kommt es zu einer fehlerhafte Zirkulation des Blutes. Die DCM ist in Form von Kammerdilatation und ist überwiegend durch systolische oder weniger diastolische Dysfunktion gekennzeichnet. Altersbedingte Anomalien des Organismus begünstigen die Entwicklung einer DCM, darunter Ischämien, endokrine Störungen oder Herzklappendefekte. Eine DCM kann jedoch auch bei Patienten in jüngeren Jahren diagnostiziert werden. Sie tritt häufig als Folge von Infektionen, Noxen, Autoimmunerkrankungen oder Magelzuständen des Körpers auf. Durch die Vergrößerung tritt eine Deformation der Herzkammer, insbesondere in Form der Abnahme der Wandstärke ein. Die führt dazu, dass die Herzklappen nicht mehr richtig schließen. Es kommt zu einem Rückstau des Blutes, zunächst in die Vorhöfe, später auch in die herznahen Gefäße. Um den Verlust der Pumpleistung auszugleichen, erhöht sich die Schlagfrequenz.
Die DCM tritt in der Veterinärmedizin vor allem bei größeren und mittelgroßen Hunderassen (Dobermann, Dogge, Labrador Retriever, Schäferhund & Locker Spaniel) auf. Die Folge der Deformation der Herzstruktur ist eine zunehmend nachlassende Belastbarkeit, die in frühen Stadien jedoch sehr gut kompensiert werden kann. Dies macht eine frühe Diagnose oft schwer möglich. Durch die unzureichende Zirkulation des Blutes können Ödeme in Organen und Bauchraum, jedoch vor allem in der Lunge auftreten. Spätestens zu diesem Zeitpunkt ist ein deutlicher Leistungsabfall erkennbar.
3.1.2 Histologie und Vererbung:
Bisher sind zwei histologische Formen der DCM bei Hunden nachgewiesen. Die erste Form ist die degenerative Fettinfiltration und tritt in erster Linie bei Boxern und Dobermann Pinschern auf.Hier wird das Myozytengewebe durch ausgedehnte Fibrosen und Fettinfiltration ersetzt. Die Folge sind Myokardläsionen und Muskelfaserdegeneration (Tidholm et al, 2005).Die zweite Form ist der abgeschwächte Wellenfasertyp. Der Wellenfasertyp konnte bei Menschen, Hunden und Katzen (Liu et al, 1970) nachgewiesen werden und lässt sich mit atrophierten, wellenförmigen Myozytendegenerationen beschreiben.Die Myozyten sind räumlich getrennt und der peruzelluläre Raum ist mit Flüssigkeit gefüllt. Untersuchungen wie von Michels et al, 1992, belegen die Einstufung der DCM unter 20 -35 % der menschlichen Patienten als erblich. Auch unter Hunden wird die DCM aufgrund ihrer Prävalenz als Erbkrankheit vermutet. Eine Autosomal dominante Vererbung wurde beim Irish Wolfhound (Cobb et al 1996), Neufundländern (Dukes-McEwan, 1999) und Dobermann Pinscher (Meurs, 1998) berichtet. Ein autosomal rezessiver Erbgang konnte durch Dambach et al aus dem Jahr 1999, beim portugiesischen Wasserhund erwiesen werden.
3.1.3 Diagnostik:
Zu den wichtigsten diagnostischen Methoden zählt neben der Auskultation die Röntgendiagnostik, das EKG. Die aufschlussreichste Diagnose kann jedoch mit einer Ultraschalluntersuchung getroffen werden. In einigen Fällen ist es ratsam ein 24-Stunden-EKG in Betracht zu ziehen. Aufgrund von eventueller Beteiligung der Schilddrüse sollten auch diese Parameter bei der Diagnostik einbezogen werden (Busch, 2004).
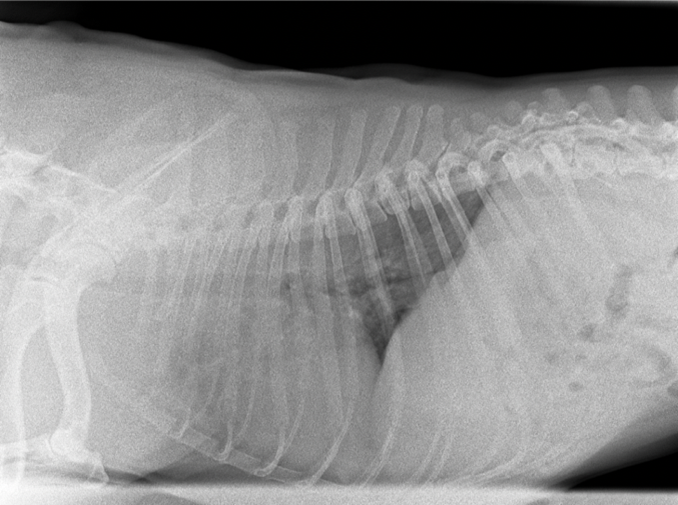
Hunde mit DCM zeigen vor allem Abnormalitäten im EKG, wie Vorhofflimmern oder ventrikuläre Arrhythmien auf. Die Radiologie belegt die Diagnose bei auftretender Kardiomegalie mit Hervorhebung des linken Vorhofs, Verstopfung der pulmonalen Venen und interstitieller oder alveolärer Ödembildung der Lunge (Tidholm und Jönsson, 2005) Bild 2-4 veranschaulichen das Beschriebene und werden zur Verfügung gestellt von der Tierarztpraxis Dr. Uwe Kästner Wernigerode.
|
Bild 1
Auf den Röntgenaufnahmen lässt sich im positiven Fall eine Vergrößerung des Herzschattens erkennen. Bei gewissem Fortschritt auch Wassereinlagerungen in der Lunge.
(Quelle: Tierartzpraxis Dr. Uwe Kästner Wernigerode)
|
|
|
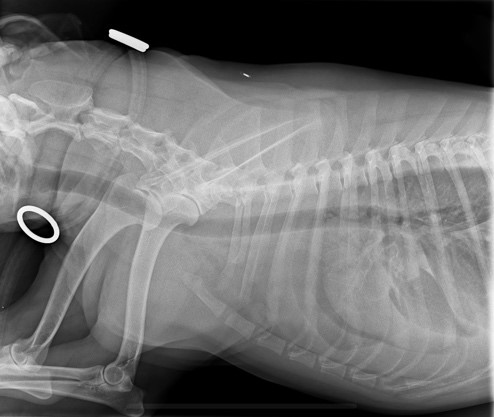
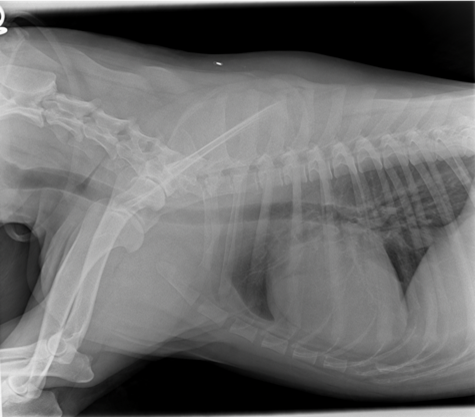
Bild 2 und 3 (Quelle: Tierartzpraxis Dr. Uwe Kästner Wernigerode)
Die Abbildungen zeigen einen Hund mit DCM. Bild 3 stellt den Hund vor der Behandlung dar; Bild 4 nach der Behandlung mit Vetmedin in Kombination mit ACE Hemmern. Ein deutlicher Rückgang der Lungenverschattung ist zu erkennen.
3.1.4 Symptomatik:
Zu den Leitsymptomen der DCM gehören unter anderem Atemnot, Leistungsschwäche, Husten, Unruhe, Depressionen und plötzliches Umfallen. Weitere Symptome sind ein angespanntes Abdomen, Inappetenz, Polydipsie, Synkope und Lethargie. Klinische Untersuchungen zeigen häufig Tachypnoe, Dyspnoe, Tachykardie, Arrhythmie, Aszites und Gewichtsverlust (Sisson et al, 1999). Diese Symptome, darunter vor allem das Husten, werden unglücklicherweise häufig mit anderen Erkrankungen, welche eine Erkältungssymptomatik verursachen, verwechselt. Dies hat zur Folge, dass eine DCM meist erst in sehr fortgeschrittenen Stadien diagnostiziert wird.
3.1.5 Therapie:
Als einzige Behandlung der DCM wird eine medikamentöse Dauerbehandlung in Betracht gezogen. Somit können die fortschreitenden Funktionsstörungen verlangsamt werden, eine Heilung oder eine Rückbildung der Anomalien im Herzen ist nicht möglich. Ein in der Veterinärmedizin häufig zur Behandlung der DCM eingesetzter Wirkstoff ist Pimobendan. Eine Kombination für Pimobendan mit ACE-Hemmern (Angiotensin-Converting- Enzyme) wird empfohlen. ACE sorgt bei Nachlassen der Herzleistung für Gefäßverengung und verringert weiterhin die Ausscheidung von Wasser und Salzen. Als Resultat erhöht sich die Blutmenge und es kommt zum Blutdruckanstieg. Diese Kombination beider Wirkstoffe sorgt statistisch gesehen für eine signifikante Verlängerung der Lebensdauer von DCM Patienten. Zur Unterstützung der Therapie erfolgt häufig die Gabe von Diuretika oder Saluretika, um die Flüssigkeitsansammlungen aus den Geweben oder Leibeshöhlen schneller zu resorbieren. In diesem Zusammenhang wird zur Therapie auch eine kochsalzarme Ernährung empfohlen.
Neben der medikamentösen Behandlung sollte vor allem Wert auf das Umfeld des Tieres gelegt werden. Es gibt zahlreiche externe Faktoren, die bei einer DCM für Komplikationen oder Verschlechterungen führen können. Eine möglichst stressfreie Umgebung für das Tier sollte angestrebt werden. Zusätzlich sollten hohe Temperaturen, große körperliche Belastungen und eine schlechte Sauerstoffversorgung vermieden werden (Busch, 2002). Dies stellt viele Hundebesitzer vor allem im Sommer vor große Probleme.
3.2 Hypertrophe Kardiomyopathie:
3.2.1 Einleitung:
Die Hypertrophe Kardiomyopathie (HCM) ist eine von der Herzmuskulatur ausgehende Muskelerkrankung. Morphologische, durch die HCM verursachte Veränderungen, sind zumeist lokal septal betonte Hypertrophien des linken Ventrikels ≥ 15 mm (Scheffold et al, 2005). Diese Anomalie führt häufig zu diastolischen Dysfunktionen. Man unterscheidet zwei Arten der HCM, die häufigere hypertrophe nichtobstruktive Kardiomyopathie (HNCM) und die hypertrophe obstruktive Kardiomyopathie (HOCM). Die HOCM verursacht aufgrund der Septumhypertrophie einen Druckradienten innerhalb des linken Ventrikels, welche durch die systolische Bewegung der Mitralklappe noch verstärkt wird. Dies kann langzeitig zu einer Mitralinsuffizienz führen.
Aufgrund der diastolischen Dysfunktion, sowie der Mitralinsuffizienz kommt es häufig zu einer Vergrößerung des linken Atriums, welche als häufige Ursache für Vorhofflimmern gesehen wird.Histologsich ist die Ursache der HCM im häufig altersbedingt vorkommenden Strukturverlust der Myozyten und interstitiellen Fibrosen des Myokards zu finden. Häufig tritt sie als Folge der kardiovaskulären Anomalien im Alter, etwa bei Patienten über 50 Jahren auf. Die HCM tritt überwiegend familiär mit autosomal-dominantem Erbgang auf. In 60% der Fälle mindestens in einem weiteren Familienmitglied ersten Grades.
3.2.2 Verlauf und Prognose
Der Großteil der Patienten zeigt keine bis zu einer leichten Symptomatik. Bei symptomatischen Fällen kommt es zu Dyspnoe in Folge von Belastungen, Schwindel, Angina pectoris, Synkopen bis hin zur Herzinsuffizienz (Scheffold et al, 2005). Bei älteren Patienten dominiert ein progredienter Verlauf, d.h. ein zu einer schweren diastolischen Dysfunktion führender Krankheitsverlauf. Häufig äußert sich dieser in einer Herzinsuffizienz, die selbst nach jahrelanger Symptomlosigkeit plötzlich auftreten kann. Im Extremfall spricht man vom so genannten „sudden death“, dem plötzlichen Herztod. Eine weitere plötzliche Komplikation ist das Auftreten von Vorhofflimmern aufgrund der strukturellen Veränderung der linken Kammer, des linken Vorhofes sowie der zunehmenden Mitralinsuffizienz. Es kommt bei etwa 60% der Patienten zu paroxysmales oder chronisches Vorhofflimmern. Bei HOCM Patienten kommt es weniger häufig zu einer Endocarditis, vor allem im Bereich des Septums und des Vorreden Mitralsegels.
3.2.3 Diagnostik
Grundlegendes diagnostischen Mittel ist die Auskultation, bei Patienten ohne Obstruktion gibt es jedoch keinen spezifischen Auskultationsbefund. Nur bei der HOCM kann auskulatatorisch ein charakteristisches spindelförmiges Systolikum am linken Sternalrand vernommen werden (Scheffold et al, 2005). Die meisten Veränderungen lassen sich mittels EKG nachweisen, sind jedoch nur unter Einbeziehung anderer diagnostischer Verfahren spezifisch. Die Hypertrophie der linken Kammer hat Repolarisationsstörungen und tiefe negative T-Wellen zur Folge. Die radiologische Untersuchung mittels Röntgen ist nur bedingt Mittel der Wahl, da bei Erkrankungen im frühen Stadium keine besonderen Anzeichen festzustellen sind. Erst imfortgeschrittenem Verlauf kann ein prominenter linker Vorhof oder pulmonale Stauungszeichen sichtbar gemacht werden. Der beste Weg für die Diagnose der HCM ist die Echokardiographie. Ein asymmetrisch hypertrophierter linker Ventrikel lässt sich mittels 2D Darstellung erkennen. Ebenso kann mittels Farbdoppler eine Dysfunktion der Mitralklappen dargestellt werden. Weiterhin ermöglicht die Echokardiographie die Diagnose einer diastolischen Füllungsstörung, sowie die Erkennung des Ausmaßes der Obstruktion bei der HOCM.
3.2.4 Therapie
Die Therapie des HCM Patienten ist primär konservativmedikamentös. Zum Einsatz kommen negativ inotrope und bradykardisierende Medikamente. Dazu zählen β-Blocker oder der Calciumantagonist Verapamil (Diltiazem). Wenn dies nicht zur gewünschten Symptomlinderung führt, kann zusätzlich eine entwässernde Medikation empfohlen werden. Vereinzelt kommt es vor allem bei progredienter Herzinsuffizienz zum Einsatz von ACE-Hemmern. Die Verlangsamung des Herzschlags hat positiven Einfluss auf die diastolischen Dysfunktionen, da die Ventrikelfüllung in der ausgedehnten Diastole vereinfacht wird. Dies führt bei HOCM Patienten im Bestfall zu einer Reduktion oder sogar Elimination des Gradienten was ein deutlich besseres klinisches Wohlbefinden für den Patienten bedeutet.
Patienten mit HOCM und/oder Mitralinsuffizienz können mit Antibiotika zur Prophylaxe einer Endokarditis behandelt werden. Bei Patienten mit HOMC empfiehlt sich eine septale Myotomie-Myektomie, um den Druckgradienten abzubauen. Hierbei wird operativ transaortal septale Muskelmasse entnommen. Dies reduziert ebenfalls die Mitralinsuffizienz. Eine modernere Methode ist die perkutane transluminale septale myokardiale Alkoholablation (PTSMA). Bei dieser Variante wird Ethanol in septale Äste der LAD injiziert, damit wird ein umschriebener Infarkt erzeugt, der für einen Rückgang an Muskelgewebe sorgt.
Für Patienten mit fortgeschrittener Herzinsuffizienz ist eine Herztransplantation der letzte Schritt. Dazu kommt es jedoch äußerst selten (Scheffold et al, 2005).
3.2.5 Gegenüberstellung HCM Mensch und Katze:
Klinisch und phänotypisch sind viele Krankheiten beim Menschen und bei den kleinen Haussäugetieren ähnlich. Dazu gehören die HCM, die bei Katzen gleichermaßen auftritt wie bei Menschen. Sie ähnelt stark der HCM beim Menschen in klinischen und pathologischen Merkmalen. Es wird angenommen, dass keine Tierart eine spontane HCM entwickelt, welche so ähnlich zu der humanen Variante ist wie die Katze (Marron und Fox, 2015). Die Prävalenz liegt insbesondere bei den Hauskatzen-, Maine Coon-, Ragdoll-, Sphynx-, Chartreux-, Britisch Kurzhaar-, norwegischen Waldkatzen- und Perser-Rassen. (Chetboul et al, 2012)
Unter anderem treten auch Fälle unter Hunden und Schweinen auf; die Dokumentation ist jedoch begrenzt. Dennoch gibt es einige Unterschiede von HCM bei Mensch und Tier, vor allem in der Expression. Die HCM bei der Katze resultiert deutlich weniger häufig in einem plötzlichen Tod, sie ist häufiger mit einer Herzinsuffizienz oder arterieller Thromboembolie als Hauptkomplikation verbunden. Ähnlich wie beim Menschen liegt die Ursache der Katzen-HCM in einer linksventrikulären Abflussobstruktion bzw. diastolischen Dysfunktion (Fox et al, 2014; Olivotto et al, 2015).
Gleichermaßen umfassende Behandlungsmethoden, wie in der Humanmedizin, lassen sich in der Tiermedizin jedoch nicht verwirklichen, darunter z.B. chirurgische Septummyektomie oder Herztransplantation. Pharmazeutika wie Betablocker, Verapamil oder Disopyramid stellen bei Katzen mit HCM die einzige Therapiemöglichkeit dar. Pathopysiologhische Übereinstimmungen lassen sich vor allem in der ungeklärten asymmetrischen linksventrikulären Hypertrophie zeigen, dabei ist das ventrikuläre Septum häufig am dicksten. Es kommt zu erhöhter LV-Masse und gesteigertem Herzgewicht (Maron et al, 2009). Gleiches lässt sich über die Histopathologischen Analogien bei Mensch und Katze sagen. Eine unorganisierte Anordnung der Myozyten mit mikrovaskuläre Erkrankungen und erweiterten interstitiellen Fibrosen ist gleichermaßen zu finden (Liu et al, 1993).
3.3 Thrombose
3.3.1 Definition:
Im lebenden Organismus können Blutpfropfen, bestehend aus Bestandteilen des Blutes, zu einer teilweisen oder vollständigen Blutgefäßverstopfung führen. Ein solches Ereignis bezeichnet man als Thrombose. Die Bildung wird durch unterschiedliche Faktoren begünstigt: Schäden an den Gefäßwänden, Beeinträchtigung des Blutstroms, sowie der Zusammensetzung des Blutes. Hierbei kann nicht nur ein lokaler Faktor, sondern auch die fehlerhafte Regulation des ganzen Organismus ursächlich sein. Die Blutgerinnung und Thrombusbildung ist ein physiologischer und lebensnotwendiger Vorgang. Entwickelt sich der Thrombus jedoch über die benötigte Größe hinaus, oder bildet er sich an Orten im Organismus an denen er keine Funktion hat (Ritter, 1955), so spricht man von der der Thrombus Krankheit (Sandritter, 2019).
3.3.2 Embolie:
Eine Embolie kann mehrere Ursachen haben. Mögliche Ursachen könne sein durch Gas, Fett oder Fremdkörper. Die Häufigste wird allerdings durch einen Thrombus verursacht. Physiologisch löst die natürliche Fibrinolyse des Körpers den entstandenen Thrombus vollständig auf. Außerdem können auch Teile oder der unveränderte Thrombus durch den Blutstrom abgeschwemmt werden. Letztendlich embolisiert der Thrombus, heißt verstopft möglicherweise lebenswichtige Organe, woraufhin langfristige irreparable Schäden entstehen können.
3.3.3 Therapie:
Bei einer Embolie muss schnell gehandelt werden, deshalb gibt es unterschiedliche Behandlungswege. Beginnend mit den Sofortmaßnahmen, wie absoluter Bettruhe, Sauerstoffzugabe, Venenzugang zur zusätzlichen Volumengabe und weitere. Als Grundtherapie steht Heparingabe zur Auswahl, allerdings löst dieses den Thrombus nicht auf, sondern hindert nur den Körper den Thrombus weiter aufzubauen. Deshalb sind Thrombolytika essenziell bei der Thrombus- bzw. Embolietherapie, wenngleich sie auch gravierende Nebenwirkungen haben (Taeger et al 1994).
3.3.4 Zusammenhang anderer kardiovaskulärer Krankheiten:
Schon PUTNOKI und FARKAS fanden bei Sektionen heraus, dass Thrombose 2,5-mal öfter bei kardiovaskulären Vorerkrankungen auftritt, als bei anderen Erkrankungen. Auch andere Urheber (BODON, KUHN, SCHLEUSSING) berichten von Embolien, die fast bedingungslos bei Defiziten der Kreislauforgane auftraten. Noch eindeutiger beschreibt KOEGEL einen Zusammenhang von einem Drittel der Thrombose- und Embolieauftreten bei Herzinsuffizienz-Erkrankten. Es besteht also ein kausaler Zusammenhang kardiovaskulärer Krankheiten mit Thrombose (Bartók, 1959).
3.3.5 Weitere Risikofaktoren:
Alter (über 65 Jahre), arterielle Hypertonie, Diabetes mellitus, früherer Schlaganfall (Stöllberger et al, 1999)
3.4. Arterieller Hypertonie
Die arterielle Hypertonie (AH) ist eine der bekanntesten chronischen Herzerkrankungen der Menschen, die zerebrovaskuläre Schlaganfälle, koronare Herzkrankheiten, Herzinsuffizienz oder Nierenerkrankungen und sekundär erhöhte Mortalität zur Folge hat.
3.4.1 Ursache:
Neuesten Berichten zufolge ist die Ursache für arterielle Hypertonie zu 95% idiopathischer Natur, nur zu 5 % auf einen bestimmten Grund zurückzuverfolgen. Die sekundäre AH allerdings ist auf Nierenparenchym- und Nierengefäßkrankheiten, Erkrankungen der Nebenniere (z.B. Cushing-Syndrom), sowie endokrine Funktionsstörungen (z.B. Schilddrüse) oder Fettleibigkeit zurückzuführen (Kallikazaros, 2013).
3.4.2 Definition:
Bei der arteriellen Hypertonie liegt der systolische Blutdruck bei mehrmaliger Messung über 140 mmHg oder der diastolische über 90 mmHg. Das Stadium der Erkrankung lässt sich ferner in drei Kategorien zuweisen: - Leicht: systolisch 140-159 mmHg, diastolisch 90-99 mmHg - Mittelschwer: systolisch 160-179 mmHg, diastolisch 100-109 mmHg - Schwer: systolisch größer gleich 180 mmHg, diastolisch größer gleich 110 mmHg Entsprechend dem Schweregrad sollte bei steigenden Blutdruckwerten proportional schneller eine Abklärung bzw. Therapie begonnen werden, um eine gesteigerte Lebenserwartung zu gewährleisten. Hierbei sind Symptome wie Somnolenz, schwere Kopfschmerzen, Verwirrung, Nausea, Vomitus oder Sehstörungen Anzeichen des hypertensiven Notfalls.
3.4.3 Pathophysiologie:
Nachstehende Messgrößen beeinflussen den Blutdruck maßgeblich und sind elementar für das Verständnis: Die Hypertonie bedeutet also eine Steigerung des Produkts aus Gefäßwiderstand und Herz-Zeitvolumen bzw. pathophysiologisch, dass die Konstanthaltung des Blutdrucks gestört ist. Meist passt sich der totale Gefäßwiderstand bei einer manifestierten Hypertonie an, indem er sich erhöht; das Herz-Zeitvolumen bleibt normal bzw. sinkt. Das Herz und die Widerstandsgefäße hypertrophieren durch die anhaltende Druckbelastung. Folglich steigt der Widerstandszuwachs bei einer Kontraktion der Gefäße, d.h. es resultiert in einer verstärkten Antwort auf Pressoren. Der erhöhte Blutdruck wird bei Hypertonieerkrankten als „normal“ wahrgenommen, da die Schwelle der Barorezeptorreflexe verschoben ist.
Blutdruck= totaler peripherer Gefäßwiderstand x Herz-Zeitvolumen
3.4.4 Folgen
Folgen der Hypertonie eingeteilt nach Schweregrad: [nach WHO] -Stadium 1: keine Schäden der Endorgane - Stadium 2: Leichte Organschäden: Linksventrikuläre Hypertrophie, Retinopathie Stadium 1 oder 2, Proteinurie -Stadium 3: Schwere Organschäden: Linksherzinsuffizienz, Retinopathie Stadium 3 oder 4, zerebrale Komplikationen, Niereninsuffizienz
Zu beachten ist ein jeder kardiovaskulärer Risikofaktor, der mit der arteriellen Hypertonie die Krankheitsrate und Sterblichkeit kardiovaskulärer Erkrankungen erhöht. Solche Risikofaktoren sind: - Hypercholesterinämie (ca. 40 % aller Hypertonieerkrankten!) - Diabetes mellitus (35-75% der kardiovaskulären Beeinträchtigungen bei Diabetikern haben ihre Ursache in der Hypertonie!) - Hypertonie, Insulinresistenz, Dyslipidämie und Adipositas häufig in Kombination - Syndrom X (Mikroalbuminurie, erhöhter Harnsäurespiegel, Hyperkoagulabilität und akzelerierte Arteriosklerose wirken synergistisch!)
Da diese Faktoren oftmals im Alter auftreten, stellt das Alter (>60) selbst den wesentlichen Risikofaktor dar (Battegay, 2001).
3.5. Aortenstenose
3.5.1 Definition:
Die Aortenstenose, oder Aortenklappenstenose zeichnet sich durch eine Verengung der Herzklappen zwischen Herz und Aorta aus.
3.5.2 Pathophysiologisch:
Infolge der Stenose steigt der Druck in der linken Kammer und der Aorta, woraufhin sich eine Hypertrophie als Ausgleich entwickelt, um ein hinreichendes Herzzeitvolumen zu gewährleisten. Genauer: Mit schwindender Größe der Öffnung, steigt das Schlagvolumen, welches zu einem erhöhten systolischen Gradienten führt. Als Kompensation auf die steigende, anhaltende Druckbelastung des linken Herzens, hypertrophiert die linke Kammer. Die Wand wird dicker; die Spannung der Wand nimmt ab. Später führt dies zur Verminderung der Kontraktionsfähigkeit und sinkender Fähigkeit des linken Herzens genügend Pumpleistung aufzubringen, heißt eine Herzinsuffizienz. Fördernd wirken hierbei Arteriosklerotische Vorgänge (Flachskampf und Daniel, 2004).
3.5.3 Pathohistologisch:
Anhand von einem Versuch an Wistarratten konnte festgestellt werden, dass die Herzmuskelzellen infolge der bestehenden Aortenstenose einzelne Nekrosen aufwiesen. Die Mitochondrien schwollen an, zudem erweiterte sich das endoplasmatische Retikulum, sowie die Dekomposition der Myofilamente. Parallel steigert sich die Aktivität der Zellen, wobei sich charakteristisches Ergastoplasma bildet. Darüber hinaus bildeten sich neue Herzmuskel- und Adventitiazellen (Wegner und Mölbert, 1966).
Bei Menschen tritt auch bei längerer Belastung durch den gesteigerten anhaltenden Druck und das hypertrophierte linke Herz, eine Schädigung des Herzmuskels, sowie der inneren subendokardialen Schichten auf.
3.5.4 Zusammenhang mit dem Alter:
Mit zunehmender Inzidenz bei älteren Personen, ist die degenerativ-kalzifizierende Aortenstenose eine der wichtigsten und verbreitesten Krankheiten. Allein 5% der über 75-Jährigen haben ebensolche. Ferner erfahren davon 50% einen schweren Verlauf.
Festzustellende Symptome sind hierbei die Belastungsdyspnoe, Schwindel oder Synkopen, sowie die Angina pectoris.
3.5.5 Prophylaxe:
Als eine Form der Prophylaxe der Aortenstenose ist die Gabe von Statinen. Die Wirkung ist allerdings noch nicht endgültig in vollem Maße geklärt (Flachskampf und Daniel, 2004).
4. Prävention?
Allgemein lässt sich über das alternde Herz folgende Aussagen treffen:
Es lassen sich Alterungsprozesse wie das Undichtwerden der Herzklappen aufgrund des unnachgiebig werdenden Endokards nachweisen. Außerdem finden sich oft leichte Vergrößerungen der Arterien, sowie der atrioventrikulären Ostien und die der Aorta nebst der A. pulmonalis. Die Kammermuskulatur hypertrophiert ebenfalls leicht, während die Koronararterien an Elastizität verlieren. Einzig die Lipofuszinablagerung, das Altersamyloid und die Ablagerung von Fett in den Arterien ließen sich mit dem Alter in Verbindung bringen, allerdings ist dies nach H.FRANKE auch schon in Herzen 40-Jähriger mit zehrenden Krankheiten zu finden. Eine wahrhaft handfeste mikroskopische Alterung der Myokardzellen lässt sich ebenfalls nicht feststellen. Eher eine schlechtere Anpassungsfähigkeit im Allgemeinen an äußere Umstände und Belastungen, sowie das Auftreten allgemeiner altersbedingter Stoffwechselerkrankungen bzw. -schwächen, die kardiovaskuläre Erkrankungen begünstigen (wie Ablagerungen in der Aorta die chronische Aortenstenose begünstigen).
Das Herz büßt zwar im Laufe des Lebens an Leistung ein, allerdings kann der alte Mensch zwischen 50 bis 60 Jahren einerseits durch einen gesunden Lebensstil, als auch durch sportliche Betätigung „dem Verfall“ entgegenwirken und dadurch auf demselben körperlichen Stand, wie 20 Jahre Jüngere kommen (Franke, 1982).
5. Literaturverzeichnis:
Wei, J.Y. (1992): Age and the Cardiovascular System. N Engl J Med 327:1735-1739
https://www.nejm.org/doi/full/10.1056/NEJM199212103272408
Müller-Werdan, U.; Meisel, M.; Schirdewahn, P. et al. (2007): Ältere Patienten mit kardiovaskulären Erkrankungen. Internist 48, 1211–1219
https://doi.org/10.1007/s00108-007-1941-7
North, B. J.; Sinclair, D. A. (2012): The Intersection Between Aging and Cardiovascular Disease. Circulation Research 110: 1097–1108
https://doi.org/10.1161/CIRCRESAHA.111.246876
Olivetti, G.; Melissari, M.; Capasso, J. M.; Anversa, P. (1991): Cardiomyopathy of the aging human heart. Myocyte loss and reactive cellular hypertrophy. Circulation Research 68:1560–1568.
https://doi.org/10.1161/01.RES.68.6.1560
Arndt, J.O. (1983): Funktions- und Regelprinzipien des Niederdrucksystems 156. Springer, Berlin, Heidelberg.
https://doi.org/10.1007/978-3-642-68881-2_3
Isoyama, S.; Grossman, W.; Wei, Y. J. (1988): Effect of age on myocardial adaptation to volume overload in the rat. J Clin Invest. 81(6):1850–1857
https://www.jci.org/articles/view/113530
Takahashi, T.; Schunkert, H., Isoyama, S.; Wei, J. Y.; Nadal-Ginard, B.; Grossmann, W.; Izumo, S. (1992): Age-related differences in the expression of proto-oncogene and contractile protein genes in response to pressure overload in the rat myocardium. J Clin Invest. 89(3):939– 946
https://www.jci.org/articles/view/115675
Wei, Y. J.; Gersh, B. J. (1987): Heart disease in the elderly. Current Problems in Cardiology. 12: 7-65
https://www.sciencedirect.com/science/article/abs/pii/0146280687900156
Lipsitz, A. L.; Jonsson, V. P.; Marks, B.L.; Parker, J. A.; Royal, H. D.; Wei, J. Y. (1190): Reduced Supine Cardiac Volumes and Diastolic Filling Rates in Elderly Patients with Chronic Medical Conditions. Implications for Postural Blood Pressure Homeostasis. Journal of the American geriatrics society. 38: 103-107)
https://doi.org/10.1111/j.1532-5415.1990.tb03469.x
Shannon, P. R.; Maher, K. A.; Santinga, T. J.; Royal H.D.; Wei, J. Y. (1991): Comparison of differences in the hemodynamic response to passive postural stress in healthy subjects >70 years and <30 years of age,The American Journal of Cardiology, 67 (13): 1110-1116
https://www.sciencedirect.com/science/article/pii/000291499190874K
Nixon, J.V. Nixon; Hallmark,H.; Page, K.; Raven, P. R.; Mitchell, J.H. (1985): Ventricular performance in human hearts aged 61 to 73 years. The American Journal of Cardiology 56 (15): 932-937
https://www.sciencedirect.com/science/article/pii/0002914985904072
Ogawa, T.; Spina, R. J.; Martin, W. H.; Kohrt, W. M.;Schechtman, K. B.; Holloszy, J. O.; Ehsani, A. A. (1992): Effects of aging, sex, and physical training on cardiovascular responses to exercise. Circulation. 86:494–503
https://www.ahajournals.org/doi/abs/10.1161/01.CIR.86.2.494
Lakatta, E. G.; Levy, D. (2003): Arterial and Cardiac Aging: Major Shareholders in Cardiovascular Disease Enterprises Part II: The Aging Heart in Health: Links to Heart Disease. Circulation 107:346–354
https://doi.org/10.1161/01.CIR.0000048893.62841.F7
Lesnefsky, E. J.; Chen, Q.; Hoppel, C. L.(2016): Mitochondrial Metabolism in Aging Heart. Circulation Research 118:1593–1611
https://doi.org/10.1161/CIRCRESAHA.116.307505
Antelmi, I.; De Paula, R. S.; Shinzato, A. R.; Peres,C. A.; Mansur, A. J.; Grupi, C. J.(2004): Influence of age, gender, body mass index, and functional capacity on heart rate variability in a cohort of subjects without heart disease.The American Journal of Cardiology 93 (3): 381-385
https://www.sciencedirect.com/science/article/pii/S0002914903015054
Calvert, C. A.; Chapman, W. L.; Toal, R. L. (1982): Congestive cardiomyopathy in Doberman Pinscher dogs. J Am Vet Med Assoc 181:598–602
https://europepmc.org/article/med/7141953
Calvert, C. A.; Hall, G.; Jacobs, G.; Pickus, C. (1997): Clinical and pathologic findings in Doberman pinschers with occult cardiomyopathy that died suddenly or developed congestive heart failure: 54 cases (1984-1991). J Am Vet Med Assoc 210:505–511
https://europepmc.org/article/med/9040836
Everett, R. M.; McGann, J.; Wimberly, H. C.; Althoff, J.(1999): Dilated cardiomyopathy of Doberman pinschers: retrospective histomorphologic evaluation of heart from 32 cases. Vet Pathol 36:221–227
https://journals.sagepub.com/doi/abs/10.1354/vp.36-3-221
Hazlett, M. J.; Maxie, M. G.; Allen, D. G.; Wilcock, B. P. (1983): A retrospective study of heart disease in Doberman pinscher dogs. Can Vet J 24:205–210
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1790348/
Collins, C.; Tzima, E. (2011): Hemodynamic forces in endothelial dysfunction and vascular aging, Experimental Gerontology. 46: 185-188
https://www.sciencedirect.com/science/article/pii/S0531556510003025
Brandes, R. P.; Fleming, I.; Busse, R. (2005) Endothelial aging, Cardiovascular Research. 66(2): 286–294
https://doi.org/10.1016/j.cardiores.2004.12.027
Nilsson, P. M.; Khalili, P.; Franklin, S. S. (2014):Blood pressure and pulse wave velocity as metrics for evaluating pathologic ageing of the cardiovascular system, Blood Pressure, 23: 17-30
https://www.tandfonline.com/doi/abs/10.3109/08037051.2013.796142
Lakatta, E. G.; Levy, D. (2003): Major Shareholders in Cardiovascular Disease Enterprises Part I: A “Set Up” for Vascular Disease. Circulation 107:139–146
https://doi.org/10.1161/01.CIR.0000048892.83521.58
Abdellatif, M.; Sedej, S.; ,Carmona-Gutierrez, D.; Madeo, F; Kroemer, G. (2018): Autophagy in Cardiovascular Aging. Circulation Research.123:803–824
https://doi.org/10.1161/CIRCRESAHA.118.312208
Tidholm, A.; Jönsson, L. (2005): Histologic Characterization of Canine Dilated Cardiomyopathy. Veterinary Pathology. 42(1):1-8
https://journals.sagepub.com/doi/abs/10.1354/vp.42-1-1
Alroy, J.; Rush, J. E.; Freeman, L.; Amarendhra Kumar, M. S.; Karuri, A.; Chase, K.; Sarkar, S. (2000): Inherited infantile dilated cardiomyopathy in dogs: genetic, clinical, biochemical, and morphologic findings. Am J of Med Genet 95:57–66, 2000
https://doi.org/10.1002/1096-8628(20001106)95:1%3C57::AID-AJMG12%3E3.0.CO;2-O
Sandusky, G. E.; Capen, C. C.; Kerr, K. M. (1984): Histological and ultrastructural evaluation of cardiac lesions in idiopathic cardiomyopathy in dogs. Can J Comp Med 48:81–86
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1236010/
Liu, S-K.; Tashijan, R. J.; Patniak, A. K.(1970): Congestive heart failure in the cat. J Am Vet Med Assoc 156:1319–1330
https://www.cabdirect.org/cabdirect/abstract/19702204976
Michels, V. V.; Moll, P. P.; Miller, F. A.; Tajik, A. J.; Chu, J. S.; Driscoll, D. J.; Burnett, J. C.; Rodeheffer, R. J.; Chesebro, J. H.; Ta-zelaar, H. D.(1992): The frequency of familial dilated cardiomy-opathy in a series of patients with idiopathic dilated car-diomyopathy. N Eng J Med 9:77–82
https://www.nejm.org/doi/full/10.1056/NEJM199201093260201
Dukes-McEwan, J. (1999): Echocardiographic/Doppler Criteria of Normality, the Findings in Cardiac Disease and the Genetics of Familial Dilated Cardiomyopathy in Newfoundland Dogs. University of Edinburgh, Edinburgh, UK, 318
https://era.ed.ac.uk/handle/1842/30168
Meurs, K. M. (1998): Insight into the hereditability of canine car-diomyopathy. Vet Clin North Am Small Anim Pract 28:1449–1457
https://www.sciencedirect.com/science/article/pii/S0195561698501313
Dambach, D. M., Lannon, A., Sleeper, M. M.; Buchanan, J. (1999): Familial dilated cardiomyopathy of young Portuguese water dogs. J Vet Intern Med 13:65–71
https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1939-1676.1999.tb02167.x
Sisson, D. S.; O'Grady, M. R.; Calvert, C. A. (1999): Myocardial diseases of dogs. Textbook of Canine and Feline Cardiology: Principles and Clinical Practice: 581–619
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1476295/
Scheffold, T.; Binner, P.; Erdmann, J.(2005): Hypertrophe Kardiomyopathie. Herz 30: 550–557 (2005).
https://doi.org/10.1007/s00059-005-2731-4
Chetboul, V.; Petit, A.; Gouni, V.; Trehiou-Sech,i E.; Misbach, C.; Balouka, D.; Sampedrano, C. C.; Pouchelon, J. L.; Tissier, R.; Abitbol, M.(2012): Prospective echocardiographic and tissue Doppler screening of a large Sphynx cat population: reference ranges, heart disease prevalence and genetic aspects. J Vet Cardiol 14:497-509.
https://www.sciencedirect.com/science/article/abs/pii/S1760273412001038
Fox, P. R.; Basso, C.; Thiene, G.; Maron, B. J.(2014): Spontaneously occurring restrictive nonhypertrophied cardiomyopathy in domestic cats: a new animal model of human disease. Cardiovasc Pathol 23: 28-34.
https://www.sciencedirect.com/science/article/abs/pii/S1054880713001567
Olivotto, I.; d’Amati, G.; Basso, C.; Van Rossum, A.; Patten, M.; Emdin, M.; Pinto, Y.; Tomberli, B.; Camici, P. G.; Michels, M. (2015): Defining phenotypes and disease progression in sarcomeric cardiomyopathies: contemporary role of clinical investigations. Cardiovascular Reserch 105: 409-423.
https://academic.oup.com/cardiovascres/article/105/4/409/277887
Maron, M. S.; Maron, B. J.; Harrigan, C.; Buros, J.; Gibson, C. M.; Olivotto, I.; Biller, L.: Lesser, J. R.; Udelson, J. E.; Manning, W. J.; Appelbaum, E. (2009): Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol 54: 220-228.
https://www.sciencedirect.com/science/article/pii/S0735109709015198
Liu, S. K.; Roberts, W. C.; Maron, B. J.(1993): Comparison of morphologic findings in spontaneously occurring hypertrophic cardiomyopathy in humans, cats and dogs. Am J Cardiol 72: 944-951.
https://www.sciencedirect.com/science/article/abs/pii/000291499391112U
Maron, B. J.; Fox, P. R. (2015): Hypertrophic cardiomyopathy in man and cats, Journal of Veterinary Cardiology, 17 (1): 6-9
https://www.sciencedirect.com/science/article/pii/S1760273415000648
Franke, H. (1982): Die Besonderheiten der Herz- und Kreislauferkrankungen im Alter. Aktuelle Themen der Alterskardiologie: 1-2
https://link.springer.com/chapter/10.1007/978-3-642-68577-4_1
Sandritter, W. (2019): Thrombose. Ergänzungsband 1: 465-590
https://www.degruyter.com/document/doi/10.1515/9783111443522-006/html
Taeger, K.; Rödig, G.; Finsterer, U. (1994): Grundlagen der Anästhesiologie und Intensivmedizin für Fachpersonal. Band I: Anatomie und klinische Physiologie: 1103-1104
https://epub.ub.uni-muenchen.de/9196/1/9196.pdf
Bartók, I. (1959): Vermehrung der Fälle von Thrombose und Lungenembolie und ihre Ursachen: 622
https://link.springer.com/content/pdf/10.1007/BF00956328.pdf
Stöllberger, C.; Finsterer, J.; Slany, J. et al. (1999): Antithrombotische Therapie bei Vorhofflimmern und zusätzlichen Schlaganfall-/Embolie-Risikofaktoren. Z Kardiol 88: 442–447
https://link.springer.com/article/10.1007/s003920050307
Kallikazaros, I. E. (2013): Arterial Hypertension. Hellenic Journal of Cardiology 54: 413-416
https://www.hellenicjcardiol.org/archive/full_text/2013/5/2013_5_413.pdf
Battegay, E. (2001): Arterielle Hypertonie: 3-9
http://home.datacomm.ch/vascularbiology/VorlesungHypertonie2002.pdf
Flachskampf, F.A.; Daniel, W.G. (2004): Aortenstenose. Internist 45: 1281–1292
https://link.springer.com/article/10.1007/s00108-004-1285-5
Wegner, G.; Mölbert, E. (1966): Das Verhalten des Myokards bei der experimentellen supravalvulären Aortenstenose. Virchows Arch. path Anat. 341: 54–63
https://link.springer.com/article/10.1007/BF00959244
Abbildungsverzeichnis:
Abbildung 1: Überblick über morphologische Veränderungen, selbst angefertigt
Bild 1: Röntgenaufnahme DCM Hund, zur Verfügung gestellt von der Tierarztpraxis Dr. Uwe Kästner Wernigerode
Bild 2: Röntgenaufnahme DCM Hund prätherapeutisch, zur Verfügung gestellt von der Tierarztpraxis Dr. Uwe Kästner Wernigerode
Bild 3: Röntgenaufnahme DCM Hund posttherapeutisch, zur Verfügung gestellt von der Tierarztpraxis Dr. Uwe Kästner Wernigerode