|
Size: 35833
Comment:
|
← Revision 95 as of 2017-05-03 18:08:42 ⇥
Size: 35991
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 79: | Line 79: |
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em;text-align:center">'''Abbildung 4''' {{https://upload.wikimedia.org/wikipedia/commons/6/6e/Alzheimer.jpg|aufspringender Text}} <<BR>>'''Stadien der Pathogenese'''<<BR>>''Veranschaulichung der Hirnatropie während der verschiedenen Stadien'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em;text-align:center">'''Abbildung 4''' {{https://upload.wikimedia.org/wikipedia/commons/6/6e/Alzheimer.jpg|aufspringender Text}} <<BR>>'''Stadien der Pathogenese'''<<BR>>''Veranschaulichung der Hirnatropie während der verschiedenen Stadien'' || |
| Line 117: | Line 117: |
| ||<tablebgcolor="#eee" tablestyle="float:center;font-size:1.0em;margin:0 0; "style="padding:0.5em; ;text-align:center">'''Abbildung 6''' || | ||<tablebgcolor="#eee" tablestyle="float:center;font-size:1.0em;margin:0 0; "style="padding:0.5em; ;text-align:center">'''Abbildung 6''' || |
| Line 147: | Line 147: |
| 1. <<Anchor(3)>> Maurer,K.; Frölich, R.; Ihl, L. (2013): Alzheimer- Grundlagen, Diagnostik, Therapie ; Springer Verlag, Seite 1-14 1. <<Anchor(4)>> Stoppe (2008): Demenz; Georg Thieme Verlag KG Stuttgart, New York, PiD - Psychotherapie im Dialog; 9(1): 43-47 1. <<Anchor(5)>> Metzler Poeschel (1998/2000): Statistisches Bundesamt; Statistisches Jahrbuch 1998 für die Bundesrepublik Deutschland. Wiesbaden; Georg Thieme Verlag 1. <<Anchor(6)>> Bickel, H. (2000): Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankungen in Deutschland, Georg Thieme Verlag Stuttgart · New York, Gesundheitswesen 2000; 62(4): 211-218 1. <<Anchor(7)>> Bickel, H. (1999): Deskriptive Epidemiologie der Demenzen. In: Helmchen,H.; Henn,F.; Lauter,H.; Sartorius,N.: (Hrsg.). Psychiatrie der Gegenwart, Bd. 4, Psychische Störungen bei somatischen Krankheiten. Heidelberg; Springer: 33-52 1. <<Anchor(8)>> Stoppe, G. (2007): Demenz. 2. Aufl. München; UTB Ernst Reinhardt 2007 a/ Stoppe 1. <<Anchor(9)>> Möller, H. J. ( 1996): Tacrin, Möglichkeiten und Grenzen bei der Behandlung der Demenz vom Alzheimer- Typ. Psychopharmakotherapie 3, 103- 108 1. <<Anchor(10)>> Rogers, S. L.; Farlow, M. R.; Doody, R. S.; Mohs, L. R.; Friedhoff, T. (1998): The Donepezil Study Group: A 24-week, double-blind, placebo-controlled trial of donepezil in patients with Alzheimer's disease Neurology 50; 135-145 1. <<Anchor(11)>> Corey- Bloom, J.; Anand, R.; Veach, J. (1998) : For the ENA 713 (rivastigimine tartrate), A new acetylcholinesterase inhibitor, in patients with mild to moderately severe Alzheimer's disease. Int. J. Geriatric Psychopharmacology 1; 55-65 |
1. <<Anchor(3)>> Maurer,K.; Frölich, R.; Ihl, L. (2013): Buch: Alzheimer- Grundlagen, Diagnostik, Therapie ; Springer Verlag, Seite 1-14 1. <<Anchor(4)>> Stoppe, Gabriela (2008): Demenz; in PiD - Psychotherapie im Dialog; Georg Thieme Verlag KG Stuttgart; 9(1): 43-47 1. <<Anchor(5)>> Metzler; Poeschel (1998/2000): Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankung in Deutschland. Zitiert aus dem Statistisches Jahrbuch 1998 für die Bundesrepublik Deutschland. Wiesbaden; Georg Thieme Verlag: 62(4):211-218 1. <<Anchor(6)>> Bickel, H. (2000): Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankungen in Deutschland, in Gesundheitswesen 2000; Georg Thieme Verlag: 62(4): 211-218 1. <<Anchor(7)>> Bickel, H. (1999): Deskriptive Epidemiologie der Demenzen. Zitiert aus Helmchen,H.; Henn,F.; Lauter,H.; Sartorius,N.: (Hrsg.). Psychiatrie der Gegenwart - Psychische Störungen bei somatischen Krankheiten. Heidelberg; Band 4; Springer: 33-52 1. <<Anchor(8)>> Stoppe, Gabriela (2008): Demenz; in PiD - Psychotherapie im Dialog; Georg Thieme Verlag KG Stuttgart; 2. Aufl. München; 9 (1): 43-47 1. <<Anchor(9)>> Möller, H. J. ( 1996): Tacrin - Möglichkeiten und Grenzen bei der Behandlung der Demenz vom Alzheimer- Typ.; in Psychopharmakotherapie 3, 103- 108 1. <<Anchor(10)>> Rogers, S. L.; Farlow, M. R.; Doody, R. S.; Mohs, L. R.; Friedhoff, T. (1998): The Donepezil Study Group: A 24-week, double-blind, placebo-controlled trial of donepezil in patients with Alzheimer's disease; in Neurology Vol. 50: 135-145 1. <<Anchor(11)>> Corey- Bloom, J.; Anand, R.; Veach, J. (1998) : A new acetylcholinesterase inhibitor in patients with mild to moderately severe Alzheimer's disease; in Geriatric Psychopharmacology 1; 55-65 |
| Line 171: | Line 171: |
| 1. <<Anchor(27)>> Hampel, H.; Padberg,F.; Möller H.-J.(1998): Donepezil in der Pharmakotherapie der Alzheimer Demenz. Psychopharmakotherapie 2, 54- 61 | 1. <<Anchor(27)>> Hampel, H.; Padberg,F.; Möller H.-J.(1998): Donepezil in der Pharmakotherapie der Alzheimer Demenz; in Psychopharmakotherapie 2: 54- 61 |
Itt írjon a(z) AlzheimerParkinson_de-ról/ről
Alzheimer: Die Pathogenese der neurodegenerativen Krankheit Alzheimer
Die KrankheitAlzheimer (AK; Alzheimer Krankheit, lateinisch Morbus Alzheimer), benannt nach dem Arzt Alois Alzheimer, (Abbildung 1) ist eine neurodegenerative Erkrankung, welche „eine schwere, ständig fortschreitende, heute noch unheilbare Hirnleistungsschwäche, die meistens in der 2. Lebenshälfte auftritt“, beschreibt. Im Bereich der Großhirnrinde und des Allokortex kommt es aus bisher unbekannten Gründen zu einem Untergang von Hirnzellen, welche für höhere noetische Funktionen verantwortlich sind [(3)].
Contents
Allgemeines über Alzheimer
Abbildung 1 |
|
Alois Alzheimer |
Alzheimer Krankheit gilt als häufigste Ursache der Demenz, welche ein ätiologisch unspezifisches Syndrom bezeichnet. Demenz ist reversibel, permanent oder progredient und kann durch eine Vielzahl von unterschiedlichen Erkrankungen verursacht werden. [(4)] Unter einer Demenz versteht man eine erworbene Störung des Gedächtnisses sowie weiterer Funktionen, z. B. der Sprache, Rechnen, Auffassungen, Orientierung, Lernfähigkeit oder Urteilsfähigkeit, die so ausgeprägt sind, dass sie die Bewältigung des Alltags beeinträchtigen [(2)].
Alzheimer Demenz
Da in mehr als zwei Drittel der Fälle die Alzheimerdemenz/Alzheimer Krankheit (AK) als primäre Ursache steht, wird in öffentlichen Diskussionen häufig Alzheimer und Demenz als synonym verwendet. Bei über 80 % aller Demenzkrankheiten, spielt die Alzheimerpathologie eine Rolle [(1)]. Für die AD ist ein progredienter Verlauf charakteristisch. Hauptsymptom ist vor allem die kognitive Beeinträchtigung. Im Verlauf der Krankheit kann es zu depressiven Phasen, Schlafstörungen und Gereiztheit kommen [(1),(2)].
Vaskuläre Demenz
Die vaskuläre Demenz verursacht lediglich 10 % der Demenz Erkrankung. Charakteristisch hierbei ist, dass diese Form der Demenz plötzlich beginnt und sich stufenweise verschlechtert. Sie ist meistens verursacht durch Schlaganfälle, ischämische Attacken, Infarkte oder Hirnblutungen, welche häufig durch venöse Verschlüsse ausgelöst werden [(1),(2)].
Auftreten in der Bevölkerung
Allein im 20. Jahrhundert, hat sich bei weiterhin anhaltenden Wachstum, die Zahl der Erkrankten von 3,2 Millionen auf 12,9 Millionen vervierfacht. Bei der über 80- Jährigen Bevölkerung, hat sich die Zahl der Betroffenen sogar verelffacht, von 0,3 Millionen auf 3,2 Millionen Betroffenen [(5)]. Somit stellt die Altersdemenz einen sehr hohen Bedarf an Pflegebedürftigkeit dar. Außerdem ist festzuhalten, dass nach Auskünften der wenigen Studien zurPrävalenzder so genannten präsenilen Demenz, darauf zu schließen ist, dass wahrscheinlich weniger als 0,1% der erkrankten Bevölkerung, sich im Altersbereich zwischen 40 und 64 Jahren befinden [(7)]. Anteilig wird von 60% der neuen Krankheitsfällen davon ausgegangen, dass es sich bei erkrankten Personen im Alter der über 80- Jährigen entwickelt. Hinzu sind 70% der Ersterkrankten Frauen [(6)]. Auf Grund der stetig zunehmenden Lebenserwartung, wird davon ausgegangen, dass im Jahre 2050 bis zur 1 Millionen Neuerkrankungen auftreten werden [(2)].
Klassische Symptome
Zu den kognitiven Störungen wie Gedächtnis-, Sprach- und Urteilsstörungen kommen auch Störungen der Emotionalität, des Verhaltens, des Schlafes, sowie Mangelerscheinungen in vielen weiteren Bereichen. Zu den häufigsten Symptomen gehören Unruhezustände, sowie Antriebs- und Interessenarmut. Ebenso treten besonders in fortgeschrittenen Krankheitsstadien häufig Aggressionen auf. All diese Symptome machen es für die Betroffenen besonders wichtig, dass sie ein geregeltes Äußeres haben. Ein einheitlicher Rhythmus und eine externe Stützung sind somit besonders wertvoll, um den Erkrankten in ihrer Situation Kraft zu geben [(8)].
Ursachen
Neurobiologische Grundlagen
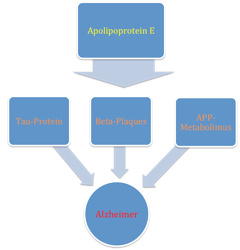
Die Ursache der Alzheimer-Erkrankung ist die fortschreitende Zerstörung von Nervenzellen und Synapsen, welche besonders im Temporal- und Parietallappen zur Ausprägung kommt. Dabei reduziert sich die Anzahl der vorhandenen Synapsen teilweise um mehr als 50% [(20)]. Es sind zwei verschiedene Formen der Krankheit bekannt. Etwa 5% bis 10% der Fälle sind auf die Mutation dreier unterschiedlicher Gene zurückzuführen, der Großteil hingegen auf Al2terungsprozesse [(23)]. Man geht heute davon aus, dass die sogenannte Pathologische Kaskade der Krankheit auf zwei Veränderungen im neuronalen Proteinstoffwechsel zurückzuführen sind [(20)] (Abbildung 3).
Das Amyloid Precursor Protein (APP)
Bei dem Amyloid- Vorläuferprotein handelt es sich um den Vorgänger eines Membranproteins mit, bis heute, ungeklärter Funktion. Es wird jedoch vermutet, dass es eine Rolle bei der Bildung synaptischer Kontakte, bei der Regulation des intraneuronalen Kalziums, dem Neuritenwachstum, sowie als Reperaturprotein spielt. Bei Alzheimer-Patienten wird dieses Eiweiß an anderen Stellen gespalten als bei gesunden Menschen. Anstelle des normalen, aus 40 Aminosäuren zusammengesetzten, beta-Amyloid-Proteins (40-βA4) kommt es zur bildung von 42 beziehungsweise 43 Aminosäuren enthaltenden Eiweißen [(20)]. Der strukturelle Unterschied ist dabei auf ein zusätzliches Cystein oder Arginin zurückzuführen [(21)]. Diese längeren Amyloideiweiße zeigen jedoch eine höhere Affinität sich zusammenzufügen und so extrazelluläre Ablagerungen zu bilden. Solche sogenannten Plaques (Abbildung 2) sind bereits unter einem Lichtmikroskop erkennbar und können eine Fläche von bis zu 100 Nervenzellen einnehmen, die hierbei abgedeckten Neuriten dystrophieren im Laufe der Zeit [(20)]. Desweiteren scheint es bei der Synthese von ApoE4 zur Bildung eines neurotoxischen Fragmentes von etwa 29 kDa zu kommen, welches ins Zytosol der Neuronen eindringen und dort zu mitochondriellen Dysfunktionen und Veränderungen des Zytoskelettes führt [(21)].
Abbildung 2 |
|
Beta-Amyloid-Plaque |
Abbildung 3 |
|
Ursachen von Morbus Alzheimer |
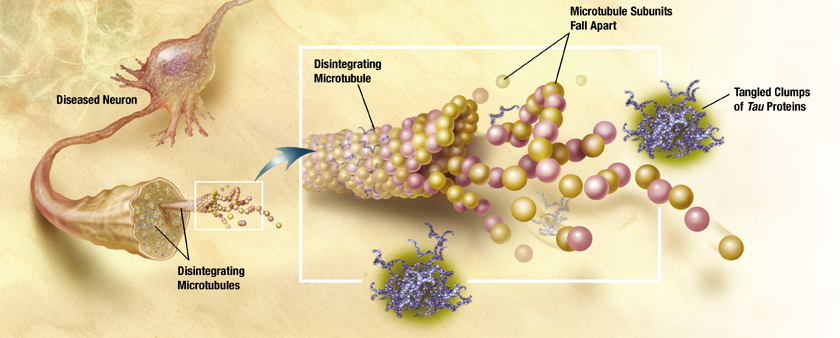
Das Tau-Protein
Das Tau-Protein unterstützt, im gesunden Organismus, den Stofftransport innerhalb der Nervenzelle indem es die Mikrotubuli stabilisiert und ihre physiologische Anordnung kontrolliert. Die Affinität des τ-Proteins sich an die Mikrotubuli zu binden wiederum, wird durch mehrere posttranslationelle Prozesse gesteuert, vor allem durch Phosphorylierung, Acetylierung und Glykolisierung [(22)]. Im Zuge der Alzheimer-Erkrankung kommt es jedoch zu einer Hyperphosporylierung des τ- Eiweißes wodurch es seine Bindungsfähigkeit an die Mikrotubuli einbüßt, stattdessen bilden sich dimere Komplexe [(20)]. Diese aggregieren zu unlöslichen Bündeln und destabilisieren so die Nervenzellen [(22)]. Ohne das intrazelluläre Mikrotubulisystem wird der Stofftransport allerdings stark gestört, teilweise kommt er sogar zum völligen Erliegen. Hinzu kommt, dass die Synthese von Protein-Phosphatasen, welche diese Aggregationsprozesse normalerweise unter Kontrolle halten, aus dem Gleichgewicht gerät [(20)]. Bei an Alzheimer-Erkrankten sind die charakteristischerweise der entorhinale Cortex, der Hippocampus, sowie teilweise der Neocortex betroffen [(22)].
Glucosemetabolismus und Insulinrezeptoren
DerGlucosemetabolismus spielt eine zentrale Rolle im Stoffwechsel des Gehirns. Die Oxidation des Pyruvates stellt dabei die ausreichende Produktion des energiereichen Acteyl–CoAsicher, welches für die Synthese von ATP und Acetylcholin benötigt wird. Der Metabolismus von Glucose wird durch Insulin, welches auch in einigen Hirnarealen gebildet wird, und Cortisol antagonistisch kontrolliert [(24)]. Durch die Erkrankung an Alzheimer kommt es vermutlich zu einer zunehmenden Desensibilisierung der Insulinrezeptoren, wobei der zugrundeliegende Mechanismus nicht abschließend geklärt ist. Gleichzeitig führt die verringerte Aktivität der Acteylcholin-Transferase zu einem Mangel an Acetylcholin, welcher mit Abnahme der mentalen Fähigkeiten der Patienten korreliert [(24)].
Genetik
Bisher gibt es nur einen einzigen genetischen Risikofaktor der als wissenschaftlich gesichert gilt. Bei diesem handelt es sich um ein Allel des, bereits angesprochenen, Apolipoprotein E (Abbildung 3), dieses dient der verstoffwechselung Triglyzeridreicher Lipoproteinbestandteile. Bei besonders vielen Patienten ließ sich dabei ein überrepräsentiertes ε3-Allel finden [(20)]. Weitere Forschungen konzentrieren sich derzeit auf die mitochondriale Vererbung, sowie den Einfluss von Mutationen der Gene für die Cytochrom-Oxidase-C I und II [(20)]. Eine genetische Vorbelastung findet sich aber nur bei etwa 5- 10% der Erkrankten, den größeren Anteil machen sogenannte sporadische Erkrankungen (ca. 90%) aus [(1)].
Das APP-Gen
Dieses Gen ist auf Chromosom 21 zu finden. Es spielt jedoch eigentlich nur im Zusammenhang mit Trisomie 21 (Down-Syndrom) eine Rolle [(20)][(1)].
Das Präsenilin 1
Hierbei handelt es sich um eine monogene Form der Erkrankung. Dieses Gen ist auf Chromosom 14 lokalisiert [20]. Es ist für ca. 70% der genetisch bedingten Alzheimerfälle verantwortlich [(1)]. Zur Ausprägung kommt es bei den Trägern meist zwischen dem 30. Und 60. Lebensjahr [(20)].
Das Präsenilin 2
Der Lokus des Präsenilin 2 wurde auf dem Chromosom 1 nachgewiesen, es handelt sich damit um ein Gen mit autosomal dominantem Erbgang. [(20)] Auf diese Variante der genetischen Prädisposition sind die restlichen 30% der Erkrankungen zurückzuführen. Im Vergleich zum Präsenilin 1 kommt es allerdings erst im deutlich höheren Alter zu den ersten Symptomen [(1)].
Risikofaktoren
Abgesehen von den genetischen Prädispositionen gibt es einige weitere Faktoren, die das Risiko an Alzheimer zu erkranken signifikant erhöhen. Dabei ist besonders ein fortgeschrittenes Lebensalter zu nennen. Die Prävalenz steigt in Europa von 0,02%, bei den 30 bis 59 Jährigen, auf etwa 10,8% bei den 80 bis 89 Jährigen [(20)]. Eine weitere Gefahrengruppe sind Personen welche bereits eine schwere Kopfverletzung davongetragen haben. Je Älter die Person zum Zeitpunkt der Verletzung ist, desto stärker steigt dabei das Risiko [(25)]. Auch ein Zusammenhang mit dem Bildungsniveau lässt sich feststellen. Mit steigender Bildung nimmt das Risiko ab. Es ist jedoch ungeklärt worauf dieser Effekt beruht, es wird vermutet, dass so eine kognitive Reserve geschaffen werden kann. Auch Faktoren die indirekt mit dem Bildungsnivau verbunden sind, etwa Ernährung oder Lebensführung, könnten eine Rolle spielen [(26)].
Risikosenkende Faktoren
Ein positiver risikosenkender Einfluss konnte ich Zusammenhang mit regelmäßiger Bewegung, dem Konsum von Kaffee, sowie Wein festgestellt werden [(26)].
Die Pathogenese des Morbus Alzheimer
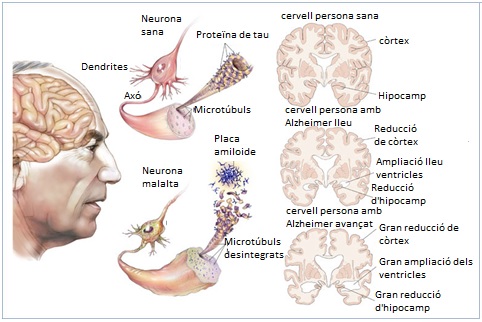
Der pathologische Prozess, der dem Morbus Alzheimer zugrunde liegt ist ein sehr langsam fortschreitender degenerativer Prozess, welcher zu fortschreitendem Verlust der synaptischen Funktion und absterben von ganzen Nervenzellen führt [(15)]. In Folge des vermehrten Absterbens von Neuronen kommt es zur „Hirnatropie“ [(16)]. Er dauert bis zur vollständigen Ausbildung fast das ganze Leben der erkrankten Person. [(1)] Da erst im Endstadium der Pathogenese klinische Symptome auftreten bleibt die Krankheit zunächst lange unentdeckt und tritt am häufigsten bei älteren Patienten auf [(18)]. Der pathologische Prozess hinterlässt ein charakteristisches Muster im Gehirn der betroffenen Person. Die Phasen in denen noch keine klinischen Symptome auftreten werden „stumme Phasen“ genannt. Typisch für die Pathogenese des Morbus Alzheimer ist das Auftreten von Senilen Plaques, neurofibrillären Bündeln und eine granulovakuläre Degeneration von Neuronen .[(1)] Verantwortlich für die alzheimer-typischen pathologischen Veränderungen sind Aggregate zweier Proteine. Zum einen das abnorme Tau-Protein, welches normalerweise die Mikrotubuli des Zytoskeletts stabilisiert und das Amyloid-β-Peptid [(17),(2)] (Abbildung 4). Es ist bisher nicht abschließend geklärt, ob die Entwicklung dieser beiden Prozesse wechselseitig voneinander abhängen oder eine gegenseitige Bedingung darstellen [(16)].
Abbildung 4 |
Neurofibirlläre Bündel
Das abnorme Tau Protein verursacht die Bildung von Einschlusskörperchen im Zytoplasma der Nervenzellen, die sogenannten neurofibrillären Bündel (Abbildung 5). Diese so entstandenen neurofibrillären Bündel bestehen vor allem aus gepaarten helikalen Filamenten des phosphorylierten Tau-Proteins. PHF-Tau- Protein ist nicht mehr in der Lage an die Mikrotubuli zu binden [(1)]. In der betroffenen Zelle wird eine hohe Konzentration Tau Protein gebildet, da es nicht in Mikrotubuli eingebaut werden kann. Diese Tau- Proteine bilden Aggregate in der Zelle, welche nicht vom Körper abgebaut werden können. Daraufhin entsteht in verschiedenen Immunreaktionen ein nichtfibrilläres Material, dass als Vorläufer der Einschlüsse angesehen wird. Dieses Material verdichtet sich im Laufe der Zeit zu steifen fibrillären Einschlüssen. Diese Einschlüsse bilden in den Dendriten der Nervenzelle Neurophilfäden („neurophil threads“) und im Zellleib neurofibrilläre Knäuel („neurofibrillary tangles“) [(12)]. Es kommt zu einer mikrotubulären Depolymerisation, was zur Unterbrechung des axonalen Transports führt. Die Nervenzelle ist demzufolge nicht mehr funktionsfähig und degeneriert [(1)]. Dieser Prozess tritt vor allem in der Anfangsphase des pathologischen Prozesses auf [(12)].
Abbildung 5 |
|
Entstehung von neurofibrillären Bündeln aus Tau-Proteinen |
Senile Plaques
Im weiteren Verlauf der Pathogenese kommt es außerhalb der Nervenzellen im extrazellulären Raum des zentralen Nervensystems zu Ablagerungen des Amyloid-β-Peptids, ein Spaltprodukt des Amyloid-Precursor-Proteins (APP)[(16)]. Diese Ablagerungen werden als „senile Plaques“ bezeichnet. [(1)] Das APP ist ein Baustein der biologischen Membran [(19)]. APP wird durch verschiedene Sekretasen enzymatisch gepalten. Zu diesen Zählen die Alpha-, Beta-, und die Gamma- Sekretasen. Die α-Sekretase spaltet das APP in der A-Region, somit kann kein Amyloid-β-Peptid entstehen. Die β- und γ- Sekretasen spalten jedoch in anderen Regionen und haben als Endprodukt das toxische Amyloid-β-Peptid [(16)].
Stadien der intraneuronalen Veränderungen
Im Verlauf des pathologischen Prozesses kommt es zu verschieden intraneuronalen Veränderungen. Pathologisch werden bei AD sechs „Braak-Stadien“ unterschieden, welche den Schweregrad der Cortexzerstörung anhand der vorhanden Neurofibrillenbündeln in den Zellkörpern und den Neurophilfasern in den Dendriten beurteilen. Die neurofibrillilären Veränderungen im Cortex verlaufen bei allen Patienten fast gleich
Stadium I
Zu Beginn steht das Stadium I. In diesem Anfangsstadium treten die beginnenden Veränderungen in einem sehr kleinen Feld in der transentorhinalen Region im medialen Bereich des Schläfenlappens auf [(13)]. Der entorhinale Cortex wird in einen medialen und lateralen Teil unterteilt und ist vor allem für Erinnerung und Koordination verantwortlich. Er steht in enger Verbindung mit dem Hippocampus und ist ein Teil des lymbischen Systems. Charakteristisch für diese Veränderung sind abnormale Tau-Proteine und APP’s. Diese Veränderungen werden von der Betroffenen Person noch nicht wahrgenommen, da sie klinisch keine Symptome hervorrufen. Das Stadium erstreckt sich über mehrere Jahre und kann sogar Jahrzehnte andauern [(12),(28)].
Stadium II
Im Stadium II breiten sich die intraneuronalen Veränderungen auf die entorhinale Region des Schläfenlappens und teilweise auch auf den Hippocampus aus. Auch in diesem Stadium machen sich noch keine klinischen Symptome bemerkbar [(12),(3)].
Stadium III und IV
Im neurofibrillären Stadium III treten schon deutlich erheblichere Veränderungen auf, immer mehr Nervenzellen im medialen Bereich des Schläfenlappens und im äußeren entorhinalen Bereich sind betroffen und äußern sich langsam durch leichte kognitive Beeinträchtigung und Veränderungen der Persönlichkeit. Deutlicher werden diese Symptome im darauffolgenden Stadium IV. Nun greifen die pathologischen Veränderungen auch auf den Neocortex und die tiefe entorhinale Region über [(12),(28)].
Stadium V und VI
Stadium V und VI sind die akuten klinischen Phasen der AD. Im Stadium V sind die Hirnrinde und der Neocortex schon größtenteils von starken neurofibrillären Veränderungen betroffen, sind allerdings noch teilweise funktionsfähig. Der Patient zeigt jedoch deutliche klinische Symptome. Oft wird Morbus Alzheimer erst in diesem Stadium diagnostiziert, was eine Therapie deutlich erschwert [(12)]. Im Endstadium der AD dem Stadium VI sind die pathologischen Veränderungen auf gesamten Hippocampus und den Neocortex übergegangen. Fast alle Regionen der zwei Großhirnhemisphären weißen deutliche neurofibrilläre Veränderungen auf [(28)]. Zusätzlich treten extrazellulären Amyloid-b-Ablagerungen im mittleren Schläfenlappen auf. Die Hirnrinde ist in diesem Stadium nicht mehr funktionsfähig, was dazu führt, dass die Patienten deutliche klinische Symptome in Form einer schweren Demenz mit Sprachstörungen und motorischen Ausfällen aufweisen [(12)].
Phasen der Amyloid-β-Ablagerung
Paralell zur Entwicklung der intraneuronalen Veränderungen und der Bildung von fibrillären Bündeln kommt es im extrazellulären Raum zu Amyloid-β-Ablagerungen im mittleren Schläfenlappen. Diese A-β- Ablagerung verläuft in fünf Phasen, es besteht allerdings kein gesicherter Zusammenhang zwischen dem Ausmaß der Ablagerungen und der Schwere der Demenz. Die Ablagerungen des A-β-Proteins treten in der 1. Phase zunächst im nur Neocortex auf. Dann kommt es in Phase 2 zu Ablagerungen im mittleren Schläfenlappen und in der entorhinalen Region. In Phase 3 sind zudem auch Teile im Hirnzentrum betroffen (Putamen, Nucleus basalis und caudatus). In den Endphasen 4 und 5 treten auch Ablagerungen im Hirnstamm und im Kleinhirn auf [(12)]. Die Plaques breiten sich von den Anfangsorten dorthin aus, wo die von dort gesendeten Signale ankommen [(14)].
Ausbreitung des pathologischen Prozesses
Die fortschreitende Pathogense verläuft fast in allen Fällen sehr ähnlich bis nahezu gleich, im späten Stadium kommt es immer zur Alzheimer typischen Hirnatrophie (Abbildung 6). Die betroffenen Gebiete des Nervensystems, erkranken immer in der selben Reihenfolge. Dabei ist auffällig, dass alle betroffenen Gebiete miteinander durch axonalen Kontakt verbunden sind. Es wird deshalb vermutet, dass der physikalische Kontakt der Nervenzellen einen Einfluss auf die Ausbreitung der Alzheimer- Erkrankung hat [(12)].
Abbildung 6 |
|
Diagnose
Bei Beginn des Auftritts von demenzartigen Symptomen wird die Diagnose der AD unter Berücksichtigung bestimmter diagnostischer Kriterien durch den behandelnden Arzt durchgeführt. Dabei wird zunächst versucht andere Demenz verursachenden Erkrankungen im Rahmen der Differentialdiagnose als Ursache auszuschließen. Die ersten Schritte in der Diagnostik sind dabei, dass feststellen von kognitiven Störungen, durch neurophysiologische Tests, wozu meistens der Mini-Mental-State-Test (MMST) herangezogen wird. Des Weiteren können bildgebende Verfahren wie Computertomografie und Kernspinresonanztomografie eingesetzt werden [(12),(2)].
Behandlungs- und Therapiemöglichkeiten
Zusammenfassend ist zu sagen, dass auf Grund der fortgeschrittenen Medizin, viele wirksame und sichere Präparate zu Bekämpfung und Milderung der Symptome der Alzheimer- Krankheit, zur Verfügung stehen. Mit einem positivem Gesamteindruck, worunter neben der Verbesserung der Symptomatik, einer Stabilisierung des Ausgangsniveaus oder einer nennenswerten Verlangsamung der Progression zu verstehen ist, kann nach einer medikamentösen Behandlung von etwa 12 Wochen, gerechnet werden [(1)]. Allerdings besteht keine Chance auf eine vollständige Heilung.
Acetylcholinesterasehemmer Tacrin (Cognex)
1992 wurde das erste Medikament gegen Alzheimer in den USA zugelassen. Hierbei handelte es sich um einen Acetylcholinesterasehemmer namens Tacrin (Cognex), da bei den Betroffenen davon ausgegangen wird, dass Sie unter einem Acetylcholinmangel in bestimmten Hirnregion leiden. Da die Wirksamkeit des Medikamentes in klinischen Prüfungen nachgewiesen werden konnte, wurde Tacrin 1995 auch in der Bundesrepublik Deutschland erstmals zugelassen [(9)].
Acetylcholinesterasehemmer Donepezil (Aricept)
Auch für die leichter und mittelschweren Erkrankten wurde weiter geforscht. Somit kam Ende 1996 Donepezil (Aricept), als Acetylcholinesterasehemmer der neuen Genration, in den USA auf den Markt. Deutschland machte demnach auch von dem neuen Medikament ab dem Jahr 1997 Gebrauch, da auch diese Substanz nach Prüfungen in placebokontrollierten Multizenterstudien, sich als wirksam gegenüber Placebo erwies [(10),(27)]. Hinzu sind auch die Nebenwirkungen des neuen Medikaments sehr gering, wodurch die bereits niedrige Dosierung von 5 mg, positive Ergebnisse zeigt und außerdem gut verträglich ist [(1)].
Acetylcholinesterasehemmer Rivastigmin (Excelon)
Um jedoch nicht nur gegen die allgemeinen Symptome der Krankheit zu wirken, sondern auch die kognitiven Leistungen, sowie das Funktionsniveau zu verbessern, wurde das Medikament Rivastigmin (Excelon) 1998 in Deutschland auf den Markt gebracht [(11)]. Der neue Acetylcholinesterasehemmer der zweiten Generation, hat sich nach verschieden Studien ebenfalls als gut verträglich erwiesen [(1)].
Memantin (Akatinol Memantine), Nootropika
Des Weiteren wird die potentiell neurotoxische Wirkung von Glutamat zur Behandlung der Krankheit sehr geschätzt. Hierbei handelt es sich um den nicht- kompetitiven NMDA- Rezeptor- Antagonisten Memantin (Akatinol Memantine), welcher zur einer signifikanten Verbesserung in verschiedenen Demenzskalen, bei guter Verträglichkeit, führt. Auch die verschiedenen Nootropika, welche lange Zeit als unzureichend wirksam angesehen wurden, können nun, nach erheblich methodischen Fortschritten, zur Behandlung gegen die Krankheit genutzt werden [(1)].
Literaturverzeichnis
Fachartikel
Hampel,H.; Padberg,F.; Buch,K.; Unger,J.; Stübner,S.; Möller, H.-J. (1999): Diagnose und Therapie der Demenz vom Alzheimer Typ. DMW (5): 120-124
Keith F. PhD; Bleier, L. (2014): Alzheimer’s disease facts and figures. Alzheimer's & Dementia 10: (2) e47-e92
Maurer,K.; Frölich, R.; Ihl, L. (2013): Buch: Alzheimer- Grundlagen, Diagnostik, Therapie ; Springer Verlag, Seite 1-14
Stoppe, Gabriela (2008): Demenz; in PiD - Psychotherapie im Dialog; Georg Thieme Verlag KG Stuttgart; 9(1): 43-47
Metzler; Poeschel (1998/2000): Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankung in Deutschland. Zitiert aus dem Statistisches Jahrbuch 1998 für die Bundesrepublik Deutschland. Wiesbaden; Georg Thieme Verlag: 62(4):211-218
Bickel, H. (2000): Demenzsyndrom und Alzheimer Krankheit: Eine Schätzung des Krankenbestandes und der jährlichen Neuerkrankungen in Deutschland, in Gesundheitswesen 2000; Georg Thieme Verlag: 62(4): 211-218
Bickel, H. (1999): Deskriptive Epidemiologie der Demenzen. Zitiert aus Helmchen,H.; Henn,F.; Lauter,H.; Sartorius,N.: (Hrsg.). Psychiatrie der Gegenwart - Psychische Störungen bei somatischen Krankheiten. Heidelberg; Band 4; Springer: 33-52
Stoppe, Gabriela (2008): Demenz; in PiD - Psychotherapie im Dialog; Georg Thieme Verlag KG Stuttgart; 2. Aufl. München; 9 (1): 43-47
Möller, H. J. ( 1996): Tacrin - Möglichkeiten und Grenzen bei der Behandlung der Demenz vom Alzheimer- Typ.; in Psychopharmakotherapie 3, 103- 108
Rogers, S. L.; Farlow, M. R.; Doody, R. S.; Mohs, L. R.; Friedhoff, T. (1998): The Donepezil Study Group: A 24-week, double-blind, placebo-controlled trial of donepezil in patients with Alzheimer's disease; in Neurology Vol. 50: 135-145
Corey- Bloom, J.; Anand, R.; Veach, J. (1998) : A new acetylcholinesterase inhibitor in patients with mild to moderately severe Alzheimer's disease; in Geriatric Psychopharmacology 1; 55-65
Braak, H.; Feldengut, S.; Del Tredici, K. (2013): Pathogenese und Prävention des M. Alzheimer. Der Nervenarzt, 84:477-482
Khan, U. A.; Liu, L.; Provenzano, F.; Berman, D. E.; Profaci, C.; Sloan, R.; Mayeux, R.; Duff, K. E.; Small, S. A. (2014): Molecular drivers and cortical spread of lateral entorhinal cortex dysfunction in preclinical Alzheimer’s disease. Nature Neuroscience 17, 304-311
Jakob-Roente, R.; Jacobsen, H. (2009): “Die Alzheimer-Demenz: von der Pathologie zu therapeutischen Ansätzen.“ Angewandte Chemie 121 (17): 3074- 3105
Duran-Aniotz, C.; Cornejo, V.H.; Espinzo, S.; Ardiles, A.; Medinas, D.B.;Salazar, C.; Foley, A.; Gajardo, I.; Thielen, P.; Iwawaki, T.; Scheper, W.; Soto, C.; Palacios, A.; Hoozemans, J.J.; Hetz, C. (2017): IRE1 signaling exacerbates Alzheimer’s disease pathogenesis. Acta Neuropathologia: doi10.1007/s00401-017-1694-x; Impact Factor: 11.360.
Pahnke, J.; Krohn, M.; Scheffler, K. (2009): The role of the blood-brain barrier in the pathogenesis of Alzheimer Dementia- Implications for Immunological therapies for plaque dissolution. Fortschritte der Neurologie - Psychartrie 77(1): 21-24.
Andorfer, C.; Kress, Y.; Espinoza, M.; De Silva, R.; Tucker, K. L.; Barde, Y. A.; Duff, K.; Davies,P. (2003): Hyperphosphorylation and aggregation of tau in mice expressing normal human tau isoforms. Journal of Neurochemistry: 86: (3) 582-590
Upadhaya, A.R.; Kosterin,I.; Kumar, S.; von Arnim, C.A.F.; Yamaguchi, H.; Walter, J.; Thal, D. R. (2014): Biochemical stages of amyloid-β peptide aggregation and accumulation in the human brain and their association with symptomatic and pathologically preclinical Alzheimer’s disease. Brain: 137 (Pt 3): 887-903
Ganguly,G.; Chankrabarti, S.; Chatterjee, U.; Saso, L. (2017): Proteinopathy, oxidative stress and mitochhondrial disfunction: cross talk in Alzheimers’s disease and Parkinson’s disease. Drug Design, Development and Therapy 2017: 11 797-810
Lautenschlager, N.; Kurz, A.; Müller, U. (1999): Erbliche Ursachen und Risikofaktoren der Alzheimer- Krankheit. Nervenarzt 70: 195- 205
Mahley, R.; Huang, Y. (2009): Multiple Causes, Multiple Effekts of Apolipoprotein E4, an Multiple Therapeutic Approaches. Annals of Neurology 65(6): 623- 5
Iba, M.; Guo, J.; McBride, J.; Zhang, B.; Trojanowski, V.; Lee, V. (2013): Synthetic Tau Fibrils Medicate Transmission of Neurofibrillary Tangles in Transgenic Mouse Model of Alzheimer´s- Like Tauopathy. The Journal of Neuroscience 33: 1024- 1037
Hoyer, S. (2004): : Glucose metabolism and insulin receptor signal transduction in Alzheimer Disease. European Journal of Pharmacology 490: 115- 125
Hoyer, S. (2000): Brain glucose and energy metabolism abnormalities in sporadic Alzheimer disease. Causes and consequences: an update. Experimental Gerontology 35: 1363- 1372
Mayeux, R.; Ottman, R.; Tang, M.; Noboa-Bauza, L.; Marder, K.; Gurland, B.; Stern, Y. (1991): Genetic susceptibility and head injury as risk factors for Alzheimer´s disease among community dwelling elderly persons and their first-degree relatives. Annals of Neurology 33: 494- 501
Lindsay, J.; Laurin, D.; Verreault, R.; Hébert, R.; Helliwell, B.; Hill, G. B.; McDowell, I. (2002): : A Prospective Analysis from the Canadian Study of Health and Aging. In: American Journal of Epidemiology. American Journal of Epidemiology 156: 445- 453
Hampel, H.; Padberg,F.; Möller H.-J.(1998): Donepezil in der Pharmakotherapie der Alzheimer Demenz; in Psychopharmakotherapie 2: 54- 61
Braak, H.; Alafuzoff, I.; Arzberger, T. (2006): Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathologia 112: (4) 389- 404. doi:10.1007/s00401-006-0127-z
Weblinks
https://de.wikipedia.org/wiki/Alzheimer-Krankheit (23.04.2017)
https://www.thieme-connect.com/products/ejournals/html/10.1055/s-2000-10858#top (23.04.2017)
https://www.alzheimer-forschung.de/alzheimer-krankheit/symptome.htm (23.04.2017)
https://www.neuronation.de/demenz/was-ist-der-unterschied-zwischen-alzheimer-und-demenz (23.04.2017)
https://www.alzheimer-forschung.de/alzheimer-krankheit/symptome.htm (23.04.2017)
https://www.neuronation.de/demenz/was-ist-der-unterschied-zwischen-alzheimer-und-demenz (23.04.2017)
https://link.springer.com/chapter/10.1007/978-3-642-19795-6_4 (23.04.2017)
https://www.eymj.org/DOIx.php?id=10.3349/ymj.2017.58.3.479 (23.04.2017)
Abbildungsverzeichnis
Abbildung 1: https://upload.wikimedia.org/wikipedia/commons/1/1b/Alzheimer_alois.jpg
Abbildung 2: https://de.wikipedia.org/wiki/Datei:Alzheimer.jpg
Abbildung 4: https://commons.wikimedia.org/wiki/File:Cerebro_corte_frontal_Alzheimer.jpg
Abbildung 6: https://upload.wikimedia.org/wikipedia/commons/5/51/TANGLES_HIGH.jpg
- Abbildung 3 von Robert Osmers, Verena Kummrow, Vivian Weiß : Ursachen von Morbus Alzheimer