Contents
Bevezetés
Az antifreeze proteinek (AFP, fagyásálló fehérjék) a sarkköri éghajlaton élő állatok túlélését segítik azáltal, hogy gátolják a jégkristályok növekedését a testfolyadékban. E növekedésgátlás pontos folyamata, mechanizmusa még nem ismert, mert hihetetlenül fejlett számítógépes technika szükséges a jégkristályokon található antifreeze proteinek kötőhelyeinek megállapításához.
---
|
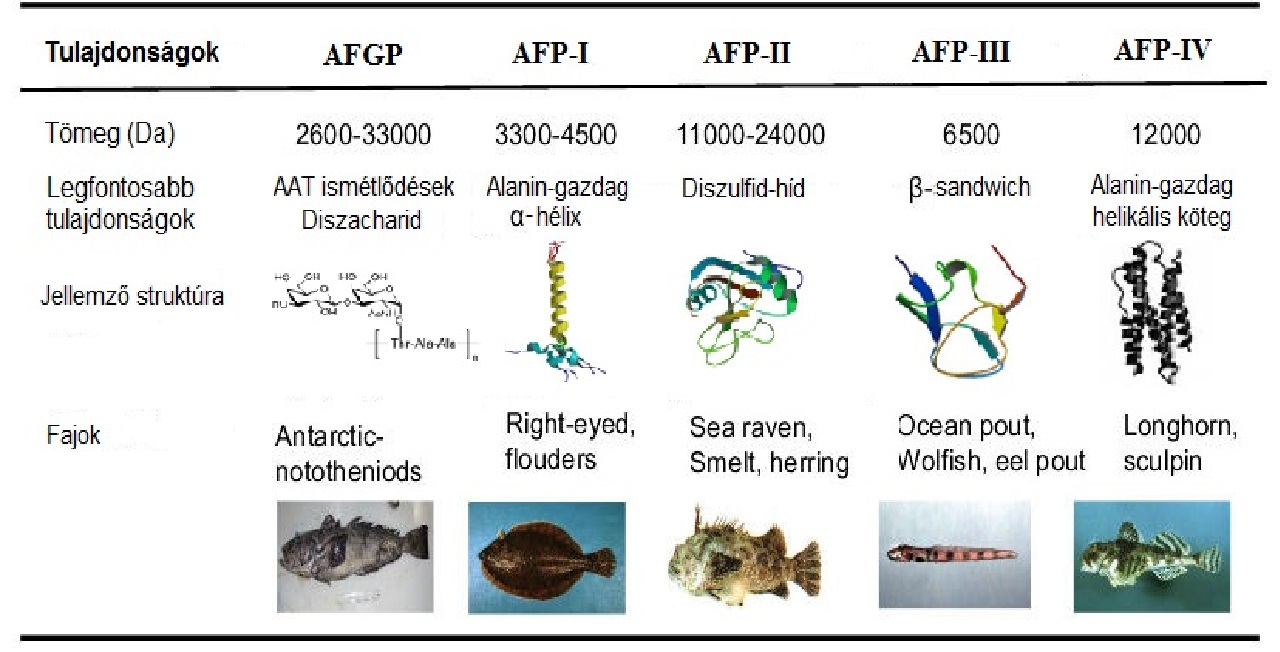
Termodinamikai szempontból a rovar AFP-ket három csoportba lehet sorolni, diszulfidhíd tartalmuk és jégkötő felületük alapján: magas olvadáspontú AFP-k (magas diszulfid-tartalom, TxT mintázat), alacsony olvadáspontú, de magas visszahajtogatódó képességű AFP-k (egy diszulfid-híd, TxTxTxT mintázat) és irreverzibilisen kihajtogatott AFP-k alacsony hőmérsékleten (nincs diszulfid-híd, TxTxTxTxT motívum).AFP-IV-ek trópusi halakban is jelen vannak, ami felveti a kérdést, hogy vajon lehet-e ezeknek a fehérjéknek a fagyásgátláson kívül más funkciójuk is. Zebrahalban mind az AFP-IV-a és AFP-IV-b specifikusan a YLS-ben (Yolk Syncytial Layer) választódtak ki. Érdekes módon az AFP-IV-a szintetizálása folytatódik az YLS-ben és az emésztőrendszerben a korai embrió kortól egészen a kifejlett példányokig, míg AFP-IV-b termelés csak az embrionális fejlődés folyamán történik. Az AFP-IV-nek fontos szerepe van az összehajló mozgásfolyamatokban, ezért mindkét AFP-IV protein szükséges a zebrahal embriók emésztőrendszerének fejlődéséhez. Alaninban gazdag alfa-hélixet tartalmazó antifreeze proteineket - I.típus - különböző halfajok termelik 3 eltérő rendszerből, hogy védelmet nyújtson számukra jeges tengervízben is egyaránt. A különböző típusok (I., II., III.) és az antifreeze glycoproteinek (AFGP) változatosságának eredete azzal magyarázható, hogy a halak különböző családjaiban hogyan jelent meg a tengerszint jegesedéséhez való alkalmazkodás. A különböző típusú AFP jelenléte a távoli rokonságban álló halaknál a laterális géntranszportnak tulajdonítható. Ez a strukturálisan komplex globuláris II.típusú lectinszerű antifreeze proteinek és az antifreeze glicoproteinek párhuzamos evolúciója esetén valósul meg. IV-es típusú AFP-k fontos szerepet játszanak a zebrahal embriók fejlődésében.
Antifreeze proteinek szerkezete
Az antifreeze proteinek dinamikus szerkezetének hatása
Algák, rovarok, halak elbővülő képessége, hogy a fagyásgátló fehérjék (antifreeze proteinek=AFP) és az antifreeze glikoproteinek segítségével átvészeljék, túléljék a fagyás mechanizmusát. Ezek felületaktív molekulák, amelyek a víz-jég közötti határfelületen hatnak és akadályozzák meg a teljes dermedést. Különböző szervezetek szintetizálják őket, hogy sejtjeik ne sérüljenek, még az északi régiókban mért nagyon alacsony hőmérsékleten sem. A Ginzburg-Landau típusú megközelítés során a fázis elkülönítés eredményeként két-komponensű rendszert (jég-AFP) állapították meg. A szabad-energia sűrűség két területet foglal magában: az egyik a jégfázis alacsony AFP koncentrációval, a másik a folyékony víz fázis magas AFP koncentrációval van összefüggésben. Az idő alakulásával a jég felfedi a fázis elválasztásból eredő mikrostruktúrális változásokat az AFP-k jelenlétében. A fagyásgátló fehérjék hatására a szemcsék záródása, csoportosulása révén gyorsabban létrejön a jeges szerkezet, mely lényegében dinamikai folyamat. Ha a következőkben vízhozzáadás után a vízmolekulák adszorpciója gátlódik, a jégkristályok további növekedése is megáll. Az AFP-k által létrejött alacsony víz-jég közötti határfelületi energia lehetővé teszi a kisebb kritikus jég-magok kialakulását.
Az antifreeze fehérje maradványok körüli felületi víz dinamika
Az antifreeze proteinek fagyásgátló aktivitását egy rövid-idejű hatás határozza meg, mely magában foglalja a jégfázishoz történő közvetlen kötődést. További kísérletek során felfedeztek egy hosszú-idejű hatást is, melynek során a víz dinamikájának erőteljes gátlása figyelhető meg, illetve ez által lehetővé válnak a jég-kötő folyamatok. Ezekért a hatásokért legfőképpen a fagyásgátló glikoproteinek (AFGP) felelősek. A különböző fagyálló protein maradványok körüli víz molekulák dinamikáját az atomi molekuláris dinamikai szimulációk segítségével vizsgálhatják. Az AFP prototípusát az antarktiszi sugaras úszójúakról a fő alegységgel az alanin-alanin-threoninnal (AAT) egy mutánssal (polyalanin) együtt, a fagyálló glikoproteinek maradványaival mutatták ki. E prototípus körül a víz dinamikája erősen gátlódik a hidrogénkötés jellemzői és a dipoláris relaxációs idő következtében. Számos eredmény utal rá, hogy kiemelkedő jelentőségűek a poláris egységek, mint a threonin és a diszacharidok, melyek közvetlenül kötődnek a vízmolekulákkal a H-kötés révén és így jelentős gátló hatást fejt ki a víz dinamikájára. A hidratációs dinamikailag jelentős változása figyelhető meg az ozmotikumok jelenlétében, mint a karbamidban és a hydroxyectoine-ben. Az eredmények azt mutatják, hogy ez a hatás még kifejezettebb kozmotróp ozmotikumok jelenlétében.
Genetikai háttér
Genomevolúció a hidegben – az antarktiszi jéghal
A Chionodraco hamatus egy, a jéghalak családjába (Channichthyidae) tartozó csontos hal faj, amely a Déli-sarkvidéken él. Ezen család tagjai az állandóan hideg és oxigén dús antarktiszi vizekben alakultak ki, megszerezve ezzel egyedi adaptációkat, morfológiai, élettani, és biokémiai szinten. A jéghalaknak, hasonlóan más Déli-sarkvidéki sugaras úszósokhoz, nincs úszóhólyagjuk és olyan antifreeze glikoproteineket (AFGPs) termelnek, amelyek kulcs innovációs lépést jelentenek a vér és testfolyadékok fagyásának kivédésében, amikor a környező hőmérséklet -1,86 Celsius fokra csökken. Ezen felül nem jelentkezik náluk a hősokk válasz sem. A jéghalak (Channychtyidae) vérében ezen felül kevés az oxigénkötő fehérje, és más szélsőséges tulajdonságaik is vannak, például az aerob szöveteikben igen sok a mitokondrium. Ezen halakról jelenttették meg, hogy a génállomány bővülése az evolúció velejárója, mégis a genetikai információ csekélysége határozza meg a sugaras úszójú halak hidegadaptációjának megértését. Rekonstruáltuk és feljegyeztük a Chionodraco hamatus (jéghal) első vázizom transzkriptumát, ellátva egy új forrással a jéghallal foglalkozó genomikát. Kihasználtuk a mély szekvenciáit ennek az energiaigényes szövetnek, hogy vizsgáljuk a feltételezést a gének szelektív duplikátum készítéséről, magában foglalva a mitkondriális funkciókat is. Kifejlesztettünk egy bioinformatikai megközelítést, hogy egyértelműen meghatározzuk a C. hamatus transzkriptumát, amivel egy törzsfejlődési ág öt modell fajából kiválasztottuk a közös őstől származó csoportot. A Chionodraco hamatus duplikátumait megtalálták minden közös őstől származó csoportban, lehetővé téve ezzel a jéghal leszármazására specifikus génduplikációk azonosítását. Szignifikánsan több duplikátumot találtak a jéghalban, amikor a transzkriptum adatokat a modell faj teljes genomjának adataival hasonlították össze. Sőt, a megkettőződött gének szignifikánsan gazdagabbak voltak mitokondrium lokalizációval rendelkező fehérjékben, beleértve a mitokondriális funkciókat és a biogenezist. Hideg állapotok között és oxigént szállító fehérje nélkül, az energiatermelés kihívást jelent. Az összetétele a magas mitokondriális sűrűségnek és a másolt gének fenntartásának – beleértve a mitokondriális biogenezist és az aerob légzést -, adhat egy szelektív előnyt azáltal, hogy fokozza az oxigén diffúziót és az energia tartalékokat az aerob szövetekben.
Farkashalak alkalmazkodása
A legtöbb hal hipoozmotikus a tengervízhez viszonyítva, így fagyáspontjukban különböznek. Ez jelentős veszélyt jelent a sekélyebb vizekben élő fajokra. AFP és AFP glikoproteinek függetlenül, több fajban is kialakultak, melyek csökkentik a testfolyadékok fagyáspontját. A környezethez való adaptáció egyik módszere egyes gének megduplázódása /sokszorozódása (GDA).
Az Új-Fundland partjainál élő két farkashal-féle (a part menti vizekben lakó Atlanti farkashal /Anarhichas lupus/, és a mélyebb vizekben megbúvó Pöttyös farkashal /Anarhichas minor/) jó példa a fagyos vizekhez történő sikeres alkalmazkodásra. A farkashal-félék a Zoarcoidei alrendbe tartozó többi fajjal együtt olyan AFP-III-at állítanak elő, ami a sialic sav szintáz enzim kis C-terminális doménjéből származik. A sekélyebb vizekben élő Atlanti farkashal nagyobb veszéllyel néz szembe sekély élőhelye miatt. Hogy ellenálljon a fagyásnak, ez a faj ötször nagyobb AFP aktivitással rendelkezik a plazmájába, mint mélyebb vízi rokona. Ennek a különbségnek az alapja a bennük fellelhető AFP gének mennyisége. Az Atlanti farkashal körülbelül háromszor annyi AFP génmásolattal rendelkezik, mint a Pöttyös farkashal. Mivel a TH (thermal hysteresis) és az AFP koncentráció között inkább hiperbolikus, mint lineáris összefüggés áll fenn, a két faj között még nagyobb az AFP koncentráció különbsége, mint ahogy a TH értékéből gondolnánk. Az AFP transzkripció mértéke a májban (ami halaknál a plazmaproteinek fő szintetizálója) szinté többszörösen nagyobb az Atlanti farkashalban. Egy magyarázat a génmennyiségbeli és transzkripciós eltérésekre az Atlanti farkashal genomjában fellelhető ismétlések, melyek az AFP-t kódoló génállománya 2/3 részét teszi ki, és gyorsabb transzkripciót biztosítanak. Ilyen ismétlések nincsenek a Pöttyös farkashalban. A rendelkezésünkre álló bizonyítékok azt mutatják, hogy e két faj egy közös ősből fejlődött ki a fagyásveszélyes zóna felbukkanásának időpontjában. Az AFP géneknek duplázódása/erősödése a farkashal ős egyik szubpopulációjában elősegítette ennek a veszélyes élőhelynek a kiaknázását, a modernkori Atlanti- és Pöttyös farkashal fajok elkülönülését és evolúcióját.
Adaptációs folyamatok különféle fajokban
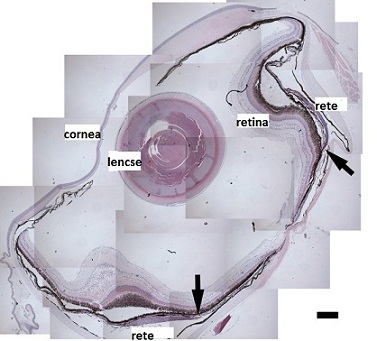
Ozmózisnyomásra adaptív válaszok a szivárványos lazac szemében
Ellenben más rovar AFP-kkel, amiket ebből a szempontból vizsgáltak, a Cser-tövisescincérben (Rhagium mordax) található AFP1-nek csak 1 diszulfid-hídja van. Megállapították, hogy a protein olvadáspontja (Tm) 28,5C (pH 7,4) ami sokkal alacsonyabb, mint a legtöbb AFP-jé vagy globuláris proteineké általában. Leszámítva alacsony olvadáspontját, mind biofizikai mind aktivitásbeli mérések azt mutatják, hogy a fehérje majdnem teljesen visszahajtogatódik eredeti állapotába miután ismételten 70 °C–os hőhatásnak volt kitéve. A Rhagium mordax AFP-je kinetikailag stabil még magasan olvadáspontja felett is.A Cser-tövisescincérAz emlősökben előforduló cukorbetegség okozta hyperglikémia helyi, intraoculáris és mikrokörnyezeti ozmotikus stresszt okoz, ami a glikozilezés olyan megnövekedett mennyiségű végtermékeihez vezet, amelyek kapcsolatba hozhatók mikrovaszkuláris sérülésekkel a retinán. Annak természete, hogy a retina kóros elváltozásának hogyan áll ellen az ozmotikus stresszhez adaptálódott lazac szeme, olyan értékes és új nézőpontokat nyújthat, amelyek hasznosak lehetnek a diabetikus vasculopátia patobiológiájának megértéséhez az emlősökben. Ez a kutatás kibővítheti az alapvető tudásunkat olyan mechanizmusokról, amelyek alapjául szolgálnak a vér-retina gát metabolikusan lényeges összetevőkhöz, mint például a glicerinhez való alkalmazkodásának.
|
Az új ismeret a szivárványos lazac szemének osmotikus adaptációjában szorosan összefügg e faj adaptációjával és túlélésével, és azon képességével, hogy a környezeti nyomás ellenére vizuális ragadozóként táplálkozik. Továbbá a szivárványos lazac molekuláris fiziológiai válasza az ozmotikus nyomásra, értékes betekintést nyújthat az emlősök kóros hyperozmotikus állapotainak – mint például a diabétesz -, megértésébe és kezelésébe. Ezen tanulmány által magunkra vállaltuk a feladatot, hogy egy eredeti értékelést adunk a szivárványos lazac ozmotikus adaptációja alatt zajló gén kifejeződésről a szem keringésében. Azoknál a lazacoknál - amiket kevesebb, mint 0,5 Celsius fok alatt tartottak -, szignifikánsan nőtt az üvegtestet kitöltő folyadék glicerin szintje és ozmotikus nyomása, azokéhoz képest, mint amiket 8-10 Celsius fokban tartottak. A 8-10 Celsius fokhoz alkalmazkodott mintapéldányokhoz képest a kevesebb, mint 0,5 fokon adaptálódottak csodarece erei és az érhártya ereinek endotheliális béléséhez kapcsolódó régiók magasabb szintű kifejeződését mutatják egy Tubedown (Tbdn) nevű proteinnek, ami a transzcelluláris endotheliális átjárók jelzőanyaga. Az emlősök Tbdn-jének és zonula occludens protein 1-ének (ZO-1) lazaccal ortológ fehérjéit is western blotting-gal mutatták ki, olyan emlős ellenes ellenanyagokat használva, amik ugyanazon epitópok ellen hatnak, mint amiket immunhisztokémiára használnak. Ez a tanulmány szolgáltat elsőként bizonyítékot arról, hogy a lazacok szemében fagyásgátló és hideg adaptációs folyamatok során olyan molekulák termelődnek és szabályoznak különböző módon, amikről tudjuk, hogy szerepet játszanak a szem vaszkuláris homeosztázisának kialakításában. Elővezetünk egy feltételezést, miszerint a hideg indukált hyperosmolaritás állapotában a ZO-1 kifejeződésében történő változások kapcsolatban vannak a kisméretű oldott anyagok a plazma térből, a szemet kitöltő folyadékba való áthaladásával, mialatt a Tbdn kifejeződésében történő változások szabályozzák a fehérjék vándorlását a plazma tér és a szemet kitöltő folyadék között.A szivárványos lazac (Osmerus mordax) egy csontos hal faj, amely úgy védekezik a fagyás ellen, hogy látszólag izoozmotikussá válik a tengervízzel. Ez a faj - hasonlóan más hideghez adaptálódott tengeri fajokhoz -, ciszteinben gazdag II.-es típusú antifreeze proteineket termel, bár csak kevés mennyiségben. Abban viszont eltér a többi fajtól, hogy glicerin, karbamid és trimetilamin-oxid termelődik a vérplazmájában és egyéb szöveteiben, ezzel az ozmotikus nyomás 325-ről 1000 mosmolra nő. A hatások, amelyek ilyen masszív változásokat hoznak létre az osmolaritásban, megtalálhatók a látás rendszerében és a nagyon fejlett és specializált keringési rendszerben, nem ismertek.
Ősi klímaváltozás, antifreeze és a déli-sarkköri halak diverzitásának evolúciós változása
A Déli-óceán a Déli-sarkkör a Föld leggyorsabban melegedő régiói között van, de az elmúlt 40 millió évben epizódszerű klímaváltozások történtek ezen a területen. Egyelőre tisztázatlan, hogy a klímaváltozás ősi ciklusai hogyan alakították az antarktiszi biodiverzitást. Az antarktiszi sugaras úszójú halakban lévő antifreeze glikoproteinek (AFGPs) eredete egy klasszikus példa lett arra, hogy egy kulcs innováció evolúciója válaszolva a klímaváltozásra hogy vezet adaptív szétterjedéséhez. A sugaras úszójúak időhöz kalibrált molekuláris fejlődéstörténetének és rekonstruált ősklíma használatával demonstráltuk, hogy az AFGP eredete 42 és 22 évmillió közötti időszakban bukkant fel, amely magába foglalja a globális lehűlés időszakát körülbelül 35 évmilliónál. Azonban a leg fajgazdagabb leszármazások váltak változatossá és szignifikáns ökológiai különbségek alakultak ki legalább 10 millió évvel az AFGP-k keletkezése után a második lehűlés alatt a késői miocénban. Ez a példa mutatja, hogy az AFGP nem az egyetlen kiváltó oka volt a sugaras úszójúak adaptív széterjedésének. Ehelyett kiváltó oka volt a késő miocén alatt és a korai pliocénban létrejött nagymértékű fajgazdagságnak és az ökológiai változatosságnak, ami időben egybeesett a sarkköri állapotok kialakulásával és a megnövekedett jég aktivitással a Déli-óceánban. Az eredményeink megkérdőjelezik a jelenlegi értelmezését az antarktiszi sugaras úszójú halak evolúciójának felvetve, hogy az ökológiai lehetőség - ami az alapjául szolgál ennek az adaptív szétterjedésnek-, nincs összeköttetésben egy egyedüli jelleggel, hanem inkább az AFGP-k által biztosított fagyás kivédés, és a megnövekedett glaciális és jégmező aktivitás által létrejött új élőhelyek és nyitott rések kihasználásának kombinációjával.
Referenciák
1. Coppe A1, Agostini C, Marino IA, Zane L, Bargelloni L, Bortoluzzi S, Patarnello T., 2013, doi: 10.1093/gbe/evs108., Department of Comparative Biomedicine and Food Science, University of Padova, Agripolis, Legnaro (Padova), Italy.
2. Desjardins M1, Graham LA, Davies PL, Fletcher GL., 2012, doi: 10.1111/j.1742-4658.2012.08605.x., The FEBS journal, Ocean Sciences Centre, Memorial University of Newfoundland, St John's, NL, Canada.
3. Friis DS1, Johnsen JL, Kristiansen E, Westh P, Ramløv H., 2014, doi: 10.1002/pro.2459., A publication of the Protein Society, 1Department of Science, Systems and Models, Roskilde University, DK-4000, Roskilde, Denmark.
4. Gendron RL1, Armstrong E, Paradis H, Haines L, Desjardins M, Short CE, Clow KA, Driedzic WR., 2011, 17:2596-604., Division of BioMedical Sciences, Faculty of Medicine, Memorial University, St. John’s, NL, A1B 3V6, Canada
5. Kutschan B1, Morawetz K2, Thoms S3., 2014, 90(2):022711, Physical review,
1Münster University of Applied Science, Stegerwaldstrasse 39, 48565 Steinfurt, Germany.,
2Münster University of Applied Science, Stegerwaldstrasse 39, 48565 Steinfurt, Germany and International Institute of Physics (IIP), Federal University of Rio Grande do Norte, Av. Odilon Gomes de Lima 1722, 59078-400 Natal, Brazil and Max-Planck-Institute for the Physics of Complex Systems, 01187 Dresden, Germany,
3Alfred Wegener Institut, Am Handelshafen 12, D-27570 Bremerhaven, Germany.
6. Laurie A. Graham, Rod S. Hobbs, Garth L. Fletcher, Peter L. Davies, 2013, DOI: 10.1371/journal.pone.0081285
7. Narayanan Krishnamoorthy A1, Holm C, Smiatek J., 2014, doi: 10.1021/jp507062r, The journal of physical chemistry. B., 1Institut für Computerphysik, Universität Stuttgart , D-70569 Stuttgart, Germany.
8. Near TJ1, Dornburg A, Kuhn KL, Eastman JT, Pennington JN, Patarnello T, Zane L, Fernández DA, Jones CD., 2012, doi: 10.1073/pnas.1115169109, Proceedings of the National Academy of sciences of the United States of America, Peabody Museum of Natural History and Department of Ecology and Evolutionary Biology, Yale University, New Haven, CT 06520, USA.
9. Nghiep H.V., Hung P.N., Ly L., 2013, DOI 10.1007/978-3-642-41190-8_37
10.Xiao Q, Xia JH, Zhang XJ, Li Z, Wang Y, Zhou L, Gui JF., 2014, doi: 10.7150/ijbs.9126., International journal of biological sciences, State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, University of the Chinese Academy of Sciences, Wuhan 430072, China