|
Size: 32021
Comment:
|
← Revision 55 as of 2013-11-29 10:04:25 ⇥
Size: 32033
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 24: | Line 24: |
| . Ezek a periodicitást mutató életfolyamatok, melyeket a belső biológiai óra CLOCK génjei szabályoznak. (Halmos, Suba, 2012) | . Ezek a periodicitást mutató életfolyamatok, melyeket a belső biológiai óra CLOCK génjei szabályoznak. (Halmos és Suba, 2012) |
| Line 28: | Line 28: |
| . A CLOCK (circadian locomotor output cycles kaput) gének a szervezet fő időzítői. Bonyolult sejttani és szövettani módszereket alkalmazva kimutatták e gének létezését, mint a CLOCK, NPAS2 (neuronal PAS domain protein-2) és BMAL1 (brain and muscle ARNT like protein). Ezek a gének komplex kölcsönhatásokon keresztül befolyásolják egymást és ezáltal irányítják az élettani folyamatokat.A CLOCK, NPAS2 és BMAL1 egy egységet létrehozva hatással vannak bizonyos gének DNS-ről való átíródására. Az NPAS2 és BMAL1 heterodimert alkotva határozzák meg a belső ritmust. Az így szabályozott fehérjék közül említésre méltó a Per (Period) és Cry (Chryptochrom), melyek negatív feedback mechanizmussal gátolják a CLOCK és BMAL1 által meghatározott folyamatot. (Halmos, Suba, 2012) | . A CLOCK (circadian locomotor output cycles kaput) gének a szervezet fő időzítői. Bonyolult sejttani és szövettani módszereket alkalmazva kimutatták e gének létezését, mint a CLOCK, NPAS2 (neuronal PAS domain protein-2) és BMAL1 (brain and muscle ARNT like protein). Ezek a gének komplex kölcsönhatásokon keresztül befolyásolják egymást és ezáltal irányítják az élettani folyamatokat.A CLOCK, NPAS2 és BMAL1 egy egységet létrehozva hatással vannak bizonyos gének DNS-ről való átíródására. Az NPAS2 és BMAL1 heterodimert alkotva határozzák meg a belső ritmust. Az így szabályozott fehérjék közül említésre méltó a Per (Period) és Cry (Chryptochrom), melyek negatív feedback mechanizmussal gátolják a CLOCK és BMAL1 által meghatározott folyamatot. (Halmos és Suba, 2012) |
| Line 32: | Line 32: |
| . Az endonukleáris receptor családok, olyan receptorokat tartalmaznak, melyek a clock gének bekötődését követően különböző célgéneket aktiválnak. Ha ez a receptor-gén kapcsolat zavart szenved különböző betegségek alakulhatnak ki, ilyen például az elhízás, szívinfarktus és metabolikus szindróma. Az emberi genom 17. kromoszómáján lokalizálódik a NR1D1 gén, ami a rev-erb-α transzkripcionális receptort kódolja, melynek célgénjei például lipoprotein ApoA1 és hidratáz-dehidrogenáz. Ennek a receptornak a transzkripcióját a CLOCK meg BMAL1 kódolja, vagyis hatással vannak az NR1D1 génre. Ez a rev-erb-α receptor például a vázizomzatban, retinában és a májban keletkezik. A Rev-erb-α negatív visszacsatolás révén szabályozza önnön termelődését, a BMAL1 gátlásával. A ROR-α (retinoid-related orphan receptor alpha) kompetitíven gátolja a Rev-erb-α BMAL1 kapcsolatát, ezáltal a negatív feedback mechanizmust, így serkenti a receptor fehérje kialakulását. A ROR-α és a Rev-erb-α közösen szabályozzák a cirkadián ritmust, a homeosztázist és a gyulladásos folyamatokat. A PPAR-α és PPAR-γ (Peroxisomeproliferator-activated receptor gamma) upregulálják a BMAL1 és rev-erb-α expresszióját. A PPAR-γ pozitívan hat a ROR-α mediált folyamatokra.(Halmos, Suba, 2012) (2. ábra) | . Az endonukleáris receptor családok, olyan receptorokat tartalmaznak, melyek a clock gének bekötődését követően különböző célgéneket aktiválnak. Ha ez a receptor-gén kapcsolat zavart szenved különböző betegségek alakulhatnak ki, ilyen például az elhízás, szívinfarktus és metabolikus szindróma. Az emberi genom 17. kromoszómáján lokalizálódik a NR1D1 gén, ami a rev-erb-α transzkripcionális receptort kódolja, melynek célgénjei például lipoprotein ApoA1 és hidratáz-dehidrogenáz. Ennek a receptornak a transzkripcióját a CLOCK meg BMAL1 kódolja, vagyis hatással vannak az NR1D1 génre. Ez a rev-erb-α receptor például a vázizomzatban, retinában és a májban keletkezik. A Rev-erb-α negatív visszacsatolás révén szabályozza önnön termelődését, a BMAL1 gátlásával. A ROR-α (retinoid-related orphan receptor alpha) kompetitíven gátolja a Rev-erb-α BMAL1 kapcsolatát, ezáltal a negatív feedback mechanizmust, így serkenti a receptor fehérje kialakulását. A ROR-α és a Rev-erb-α közösen szabályozzák a cirkadián ritmust, a homeosztázist és a gyulladásos folyamatokat. A PPAR-α és PPAR-γ (Peroxisomeproliferator-activated receptor gamma) upregulálják a BMAL1 és rev-erb-α expresszióját. A PPAR-γ pozitívan hat a ROR-α mediált folyamatokra.(Halmos és Suba, 2012) (2. ábra) |
| Line 69: | Line 69: |
| . A hosszú utazások, több időzónán átívelő repülőutak hatással vannak belső ritmusunkra, befolyásolják egészségügyi állapotunkat. A jetlag nem nevezhető betegségnek, inkább belső óránk zavarára visszavezethető tünetegyüttesnek tekinthetjük. A jetlag jelenségéről az Amerikai Alvásmedicina Akadémia leírásai szerint a következő három tényező együttes fennállásakor beszélhetünk: (1) minimum 2 időzóna gyors átlépése után megjelenő álmatlanság, illetve napközben aluszékonyság, (2) csökkent teljesítőképesség, valamint emésztőrendszeri problémák az utazást követő 2-3 napon belül, (3) mással nem indokolható alvászavar. A CLOCK rendszer és ritmusaink működésének megismerése segített abban is, hogy a tünetegyüttest különböző módszerekkel kezelni tudják. A belső ciklusunk helyreállítása történhet megfelelő fényimpulzus, vagy melatonin segítségével, az alvás-ébrenlét optimalizálásával, illetve különféle gyógyszerek alkalmazásával. Attól függően, hogy milyen napszakban alkalmazzuk a fényt, továbbá a melatonint, más hatást érhetünk el a belső óránkban. Este alkalmazott fényimpulzus, az órát későbbre, míg a reggeli korábbra állítja. A melatoninról már korábban leírtak alapján tudjuk, hogy alapvetően sötétségben, éjjel 10-12 óra között mutat termelődési csúcsot. Ezekből következően a melatonin bevétele ellenkező hatást fejt ki belső óránkra, mint a fény. Szükség esetén pedig gyógyszereket is alkalmazhatunk, leggyakoribb a rövid hatástartalmú altatók szedése, ezeket akár már a repülő úton is bevehetjük. A nap folyamán jelentkező álmosságot a legkönnyebben koffein segítségével orvosolhatjuk. Kutatások folynak a narcolepsia ellenes gyógyszerek ilyen célú alkalmazásával kapcsolatban, de tünetek megszüntetése mellett sajnos mellékhatások is felléptek, az armodalfinil esetén például hányás és fejfájás. Továbbá megoldások lehetnek az esetlegesen felmerülő problémákra a melatonin receptorokon ható gyógyszerek is, ilyen a ramelteron és tasimelteon. Utazásunknak számos hatása lehet ritmusos folyamatainkra, kritikus esetekben pedig a nagyon gyakori időzónaváltás, következményesen az cirkadián ritmus felborulása, súlyos betegségek, vérnyomás problémák és daganatok kialakulását is előidézheti. (Igaz, Tulassay, 2011) | . A hosszú utazások, több időzónán átívelő repülőutak hatással vannak belső ritmusunkra, befolyásolják egészségügyi állapotunkat. A jetlag nem nevezhető betegségnek, inkább belső óránk zavarára visszavezethető tünetegyüttesnek tekinthetjük. A jetlag jelenségéről az Amerikai Alvásmedicina Akadémia leírásai szerint a következő három tényező együttes fennállásakor beszélhetünk: (1) minimum 2 időzóna gyors átlépése után megjelenő álmatlanság, illetve napközben aluszékonyság, (2) csökkent teljesítőképesség, valamint emésztőrendszeri problémák az utazást követő 2-3 napon belül, (3) mással nem indokolható alvászavar. A CLOCK rendszer és ritmusaink működésének megismerése segített abban is, hogy a tünetegyüttest különböző módszerekkel kezelni tudják. A belső ciklusunk helyreállítása történhet megfelelő fényimpulzus, vagy melatonin segítségével, az alvás-ébrenlét optimalizálásával, illetve különféle gyógyszerek alkalmazásával. Attól függően, hogy milyen napszakban alkalmazzuk a fényt, továbbá a melatonint, más hatást érhetünk el a belső óránkban. Este alkalmazott fényimpulzus, az órát későbbre, míg a reggeli korábbra állítja. A melatoninról már korábban leírtak alapján tudjuk, hogy alapvetően sötétségben, éjjel 10-12 óra között mutat termelődési csúcsot. Ezekből következően a melatonin bevétele ellenkező hatást fejt ki belső óránkra, mint a fény. Szükség esetén pedig gyógyszereket is alkalmazhatunk, leggyakoribb a rövid hatástartalmú altatók szedése, ezeket akár már a repülő úton is bevehetjük. A nap folyamán jelentkező álmosságot a legkönnyebben koffein segítségével orvosolhatjuk. Kutatások folynak a narcolepsia ellenes gyógyszerek ilyen célú alkalmazásával kapcsolatban, de tünetek megszüntetése mellett sajnos mellékhatások is felléptek, az armodalfinil esetén például hányás és fejfájás. Továbbá megoldások lehetnek az esetlegesen felmerülő problémákra a melatonin receptorokon ható gyógyszerek is, ilyen a ramelteron és tasimelteon. Utazásunknak számos hatása lehet ritmusos folyamatainkra, kritikus esetekben pedig a nagyon gyakori időzónaváltás, következményesen az cirkadián ritmus felborulása, súlyos betegségek, vérnyomás problémák és daganatok kialakulását is előidézheti. (Igaz és Tulassay, 2011) |
Contents
- A biológiai ritmusok
- A biológiai óra
- A belső óra felépítése
- CLOCK gének
- Endonukleáris receptor családok
- Endokrin szabályozási ív
- Az óragének vizsgálata madarakban (2004-2007 közötti kísérletek elemzése)
- A biológiai óra mechanizmusának zavarából eredő megbetegedések
- A jet lag
- Életkort befolyásoló gének
- A belső biológiai óra ismeretének alkalmazása a klinikumban
- Irodalomjegyzék
A biológiai ritmusok
- Az élőlényekben jelen lévő ritmusokat, biológiai ritmusoknak nevezzük, ami az élő szervezetben lejátszódó folyamatok periodocitását jelenti. Ilyen ritmusos folyamatok például az emésztés, a menstruációs ciklus, az alvás-ébrenlét váltakozása és a ciklikusan termelődő hormonok szintje. Azokat a belső és külső hatásokat, amik a biológiai ritmusokat szabják meg Zeitgeber-eknek (időadónak) nevezzük. A külső környezeti tényezők közül legfontosabb a fény, ezzel ellentétben azonban a hőmérséklet szerepe szinte elhanyagolható. Ezeket az élővilágban megfigyelhető periodikus folyamatokat 3 csoportba oszthatjuk, a cirkadián, ultradián és infradián ritmusokra. Az ultradián (latinul: ultra diem = egy napon túli, kevesebb, mint egy nap) ciklusok azok, melyek egy nap alatt többször is ismétlődnek, ilyenek például a szívverés, légzés vagy akár az ecetmuslica hímjének nászéneke, melynek frekvenciája periodicitást mutat. (Kyracou és Hall, 1980.) Az infradián (latinul: infra diem = egy nap alatti) ciklusok azok, melyek ismétlődéséhez több nap kell, például a menstruációs ciklus, mely primatákban 28–32 napos. Az leghosszabb infradián ritmus a cirkannuális ritmus, ami éves ismétlődést mutat, a legközismertebb ezek közül a téli álmot alvó állatok nyugalmi periódusa. A harmadik csoportot a cirkadián ritmusok alkotják, melyek periódus hossza körülbelül egy nap. Emberekben ez 23,5 és 24,65 óra, melyet a Harvard kutatói bizonyítottak. (Scheer és mtsai, 2007)
A biológiai óra
- Az élőlényekben jelen levő ritmikus folyamatokat és a környezeti tényezőket a belső óra hangolja össze. A belső óra létezését sokáig vitatták, nehezen elképzelhető szabályozhatósága miatt. Ma azonban már megközelítőleg ismerjük a működését és felépítését.
A belső óra felépítése
A klasszikus óramodellt (Merrow és mtsai, 1998; Johnson és mtsai, 1998) három részre oszthatjuk. Van egy bemeneti, egy kimeneti és egy központi, azaz oszcillátor része. A fény a retinában található fotoreceptorokon keresztül jut be és alakul át ingerületté, ami a Nucleus Suprachiasmaticusba (SCN) érkezik és különböző mechanizmusokon keresztül befolyásolja a szervezet periodikus folyamatait. Ebben az esetben az inputot (bemeneti rész) a fény fotoreceptorokra kifejtett hatása, az outputot (kimeneti rész) pedig az idegi- vagy hormonális úton végbemenő folyamat jelenti. Az oszcillátor mechanizmus pedig a Nucleus Suprachiasmaticus által végzett munka. (1. ábra)
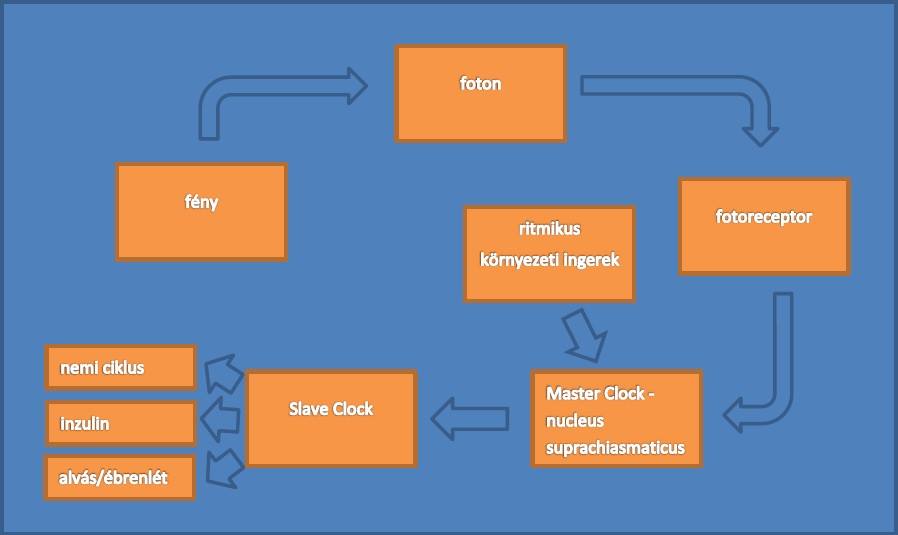
1. Ábra
A belső óra felépítése
Retina
- A retina pigmenthám alatti rétege tartalmazza a receptorokat, melyek a csapok és pálcikák, illetve a mechanizmus szempontjából kiemelendők az alsóbb rétegben található specializált fotoszenzitív ganglionsejtek. Utóbbiak fényinger esetén közvetlenül, a retinától hipothalamikus traktuson szállítják az ingerületet a központba (SCN) az általuk termelt melanopszin nevű fotopigment segítségével.
Nucleus Suprachiasmaticus (SCN)
- A Nucleus Suprachiasmaticus a belső óra központja (Master CLOCK). Ez megközelítőleg 9 mm mélyen található a sinus sagittalis alatt és szorosan egymáshoz simuló kisméretű sejtekből áll. Ha ezt a magcsoportot eltávolítjuk és izolált körülmények között vizsgáljuk, akkor kiderül, hogy azok megtartják ritmusos működésüket, azonban a szervezet folyamatai elvesztik ritmicitásukat. Továbbá a szervezetben jelen vannak még a Slave CLOCK szabályzó rendszerek is, melyek működését a Master CLOCK befolyásolja, ilyen Slave CLOCK található például a pancreasban is. Érdemes megemlíteni, hogy a „Slave Clock”, és a „Master Clock” kifejezések a telekommunikációban használatosak, és egy hierarchikus időmérő rendszert jelentenek.
Output
- Ezek a periodicitást mutató életfolyamatok, melyeket a belső biológiai óra CLOCK génjei szabályoznak. (Halmos és Suba, 2012)
CLOCK gének
- A CLOCK (circadian locomotor output cycles kaput) gének a szervezet fő időzítői. Bonyolult sejttani és szövettani módszereket alkalmazva kimutatták e gének létezését, mint a CLOCK, NPAS2 (neuronal PAS domain protein-2) és BMAL1 (brain and muscle ARNT like protein). Ezek a gének komplex kölcsönhatásokon keresztül befolyásolják egymást és ezáltal irányítják az élettani folyamatokat.A CLOCK, NPAS2 és BMAL1 egy egységet létrehozva hatással vannak bizonyos gének DNS-ről való átíródására. Az NPAS2 és BMAL1 heterodimert alkotva határozzák meg a belső ritmust. Az így szabályozott fehérjék közül említésre méltó a Per (Period) és Cry (Chryptochrom), melyek negatív feedback mechanizmussal gátolják a CLOCK és BMAL1 által meghatározott folyamatot. (Halmos és Suba, 2012)
Endonukleáris receptor családok
Az endonukleáris receptor családok, olyan receptorokat tartalmaznak, melyek a clock gének bekötődését követően különböző célgéneket aktiválnak. Ha ez a receptor-gén kapcsolat zavart szenved különböző betegségek alakulhatnak ki, ilyen például az elhízás, szívinfarktus és metabolikus szindróma. Az emberi genom 17. kromoszómáján lokalizálódik a NR1D1 gén, ami a rev-erb-α transzkripcionális receptort kódolja, melynek célgénjei például lipoprotein ApoA1 és hidratáz-dehidrogenáz. Ennek a receptornak a transzkripcióját a CLOCK meg BMAL1 kódolja, vagyis hatással vannak az NR1D1 génre. Ez a rev-erb-α receptor például a vázizomzatban, retinában és a májban keletkezik. A Rev-erb-α negatív visszacsatolás révén szabályozza önnön termelődését, a BMAL1 gátlásával. A ROR-α (retinoid-related orphan receptor alpha) kompetitíven gátolja a Rev-erb-α BMAL1 kapcsolatát, ezáltal a negatív feedback mechanizmust, így serkenti a receptor fehérje kialakulását. A ROR-α és a Rev-erb-α közösen szabályozzák a cirkadián ritmust, a homeosztázist és a gyulladásos folyamatokat. A PPAR-α és PPAR-γ (Peroxisomeproliferator-activated receptor gamma) upregulálják a BMAL1 és rev-erb-α expresszióját. A PPAR-γ pozitívan hat a ROR-α mediált folyamatokra.(Halmos és Suba, 2012) (2. ábra)
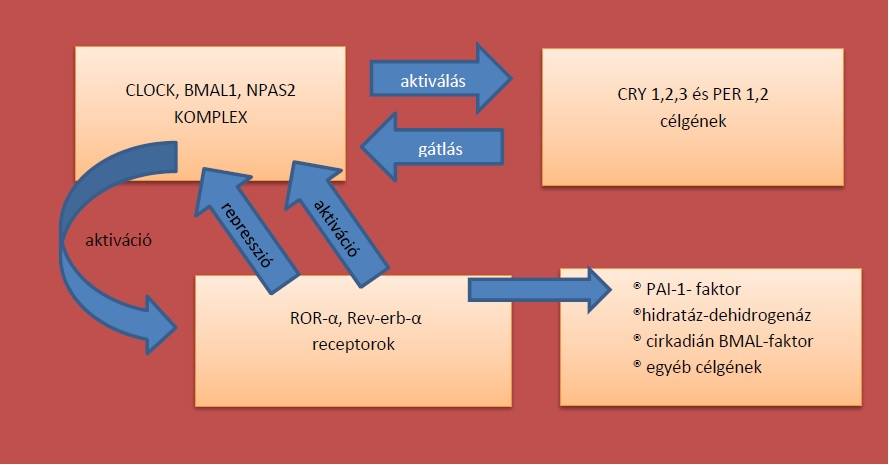
2. Ábra
Endonukleáris receptor családok
Endokrin szabályozási ív
- Megvilágítás hiányában a corpus pinealéban aktiválódik a szerotonin-melatonin (n-acetil-5-metoxitritpamin) átalakulás, ami N-acetiltranszferáz (NAT) és a hidroxi-indol-O-metiltranszferáz (HIOMT) enzimek által katalizált. A melatonin legfontosabb hatásai közé tartozik a Scavenger (antioxidáns) mechanizmusban és a biológiai ritmusban betöltött szerepe. Befolyásolja a szexuális ciklusokat, a GnRH, FSH és LH hormonok szabályzása révén. Hatással van az ovulációra és a szexuális érésre. Az állatoknál nagyobb szerepe van a szexuális maturációban, magas szintje gátolja azt. A szexuális ciklusra kifejtett hatása alapján megkülönböztetünk hosszú és rövidnappalos állatokat. Hosszú nappalos állatok esetében, mint a ló, a 9,5 óránál több nappali megvilágítás, azaz a csökkenő melatonin szint, elindítja az ösztrusz folyamatát, így a vemhesülés időpontja a tavaszi-nyári időszakra esik, majd közel egy éves gestáció után, ismét a tavaszi-nyári időszakban következik be az ellés, ami az utód túlélési esélyeit növeli. A rövidnappalos állatok esetében, mint a juh is, ez éppen ellenkezőleg van, vagyis a rövidülő nappali megvilágítás, ezáltal a növekvő melatonin szint, váltja ki náluk a szexuális aktivitást, így a rövidebb vemhességi időnek köszönhetően az ellés úgyszintén a melegebb időszakra esik. Továbbá a melatonin nagy szerepet játszik a pszichés változásokban is. Fény hiányában mentális kórképek alakulhatnak ki, például bipoláris elmezavar. Londoni kutatók bebizonyították, hogy ezek a pszichés zavarok etnikumtól függetlenül megjelenhetnek a biológiai ritmus zavarása következében.(Hamer és mtsai, 2012) Érdemes említeni még a táplálékokban fellelhető melatonin tartalmat, mely csirkékre hatással van, ám emberekben semmilyen észlelhető reakciót nem váltott ki. Léteznek melatonin tartalmú táplálékkiegészítő készítmények, melyeket számos országban álmatlanság kezelésére alkalmaznak.(Zhdanova és mtsai, 2001)
Az óragének vizsgálata madarakban (2004-2007 közötti kísérletek elemzése)
- Az emlősökben feltételezett óragén létezését vizsgálták madarakban RT-PCR technikával a reverz transzkripció útján. (PCR (Polimerase Chain Reaction): Kary Mullis nevéhez köthető. Lényegében ez a DNS szintézis in vitro körülmények között modellezve. Adott egy megfelelő körülményekkel ellátott közeg, amelybe a DNS szintézis elemeit (a szintetizálandó DNS, a primerek, aktivált nukleotidok, monomerek, DNS polimeráz) visszük be, ahol a megfelelő körülmények hatására lejátszódik láncreakciószerűen a DNS szintézis.) A kísérletek során kimutatták az emberben fellelhető CLOCK gének nagy részét a madarak genomjában, amelyek: CLOCK, BMAL1-2, PER1-2-3, CRY1-2. A megvilágítás változtatásának hatására már két óra elteltével jelentkezett a csirkék óragén expressziójának ritmus változása. 18 napos csirke-embriókon végrehajtott kísérlet bizonyította, hogy nem szükséges a fény-sötét ciklus ritmikus változtatása ahhoz, hogy a biológiai óra megfelelően működjön. Tehát a csak sötétben inkubált embrióknál ugyanúgy működik a circadian ritmus, mint a periodikus megvilágítást kapó társaiknál. Ezt a folyamatot nevezzük freerun-nak. (Tipikus példája ennek a vakondok, akinél a fény érzékelésének hiányában is működik a biológiai óra.) A kísérletben észlelhető volt, hogy a madarakban, fény hiányában már a 14. naptól beindult a melatonin termelés. Azonban csak a 17. naptól kezdve alakult ki a melatonin-ciklus. Tehát a fényingerek nincsenek hatással a tobozmirigyre a 17. nap előtt. A fény-sötét szakaszok felcserélése, illetve az intenzitás csökkentése az embriók 17. fejlődési napja után két ciklusnak kellett eltelnie ahhoz, hogy a madár biológiai órája alkalmazkodjon a külső hatásokhoz. Vagyis 18 napnak kell eltelnie ahhoz, hogy a fény igen kismértékű változtatása is befolyásolni tudja a ciklusos működést. Ezen kívül meghatározták, hogy a PACAP (Pituitary adenylate cyclase-activating peptide) és a VIP (Vasoactive intestinal peptide) alapvetően nem esszenciális faktorok a circadian ritmus kialakításában. A kialakulást segítik, de nélkülözhetőek. A ritmus ezek nélkül is kialakul az embriókban. A madarak vizsgálata során kiderült, hogy nem a fény az egyetlen befolyásoló tényező a circadian ritmus kialakításában. Kísérleteztek a hőmérséklet és a mágneses terek változtatásának hatásával is.(Rékási és mtsai, 2007)
A biológiai óra mechanizmusának zavarából eredő megbetegedések
- A cirkadián ritmus összekuszálódása számos kórkép kialakulását vonja maga után, mint pl. korunk egyik leggyakoribb betegségéét, a Diabetes Mellitusét, de ezen kívül hatása van pl. a rheumatoidarthritis, gastrointestinális kórképek, metabolikus szindróma kifejlődésében is. Továbbá bizonyított tény, hogy a biológiai óra szabálytalansága kedvez a memória zavaroknak, a demenciának, érzelmi, emócionális instabilitásnak. Ezeket legtöbbször az okozza, hogy az alvási periódus eltolódik.
Hypertonia
- Hypertóniás betegek biológiai ritmusát vizsgálva, a tudósok megfigyelték, hogy a vérnyomásnak ciklusos ingadozásai vannak a nap folyamán. Ennek a ciklusnak a pontos ismeretében a megfelelő időpontban adott vérnyomást állító készítmények adása még hatásosabb eredményt érhet a betegség kezelésében. A ciklusos változás során éjszaka lecsökken a vérnyomás és napközben pedig ingadozást mutat.(Zhao és mtsai, 2011)
Véralvadás
- A véralvadás cirkadián ritmusának felborulása esetén, a rögösödés irányába tolódik el az egyensúly. A PAI1 (plasminogenactivator inhibitor 1) fehérje kifejeződése is egy bizonyos ritmust mutat. Ez a fehérje a véralvadási rendszer egyik fontos szabályozója. Az uPA (urokinase-type plasminogen activator), és tPA (tissue plasminogen activator) plazminogén aktivátorok serkentése révén, ez a fehérje képes fibrinolízis előidézésére, a vérrögösödés kiváltására, ezeken kívül pedig atherosclerotikus, és gyulladáskeltő hatású. A PAI1 természetes esetben blokkolva van a Rev-erb-α által, azonban ha a ciklus felborul, a PAI1 felszabadul a gátlás alól, és ez véralvadási zavarokhoz vezet. (Wang és mtsai, 2006)
Diabetes mellitus
- Feltételezik, hogy a reggelenként jelentkező inzulinrezisztencia és a délelőtt fellépő fokozott inzulin érzékenység is a CLOCK gének befolyása alatt áll, ami bizonyos azonban, hogy a szénhidrát-anyagcsere és a cirkadián rendszer között molekuláris összefüggés van. Kalsbek munkatársaival együtt, a világon elsőként, kimutatta, hogy a 2-es típusú diabétesz kialakulásában jelentős szerepet játszik a CLOCK gének rendszertelensége. Az általuk végzett megfigyelések során kiderült, hogy az óra gének normálistól eltérő működése során a vázizmok glükóz felvétele és a máj glükóz kiáramlása zavarttá válik. (Kalsbeek és mtsai, 2010) Los Angelesben, Gale és kollégái bebizonyították, hogy a napi bioritmus megzavarása növeli a 2-es típusú diabétesz kialakulását, különösképpen az arra hajlamos egyedekben. Kísérletükben kétféle patkány típust figyeltek meg, és azt tapasztalták, hogy a diebéteszre hajlamos rágcsálók esetében hyperglykaemia és hypoinsulinaemia alakult ki az inzulinszekréció és a β-sejtek csökkenése végett. (Gale és mtsai, 2011) Sadacca és munkatársai BMAL-hiányos egereket használva felfedezték új, eddig ismeretlen perifériás órák (Slave CLOCK) létezését. Ezeket, a pancreasban található, β-sejtek autonóm szabályzó rendszereket – perifériás órákat – fontosabbnak tartják, mint magát a Master CLOCK-ot az inzulin- és szénhidrát-anyagcsere megfelelő működésének fenntartása esetén. További számos kísérletek elvégzése után különböző tudósok megállapították, hogy a Rev-erb-α gének jelentősen befolyásolják a pancreas inzulint termelő sejtjeit. Míg a leptin kezelés megnöveli, addig a zsíros ételek fogyasztása megzavarja az előbb említett CLOCK gén, az-az a Rev-erb-α képződését. A CLOCK, BMAL1, PER 1-2-3 és CRY 1-2 CLOCK gének úgyszintén megtalálhatók a pancreasban és segítik annak megfelelő működését. A BMAL1csökkenti a diabetogén hajlamot azáltal, hogy gátolja az arilhidrokarbon-receptorok működését, melyek aktivitása növeli a 2-es típusú diabétesz kialakulását. (Sadacca és mtsai, 2011) A cukorbeteg emberektől vett mintákat tanulmányozva megállapították, hogy esetükben a PER 1-2-3 és a CRY 1-2 mRNS-szintje jelentősen alacsony volt. A Nurses’s Health Studies adataiból kiderült, hogy az éjszakai műszakban dolgozók közt jelentősen több cukorbeteg, mint a csak nappali műszakosok közt. (Stamenkovic és mtsai, 2012)
Metabolikus szindróma
- A metabolikus szindróma (MS) a keringési rendellenességek és valamennyi anyagcsere problémák összessége. A cirkadián óra felborulása nagyban hozzájárul, az imént említett betegségek kialakulásához. Vizsgálatok kimutatták, hogy egereknél, akikből hiányzik a CLOCK vagy BMAL1 gén glükóz keringési zavar, glükoneogenetikus problémák és a trigliceridek rendszeres termelődésének rendellenessége jelentkezett. A zsíranyagcsere szabályzásának felborulása nagyban befolyásolja a metabolikus szindróma kialakulását. Ezeknek az anyagcsere folyamatoknak a szabályzásában, a zsírsejtekben (adipocyta) jelen lévő perifériás óráknak fontos szerepe van. A zsigeri zsírszövet gyarapodását növeli és ezzel együtt a MS kialakulását idézi elő, a BMAL1, CRY1 és PER2 gének kifejeződése az mRNS-ről. Ahogy a 2-es típusú diabétesz, az anyagcsere zavarok is nagyobb számban jelentkeztek váltott vagy éjszakai műszakban dolgozók körében, a belső biológia óra felborulása, a rendszertelen melatonin avagy szerotonin termelődés miatt. Argentin kutatók a szerotonintranszporter gén (SLC6A4) és a CLOCK gén egymásra hatását vizsgálva rájöttek, hogy kölcsönhatás van a két gén között és ebből kifolyólag azoknál, akik rendszertelenül alszanak nagyobb a valószínűsége a MS kialakulásának. (Sookoian és mtsai, 2010.)
Rákos betegségek
- Kutatások bizonyítják, hogy a BMAL-1, és PER-2 gének megváltozott expressziója carcinomát indukál. Sahar és Sassone-Corsi mutattak rá egyértelműen, hogy a CLOCK rendszer génjeinek diszfunkciója, ezáltal a biológiai ritmus felborulása daganatos betegségek kialakulásához vezethet. Mindemellett érdekes tény, hogy a kemoterápia is hasonló ciklusfelborító hatással bír, így az is élethossz-rövidítő tényező. (Sahar és Sassone-Corsi, 2009)
Máj működésére kifejtett hatása
- Hoogerwerf kísérleteken keresztül bizonyította a PER-2 gén defenzív szerepét a májra. Kiderült, hogy szén-tertraklorid-mérgezés esetén a várható cholostaticus májkárosodás és fibrosis nem alakul ki, amennyiben a biológiai ritmus szabályozva van a PER-2 gén által. (Hoogerwerf, 2009)
A jet lag
- A hosszú utazások, több időzónán átívelő repülőutak hatással vannak belső ritmusunkra, befolyásolják egészségügyi állapotunkat. A jetlag nem nevezhető betegségnek, inkább belső óránk zavarára visszavezethető tünetegyüttesnek tekinthetjük. A jetlag jelenségéről az Amerikai Alvásmedicina Akadémia leírásai szerint a következő három tényező együttes fennállásakor beszélhetünk: (1) minimum 2 időzóna gyors átlépése után megjelenő álmatlanság, illetve napközben aluszékonyság, (2) csökkent teljesítőképesség, valamint emésztőrendszeri problémák az utazást követő 2-3 napon belül, (3) mással nem indokolható alvászavar. A CLOCK rendszer és ritmusaink működésének megismerése segített abban is, hogy a tünetegyüttest különböző módszerekkel kezelni tudják. A belső ciklusunk helyreállítása történhet megfelelő fényimpulzus, vagy melatonin segítségével, az alvás-ébrenlét optimalizálásával, illetve különféle gyógyszerek alkalmazásával. Attól függően, hogy milyen napszakban alkalmazzuk a fényt, továbbá a melatonint, más hatást érhetünk el a belső óránkban. Este alkalmazott fényimpulzus, az órát későbbre, míg a reggeli korábbra állítja. A melatoninról már korábban leírtak alapján tudjuk, hogy alapvetően sötétségben, éjjel 10-12 óra között mutat termelődési csúcsot. Ezekből következően a melatonin bevétele ellenkező hatást fejt ki belső óránkra, mint a fény. Szükség esetén pedig gyógyszereket is alkalmazhatunk, leggyakoribb a rövid hatástartalmú altatók szedése, ezeket akár már a repülő úton is bevehetjük. A nap folyamán jelentkező álmosságot a legkönnyebben koffein segítségével orvosolhatjuk. Kutatások folynak a narcolepsia ellenes gyógyszerek ilyen célú alkalmazásával kapcsolatban, de tünetek megszüntetése mellett sajnos mellékhatások is felléptek, az armodalfinil esetén például hányás és fejfájás. Továbbá megoldások lehetnek az esetlegesen felmerülő problémákra a melatonin receptorokon ható gyógyszerek is, ilyen a ramelteron és tasimelteon. Utazásunknak számos hatása lehet ritmusos folyamatainkra, kritikus esetekben pedig a nagyon gyakori időzónaváltás, következményesen az cirkadián ritmus felborulása, súlyos betegségek, vérnyomás problémák és daganatok kialakulását is előidézheti. (Igaz és Tulassay, 2011)
Életkort befolyásoló gének
- Csaknem 30.000 évvel ezelőtt az emberek átlag élethossza megközelítette a 30 évet. Ez a szám idők során fokozatosan, a szociális, higiénés, és egészségügyi fejlődés révén növekedett, olyannyira, hogy a mai emberi élethossz elérheti akár a 120-122 évet is. George Buffon (1707-1778) gondolata nyomán az állatok átlag élethossza a növekedésük teljes befejeződéshez szükséges idő hatszorosa. Az emberi élet hosszabbítása nagyon sok tudós fantáziáját megmozgatta, ilyen irányú génkutatások ma is sűrűn zajlanak. Azonban emellett azt is tudnunk kell azt is, hogy az öregedő társadalom ellátása igencsak problémás feladat. Az emberi és állati élet hossza 70%-ban környezeti (higiénia, egészségügyi ellátás, környezetszennyezés), 30%-ban egyéni tényezők (életmód, öröklött faktorok) által befolyásolt. Érdemes megemlíteni, hogy a hypogonad hímek élettartama hosszabb, a tesztoszteron anyagcserehatásainak kiesése miatt. Ezek a gének az embereket, és állatokat sújtó egyik legkomolyabb betegség típusra, a tumoros megbetegedésekre is hatással vannak. Ismert egy bizonyos daf-2 gén, mely apoptikus hatása révén – féregkísérletekben – elpusztítja a tumorsejteket, így hatása alapján antikarcinogénnek nevezhető, és az élettartamot akár kétszeresére is képes növelni. Ezzel szemben egy másik gén, a gld-1 gén tumorigén hatása révén az élettartamot rendkívüli módon lerövidíti. Pinkston elmés ötlete volt, hogy megalkotta a „kiméra” állatot, vagyis ezt a két gént tartalmazó genomú élőlényt hozott létre, így abban a daf-2 gén közömbösítette a gld-1 hatását, vagyis hosszú, daganatmentes életet élhetett az állat. (Pinkston, 2006)
Az öregedést okozó gének
- A szervezetben normális esetben összerendezetten működnek az életfolyamatok,egészen a legapróbb folyamatokig irányítva,szabályozva vannak, ám, ha valamilyen okból kifolyólag az egyik fő szabályozó, a CLOCK rendszer sérülést szenved, ez a finom szabályozás tönkremegy. Léteznek olyan génmutációk, melyek képesek a szervezetben előidézni a korai öregedést. ilyen gének például WRN, mely a Werner szindróma nevű betegséget okozza, mely recesszíven öröklődik, (Yu és mtsai, 1996), illetve a LMNA laminA/C nevű, mely a Hutchinson-Gilford szindrómát hozza létre, mely már domináns módon öröklődik (Eriksson és mtsai, 2003) Hayflick állította, hogy az egysejtűek esetében, a replikációjukkor (mely lényegében az öregedésüknek felel meg) körülbelül 50 duplikációra képesek, ezután megrekednek a G1 szakaszban, ahonnan az egyetlen kiutat az apoptózis jelenti számukra. Másik ismert tény, hogy létezik egy úgynevezett telomeráz enzim, amely képes megakadályozni, hogy a kromoszómák osztódásukkor elveszítsenek egy 50 TTAGGG kódsorrendű nukleotidot. Ez a telomeráz enzim akkumulálódik néhány szomatikus, ivari, de kiemelendően a tumor sejtekben. Tehát, logikusan levezethető, hogy az enzim gátlása apoptózist von maga után, vagyis ez a folyamat tumor kezelésben alkalmazható. (Hayflick, 1961) Ezeken kívül az 1. kromoszómán fedeztek fel egy olyan génszakaszt, mely elvesztése 20%-kal hosszabbította meg az életet, így a gént elnevezték „agg” génnek. (Vojta és mtsai, 1996) Másik génszakasz, a Clock 1 gén, mely eltávolítása az embrió elhalását vonta maga után, a gén mutációja pedig növeli az élethosszt, illetve befolyásoló szerepű az egyedfejlődésben. (Takuji és mtsai, 2001)
Mitokondriális DNS
- A mikokondrium, működése során véthet hibákat. Ezek a hibák az anyai eredetű, cirkuláris DNS-ének mutációjából adódnak. Mindez azért okoz gondot, mert a mitokondrium működésének mechanizmusa szerint az oxigén molekulára elektront kapcsol, melyből így reaktív oxigén gyökök (hidrogén-peroxid, OH∙ ) keletkeznek, és ezekből elméletileg víz keletkezne, ám ha a folyamat elakad valamilyen okból kifolyólag, akkor a szabad gyökök kiszabadulnak, és hatalmas pusztításokat végezhetnek rendkívüli reakcióképességükből kifolyólag. (daganatokat, enzimzavarokat okoznak, membránkárosító hatásúak) Ezen szabadgyökök ellen védekeznek a már említett scavenger anyagok, mint például a melatonin, illetve a peroxiszómában lokalizálódó szuperoxid dizmutáz nevezetű enzim is. Szabad gyökök kialakulása, és pusztítása vezet az Parkinson- és Alzheimer-kórhoz is. Élettartamot növelő génekre pár példát említhetünk: SIR-2, mely 30%-os élettartam növekedést idéz elő, illetve a metabolikus folyamatokra hat, és a stresszre ad specifikus választ. Hasonló hatású az Amp1 nevű gén is. A GH 7-150%-os élethossz növekedést is előidézhet, ám törpenövést okozhat a túlzott aktivitása. (Rucz, 2008)
A belső biológiai óra ismeretének alkalmazása a klinikumban
- Ahogy azt már fentebb leírtuk a belső biológiai órának nagy jelentősége van egyes kórképek kialakulásában, kivédésben. A melatoninnak fontos szerepet tulajdonítanak különböző betegségek kialakulásában ilyen például a metabolikus szindróma, 2-es típusú diabétesz, alvási zavarok vagy az elhízás. Továbbá közrejátszik még az idegrendszeri panaszok, károsodások (pl.: depresszió) megelőzésében, a mitochondriális biogenezisben és a gyulladásgátlásban. Az USA-ban már közel 20 éve recept nélkül kiválthatók olyan készítmények, melyek melatonint tartalmaznak, táplálékkiegészítő formában. Európában pedig csaknem 5 éve a Circadian néven ismert úgyszintén melatonin tartalmú gyógyszert ajánlják álmatlanság kezelésére. Napjainkban hazánkban például a Bio-Melatonin nevű készítményt alkalmazzák a többek közt jet-lag hatás elkerülésére. Valamint lehetségesnek tartják, hogy melatonin adagolása esetén megelőzhető a 2-es típusú diabétesz (Espino és mtsai, 2011). Fényterápia alkalmazása javallott például a gyerekek viselkedés zavarának kezelésében. Az előbb említett terápiát alkalmazzák még az északi országokban (időszakos fényhiány) a depressziós tünetek csökkentésére. A cirkadán CLOCK-rendszer felborulását okozhatja a például zsíros ételek fogyasztása, vagy a nem rendszeres megvilágítás is. Ennek ismeretében elő lehet segíteni a szervezet gyorsabb felépülését. Az egyéni biológiai ritmus pontos ismerete továbbá segítheti az egyes gyógyszerek célzott hatását, a megfelelő időben történő beadással.
Irodalomjegyzék
- Eriksson, M., Brown, W. T., Gordon, L. B. és mtsai: Recurrent de novo point mutations in lamin A cause Hutchinson–Gilford progeria syndrome. Nature, 2003, 423 , 293–298.
- Espino, J., Pariente, J. A., Rodríguez, A. B.: Role of melatonin on diabetes-related metabolic disorders. World J. Diabetes, 2011, 2, 82–91
- Gale, J., Cox, H. I., Qian, J., et al.: Disruption of circadian rhythms accelerates development of diabetes through pancreatic β-cell loss and dysfunction. J. Biol. Rhythms, 2011, 26, 425–433.
- Golden SS, Johnson CH, Kondo T (1998) The cyanobacterial circadian system: a clock apart. Curr. Opin. Microbiol. 1, 669-673.
- Halmos Tamás Dr., Suba Ilona Dr., Orvosi Hetilap 2012, 153. évfolyam, 35. szám, oldalszám: 1371-1377
- Hamer, M., Frasure-Smith, N., Lespérance, F., et al.: Depressive Symptoms and 24-Hour Ambulatory Blood Pressure in Africans: The SABPA Study.; Int. J. Hypertens., 2012, 2012,ID 426803 [Epub ahead of print 2011 Oct 19.]
- Hayflick, L.: The limited in vitro lifetime of human diploid cell strains. Exp. Cell. Res., 1961,25 , 585–621.
- Hoogerwerf, W. A.: Role of biological rhythms in gastrointestinal health and disease. Rev. Endocr. Metab. Disord., 2009, 10, 293–300.
- Igaz Péter Dr., Tulassay Zsolt Dr., Orvosi Hetilap 2011, 152. évfolyam, 50. szám, oldalszám: 2021-2024
- Kalsbeek, A., Yi, C. X., La Fleur, S. E., et al.: The hypothalamic clock and its control of glucose homeostasis. Trends Endocrinol. Metab., 2010, 21, 402–410.
- Kyriacou, C.P., Hall, J.C. (1980). Circadian rhythm mutations in Drosophila melanogaster affect short term fluctuations in the male's courtship song. Proc. Natl. Acad. Sci. U.S.A. 77(11): 6729--6733.
- Pinkston, J. M., Garigan, D., Hansen, M.: Mutations that increase the life span of C. elegans inhibit tumor growth. Science, 2006, 313 , 971–975.
- Polgár Veronika Dr. : Alkalmazott biológia, Semmelweis Egyetem, Egészségtudományi Kar, Budapest, 2008
- Rékási, Zoltán és Dénes, Viktória és Gábriel, Róbert és Mess, Béla és Toller, Gábor (2007) Az óragének és a környezeti fényviszonyok szerepe az N-acetiltranszferáz gén expressziójának szabályozásában, csirke retinában = The role of clock-genes and environment allighting conditions in the regulation of N-acetyltransferase gene expression in the chicken retina. Munkabeszámoló. OTKA.)Rekasi Z., és mtsai.,PNAS, 102: 3435-3440, 2005; Rekasi és mtsai., Tissue Antigens, 64: 391. 2004;
- Roenneberg T. , Merrow M. , 1998. Molecular circadian oscillators – an alternative hypothesis , J Biol Rhythms, 13: 167-179
- Rucz Károly Dr., Orvosi Hetilap 2008, 149. évfolyam, 30. szám, oldalszám: 1419-1424
- Sadacca, L. A., Lamia, K. A., deLemos, A. S., et al.: An intrinsic circadian clock of the pancreas is required for normal insulin release and glucose homeostasis in mice. Diabetologia, 2011, 54, 120–124.
- Sahar, S., Sassone-Corsi, P.: Metabolism and cancer: the circadian clock connection. Nat. Rev. Cancer, 2009, 9, 886–896.
Scheer, Frank A. J. L., Kenneth P. Wright, Jr., Richard E. Kronauer, Charles A. Czeisler (2007. augusztus 8.) „Plasticity of theIntrinsicPeriod of the Human CircadianTiming System”
- Sookoian, S., Gianotti, T. F., Burgueño, A., et al.: Gene-gene interaction between serotonin transporter (SLC6A4) and CLOCK modulates the risk of metabolic syndrome in rotating shiftworkers. Chronobiol. Int., 2010, 27, 1202–1218.
- Stamenkovic, J. A., Olsson, A. H., Nagorny, C. L., et al.: Regulation of core clock genes in human islets. Metabolism, 2012, 61, 978–985.
- Takuji, S., Daisuke, N., Shzuji, H. és mtsai: Clock-1 and Longevity. Biomed. Gerontol., 2001, 25 , 17–18.
- Vojta, P. J., Futreal, P. A., Annab, L. A.: Evidence for two senescence loci on human chromosome 1. Genes Chromosom. Cancer, 1996, 16 , 55–63.
- Wang, J., Yin, L., Lazar, M. A.: The orphan nuclear receptor Rev-erbα regulates circadian expression of plasminogen activator inhibitor type1. J. Biol. Chem., 2006, 281, 33842–33848.
- Yu, C. E., Oshima, J., Fu, Y. H. és mtsai: Positional cloning of the Werner’s syndrome gene. Science, 1996, 272 , 258–262.
- Zhao, P., Xu, P., Wan, C., et al.: Evening, versus morning dosing regimen drug therapy for hypertension.; Cochrane Database Syst. Rev., 2011, Oct 5. (10), CD004184.
(Megjegyzés: A képeket mi szerkesztettük)
