|
Size: 55608
Comment:
|
← Revision 295 as of 2017-05-05 10:07:35 ⇥
Size: 55607
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 278: | Line 278: |
| Halis, S.; Berna, D.; Yalçin, K. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmalogical Reports 59: (12) 247-258 | Halis, S.; Berna, D.; Yalçin, K. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmalogical Reports 59: (3) 247-258 |
| Line 302: | Line 302: |
| Laudanno, O. M.; Cesolari, J. A.; Esnarriaga, J.; Rista, L.; Piombo, G.; Maglione, C.; Aramberry, L.; Sambrano, J.; Godoy, A.; Rocaspana, A. (2000): Gastrointestinal damage induced by celecoxib and rofecoxib in rats. Digestive Diseases and Sciences 46: (6) 779–784 | Laudanno, O. M.; Cesolari, J. A.; Esnarriaga, J.; Rista, L.; Piombo, G.; Maglione, C.; Aramberry, L.; Sambrano, J.; Godoy, A.; Rocaspana, A. (2000): Gastrointestinal damage induced by celecoxib and rofecoxib in rats. Digestive Diseases and Sciences 46: (4) 779–84 |
| Line 332: | Line 332: |
| Süleyman, H.; Demircan, B.; Karagöz, Y. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmacological Reports 59: (12) 247-258 | Süleyman, H.; Demircan, B.; Karagöz, Y. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmacological Reports 59: (3) 247-258 |
| Line 340: | Line 340: |
| Vane, J. R.; Botting, R. M. (2003): The mechanism of action of aspirin. Thrombosis Research 110: (4) 255–258 | Vane, J. R.; Botting, R. M. (2003): The mechanism of action of aspirin. Thrombosis Research 110: (5-6) 255–258 |
A ciklooxigenáz (COX) gátlás, azaz a nem szteroid gyulladáscsökkentők szerepe a daganatterápiában
A ciklooxigenáz gátló anyagok egyikei a világ leggyakrabban használt gyógyszereinek. Ezeknek hatása a ciklooxigenáz rendszerekkel (COX) való kölcsönhatásuk során mutatkozik meg, melyről a későbbiekben lesz szó.
A gyulladás egy olyan biológiai láncreakciós válasz, mely a szervezetet érő negatív hatás ellen lép fel. Ezen folyamat kialakításában és lezajlásában sok anyag kölcsönhatása, szintézise vagy éppen lebomlása történik meg. Máig sem teljesen tisztázott ez a fejezet az orvostudományban. Ezen folyamatok gátlását, csökkentését előidéző gyógyszerek, hatásai, mellékhatásai és egyéb jellemzőinek kutatása, nagy jelentőséggel bír orvostudomány területén.
Contents
1. A ciklooxigenázokról általában
A ciklooxigenáz enzimrendszernek két főbb izoformája létezik: az élettani szereppel bíró, ún. konstitutív a COX-1, és az induktív, gyulladásos folyamatokkal összefüggésbe hozható COX-2.
A ciklooxigenázok másik ismert neve a prosztaglandin- endoperoxid szintáz (PTGS). Kódoló génjeik is ezt a nevet viselik, PTGS1 és PTGS2. Kis eltolódással sikerült izolálni őket: A COX-1-et több mint 20 éve sikerült először tisztított formában kinyerni, majd klónozni 1988-ban (Bakhle, 1999), míg a COX-2-t néhány évvel később fedezték fel (Simmons és mtsai, 1991).
Kutyákban létezik egy COX-3 forma is, mely a PTGS1 génről íródik le, viszont egy olyan intron megmarad rajta, ami a COX-1-ről lekerül (Botting, 2003).
A rendszer két katalítikus centrummal rendelkezik, és mindkét enzim 3 részből áll: egy növekedési faktor-, egy membránkötő- és egy enzimaktivitással rendelkező régió. Felépítésüknél fontos, hogy a membrán lipidrétegei között "könnyű" legyen az arachidonsav mozgatása (Újszászy és mtsai, 2000).
2. A ciklooxigenázok hatásmechanizmusa
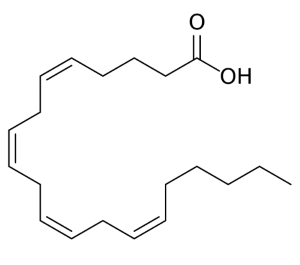
A gyulladás elindításában különböző ingerek vesznek részt. Ennek hatására az immunsejtek hisztamint, a (sérült) sejtmembrán foszfolipidjei pedig arachidonsavat (1.Ábra) termelnek. Az arachidonsav termelődését foszfolipáz-A2 enzim serkenti.
|
Ez az arachidonsav különböző enzimek segítségével 3 különböző úton más anyagokká alakulhat át:
CIKLOOXIGENÁZ ÚT (ciklooxigenáz enzim) során Prosztaglandin (PG), Prosztaciklin és Tromboxán jöhet létre;
LIPOXIGENÁZ ÚT (lipoxigenáz enzim) lipoxin és leukotrién szintézissel végződik;
EPOXIGENÁZ ÚT (epoxigenáz enzim) folyamán epoxi származékok jelennek meg.
ezen anyagok eikozanoidok:
prekurzor → arachidonsav
- 20 szénatomosak
- lokális lipid hormonok, ott hatnak, amely sejten megtalálható a receptoruk
- anyagcsoporttól függően hatnak a sejtek működésére
2.1. COX-1
Élettani szerepet betöltő ciklooxigenáz, de kis mértékben a gyulladásos folyamatokat is szabályozza. Főbb szerepek (Halis és mtsai, 2007):
Citoprotektív prosztaglandin (PGE2) termelés ⇒ trombocytákban, az erek endotheliumában, a gyomornyálkahártyában (cAMP-t növeli→mucus elválasztás is nő), vesében, Langerhans- szigetekben;
Prosztaglandin (PGF 2alfa) ⇒ luteolizáló hatású, ezáltal az ösztrusz ciklus fenntartásában is segít;
Prosztaciklin (PGI) termelés ⇒ endotheliumnál véralvadásgátló szerep, gyomor mucosa hidrogén ion elválasztása lanyhul a hatására;
Tromboxán (TXA2) ⇒ thrombocyta aggregációt segíti elő.
Azon anyagok (pl.: ibuprofen, naproxén), amik a COX-1- et jobban gátolják mint a COX-2- őt, nagyobb kárt tesznek a gyomor szövetében (Laudanno és mtsai, 2000).
2.2. COX-2
Gyulladás kialakításában vesz részt, mivel az ehhez szükséges gyulladáskeltő prosztaglandinokat termeli. Konstitutív funkcióval is bír. Termelődését segítő anyagok között megemlíthető a citokinek, mitogének és endotoxinok szerepe.
Egyéb gyulladáskeltő mediátorok:
Nitrogén-monoxid (NO) ⇒ prosztaglandin termelést serkenti, vasodilatatiot okoz, permeabilitást növeli;
- sejtadhéziós molekulák szerepe (Anderson és mtsai, 2002);
proinflammációs citokinek ⇒ T helper sejtekből szabadulnak fel, az inflammációs citokinek termelésére hat a tumor nekrózis faktor, amely anyag egy másik megoldást jelenthet a tumor ellenes terápiában (Wen-Ming, 2013).
A mediátorok egymással kölcsönhatásban vannak, így jön létre a gyulladás önerősítése. Mindemellett a gyulladás helyén gyulladáscsökkentő anyagok felszabadulása is megfigyelhető.
3. A COX rendszer gátlása
Több betegség (pl.: reuma) elleni harc már több ezer évre visszanyúlik. A múltban különféle gyógymódokkal próbálkoztak az emberek: főzetekkel, kivonatokkal amelyeket legtöbbször bizonyos növényekből sikerült előállítaniuk. Ezekről a modern kutatások során kiderült, hogy szalicilátokat tartalmaznak. 1897-ben Felix Hoffman előállította a szalicilsav acetilezett formáját és az 'Aspirin' nevet adta a vegyületnek. 1971-ben Vane felfedezte az Aspirin működési mechanizmusát, hogy miként fejti ki gyulladáscsökkentő, fájdalom-, és lázcsillapító hatását. Leírta, hogy miként hat a prosztaglandinok egy csoportjára amelyek a láz, a gyulladás, a fájdalom és a duzzanat kialakításáért felelősek. Mindemellett kiemelte, hogy az egészséges működéshez szükséges prosztaglandinokat is gátolja a vegyület. Ez a tanulmánya fontos volt az aszpirin-szerű gyógyszerek működésének megértésében, így a terápiás hatások mellett megjelenő mellékhatások okának további kutatásában. 20 év múlva aztán kimutatták a ciklooxigenáz rendszer két különböző izoenzimét, ezzel is bizonyítva ezen mechanizmus lezajlásának komplexitását (Vane és Botting, 2003).
Az ilyen hatású anyagokat a tudomány ma Nonsteroidal anti-inflammatory drugs (Nem szteroid gyulladáscsökkentők), röviden NSAID néven ismeri. Világszerte mintegy 30 millió ember szed NSAID-ot naponta, a 65 év felettiek 10–15%-a használja rendszeresen (Al-Saeed, 2011).
|
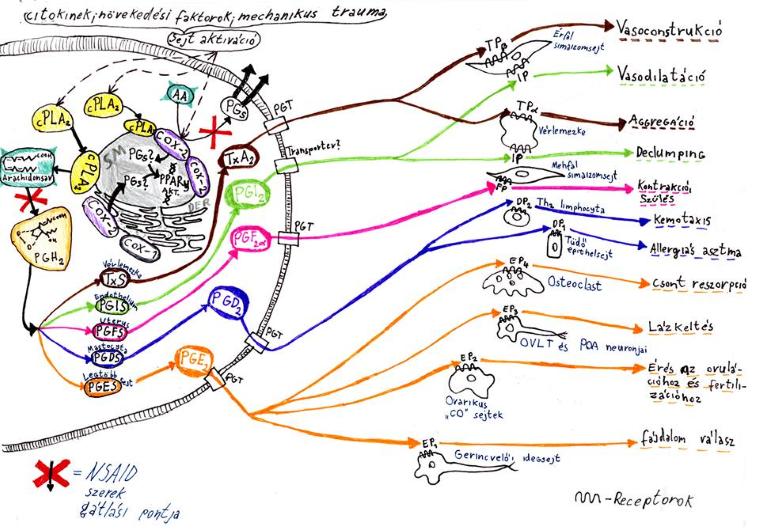
Működési mechanizmusaik az arachidonsav átalakulását gátolják (2.Ábra), mivel megbénítják az ehhez szükséges enzimeket, ezáltal inhibitálják a COX és leukotrién (LO) termékek létrejöttét, így megelőzik az oxigén gyökök, lizoszomális enzimek létrejöttét. Ezenfelül a neutrophil granulocyták aggregációját, adhézióját és kemotaxisát is befolyásolják. Egyébiránt felmerült a peroxiszóma proliferátor-aktivált receptorjainak (PPAR) stimulációjának, a nucleáris kappa B faktornak (NF-κB) és egyéb transzkripciós anyagoknak a szerepe az NSAID mechanizmus lezajlásánál.
A PPAR egy olyan nucleáris receptorcsalád tagja, amelynek három fajtája különböző szövetek sejtjeinek felületén expresszálódik, viszont mindhárom megjelenik az erek falánál és az immunsejtekben. A receptorok expressziója zsírsavak, gyógyszerek mellett például az eikoszanoidok hatására is megtörténik és fontos szerepet töltenek be a génexpresszió szabályozásában (célgén-promóter kötés, transzkripciós illesztések). Emellett a PPAR-ok gátolják a transzrepresszorokként működő egyes gyulladásos válaszgének aktiválódását.
A NF-κB faktor felelős a sejtnövekedést, az inflammációt kialakító és az apoptózist beindító (programozott sejthalál) gének expressziójáért. Tulajdonképpen inaktív állapotában a citoplazmában található meg egy gátló fehérjével (IκB) kapcsoltan. Induktorai (gyulladásos citokinek, reaktív oxigén vegyületek, vírus termékek) hatására az IKK komplex lebontja a gátlófehérjét, ennek köszönhetően a kappa B faktor a magba kerülhet, ahol befolyásolhatja a célgének transzkripcióját (Süleyman és mtsai, 2007).
Kísérletesen összehasonlították az NSAID-ok és a SAID-ok (szteroid gyulladáscsökkentők) hatásait vírusfertőzött borjak tüdejére (Bednarek és mtsai, 1999). Szteroid szerként a flumetazont, nem szteroid szerként pedig meloxicam-ot használtak. Az utóbbi nem változtatta a hematológiai paramétereket, viszont mindketten növelték a TNF (tumor nekrosis factor) termelését a fagocitáló sejteknek.
3.1. NSAID csoportok és főbb mellékhatásaik
A nem szteroid gyulladáscsökkentők csoportokra oszthatók, miszerint melyik izoenzim formára fejtik ki leginkább a hatásukat (Lakatos és mtsai, 2008):
Specifikus COX-1 gátló → Aspirin
Nemszelektív COX gátlók → Diclofenac, Indomethacin, Ibuprofen, Naproxen, Piroxicam
Szelektív COX-2 gátlók → Aceclofenac, Meloxicam, Nabumeton, Nimesulid
Specifikus COX-2 gátlók (Coxibok) → Rofecoxib, Celecoxib, Parecoxib
Emellett össze lehet hasonlítani az egyes csoportok hatásait is (3.Ábra).
|
3.1.1. Specifikus COX-1 gátlók (szalicilátok)
Az acetilszalicilsav (ASA), aszpirinként híresült el a szalicilátok legismertebb fajtája. Ez a csoport legfőképp a COX-1-et gátolja, és ez a gátlás irreverzibilis. Az ASA hatásos ízületgyulladás, szívizomgyulladás és akut rheumatoid láz esetén. Fontos megjegyezni, hogy ezek mellett kialakíthat fekélyt és vérzéseket a gyomorban, mivel károsítja az epitheliumot a gyomor mucosájában (Kelly és mtsai, 1996). Ez a hatás a máj véralvadási faktorainak szintézisénél és a trombocyta aggregáció gátlásánál alakul ki, melyek lezajlásának idejét az ASA redukálja. Ezenkívül neurotoxikus és hepatotoxikus hatásokat is tulajdonítanak ezeknek a szereknek (Jolobe, 2001).
Nátrium-szalicilát egy másik NSAID, bár gyengébbb hatással rendelkezik mint az acetilszalicilsav, éppen ezért nem jellemzőek itt a gastrointestinális problémák. Hatását a tromboxán szintáz gátlásán fejti ki.
Egyes difluorofenil származékok is rendelkeznek gyulladáscsökkentő, fájdalomcsillapító és lázcsillapító hatással. Hosszabban hatnak, de hatásaik megegyeznek, csak gyengébbek a többi szalicilátnál.
3.1.2. Nemszelektív COX gátlók (fenil-propionsav származékok)
Az ide tartozó anyagok egyaránt gátolják mindkét COX rendszert.
Az ibuprofen hatásosan alkalmazható az izületi-, csont-, és köszvényes ízületi gyulladással szemben. Mindezek mellett fontos gyógyszere a fájdalommal járó betegségeknek (fejfájás, fogfájás) és lázcsillapító hatású, köszönhetően a prosztaglandin szintézist gátló hatásának. Mellékhatásai közt található gastrointestinális probléma, csontvelő leépülés, vese működési zavarok (Laine és mtsai, 1999).
A naproxen hatása hosszan tartó, mindkét COX rendszert gátolja. Legerősebb gátló hatása a leukocytákkal szemben valósul meg, ennek is köszönhető a gyulladáscsökkentő hatása. Használják reumára, Bechterew-kór kezelésére (főként csigolyák közti ízületi gyulladás), ízületek és az azt körülvevő szövetek traumás sérülésének kezelésére. Mellékhatásai közt tartják számon a szédülést, depressziót, fejfájást és gastrointestinalis irritációkat (Süleyman és mtsai, 2007).
Egyéb származékok: Ketoprofen, Fenbufen, Tiaprofen
3.1.3. Szelektív COX-2 gátlók
A COX-2 szelektív inhibitorai olyan gyógyszerek, amelyek terápiás hatása ugyanolyan erős, mint a hagyományos gyulladás csökkentőké, de kevesebb mellékhatást eredményeznek.
A meloxicam kis mennyiségben a COX-2-t gátolja, nagyobb dózisban inhibitálja a COX-1 rendszert is. 1998-ban Lund és munkatársai által folytatott kutatáskor bizonyítani próbálták a meloxicam biztonságosabb mivoltát a többi NSAID-hoz képest.
Nimesulid olyan hatással rendelkező gyógyszer, mely a kimutatások szerint ötször jobban gátolja a COX-2 enzimet, mint a COX-1-et (Cullen, 1998). Prosztaglandin szintézis gátlásával éri el a lázcsillapító hatását, a fájdalomcsillapítást pedig a citokinekre kifejtett gátlásának köszönheti. Gastrointestinális mellékhatást nem figyeltek még meg, emellett antioxidáns szerepet is tulajdonítanak neki.
3.1.4. Specifikus COX-2 gátlók (coxibok)
A celecoxib és a rofecoxib a hagyományos gyulladáscsökkentőkkel azonos hatással rendelezik, viszont az előbbi 375-ször az utóbbi 800-szor nagyobb affinitásal viszonyul a COX-2-höz mint az 1-es izoenzimhez. Gastrointestinalis hatás nem jellemző, viszont összefüggésbe hozzák trombotikus keringési problémákkal (Süleyman és mtsai, 2007).
Manapság egyre több coxib megjelenésével új távlatok nyílhatnak. Ezeknek a vegyületek specifikáltabbak a COX-2-re a celecoxibnál és a rofecoxibnál is. Egyik ilyen anyag a valdecoxib, mely nagyobb biokémiai szelektivitású a celecoxibnál. Ennek a prekurzora a parecoxib, mely az injektálható inhibitorok közé tartozik. Még egy ilyen gátló anyag a lumiracoxib az egyik legszelektívebb inhibitor in vitro és egyike a savas coxiboknak.
Ezen anyagok, melyek COX-2-re hatnak (specifikus és szelektív gátlók csoportja) nem gátolják a tromboxán A2 szintézist. Azt feltételezték, hogy nem használhatóak aszpirin helyett (Halter és mtsai, 2001). Fontos még megjegyezni, hogy ezek az inhibitorok a PGI2-re is hatnak, ami vasodilatator hatású és segíti a trombocyta aggregációt, így közvetetten hathatnak a trombotikus folyamatokra. Mellékhatásaikként (főleg rofecoxibnál) jelentkezett vérnyomás probléma és renális toxicitás.
A vesében ezeken felül szintúgy megtalálható a COX-2 mint a COX-1. Emiatt a COX-2 gátló anyagok a renális prosztaglandinokra nagyjából azonos hatással vannak mint a nonszelektív inhibitorok. A PGE2 csökkenti a nátrium visszatartást, a PGI2 a renin (aldoszteronnal kapcsolatba hozható) felszabadulását stimulálja, ezáltal közvetett hatással van a bevitt farmakon az aldoszteron felszabadulásra, ezáltal a Na reabszorpcióra és a K sekrécióra. PGI2 vasodilatátor szerepe a vesében a nem egészséges funkcionalitásnál fenntartja az élettani glomeruláris filtrációs szintet és a keringési térfogatot. A prosztaglandinok élettani funkcióját ismerve és átlátva logikailag felépíthető az inhibitorok vesére gyakorolt hatása. Így megemlítendő, hogy a renális PGE2 gátlás nagyobb nátrium visszatartást eredményezhet, ami túlsúlyt, perifériás ödémát és magas vérnyomást okozhat. Éppen ezért gyakran vérnyomáscsökkentő gyógyszerek alkalmazása is szükségeltethet. Kialakulhat hyperkalaemia, amely káros mellékhatásokhoz vezethet, például akut veseelégtelenséghez.
4. Gyulladás és tumor kapcsolata
A gyulladás a természetes immunitás legfőbb reakciója, azzal a céllal, hogy megvédje a szervezetet a patogénektől. A gyulladást baktériumok és vírusok egyaránt indukálhatják, emellett fizikai sérülés vagy kémiai vegyület is közrejátszhat.
4.1. A tumor kialakulása
A speciális receptorok aktivációja intracelluláris jelet vált ki, amelyek gyulladásos citoknek [interleukin 1 beta (IL1β), tumor necrosis factor alpha (TNFα), interleukin 6 (Il6)], chemokinek és sejtkötő proteinek expresszióját szabályozzák. Végül az immunsejtek megerősödéséhez és aktivációjához vezetnek. Számos betegség összekapcsolható krónikus gyulladással, mint az osteoarthritis, a Crohn betegség és a rák. Habár az első bizonyíték a gyulladás és a rák kapcsolata közt több, mint egy évszázadra nyúlik vissza, csak mostanában lett ez a kapcsolat részletesebben kutatva. Számos rák előfordulása szorosan összefügg a gyulladással, úgy mint a vastagbél-, mell-, és prosztatarák esetében. Ezt a hipotézist alátámasztja az a felfedezés, hogy a tumor közvetlen környezetét meghatározza a különböző, citokinek felszabadításáért felelős immunsejtek beszűrődése. Ezen citokinek szerepét a tumor előfordulásában számos tanulmányban bizonyították. Például a TNFα túlzott kifejeződése tüdőtumoros transzgénikus egérben a tumor méretének növekedésével jár (Suganuma és mtsai, 1999).
Ezenfelül tartós NSAID bevitel szignifikáns csökkenést okoz a legtöbb tumorban. A colorectalis rák (CRC), ami jelentős halálozási ok az iparosított világban, egy olyan tumor típus, ami NSAID-del kezelhető. A gyulladás talán azzal játszik fontos szerepet a tumorképződésben, hogy fokozza a reaktív oxigén gyökök képződését, felelős a DNS károsodásért, így növeli a mutáció előfordulási esélyét. A tumor fejlődésében is lehet szerepe a gyulladásnak, ahol a növekedési faktor szekrécióját fokozza, úgy mint az epithel és a fibroblast growth factort. A kiegyensúlyozatlanság a sejtburjánzás és a sejthalál között különböző sejt túlélési utakhoz vezet. A gyulladás közben termelt különböző citokinek szintén tudják aktiválni ezeket a menekülő utakat, ami ahhoz vezet, hogy a tumorsejtek el tudják kerülni a sejthalált. Jól ismert, hogy a TNFα hatás, amit a tumor és immunsejtek termelnek, a rákos sejtek túléléséhez vezet. Ez az antiapoptotikus fehérjék túltermelésén keresztül valósul meg (Sobolewski és mtsai, 2009).
4.2. A COX szerepe
A COX-2 túlzott kifejeződése számos tumornál volt tapasztalható, úgy mint a colorectális-, emlő-, hasnyálmirigy- és tüdőráknál. Felmerült, hogy a COX-2 szerepet játszhat a rák fejlődésében azzal, hogy serkenti a mutálódott sejtek burjánzását. A COX-2 túltermelés összefügg a megnövekedett PGE2 termeléssel, ami a COX-2 egyik legfőbb produktuma. Ez modulálja a sejtosztódást, a sejthalált, és a tumor inváziót számos ráktípusban. A prosztaglandin E2 különbőző membránreceptorokon keresztül hat. Ezek az EP receptorok (EP1, EP2, EP3, és EP4) a sejtfelszínen helyezkednek el, és 7 transzmembrán doménnel jellemezhetők. Rodopszin típusú G-protein receptorok, de különböző jelátviteli utak jellemzők rájuk. Így az EP1 a foszfolipáz C/ inozitol trifoszfát úton intercelluláris kalcium mobilizációhoz vezet. Az EP2 és EP4 receptorok G-protein kapcsoltak, amelyek az adenilát ciklázt aktiválják, így az intracelluláris cAMP szintet növelik. A cAMP így már képes aktiválni a kinázokat, úgy mint a protein kináz A-t és a GSK3-at (Glycogen synthase kinase 3), ami a β-catenin aktivációjához vezet. Egy út, ami szabályozza a sejtosztódást. Az EP3 Gi protein kapcsolt, így az adenilát cikláz gátlásához vezet, tehát csökkenti az intercelluláris cAMP szintet. Ezen különböző receptorok eltérő kifejeződése magyarázhatja a PGE2 különböző és ellentétes hatásait (Grossmann, 2002).
4.2.1. Colorektális hatás
Már több bizonyíték is van a PGE2 szerepére a tumor létrejöttében néhány ráktípusnál. Valóban számos tanulmány született arról, hogy a PGE2 a legfontosabb prosztaglandin, ami a colorektális carcinogenezis során termelődik. Familiáris adenomatosus polyposis (FAP) esetén a tumor növekedése összefüggésben volt a prosztaglandin bioszintézissel. A PGE2 képes az apoptosis gátlására humán vastagbélrák sejteknél az anti-apoptotikus protein termelés serkentésével (Yang és mtsai, 1998).
A PGE2 tumor növekedését szabályzó hatása más vastagbél rákos modellekben is mutatkozott, például a HT-29 sejteken, amelyek EP receptorokat expresszáltak. Ebben a sejttípusban a PGE2 a cAMP szint növelésével hatott az EP4 receptorokon keresztül. A hatás megfordítható volt, az EP4 egy antagonistájával. Egy COX-2 gátló, képes a HT-29 sejtek osztódását gátolni, és ez a hatás erősíthető egy növekedési faktort semlegesítő antitestek alkalmazásával. A PGE 2 az amphiregulin szint növekedésével az EGFR (Epidermal growth factor receptor) aktivitást is növelte. Ebben a sejtvonalban az amphiregulin mennyisége egyenes arányosságot mutatott a COX-2-vel (Doherty és mtsai, 2009).
Az EGFR aktiváció AKT aktivációhoz vezethet, amely egy jól ismert túlélési út. Ezt egy tanulmányban (Tessner és mtsai, 2004) kimutatták, hogy a 16,16-dimethyl PGE2 gátolja a sugárzás-indukált sejthalált egér bélhámsejteken. A dmPGE2 EP2 receptorokhoz kötődése szorosan összefügg az AKT foszforizációjához az EGFR aktiváción keresztül.
4.2.2. Tüdőre gyakorolt hatás
A PGE2 szabályozó hatását tüdőráknál is kimutatták, mely szerint a PGE2 aktiválja az Src kinázt A549 sejtekben, ezzel sejtnövekedéshez vezetve (Yamaki és mtsai, 2004). Az Src kináz foszforizálja a p27-et. Egy fehérjét, amely a sejtciklus gátlásában vesz részt, főleg a G1/S átmenetben. A nem foszforizált p27 gátolja a sejtciklust, így a sejtosztódát is. A foszforizált p27 serkenti. A PGE2 növeli a sejtosztódást a p27 foszforizációjával az EP4 receptorokon keresztül.
4.2.3. Egyéb hatások
A PGE2 szintén fontos a tumor invazívitása szempontjából. Egy tanulmányban (Ma és mtsai, 2006) leírták, hogy a PGE2 növeli a metastasisok számát. Ezt a hatást egy modellel demonstrálták, ahol egér emlőrák sejteket injektáltak syngenikus immun kompetens egerekbe. Ezek a sejtvonalak mind EP 1, 2, 3 és 4 receptorokat expresszáltak. Ep 4 antagonisták használatával csökentették a felületi tumor telepeket és csökkentették a tumor invazivitását.
Egy másik tanulmányban (Majima és mtsai, 2000) a PGE2 VEGF (Vascular endothelial growth factor) szint növelő szerepét vizsgálták granulómában. A VEGF egy fontos faktor az angiogenezisben és így a tumor fejlődésében is, annak erekkel történő ellátásában (Folkman, 1971).
4.2.4. Összegzés
Mindent összevetve A PGE2, így COX-2 is fontos szerepet játszik a tumor fejlődésében. Serkenti a sejtek osztódását, sejtek túlélését, és a tumor invazivitását. A PGE2 receptorok és a különböző jelátviteli utak különböző hatásokat eredményeznek. Ezek a sejttípustól és az expresszált receptoroktól függnek. Sok jelátviteli út, amely a tumor növekedéssel van kapcsolatban a PGE2-höz kapcsolt. Ez megmagyarázza, hogy a COX-2 gátlók miért lehetnek hasznosak a daganatterápiában. Habár az EP receptorok jelátviteli utai nincsenek teljesen jellemezve, és a pontos szerepüket még tovább kell vizsgálni a klinikai alkalmazás előtt (Sobolewski és mtsai, 2009).
A COX-gátló szerek felfedezése, és előállítása fontos célja a daganat kutatásnak. A gátlók és rák-ellenes szerek együttes alkalmazása azzal a céllal történik, hogy növelje a rák-ellenes protokollok hatékonyságát.
5. NSAID-ok használata a tumor terápiában
A legutóbbi daganat kutatásokban, és kulünböző daganatterápiákban, számos tumor ellenált a megszokott terápiás kezeléseknek (radioterápia, kemoterápia…stb.). COX-2 gátlók fontos szerepet játszanak a daganat megelőzésében. A krónikus NSAID bevitel képes csökkenteni az előfordulását számos tumor típusnak, ahogy azt a Familial Adenomatous Polyposisban (bőrpolip) és a mellráknál is kimutatták (Lynch, 2001)(Arun és Goss, 2004). A szakirodalom azt javasolja, hogy a COX-2 gátlók (proliferáció gátlás, és apoptosis indukáló hatása miatt számos daganatsejttípusban) más anti-tumor hatóanyagokkal/ terápiával együtt alkalmazva serkentik a tumor sejtek pusztulását.
5.1. Radioterápia
A radioterápia ún. solid tumorok ellen jó (pl.: here-, mell-, vastagbél-, tüdőrák).
Ionizáló sugárzás antitumorra kifejtett hatása:DNS roncsolás, osztódás lassulás, apoptózis indukáció
Fontos tényezők: egy bizonyos Bcl-2 fehérjecsalád anti-apoptikus hatást fejt ki (Burlacu, 2003). NFκB nevű faktor, csökkenti előbb említett fehérjecsalád expresszióját (Johnson és mtsai, 2008), valamint COX-2 szintre is hat. A COX-2 akár radioterápiás rezisztánciát is kiválthat (Chandrasekharan és Simmons, 2004). Egy Nimesulide nevű hatóanyag növeli a radioterápia hatékonyságát (in vivo kopasz egérben, in vitro A549-es sejtvonalban). Ez a MnSOD (szuperoxid-diszmutáz, mangántartalmú, mitokondriumban megtalálható, antioxidáns) downreguláció miatt van. MnSOD és Bcl-2 szintet szintén befolyásolja a NFκB, ez pedig a radioterápia során upregulálhat a reaktív oxidok miatt kialakult gyulladások által. Ebből arra következtetnek, hogy a nimesulide hatással lehet az NFκB-re, amely gátolja a MnSOD-ot (Grimes és mtsai, 2006).
A melanoma nagyon ellenálló a radio- és kemoterápiával szemben. Két melanoma sejtvonalat (WM35, LU1205) NS-398-al (COX-2 gátló) kezelve, elősegítette az apoptózist (COX-2 downreguláció RNS zavar miatt, majd p53 és G2/M upreguláció). Ezzel megerősítve, hogy az NS-398 a COX-2 gátlás miatt hat (Johnson és mtsai, 2008). Más tanulmányok kimutatták, hogy a PC3 (humán hererák sejtek) és Hela (humán méhnyak rák sejtek), radioérzékenységét erősítette a COX-2 csökkenés a siRNS által. NS-398 képes növelni a radioérzékenységét, a PC3 COX-2 kibocsátó sejteknek, de nem a COX-2 csökkent pc3 sejteknek. Ezzel szemben a Hela sejtekben mindkét esetben növelte (Palayoor és mtsai, 2005). Ellenben a COX-2 gátlók (röviden: C2I) akár csökkenthetik is a radioterápia hatékonyságát. Egy tanulmány szerint, a szelektív C2I, nimesulide csökkentette a sugárzás hatékonyságát két ráksejt típusban (SCC és SCC25) amik COX-2 pozitívak voltak. Ez azt mutatja, hogy a sugárzásra való érzékenység, erősen függhet a tumor sejt típusától is (Czembirek és mtsai, 2009).
5.2. COX-2 inhibitor kemoterápiával kombinálva
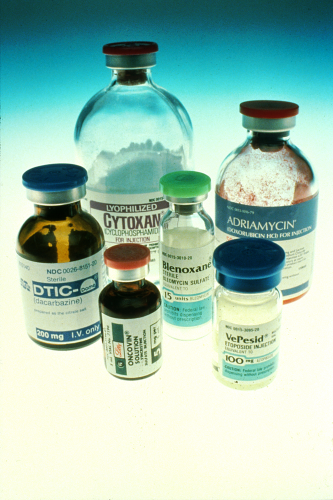
Kemoterápia (5.Ábra): sok tumorsejttípus proliferációját gátolja, és indukálja a sejthalált.
|
A fő oka a kemoterápia hatástalanságának azok a túlélő vagy fejlődő tumorsejtek, amelyek multidrog rezisztensek. Ezt a rezisztenciát számos mechanizmus alakíthatja ki: apoptózisgátló fehérje túltermelés (pl.: Bcl-2), érzéketlenség az apoptózis stimulusra a tumorsejtben, a DNS-javító enzimek upregulációja, detoxikáló enzim kibocsátó faktorok upregulációja (glutation, s-transzferáz), kemoterápiás gyógyszerek kilökése az ATP-kötő „kazetta” család fehérjék által például: MRP (multidrug resistant-associated protein), BCRP(breast cancer resistance protein vagy mitoxantrone resistance protein). Ezek a fehérjék, szabályozzák az abszorpcióját, felszívódását és exkrécióját számos gyógyszer összetevőjének. Ezért konzekvensen a kemoterápiás hatóanyagok azonnal kilökődnek a sejtből ezek túltermelődése esetén. A P-gp (P-glikoprotein) által okozott multidrog-rezisztencia (Patel és mtsai, 2002), az egyik legjobban megértett mechanizmus. Az utóbbi időben, a C2I-k azt mutatták, képesek érzékenyíteni a tumorsejteket a kemoterápiás hatóanyagokkal szemben. Vastagbélráknál gyakran fordul elő kemorezisztencia.
Egy tanulmány kimutatta, hogy a C2I naproxen és indomethacin-heptyl észter képes volt downregulálni a P-glikoproteint a CACO-2 sejtvonalban (vasttagbélrák). Indomethacin gátolta a fehérje aktivitását és a COX-2 mRNS és fehérje szintjét (Zrieki és mtsai, 2008). Egy másik tanulmány szerint a meloxicam downregulálta MDR1 szintet a HL60 (humán promyelocytic leukémia) sejtvonalban. A COX-2 cDNS-be adenovirussal transzfektálva, patkány vese mesangiális sejtjeiben MDR1 (Multi Drug Resistence) gén upregulációt okozott (Puhlmann és mtsai, 2005). C2I kombinálva a kemoterápiával, szintén tesztelve volt egy tanulmányban, ahol humán gyomorrák sejtvonal (MKN45) cisplatin érzékenység nőtt a COX-2 downregulációval siRNS -sel (Chan és mtsai, 2007). Ez egy lehetséges módja, a kettő (kemoterápia és C2I) kombinációjának. Hasonlóan ehhez, a celecoxib érzékenység a humán osteosarcoma sejtvonalban (MG-63), anti-apoptózis fehérjék (Bcl-2) túlélésében downregulációt okozott, és gátolta a PI3K/Akt túlélő útvonalat (Liu és mtsai, 2008). Szintén kimutatták, hogy B-CLL (B chronic limphoid leukémia) -nél, NS-398-al és chlorambucil-al kezelve megnövekedett a sejthalál a B-CLL blastokban. Továbbá számos limphoma COX-2+ sejtvonal (RAJI, BJAB, BL41) celecoxib kezelése csökkentette a sejt proliferációt, dózistól függő módon (Wun és mtsai, 2004). Mindezen adatból következik, hogy a COX-2 anti- apoptikus hatással bír, a MDR növelése által. Valamint a szelektív C2I használhatóak a kemoterápia hatékonyságának növelésében.
5.3. A fotodinamikus terápia
Fotodinamikus terápia röviden: "A szoft-lézeres kezelés és a lézersebészet közé sorolható a fotodinámiás terápia, melynek során a szoft-lézerekhez képest többnyire nagyobb teljesítményű lézereket alkalmaznak.A fotodinámiás kezelés által kiváltott hatás nem kizárólag lézeres besugárzásnak köszönhető, speciális fényérzékenyítő anyag használata szükséges. A módszert a rák kezelésére dolgozták ki. Egyes ráktípusok (bőr hámeredetű tumorai, ill. üreges szervek tumorai - nyelőcső, bronchus, húgyhólyag) kezelésében forradalmi újítást jelentett.
A fotodinámiás terápia a következőkön alapul. A beteg szervezetébe a tumor elhelyezkedésétől függően intravénásan, vagy krém segítségével fényérzékenyítő anyagot juttatnak be, mely szelektíven dúsul a tumorszövetben, miközben az ép struktúrák a felvett anyagot néhány óra alatt kiürítik magukból. Ha a festett területet megfelelő hullámhosszúságú lézerfénnyel megvilágítják, a tumorszövet fotofluoreszcens effektus következtében világítani fog, láthatóvá, kimutathatóvá válik. Ezt a technikát fotodinamikus diagnosztikának nevezik (PDD). A PDT (photodinamic therapy) során egy más hullámhosszon történő megvilágítás hatására a fényérzékenyítő anyag molekuláiban beinduló reakció nascens oxigén (1/2 O2) vagy hidroxid-ion (-OH) keletkezéséhez vezet, amely az adalékanyagot tartalmazó (daganatos) sejtekben szöveti bomlást eredményez. Az eljárás tehát a fény fotokémiai hatását használja ki. A PDT előfeltétele a megfelelő paraméterekkel rendelkező fény behatolása illetve bejuttatása a kívánt szövetbe, így elsősorban a test felszínét, a direkt elérhető testüregeket valamint az endoszkóppal megközelíthető felszínek szöveteit lehet ezzel a módszerrel kezelni. Fontos paraméter, a szövet hypoxia/anoxiája, a tumor erezettsége is (Hopp és mtsai, 2012) (forrás:http://titan.physx.u-szeged.hu/tamop411c/public_html/L%C3%A9zerek%20az%20orvostudom%C3%A1nyban/92_fotodinmis_fotodinamikus_terpia_pdt.html).
A fő oka a módszer hatástalanságának, a vérképző- és gyulladáskeltő faktorok upregulációja a tumor microkörnyezetében, amelyek erősen lecsökkentik a PDT hatékonyságát. A kapcsolat a gyulladás és a túlélő-utak között, proliferáció, angiogenesis jól ismert a tumor fejlődésében. Kimutatták, hogy a PDT növeli a TNFα, IL1ß, PGE2, VEGF (vascular endothelial Growth Factor) és MMP9 (matrix metalloproteináz) szinteket (Doughertyés és mtsai, 1998). Ezek a molekulák erősen csökkentik a PDT hatékonyságát, a sejtek túlélőképességét és proliferációját növelve. Érdekes, hogy a COX-2 upreguláció volt észlelhető, a PDT kezelés alatt különböző rák típusoknál. Ezért ahogy korábban, a sugárzásterápiánál, és kemoterápiánál, a PDT-nél is javasolt a COX-2 gátlók alkalmazása, mint kutatási terület, a módszer hatékonyságának növelése érdekében.
Néhány eredmény ezzel kapcsolatban: Celecoxib, NS-398 növeli a PDT-indukált apoptózist (egér emlődaganat kísérlet). Ezek összefüggtek, a caspase-3, PARP (Poly ADP-Ribose Polymerase) hasítás és Bcl-2 degradációval. In vivo a fotoszentiblitás a C2I által nem az apoptózis növekedés miatt volt. Érdekes módon a celecoxib, és NS-398, csökkenti a PDT-indukált sejthalált de szintén csökkenti az angiogén faktorokat (pl:TNFα) (Ferrario és mtsai, 2005).
PDT-indukált COX-2/PGE2 növekedés, NS-398-al redukálható. A PDT indukálta VEGF növekedés, gyengül NS-398 kezelésre, ami azt mutatja, hogy a COX-2nek szerepe lehet az angiogenesisben is. Ezek az esetek azt mutatták, hogy érdemes kombinálni a C2I-ket a PDT-vel (Ferrario és mtsai, 2002). C2I kombinációja (PDT-vel) nem működött Hela és T24-es (húgyhólyagrák) sejteknél (Hendrickx és mtsai, 2003), valamint a C-26-os sejtekben (kevésbé differenciálódott bél adenocarcinoma sejvonalak) se. Kivéve a nimesulide-t, krónikus adagolással alkalmazva (Makowski és mtsai, 2003).
Ismert, hogy a daganat vérellátásában okozott károk, fontosak a PDT hatékonyságában. A C2I-ok anti-angiogén faktorként is működnek (Tsujii és mtsai, 1998). Így azt feltételezik, hogy ez az antiangiogén hatás felelős lehet az anti-tumor hatásért. Jelenleg a PDT és C2I kombinációja, még nem túl jól körülírt. Néhány tanulmány azt mondja, hogy a C2I hatékony a PDT hatékonyságának növelésében, néhány azt állítja, hogy nincs rá hatása. Bárhogy is, ez valószínű szintúgy tumor-sejt függő, akár csak a kemo- és sugárzásterápiánál.
5.4. A COX-2 kibocsátásának gátlása természetes összetevőkkel
Szintetikus C2I-k néhány toxikus mellékhatást mutattak, ezért szükséges néhány új természetes eredetű hatóanyag felfedezése. Emiatt az elmúlt években nagy figyelmet kapott a természetes eredetű C2I hatóanyagok vizsgálata, és azok alkalmazása magában vagy kombinálva más kemoterápiás gyógyszerekkel.
|
A közelmúltban kimutatták, hogy a Bromelain (egy farmakolóilag aktív hatóanyag az ananászban(6.Ábra)), COX-2 kibocsátás gátló, és inaktiváló hatása van. Ennek az összetevőnek p53 upreguláló hatása van és aktiválja a caspáz-3 és 9-et Bcl-2 kibocsátás csökkenés mellett (Bhui és mtsai, 2009). Továbbá, a bromelain hatóanyag, apoptosist indukál IC hatás által (Kalra és mtsai, 2008).
Curcumin is (egy természetes polifenol, a gyömbérben (Curcuma longa)) mutatott apoptózist segítő és antiproliferatív hatást, COX-2 downreguláció által méhnyakrák sejtekben (Singh és Singh, 2009). Apoptosist segítő hatása is van, apoptózist segítő anyagok (pl:Bax, AIF stb.) upregulációja, és anti-apoptikus anyagok (Bcl-2) downregulációja által. Ez kapcsolatba vonható a kaszpáz-3 és 9 aktivitásnövekedéssel, amiből a mitokondrium szerepére is következtethetünk. Emellett a kutató leírta, hogy szelektíven elősegíti a melanoma sejtek apoptosisát míg a normál melanocytáét nem. Valamint COX-2 mRNS és fehérje szint csökkenést, COX-1 szintjének befolyásolása nélkül éri el (Marín és mtsai, 2007)(Park és mtsai, 2007).
Kumarin (1,2-benzopirén) természetes hatóanyag, számos növényben (pl. fahéj). Bcl-xL, COX-2 és MAP kináz downregulációt, és p53 upregulációt okoz. Ezek által indukálja az apoptózist (Goel és mtsai, 2009).
A Sulforafan (SFN) egy biológiailag aktív hatóanyag, amit a salátafélékből vonnak ki (káposzta, saláta, brokkoli). NFκB-függő gén szupresszió által, anti-tumor és gyulladáscsökkentő, anti-apoptotikus (Bcl-2 csökkentés), anti-proliferáció (COX-2 gátlás) aktivitást mutat (Moon és mtsai, 2009).
Butein az anti-apoptosis hatásért felelős fehérjék génjeinek expresszióját csökkenti, valamint prolifeláció gátló. Ezen gének szupressziója, a TNF és kemoterápiás anyagok által indukált apoptózist segíti (Pandey és mtsai, 2007).
|
EGCG a zöld teából (7.Ábra) kivonható hatóanyag, amely IGF-1 downregulációval módosítja a COX-2 kibocsátást, és csökkenti a MAPK-t (Mitogen Activated Protein Kinase), így csökkenti a proliferációt (Harper és mtsai, 2007). EGCG-t kombinálva a C2I NS-398-al, apoptózist indukál, tumornövekedést gátol, különböző faktorok és enzimek gátlásával. Celecoxib-bal kombinálva tumornövekedés gátlás, prosztata-specifikus antigén-szint csökkenés,és IGF-I szint csökkenés tapasztalható (Adhami és mtsai, 2007).
5.5. COX-2 független hatások
Jól ismert, hogy számos szekektív-C2I sejt-proliferáció gátló és apoptózis serkentő a COX-2-től függetlenül. Olyan tumorsejtekben is tudják serkenteni az apoptózist, amelyek nem COX-2+ -ak, más mch. által. Egy tanulmány szerint két szelektív ciklooxigenáz-gátló(SC58123, CAY10404), képes csökkenteni a GSH szintet az emberi B-sejtekben, ezzel az oxidatív stresszt növelve a sejtekben. Ezáltal a sejtek elpusztulnak (Hostanska és mtsai, 2007).
Összefoglalva: Számos tanulmány mutatja, hogy a COX-2 gátlók sejt-proliferáció gátlást okoznak különböző tumorsejt típusokban. COX-2 gátlók emellett triggerelik a tumor sejtek apoptózisát és/vagy növeli a sejtek citotoxikus anyagokra való szenzitivitását. Továbbá, a COX-2 gátlók kombinálva más daganatterápiákkal (sugárzásterápia, kemoterápia) hatékonyabbá teszik az apoptosist, illetve a tumort károsító hatásokat. Azonban a COX-2 független hatások óvatosságra intenek a C2I-k használatában.
6. A NSAID-ok jövője
A COX 1-es és a 2-es rendszer gátlásának szelektivitásában mutatkozó különbségeket használják a mellékhatások valószínűségét jelző indikátorként, de a szelektivitás mérése általában kevésbé helyénvaló, és a szelektivitás nem eredményezett egyértelműen jobb biztonságot. Előfordul, hogy a betegek biztonságának érdekében nem javasolják az NSAID-ok alkalmazását. A jelenkori útmutatás szerint az NSAID-ok legkisebb hatásos dózisának alkalmazását ajánlják a lehető legrövidebb ideig. Válaszul alacsony dózisú NSAID készítményeket fejlesztettek ki, melyek segíthetnek az általános szisztémás expozíció csökkentésében, csökkentve ezáltal a betegség gyakoriságát vagy súlyosságát. Időszerűnek tűnik felülvizsgálni egy ilyen megközelítés szükségességét, logikáját és alkalmazását (Pergolizzi, 2016). Emellett további kutatásokat végeznek az NSAID-ok immunoterápiai veszélyeinek kiszűrésére és esetlegesen néhány szer beszüntetésére (Chen és mtsai, 2013).
Előreláthatólag további kutatások sora fog zajlani ezen a tudományterületen, így kiszűrve a lehető legtöbb rizikófaktort. Ezen kutatások egyik iránya feltehetően a gyógyíthatatlan betegségek felé orientálódhat, amely mindmáig rengeteg embert foglalkoztat és az elkövetkezendő időkben is foglalkoztatni fog.
Irodalomjegyzék
Adhami, V. M.; Malik, A.; Zaman N. (2007): Combined inhibitory effects of green tea polyphenols and selective cyclooxygenase-2 inhibitors on the growth of human prostate cancer cells both in vitro and in vivo. Clinical Cancer Research 13: (5) 1611–1619
Al-Saeed, A. (2011): Gastrointestinal and Cardiovascular Risk of Nonsteroidal Anti-inflammatory Drugs. Oman Medical Journal 26: (6) 385–391
Arun, B.; Goss, P. (2004): The role of COX-2 inhibition in breast cancer treatment and prevention. Seminars in Oncology 31: (7) 22–29
Bakhle, Y. R. (1999): Structure of COX-1 and COX-2 enzymes and their interaction with inhibitors. Drugs Today 35: (4-5) 237-250
Bednarek, D.; Szuster-Ciesielska, A.; Zdzisiñska, B.; Kondracki, M.; Paduch, R.; Kandefer-Szerszeñ, M. (1999): The effect of steroidal and non-steroidal anti-inflammatory drugs on the cellular immunity of calves with experimentally-induced local lung inflammation. Veterinary Immunology and Immunopathology 71: (1) 1-15
Bhui, K.; Prasad, S.; George, J.; Shukla, Y. (2009): Bromelain inhibits COX-2 expression by blocking the activation of MAPK regulated NF-kappa B against skin tumor-initiation triggering mitochondrial death pathway. Cancer Letters 282: (2) 167–176
Botting, R. (2003): COX-1 and COX-3 inhibitors. Thrombosis Research 110: (5-6) 269–272
Chan, M. W.; Wong, C. Y.; Cheng, A. S. (2007): Targeted inhibition of COX-2 expression by RNA interference suppresses tumor growth and potentiates chemosensitivity to cisplatin in human gastric cancer cells. Oncology Reports 18: (6) 1557–1562
Chandrasekharan, N. V.; Simmons, D. L. (2004): The cyclooxygenases. Genome Biology 5: (9) 241
Chen, Y. F. J.; Lee, K. J. (2013): A series of NSAID-induced anaphylactic response to immunotherapy and a proposal to include NSAIDS avoidance in future immunotherapy guidelines. Allergy, Asthma, and Clinical Immunology 10: A15
Cullen L.; Kelly L.; Connor S. O.; Fitzgerald, D. J. (1998): Selective cyclooxygenase-2 inhibition by nimesulide in man. The Journal of Pharmacology And Experimental Therapeutics 287: (2) 578–582
Doherty, G. A.; Byrne, S. M.; Molloy, E. S.; Malhotra, V.; Austin, S. C.; Kay, E. W.; Murray, F. E.; Fitzgerald, D. J. (2009): Proneoplastic effects of PGE2 mediated by EP4 receptor in colorectal cancer. BMC Cancer 9: 207
Dougherty, T. J.; Gomer, C. J.; Henderson, B. W. (1998): Photodynamic therapy. Journal of the National Cancer Institute 90: 889–905
Ferrario, A.; Fisher, A.; Rucker, N.; Gomer, C. J. (2005): Celecoxib and NS-398 enhance photodynamic therapy by increasing in vitro apoptosis and decreasing in vivo inflammatory and angiogenic factors. Cancer Research 65: (20) 9473–9478
Ferrario, A.; Tiehl, Von K.; Wong, S.; Luna, M.; Gomer, C. J. (2002): Cyclooxygenase-2 inhibitor treatment enhances photodynamic therapy-mediated tumor response. Cancer Research 62: (12) 3956–3961
Folkman, J. (1971): Tumor angiogenesis: therapeutic implications. The New England Journal of Medicine 285: (21) 1182–1186
Goel, A.; Prasad, A. K.; Parmar, V. S.; Ghosh, B.; Saini, N. (2009): Apoptogenic effect of 7,8-diacetoxy-4-methylcoumarin and 7,8-diacetoxy-4-methylthiocoumarin in human lung adenocarcinoma cell line: role of NF-κB, Akt, ROS and MAP kinase pathway. Chemico-Biological Interactions 179: (2-3) 363–374
Grimes, K. R.; Warren, G. W.; Fang, F.; Xu, Y.; St Clair, W. H. (2006): Cyclooxygenase-2 inhibitor, nimesulide, improves radiation treatment against non-small cell lung cancer both in vitro and in vivo. Oncology Reports 16: (4) 771–776
Grossmann, J. (2002): Molecular mechanisms of detachment-induced apoptosis—anoikis. Apoptosis 7: (3) 247–260
Halis, S.; Berna, D.; Yalçin, K. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmalogical Reports 59: (3) 247-258
Halter, F.; Tarnawski, A.; Schmassmann, A.; Peskar, B. (2001): Cyclooxygenase 2—implications on maintenance of gastric mucosal integrity and ulcer healing: controversial issues and perspectives. Gut 49: (3) 443–453
Harper, C. E.; Patel, B. B.; Wang, J.; Eltoum, I. A.; Lamartiniere, C. A. (2007): Epigallocatechin-3-gallate suppresses early stage, but not late stage prostate cancer in TRAMP mice: mechanisms of action. Prostate 67: (14) 1576–1589
Hendrickx, N.; Volanti, C.; Moens, U. (2003): Up-regulation of cyclooxygenase-2 and apoptosis resistance by p38 MAPK in hypericin-mediated photodynamic therapy of human cancer cells. The Journal of Biological Chemistry 278: (52) 52231–52239
Hopp, B.; Dr. Kemény, L.; Smausz, K. T.; Morvai, M.; Ónodi, K.; Degovics, D. (2012): Lézerek az orvostudományban. (Megtekintés: 2017.04.23) http://titan.physx.u-szeged.hu/tamop411c/public_html/Lézerek%20az%20orvostudományban/92_fotodinmis_fotodinamikus_terpia_pdt.html
Hostanska, K.; Jurgenliemk, G.; Abel, G.; Nahrstedt, A.; Saller, R. (2007): Willow bark extract (BNO1455) and its fractions suppress growth and induce apoptosis in human colon and lung cancer cells. Cancer Detection and Prevention 31: (2) 129–139
Johnson, G. E.; Ivanov, V. N.; Hei, T. K. (2008): Radiosensitization of melanoma cells through combined inhibition of protein regulators of cell survival. Apoptosis 13: (6) 790–802
Jolobe, O. M. P. (2001): Nephrotoxicity in the elderly due to co-prescription of ACE inhibitors and NSAIDs. Journal of the Royal Society of Medicine 94: (12) 657–658
Kalra, N.; Bhui, K.; Roy, P. (2008): Regulation of p53, nuclear factor κand cyclooxygenase-2 expression by bromelain through targeting mitogen-activated protein kinase pathway in mouse skin. Toxicology and Applied Pharmacology 226: (1) 30–37
Kelly, J. P.; Kaufman, D. W.; Jurgelon, J. M.; Sheehan, J.; Koff, R. S.; Shapiro, S. (1996): Risk of aspirin-associated major upper-gastrointestinal bleeding with enteric-coated or buffered product. Lancet 348: (9039) 1413-6
Laine, L.; Harper, S.; Simon, T.; Bath, R.; Johanson, J.; Schwartz, H.; Stern, S.; Quan, H.; Bolognese, J. (1999): A randomized trial comparing the effect of rofecoxib, a cyclooxygenase 2-specific inhibitor, with that of ibuprofen on the gastroduodenal mucosa of patients with osteoarthritis. Rofecoxib Osteoarthritis Endoscopy Study Group. Gastroenterology 117: (4) 776-783
Lakatos, G.; Herszényi, L.; Tulassay Zs. (2008): A COX-2-gátlók biztonságossága. Orvosi Hetilap 149: (33) 1539-1547
Laudanno, O. M.; Cesolari, J. A.; Esnarriaga, J.; Rista, L.; Piombo, G.; Maglione, C.; Aramberry, L.; Sambrano, J.; Godoy, A.; Rocaspana, A. (2000): Gastrointestinal damage induced by celecoxib and rofecoxib in rats. Digestive Diseases and Sciences 46: (4) 779–84
Liu, B.; Shi, Z. I.; Feng, J.; Tao, H. M. (2008): Celecoxib, a cyclooxygenase-2 inhibitor, induces apoptosis in human osteosarcoma cell line MG-63 via down-regulation of PI3K/Akt. Cell Biology International 32: (5) 494–501
Lund, B.; Distel, M.; Bluhmki, E. (1998): A double-blind, randomized, placebo-controlled study of efficacy and tolerance of meloxicam treatment in patients with osteoarthritis of the knee. Scandinavian Journal of Rheumatology 27: (1) 32-7
Ma, X.; Kundu N.; Rifat, S.; Walser, T.; Fulton, A. M. (2006): Prostaglandin E receptor EP4 antagonism inhibits breast cancer metastasis. Cancer Research 66: (6) 2923–2927
Majima, M.; Hayashi, I.; Muramatsu, M.; Katada, J.; Yamashina, S.; Katori, M. (2000): Cyclo-oxygenase-2 enhances basic fibroblast growth factor-induced angiogenesis through induction of vascular endothelial growth factor in rat sponge implants. British Journal of Pharmacology 130: (3) 641–649
Makowski, M.; Grzela, T.; Niderla, J. (2003): Inhibition of cyclooxygenase-2 indirectly potentiates antitumor effects of photodynamic therapy in mice. Clinical Cancer Research 9: (14) 5417–5422
Marín, Y. E.; Wall, B. A.; Wang, S. (2007): Curcumin downregulates the constitutive activity of NF-κB and induces apoptosis in novel mouse melanoma cells. Melanoma Research 17: (5) 274–283
Moon, D. O.; Kim, M. O.; Kang, S. H.; Choi, Y. H.; Kim, G. Y. (2009): Sulforaphane suppresses TNF-α-mediated activation of NF-κB and induces apoptosis through activation of reactive oxygen species-dependent caspase-3. Cancer Letters 274 (1) 132–142
Pandey, M. K.; Sandur, S. K.; Sung, B.; Sethi, G.; Kunnumakkara, A. B.; Aggarwal, B. B. (2007): Butein, a tetrahydroxychalcone, inhibits nuclear factor (NF)-κB and NF-κB-regulated gene expression through direct inhibition of IκBα kinase β on cysteine 179 residue. The Journal of Biological Chemistry 282: (24) 17340–17350
Park, C.; Moon, D. O.; Choi, I. W. (2007): Curcumin induces apoptosis and inhibits prostaglandin E2 production in synovial fibroblasts of patients with rheumatoid arthritis. International Journal of Molecular Medicine 20: (3) 365–372
Patel, V. A.; Dunn, M. J.; Sorokin, A. (2002): Regulation of MDR-1 (P-glycoprotein) by cyclooxygenase-2. The Journal of Biological Chemistry 277: (41) 38915–38920
Pergolizzi Jr, V. J.; Raffa, B. R.; Nalamachu, S.; Taylor Jr, R. (2016): Evolution to low-dose NSAID therapy. Pain Management 6: (2) 175-189
Puhlmann, U.; Ziemann, C.; Ruedell, G. (2005): Impact of the cyclooxygenase system on doxorubicin-induced functional multidrug resistance 1 overexpression and doxorubicin sensitivity in acute myeloid leukemic HL-60 cells. Journal of Pharmacology and Experimental Therapeutics 312: (1) 346–354
Sobolewski, C.; Cerella, C.; Dicato, M.; Ghibelli, L.; Diederich, M. (2009): The Role of Cyclooxygenase-2 in Cell Proliferation and Cell Death in Human Malignancies. International Journal of Cell Biology 2010: (Megtekintés: 2017.04.23) http://dx.doi.org/10.1155/2010/215158
Suganuma, M.; Okabe, S.; Marino, M. W.; Sakai, A.; Sueoka, E.; Fujiki, H. (1999): Essential role of tumor necrosis factor α (TNF-α) in tumor promotion as revealed by TNF-α-deficient mice. Cancer Research 59: (18) 4516–4518
Süleyman, H.; Demircan, B.; Karagöz, Y. (2007): Anti-inflammatory and side effects of cyclooxygenase inhibitors. Pharmacological Reports 59: (3) 247-258
Tessner, T. G.; Muhale, F.; Riehl, T. E.; Anant, S.; Stenson, W. F. (2004): Prostaglandin E2 reduces radiation-induced epithelial apoptosis through a mechanism involving AKT activation and Bax translocation. Journal of Clinical Investigation 114: (11) 1676–1685
Tsujii, M.; Kawano, S.; Tsuji, S.; Sawaoka, H.; Hori, M.; DuBois, R. N. (1998): Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell 93: (5) 705–716
Újszászy, L.; Nemesánszky, E.; Rácz, I. (2000): A ciklooxigenáz-2 (COX-2) enzim gátlás evolúciója és az alkalmazás gasztroenterológiai vonatkozásai. Gyógyszereink 50: (1) 181-189
Vane, J. R.; Botting, R. M. (2003): The mechanism of action of aspirin. Thrombosis Research 110: (5-6) 255–258
Wen-Ming, C. (2013): Tumor necrosis factor. Cancer Letters 328: (2) 222–225
Xie, W. L.; Chipman, J. G.; Robertson, D. L.; Erikson, R. L.; Simmons, D. L. (1991): Expression of a mitogen-responsive gene encoding prostaglandin synthase is regulated by mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America 88: (79) 2692–2696
Yamaki, T.; Endoh, K.; Miyahara, M.; Nagaminea, I.; Huonga, T. T. N.; Sakuraia, H.; Pokornyb, J.; Yanoc, T. (2004): Prostaglandin E2 activates Src signaling in lung adenocarcinoma cell via EP3. Cancer Letters 214: (1) 115–120
Yang, V. W.; Shields, J. M.; Hamilton S. R.; Spannhake, E. W.; Hubbard, W. C.; Hylind, L. M.; Robinson, C. R.; Giardiello, F. M. (1998): Size-dependent increase in prostanoid levels in adenomas of patients with familial adenomatous polyposis. Cancer Research 58: (8) 1750–1753
Yusuf-Makagiansar, H.; Anderson, M. E.; Yakovleva, V. T.; Murray, S. J.; Siahaan, J. T. (2002): Inhibition of LFA-1/ICAM-1 and VLA-4/VCAM-1 as a therapeutic approach to inflammation and autoimmune diseases. Medical Research Reviews 22: (2) 146–167
Zrieki, A.; Farinotti, R.; Buyse, M. (2008): Cyclooxygenase inhibitors down regulate P-glycoprotein in human colorectal caco-2 cell line. Pharmaceutical Research 25: (9) 1991–2001
1. Felhasznált irodalom
Gálfi, P.; Csikó, Gy.; Jerzsele, Á. (2010): Állatorvosi Gyógyszertan I. , Robbie-Vet Kft.
Gyires, K.; Fürst, Zs. (2011): A farkmakológia, 10. fejezet - A gyulladás farmakológiája és a helyi hormonok , Medicina Könyvkiadó Zrt.
2. Képek forrásai
1. Ábra - wikipedia.org (megtekintés: 2017.04.20)
2. Ábra - Science 294: (5548) 1871-1875 alapján készített saját ábra
3. Ábra - Gálfi, P.; Csikó Gy.; Jerzsele, Á. (2010): Állatorvosi Gyógyszertan I. tankönyv alapján készített saját ábra
4. Ábra - https://pixabay.com/hu/radioakt%C3%ADv-nukle%C3%A1ris-sug%C3%A1rz%C3%A1s-154139/ (megtekintés: 2017.04.22)
5. Ábra - https://commons.wikimedia.org/wiki/File:Chemotherapy_bottles_NCI.jpg (megtekintés: 2017.04.22)
6. Ábra - https://www.flickr.com/photos/7304492@N06/417626435 (megtekintés: 2017.04.22)
7. Ábra - https://en.wikipedia.org/wiki/File:Panda_Tea_Green_Tea.jpg (megtekintés: 2017.04.22)