|
Size: 28260
Comment:
|
Size: 28383
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 86: | Line 86: |
''' Abbildung 3: Die Auswirkung von Ernährung auf die Darm-Hirn-Achse ''' https://academic.oup.com/view-large/figure/200612275/nmaa016fig1.jpg <<BR>> |
{{attachment:Abbildung 2.jpeg|Gehirn-Darm-Verbindung|height="300"}} <<BR>> ''' Abbildung 3: Die Auswirkung von Ernährung auf die Darm-Hirn-Achse ''' <<BR>> (Bear et al, 2020) |
| Line 128: | Line 129: |
| Abbildung 3: Die Auswirkung von Ernährung auf die Darm-Hirn-Achse <<BR>> https://academic.oup.com/view-large/figure/200612275/nmaa016fig1.jpg |
Abbildung 3: selbstangefertigtes Bild nach Vorlage von Bear T.L.K., Dalziel J.E., Coad J., Roy N.C., Butts C.A., Gopal P.K.(2020): The Role of the Gut Microbiota in Dietary Interventions for Depression and Anxiety. Advances in Nutrition <<BR>> |
Itt írjon a(z) Darmflora_Depression-ról/ről
Die Rolle der Darmflora in Depression und Angst
Contents
Was sind Depressionen?
Depressionen werden durch ein bestimmtes Trias beschrieben, welches sich aus einer Traurigen/Ängstlichen Grundstimmung, Hemmung des Denkens und Störung der zentrifugalen psychischen und psychomotorischen Funktion zusammensetzt.
Die Ursachen einer Depression können organisch, toxisch, endogene und psychogene Gründe (äußere Einflüsse) sein.
Eine Depression wird oft von anderen Symptomen begleitet, wie z.B. neuralgiforme Schmerzen, Kopfdruck, Herzbeklemmung, Kreuzbeschwerden und wie in diesem Artikel behandelt, Magen-Darm-Beschwerden. Jedoch treten in den seltensten Fällen alle dieser Symptome zum Vorschein. Dieses Geschehen wird als „Larvierte Depression“ bezeichnet, wobei Körperliche Beschwerden im Vordergrund stehen.
Das Depressive Syndrom setzt sich aus zwei Faktoren zusammen.
Grundsyptome:
Die Depressive Grundstimmung, also „Denkhemmung“, welche sich zum Beispiel als Einfallsarmut, Innere Leere und Pessimismus auszeichnet und „Hemmung der zentrifugalen Funktionen“, wie Entschlussunfähigkeit und Schwunglosigkeit, zusammensetzt.
und Akzessorische Symptome:
also Begleitbeschwerden.
Hierbei unterscheiden wir „Holothyme (stimmungsbedingte) Wahnideen“, wie Hypochondrie, also übermäßige Angst vor Erkrankungen, und „Somatische Erscheinungen“.
Beispiele für Somatische Erscheinungen sind, wie schon teilweise oben beschrieben:
o Schlafstörungen
o Appetitlosigkeit und Gewichtsverlust
o Herz- und Atembeschwerden
o Schmerzen aller Art
o Störung des Urogenitaltrakts, wie Dysurie, Mensturationsstörungen, Impotenz
o Störung der Gastrointestinaltraktes, wie Obstipation, Mundtrockenheit, Diarrhoe, Magendruck
Akzessorische Begleitsymptome liefern uns differentialdiagnostische Rückschlüsse.
Der Patient empfindet eine Depression oft als innere Spannung und Leere, Angst, Willenlosigkeit und Gleichgültigkeit. Bei Älteren Patienten zeigt sich dies oft als motorische Unruhe, Klagen und Jammern, wobei bei Kindern eine mürrisch-gereizte Stimmung, schlechte Laune und Unbeherrschtheit beobachtet wird.
Jedoch ist die Erscheinung einer Depression bei jedem Individuum anders und es können keine universellen Schlüsse getroffen werden.
Darmflora im Allgemeinen
Rolle
Die aus etwa 50-1000 verschiedenen Mikrobenarten und mehr als 35000 Bakterienarten bestehende Darmflora hat eine Vielfalt an wichtigen Rollen. Durch die hohe metabolische Fähigkeit und die Bildung von vielen Verdauungsenzymen ist der Gastrointestinaltrakt fähig wichtige Nährstoffe aus der aufgenommenen Nahrung zu spalten. Kohlenhydrate werden zu flüchtigen Fettsäuren die einen wichtigen Energielieferant darstellen. Die Aktivität von Lipasen und Proteinasen tragen auch zu einem wichtigen Stoffwechsel bei. Bei Pfanzenfresser spielen Mikroben eine wichtige Rolle, sie spalten den Zellulosegehalt im Futter auf, dienen jedoch auch beim Menschen zur Einstellung eines optimalen pH-Wertes. Im gesunden Organismus hat die Darmflora auch eine schützende und immunstärkende Fähigkeit. Die Peyer´sche Platten und GALT dient durch die Produktion von Immunglobulin A zur Immunabwehr. Durch die mehrschichtige Schleimhaut der Darmwand gelingt es dem Magen-Darm-Trakt die Homeostase aufrecht zu behalten. Der mechanische und chemische Schutz wird zudem auch noch durch die Resorption von wichtigen Nährstoffen, Wasser und Elektrolyten gesteigert. (Wang et Wang, 2016)
Regulation
Die Darmfunktion wird sowohl durch das vegetative Nervensystem als auch durch das zentrale Nervensystem reguliert. Das vegetative Nervensystem ist zuständig für eine ständige Blutzufuhr und die autonome Aktivität des Traktes. Das Zentrale Nervensystem steuert eher die hormonelle Aktivität. Hormone genau wie Neurotransmitter sind wichtige orexigene und anorexigene Faktoren. Aber auch der Sympathikus und Parasympathikus spielen eine wichtige Rolle bei der Regulation. Das sympathische Nervensystem wird durch den n.splanchnicus vertreten und hemmt den Tonus wogegen das parasympathische Nervensystem durch den n. vagus zu einer steigenden Aktivität beitritt. Des Weiteren spielen auch innere und äußere Signale eine Rolle bei der Regulation der Motilität und Sekretion des Darmtraktes. Äußere Reflexe können zum Beispiel Temperatur und Tages-Nacht-Rhythmus sein. Innere Reflexe können das Hunger- oder Sättigungsgefühl aber Reflexe des Rückenmarks oder Hirnstamms, autonome Reflexe oder Reflexe von sympathischen Ganglien sein. (Jandhyala et al, 2015)
Die Veränderung der Darmflora durch psychisch-emotionale Überbelastung
Durch das vegetative Nervensystem besteht zwischen dem Darm dem Gehirn eine bidirektionale Kommunikation. Somit können sowohl Depressionen und Angst den Darmzustand angreifen, aber auch können Darmerkrankungen einen Einfluss auf die Psyche haben.
Die Veränderung der Darmflora beeinträchtigt die Permeabilität der Darmbarriere, wodurch die Freisetzung von proentzündlichen Zytokinen erhöht wird . Bakterielle Stämme können vermehrt oder vermindert werden. Die Freisetzung von bestimmten Neurotransmitter wie Serotonin und GABA durch das enterische Nervensystem kann zu Angststörungen und Depressionen führen.
Im 19. Jahrhundert wurde der erste Krankheitsfall basierend auf der Verbindung zwischen Gastrointestinaltrakt und dem Gehirn beschrieben. Veränderungen der Magensekretion bei verschiedenem Stimmungswechsel führte auf eine entstandene Magenfistel durch ein Trauma zurück. (Konturek et Zopf, 2016)
Das Experiment an Mäusen die mit Lactobacillus Rhamnosus JB-1 gefüttert wurden kam zum positiven Endergebnis. Neben ungestresstem, aktiverem, ruhigem Verhalten zeigte das Resultat auch eine Veränderung der Rezeptoren für GABA (siehe 5.a. Neurotransmitter) im Gehirn. (Rossbach, 2018)
Leider sind viele Fragen der Darm-Hirn-Kommunikation noch nicht beantwortet worden und haben den Bedarf nachgewiesen zu werden.
Verbindung Darm-Gehirn
Neurotransmitter
Wirkung |
Darm |
Nervensystem |
||||
Zufriedenheit, Wohlbefinden |
Herbabsetzen der Futteraufnahme |
Auslösen der langen Schlafphase |
||||
Glückshormon |
Erhöhung der Futteraufnahme |
inhibitorisches Hormon, hemmt Thyroid-stimulierendes Hormon und Prolaktin |
||||
GABA : Gamma-Aminobuttersäure |
angstlösend, entspannend, beruhigend, reizreduzierend, schlafverbessernd, antidepressiv |
Erhöhung der Futteraufnahme |
hemmendes Hormon des Hypothalamus, Reize werden langsamer oder nicht weitertransportiert, optimiert Hirnstoffwechel |
|||
reizreduzierend, schlafverbessernd, beruhigend, antidepressiv |
Bestandteil der Zellmembran, intrazelluläre Botenstoff |
optimieren Hirnstoffwechel |
||||
innere Gelassenheit, Belastbarkeit, entzündungshemmend, schlafverbessernd, beruhigend, antidepressiv |
durch Nahrung aufgenommen |
bessere Hirnfunktion |
||||
entzündungshemmend, immunsystemstärkend |
Förderung der Salzsäureproduktion, Appetitkontrolle |
Schlaf-Wach-Rhythmus |
||||
Aggressivität |
Hyperpolarisation der glatten Muskelzellen, Senkung des Ruhepotential, Hemmung der Weiterberförderung des Darminhalts |
hemmendes Hormon des Hypothalamus |
||||
Tabelle 1: Neurotransmitter und ihre Wirkungen im Darm und im Nervensystem
Sowohl der Darm als auch das Gehirn besitzt Rezeptoren beispielsweise Sensoren auf der Oberfläche der Zellen um bestimmte Neurotransmitter zu identifizieren (siehe Tabelle 1). Da einige Medikamenter sowohl das Gehirn als auch den Darm beeinflussen, schließt man darauf, dass Darm- und Hirn die gleichen Rezeptoren besitzen. (Rossbach, 2018)
Enterisches Nervensystem
Der Gastrointestinaltrakt wird umgeben von einem Netz aus etwa 100 Millionen Nervenzellen, die das enterische Nervensystem darstellen. Der Darm kann durch diese Darmzellen über den n.vagus eine Kommunikation sowohl mit nebenliebengenden Organen als auch mit dem Gehirn herstellen. Die im Magen-Darm-Trakt enthaltenen Mikroben: Bakterielle Stoffwechselprodukte, proentzündliche Zytokine, verschiedene Neuro-mediatoren stellen eine Verbindung mit dem Gehirn dar.
Die Hauptaufgabe des enterischen Nervensystems ist die Koordination der Motilität, Sekretion und Freisetzung von Verdauungsenzymen. Durch die Mikroorganismen grundsätzlich im Magen aber auch im Darm besteht ein Teil der Aufgabe auch eine Hirn-Darm-Kommunikation aufzubauen, deshalb wird dieses Nervensystem auch als Darmhirn bezeichnet. (Konturek et Zopf, 2016)
Darmmikrobiota-Gehirn-Achse
Die Darmflora steht im engen Zusammenhang mit dem Gehirn und kann so unsere Stimmung beeinflussen.
Forscher arbeiten derzeit an der „Darmmikrobiota-Gehirn-Achse“, welche diese bidirektionale Beziehung darstellt und in der Therapie zum Schutz des Gehirns helfen soll. Sie stellt das Informationsnetzwerk zwischen Darm und Gehirn dar.
Die „Darmmikrobiota-Gehirn-Achse“ wird durch verschiedene Faktoren beeinflusst, darunter zählt das enterische Nervensystem, sympathische- und parasympathische Zweige des autonomen Nervensystems, neurales Immunsystem, neuroendokrines System und das Zentrale Nervensystem.
Als Kommunikationssystem dienen das Immunsystem, die Synthese und der Metabolismus von Metaboliten und Neurotransmittern und die Aktivierung des Vagusnerv.
Depressionen sind aus klinischer Sicht mit einer dysregulierten HPA (Hypothalamus-Hypophysen-Nebennieren-Achse) assoziert und umgekehrt sind verbesserte Symptome mit einer Stabilisierung dieser Achse verbunden. Dieser Zusammenhang wird bei einer Studie von Sudo und Kollegen dargestellt. Verglichen wurden keimfreien Mäuse und konventionelle gehaltenen. Bei spezifischen Stress zeigten pathogenfreie (SPF) Mäuse einen übertriebenen Corticosteron- (CORT) und Adrenocorticotropin (ACTH) Spiegel.
Weitere Versuche wurden bei Ratten durchgeführt, Ihnen wurde Probiotika (Lactobacillus sp.) verabreicht bevor die Ratte von der Mutter getrennt wurde, dies zeigte eine Normalisierung des basalen CORT-Spiegels während der frühen Stressperiode.
Außerdem konnte die Funktion der HPA-Achse die Mikrobiota die Funktion des ZNS direkt beeinflussen durch neuronale Aktivierung von Stresskreisläufen. Studien zur oralen Verabreichung der pathogenen Bakterien Citrobacter rodentium und Campylobacter jejuni zeigen, dass Darmmikroben die Stressreaktion durch Aktivierung der Vaguswege vermitteln können. Veränderungen im Mikrobiom können außerdem zu einer entzündlichen Zytokinie führen, meist bei Depressionen beobachtet.
Schließlich wurden Depressionen mit einer Beeinträchtigung der Fähigkeit des Mikrobioms zur Produktion neuroaktiver Metaboliten und mit einer gestörten Darmbarrierefunktion in Verbindung gebracht.
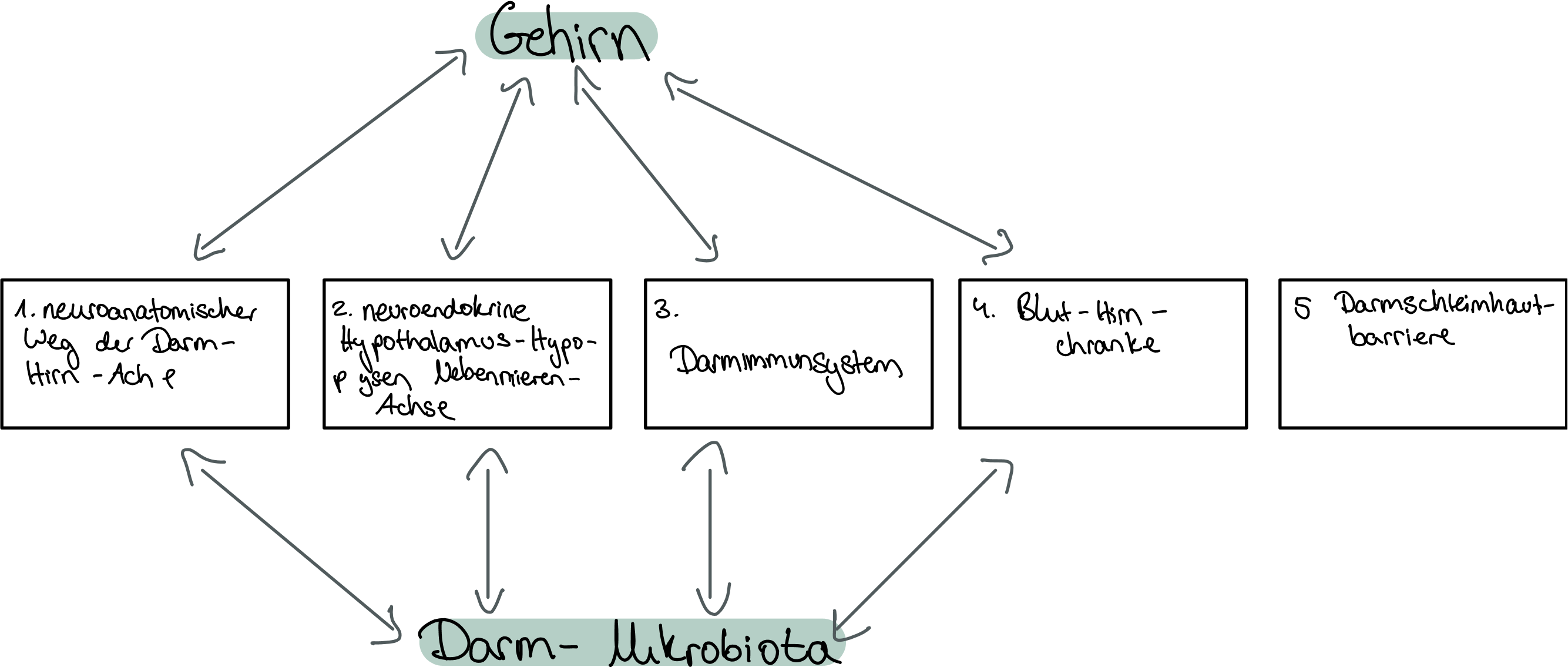
Abbildung 1:Gehirn-Darm-Verbindung
(Wang et Wang, 2016)
Episoden von Depressionen sind aus klinischer Sicht mit einer dysregulierten Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) assoziiert - umgekehrt sind verbesserte depressive Symptome mit einer Stabilisierung der HPA-Achse verbunden
Ein direkter Zusammenhang zwischen der Mikrobiota und der HPA-Funktion wurde in einer Studie von Sudo et al ersichtlich. Dabei wurde die Stressreaktion von keimfreien Mäusen im Vergleich zu konventionell gehaltenen untersucht. Als Ergebnis wiesen pathogenfreie (SPF) Mäuse bei spezifischem Stress einen übertriebenen Corticosteron- (CORT) und Adrenocorticotropin- (ACTH) Spiegel auf. Konventionell gehaltene dagegen wesentlich geringer.(Sudo et al, 2004)
Als weiteres Beispiel dient eine Studie bei Ratten, bei der sich durch die Verabreichung von Probiotika (Lactobacillus sp.) während der frühen Stressperiode die basalen CORT-Spiegel normalisieren, die normalerweise nach der Trennung der Mutter erhöht sind. (Gareau et al, 2007)
Des Weiteren wurde nachgewiesen, dass die Mikrobiota zusätzlich zur Beeinflussung der Funktion der HPA-Achse durch neuronale Aktivierung von Stresskreisläufen die Funktion des Zentralnervensystems direkt beeinflussen konnte. Studien zur Verabreichung der pathogenen Bakterien Citrobacter rodentium und Campylobacter jejuni zeigen, dass Darmmikroben durch Aktivierung der Vaguswege Stressreaktionen vermitteln können.(Goehler et al, 2007)
Schließlich wurde eine Verbindung zwischen Depressionen und einer gestörten Darmbarrierefunktion mit einer Beeinträchtigung der Fähigkeit des Mikrobioms zur Produktion neuroaktiver Metaboliten entdeckt. (Valles-Colomer et al, 2019)
Darmkrankheiten
Symptome
o Reizmagen, Reizdarm, Blähungen, Sodbrennen, Übelkeit, Bauchschmerzen, Magenfistel, Magensekretveränderung
o Migräne, Schlafstörungen, psychische Störungen, depressive Störungen, Angststörungen
o Dysregulation der Hirn-Darm-Achse: gastroenterologische Erkrankungen: Refluxkrankheit, peptischer Ulkus, funktionelle Darmerkrankungen
o Dysfunktion durch Darmmikrobiom Versuch:
* Helicobacter-pylori-Infektionen: erhöhte viszerale Hypersensibilität im Magen, verstärkte Kontraktion des Magens, pathologische Freisetzung von Hormonen, Störung der mukosalen Schleimhautdurchblutung
o Stress: extrem negativer Einfluss auf GIT durch indirekte und direkte Wirkung auf die Mikrobiota-Hirn-Darm-Achse, vermehrte Permeabilität der Darmbarriere, erhöhte freisetzung von proentzündlichen Zytokinen, Mukosaschädigungen
o Reizdarmsyndrom: viszerale Hypersensitivität
(Konturek et Zopf, 2016)
Therapie
Spezielle Diäten bieten sich als kostengünstige Alternative bzw. als Ergänzung zur Therapie von Darm-assoziierten Depressionen und Angstzuständen an, da die Darmmikrobiota stark durch die Ernährungsgewohnheiten beeinflusst wird.
Positive Wirkungen auf Depressionen haben Vitamine bzw. Minerale, Omega3, Magnesium, Folsäure und Zink, Selen und Eisen, welche essenziell für die Dopamin-Synthese sind. Antiinflammatorisches Essen hat eine Auswirkung von Monoamin-Neurotransmittern darunter Serotonin, welches eine beruhigende Wirkung aufweist.
Gemüse enthält eine hohe Menge oben genannter Mikronährstoffe, sowie Vitamin C, Polyphenole und Flavonoide, die antidepressiv und anxiolytisch wirken.
Erhöhung des Verzehrs von Ballaststoffen und Fisch, welche ein wichtiger Bestandteil der mediterranen Ernährung sind, sind mit einer erhöhten Anzahl von Bakterien mit entzündungshemmenden Eigenschaften verbunden. So geht ihr regelmäßiger Verzehr mit der erhöhten Häufigkeit von Mikroben einher, die kurzkettige Fettsäuren (SCFAs) produzieren. Zudem verkürzen sie Episoden von Depressionen. (Dinan et al, 2018)
Möchte man gezielt seine Darmflora verbessern bieten sich Präbiotika, Probiotika und Nährergänzungsmittel an.
Präbiotika sind für den Menschen unverdaulich und haben eine positive Wirkung auf das Mikrobiom des Wirts. Von den Darmbakterien werden sie zu kurzkettigen Fettsäuren abgebaut und können zum Beispiel die Zellen der Darmschleimhaut ernähren. Zudem sorgen sie für ein saures Darmmilieu und schützen so vor schädlichen Keimen. Fermentierbare Kohlenhydrate, Polyole und sekundäre Pflanzenstoffe fördern selektiv das Wachstum und die mikrobielle Aktivität nützlicher Bakterien (Bifidobakterien und Lactobillus), jedoch auch das Wachstum Butyrat produzierender Bakterien. Die am besten erforschten Präbiotika sind die löslichen Fasern „Fructane“ (Fructooligosaccharide (FOS) und Inulin) und Galactane (Galactooligosaccharide (GOS)). Ballastoffe wie Pektine Leinsamen und Flohsamen und resistente Stärke, welche bei abgekühlten Kartoffeln und Reis entsteht, fördern nicht nur das Sättigungsgefühl sondern sind auch besonders verdauungsfördernd durch ihre Darm-stimulierende Eigenschaft.
Die Kohlenhydratfermentation erhöht tendenziell die gesamte mikrobielle Fermentation und die Produktion kurzkettiger Fettsäuren. Die Menge der Fermentation hängt davon ab, wie viel den Dickdarm erreicht, dies wird durch die Menge und Art der Ballaststoffe und präbiotischen Kohlenhydrate beeinflusst.
Pfanzenreiche Ernährung fördert das Phylum Bacteroidetes, besonders die Gattungen Prevotella und Xylanibacter, welche Pflanzenfasern fermentieren.
Bei übermäßigem Verzehr von fermentierbaren Kohlenhydraten können im Darm durch Gärung Symptome verursachen. Besonders Reizdarmpatienten sind häufig empfindlicher auf ihre Wirkung. Verringerung von Kohlenhydraten dagegen führt zu weniger Roseburia/ Eubacterium rectale-Gruppen, was wegen ihrer Butyrat-produzierenden und somit Gasbildung fördernden Eigenschaft ebenfalls zu einer Besserung bei Beschwerden wie bspw. Blähungen führen kann. (Bear et al, 2020)
Probiotika sind lebende Mikroben, die sich positiv auf den Wirt auswirken und herkömmlicherweise als Zugabe in Lebensmitteln oder als Arzneimittel verabreicht werden. Zusammen mit Präbiotika verabreicht werden sie Synbiotikum genannt. Werden sie speziell zur Verbesserung der psychischen Gesundheit entwickelt werden sie auch als Psychobiotika bezeichnet. Die gängigste Quelle für Probiotika sind Joghurts und Milchprodukte. Sie enthalten verschiedene Laktobazillen und Bifidobakterien. Um aber ihren Zielort – dem Dickdarm- zu erreichen, müssen diese Lebensmittel regelmäßig und in großer Menge aufgenommen werden. Wichtig ist daher, dass sie der Magen-, Gallensäure und den Verdauungsenzymen gegenüber resistent sind.
Die Tücken der westlichen Ernährung
Charakteristisch für die westliche Diät ist der oft in einem hohen Anteil in verarbeiteten Lebensmitteln zugesetzte Lebensmittelzusatzstoff, um die Haltbarkeit und den Geschmack zu optimieren. Bei einer Studie an Mäusen, die mit Emulgatoren gefüttert wurden, erhöhte sich sowohl das proinflammatorische Potential der Darmmikrobiota als auch die Infiltration der Darmschleimhautschicht durch Mikrobiota. Des Weiteren konnte eine Veränderung des angstähnlichen Verhaltens beobachtet werden. (Bear et al, 2020)
Auch die besonders fettreiche Ernährung bringt Nachteile mit sich. Bei einer Studie zur Wirkungsweise von Nahrungsfett auf die Darmflora wurden Mäuse mit fettreicher Ernährung (HFD) (45% kcal Fett) im Vergleich zu Mäusen mit einer Kontrolldiät (10-12% kcal Fett) untersucht. Beobachtet wurde eine Abnahme der nützlichen Bacteroidetes, Akkermansia, Bifidobacteria und Lactobacillus und eine Zunahme von Firmicutes, insbesondere der potenziell entzündlichen Clostridiales, Enterobacteriaceae und Proteobacteria. (Bastiaanssen et al, 2020)
Es wird angenommen, dass eine erhöhte Fettaufnahme die Zusammensetzung der Darmmikrobiota möglicherweise über Stimulation der Galle und ihre Modulation in sek. Gallensäureprodukte verändert. (Chassaing et al, 2015)
Seck et al. fanden heraus, dass ein hoher Salzgehalt im Stuhl die Zusammensetzung der Darmmikroben verändert und eine Abnahme der nützlichen Bakterien Akkermansia muciniphila und Bifidobacterium spp. zu beobachten sind. (Seck et al, 2018)
Um genauerer Aussagen über die Wirkungsmechanismen der Diät beim Menschen treffen zu können werden dringend mehr gezielte Humanstudien benötigt. Es muss beachtet werden, dass es generell individuelle unterschiedliche Reaktionen auf Ernährungsumstellung gibt.
Fäkale Mikrobiomtransplantation
Bisher gibt es nur eine Studie von einer Transplantation von fäkalen Mikrobiomen von einem gesunden Spender auf einen Empfänger mit entzündlicher Darmerkrankung. Als Ergebnis konnte eine Verminderung von Depression und Angst beobachtet werden (siehe Abbildung 3). Spezielle Studien in diese Richtung fehlen jedoch. Ebenso ist ungewiss ob es die Mikroben selbst, oder ihre Metaboliten sind, die ein vorteilhafte Wirkung zeigen. Es muss noch gezieltere Studien am Menschen zu Depressionen in Verbindung mit dem Mikrobiom geben.
Abbildung 2: Human Studies Reporting Altered Microbial Composition in Depression https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7012351/table/T1/?report=objectonly
Fazit
Das Mikrobiom sollte als therapeutisches Ziel für Depressionen betrachtet werden. Dafür spricht, dass die Zusammensetzung des Mikrobioms leicht zu modifizieren und seine Manipulationen keine nachteiligen Auswirkungen bei Verwendung sicherer Mikroben verursachen. Darüber hinaus sprechen Patienten oftmals nicht auf die Behandlung allein mit Antidepressivum an oder nur gering (30-40%) (Bear et al, 2020)
Untersuchungen zeigen, dass es einen Zusammenhang zwischen Ernährung und Depression gibt, aber widersprüchliche Ergebnisse und begrenzte Forschungsergebnisse bedeuten, dass die Art der Beziehung noch ungeklärt ist. Die Ernährung hat einen großen Einfluss auf die Zusammensetzung und Änderung der Darmmikroben, somit hat sie wahrscheinlich auch auf auch Auswirkungen auf Depressionen und Angstzustände.
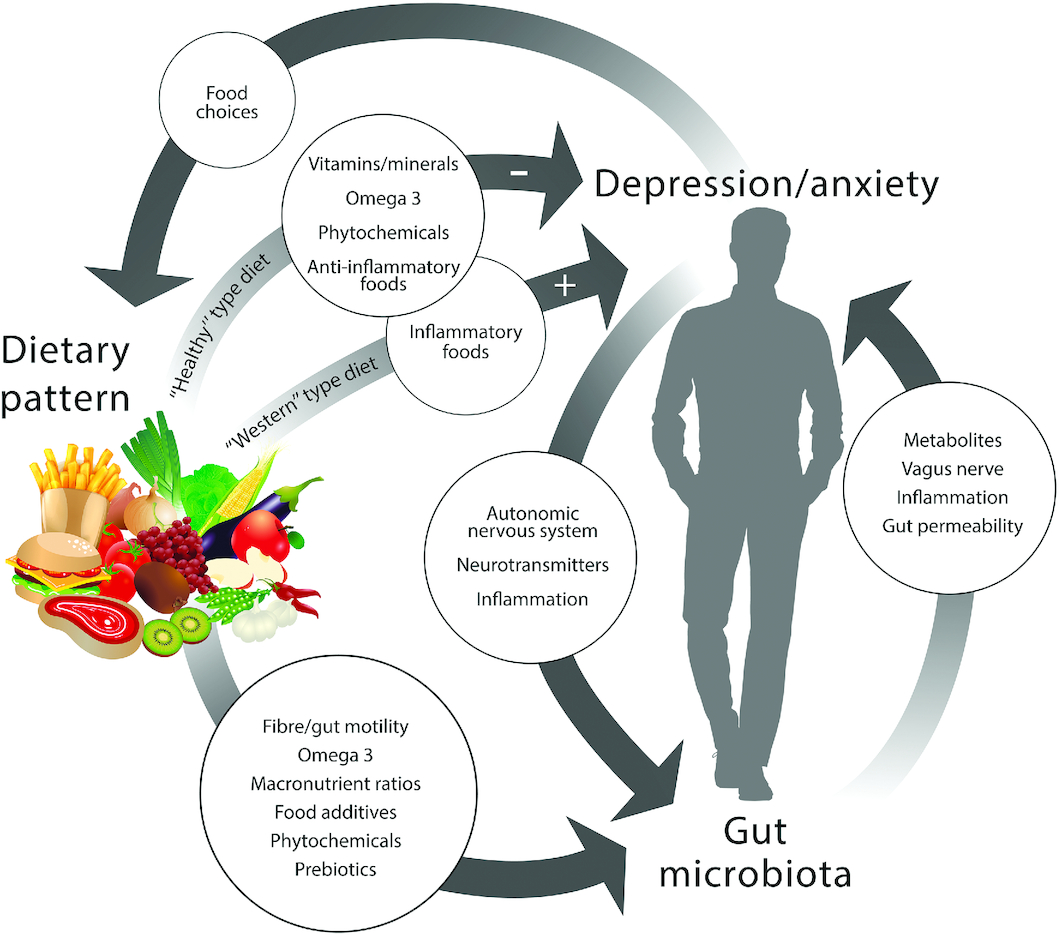
Abbildung 3: Die Auswirkung von Ernährung auf die Darm-Hirn-Achse
(Bear et al, 2020)
Fazit
Schlussendlich ist gewusst, dass die Kommunikation zwischen dem Hirn und dem Darm über die Hirn-Darm-Achse funktioniert. Eine Dysfunktion dieser Hirn-Darm-Achse über eine Veränderte Zusammensetzung der Mikroben im Darm und eine Ungeregelte Ausschüttung von Neurotransmitter kann zu harmlosen aber in manchen Fällen auch zu fatalen Erkrankungen führen. Bei diesen Problemen kann es sowohl zu psychischen als auch zu gastrointestinalen Beschwerden kommen. Einer der bestfunktionierenden Therapie ist wie bei jeder Darmkrankheit jedoch noch immer die Einstellung einer gut angepassten Ernährung.
Referenzen
Fachartikel
1. Bastiaanssen T.F.S., Cussotto S., Claesson M.J., Clarke G., Dinan T.G.,Cryan J.F.(2020): Gutted! Unraveling the Role of the Microbiome in Major Depressive Disorder. Harv Rev Psychiatry 28(1):26–39.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7012351/
2. Konturek P.C., Zopf Y. (2016): Darmmikrobiom und Psyche: der Paradigmenwechsel im Konzept der Hirn-Darm-Achse. MMW - Fortschritte der Medizin 158:12-16
https://link.springer.com/article/10.1007/s15006-016-8304-z
3. Autenrieth (2000): Die Ökologie der humanen Darmflora: physiologische und pathophysiologische Aspekte. Journal für Ernährungsmedizin; 2 (4) (Ausgabe für Österreich), 6-9
https://www.kup.at/kup/pdf/409.pdf
4. Wang H., Wang Y. (2016): Gut Microbiota-brain Axis. Chin Med J (Engl) 129(19): 2373-2380
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5040025/
5. Jandhyala S.M., Talukdar R., Subramanyam C., Vuyyuru H., Sasikala M. (2015): Role of the normal gut microbiota. World J Gastroenterol 7;21(29):8787-803.
https://www.ncbi.nlm.nih.gov/pubmed/26269668
6.Rossbach G. (2018): Gehirn und Darm – eine unbemerkte Kooperation.Glücksorgan Gehirn 89-101
https://link.springer.com/chapter/10.1007/978-3-662-57729-5_8
7. Sudo N., Chida Y., Aiba Y., Sonoda J., Oyama N., Yu X., Kubo C., Koga Y. (2004): Postnatal microbial colonization programs the hypothalamic–pituitary–adrenal system for stress response in mice. J Physiol 558(Pt 1): 263–275
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1664925/
8. Gareau M.G., Jury J., MacQueen G., Sherman P.M., Perdue M.H. (2007): Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation. Gut 56(11): 1522–1528
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2095679/
9. Goehler L.E., Park S.M., Opitz N., Lyte M., Gaykema R. (2008): Campylobacter Jejuni Infection Increases Anxiety-Like Behavior in the Holeboard: Possible Anatomical Substrates for Viscerosensory Modulation of Exploratory Behavior. Brain Behav Immun. 22(3):354-66
https://pubmed.ncbi.nlm.nih.gov/17920243/
10. Valles-Colomer M., Falony G., Darzi Y., Tigchelaar E.F., Wang J., Tito R.Y., Schiweck C., Kurilshikov A., Joossens M., Wijmenga C., Claes S., Van Oudenhove L., Zhernakova A., Vieira-Silva S., Raes J. (2019): The Neuroactive Potential of the Human Gut Microbiota in Quality of Life and Depression. Nat Microbiol 4(4):623-632
https://pubmed.ncbi.nlm.nih.gov/30718848/
11. Dinan T.G., Stanton C., Long-Smith C., Kennedy P., Cryan J.F., Cowan C.S.M., Cenit M.C., van der Kamp J.W., Sanz Y. (2019): Feeding melancholic microbes: MyNewGut recommendations on diet and mood. Clin Nutr. 38(5):1995-2001
https://www.ncbi.nlm.nih.gov/pubmed/30497694
12. Bear T.L.K., Dalziel J.E., Coad J., Roy N.C., Butts C.A., Gopal P.K.(2020): The Role of the Gut Microbiota in Dietary Interventions for Depression and Anxiety. Advances in Nutrition
https://academic.oup.com/advances/article/doi/10.1093/advances/nmaa016/5801053
13: Chassaing B., Koren O., Goodrich J., Poole A., Srinivasan S., Ley R.E., Gewirtz A.T.(2015): Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 519(7541): 92–96.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4910713/
14: Seck EH et al (2018): Salt in stools is associated with obesity, gut halophilic microbiota and Akkermansia muciniphila depletion in humans. Int J Obes (Lond). 2019;43(4):862–871. doi:10.1038/s41366-018-0201-3
Fachbücher
1. Kielholz P.(1971): Diagnose und Therapie der Depressionen für den Praktiker; J.F. Lehmanns Verlag München, 3. vollständig überarbeitete Auflage
https://books.google.de/books?hl=de&lr=&id=UQ6qBgAAQBAJ&oi=fnd&pg=PA8&dq=Depressionen+Definition&ots=GR885i45jJ&sig=PIiW__7Kp-DTirEmLxM2gRWeX8E&redir_esc=y#v=onepage&q=Depressionen%20Definition&f=false
Abbildungen
Abbildung 1: selbstangefertigtes Bild: Linda Becker
Abbildung 2: Human Studies Reporting Altered Microbial Composition in Depression
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7012351/table/T1/?report=objectonly
Abbildung 3: selbstangefertigtes Bild nach Vorlage von Bear T.L.K., Dalziel J.E., Coad J., Roy N.C., Butts C.A., Gopal P.K.(2020): The Role of the Gut Microbiota in Dietary Interventions for Depression and Anxiety. Advances in Nutrition
Tabellen Tabelle 1: selbstangefertigte Tabelle: Elisabeth Clemens
