|
Size: 26319
Comment:
|
← Revision 81 as of 2019-05-05 10:58:50 ⇥
Size: 28793
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 3: | Line 3: |
| <<TableOfContents(3)>> | |
| Line 4: | Line 5: |
| == BEVEZETÉS == Az astrocytákról egészen az 1990-es évekig úgy tartották, hogy csupán támasztó szereppel bírnak a központi idegrendszerben. Az akkoriban felfedezett kalcium nyomonkövetési technikák (calcium imaging) segítségével új funkciók váltak ismertté. Cikkünk ezek közül a gliotranszmitterek kibocsátásával és ezáltal, a szinaptikus folyamatok befolyásolásában betöltött szerepükkel foglalkozik. Bár ezen sejtek nem mutatnak elektromos ingerlékenységet, kimutatták, hogy aktív résztvevői a neurális hálózatnak. Figyelembe véve a viszonyukat az idegsejtekkel, az astrocyták nyúlványai szoros kapcsolatot létesítenek mind a pre- és postsynapticus térrel. Ezt a struktúrát nevezzük „háromoldalú szinapszisnak” (1. KÉP). 1. kép: Az astrocytáknak szoros morfológiai és funkcionális kapcsolatuk van az agyi vérerekkel és a neuronokkal (“háromoldalú szinapszis”). A kép az astrocyták helyzetét ábrázolja a vérerek és a neuronok körül a központi idegrendszerben. Egy astrocyta több vérérrel és neuronnal létesít kapcsolatot a nagy számú nyúlványaikkal. |
== Bevezetés == Az [[https://hu.wikipedia.org/wiki/Idegsejt#Astrocyták|asztrocitákról]] egészen az 1990-es évekig úgy tartották, hogy csupán támasztó szereppel bírnak a központi idegrendszerben. Az akkoriban felfedezett kalcium nyomkövetési technikák ([[https://en.wikipedia.org/wiki/Calcium_imaging|calcium imaging]]) segítségével új funkciók váltak ismertté. Cikkünk ezek közül a gliotransmitterek kibocsátásával, és ezáltal a szinaptikus folyamatok befolyásolásában betöltött szerepükkel foglalkozik. Bár ezen sejtek nem mutatnak elektromos ingerlékenységet, kimutatták, hogy aktív résztvevői a neurális hálózatnak. Figyelembe véve a viszonyukat az idegsejtekkel, az asztrociták nyúlványai szoros kapcsolatot létesítenek mind a pre- és posztszinaptikus térrel ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). Ezt a struktúrát nevezzük „háromoldalú szinapszisnak” (1. ábra). ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em;"> {{attachment:ábra1.png|ábra1.png|width="600"}} || ||'''1. ábra: '''''Az asztrocitáknak szoros morfológiai és funkcionális kapcsolatuk van az agyi vérerekkel és a neuronokkal (“háromoldalú szinapszis”). A kép az asztrociták helyzetét ábrázolja a vérerek és a neuronok körül a központi idegrendszerben. Egy asztrocita több vérérrel és neuronnal létesít kapcsolatot a nagy számú nyúlványaikkal.'' || |
| Line 7: | Line 10: |
| Az astrocyták képesek a neurotranszmitterekre válaszolni, és hozzájárulnak az ingerület tovaterjedéséhez bizonyos kémiai ingerületátvivő anyagok, gliotranszmitterek segítségével. Két fő technikai áttörés született, amelyek segítségével érthetővé vált az astrocyták működési mechanizmusa: az egyre korszerűbb mikroszkópok, illetve a már említett kalcium nyomonkövetési technikák. A kezdeti felfedezések kémiai kalcium indikátorok felhasználásával történtek, így mutatkozott meg az astrocytákban a növekvő intracelluláris kalcium koncentráció, ami átterjed a szomszédos astrocytákra. Ezen jelenség neve: kalcium hullám. A genetikailag kódolt kalcium indikátorok lehetővé tették az astrocyta funkciók még részletesebb analízisét. Ezeknek a kísérleti áttöréseknek hála bizonyosodott be, hogy az inozitol-1,4,5-triszfoszfát (IP3) mediálta kalcium kiáramlás az endoplazmatikus retikulumból intracelluláris kalcium –ion koncentrációnövekedést okoz az adott astrocytában. Ez eredményezi a szomszédos astrocyták és neuronok fokozott gliotranszmitter kibocsátását (Kazuki és mtsai, 2016). | |
| Line 9: | Line 11: |
| == GLIOTRANSZMITTEREK == Az astrocyták három fő gliotranszmittert adnak le; glutamát, D-szerin és ATP, melyek a neuronokon található specifikus receptorukhoz kötődve modulálják azok tüzelési frekvenciáját és/vagy a szinaptikus transzmissziót. (2. Kép) Ezek sokszínű hatása nagyban függ a speciális idegi környezettől. (Kazuki és mtsai, 2016) |
|
| Line 12: | Line 12: |
| 2. Kép: Sematikus ábra mutatja a neuro- és gliotransmitterek által mediált „háromoldalú” szinapszist és a komplex jelátadó interakciót. A Neurotransmitterek, mint a glutamát, a preszinaptikus terminálisból ürülnek, ezek azonban nem csak a posztszinapszisokon hatnak, hanem az astrocytákon is. Az aktivált astrocyták gliotranszmittereket (glutamát, D-szerin, ATP) ürítenek vezikuláris exocitózissal, de létrejöhetnek connexonok is az ATP számára. A kiürített gliotransmitter kapcsolódik mind a preszinaptikus és mind a posztszinaptikus receptorokhoz. Így regulálják a szinaptikus transzmissziót. Az astrocyták részt vesznek ezen felül a glutamát transzporton keresztül az extracelluláris glutamát klírenszében. | Az asztrociták képesek a neurotransmitterekre válaszolni, és hozzájárulnak az ingerület tovaterjedéséhez bizonyos kémiai ingerületátvivő anyagok, gliotransmitterek segítségével. Két fő technikai áttörés született, amelyek segítségével érthetővé vált az asztrociták működési mechanizmusa: az egyre korszerűbb mikroszkópok, illetve a már említett kalcium nyomkövetési technikák. A kezdeti felfedezések kémiai kalcium indikátorok felhasználásával történtek, így mutatkozott meg az asztrocitákban a növekvő intracelluláris kalcium koncentráció, ami átterjed a szomszédos asztrocitákra. Ezen jelenség neve: kalcium hullám. A genetikailag kódolt kalcium indikátorok lehetővé tették az asztrocita funkciók még részletesebb analízisét. Ezeknek a kísérleti áttöréseknek hála bizonyosodott be, hogy az inozitol-1,4,5-triszfoszfát (IP3) mediálta kalcium kiáramlás az endoplazmatikus retikulumból intracelluláris kalcium-ion koncentrációnövekedést okoz az adott asztrocitában. Ez eredményezi a szomszédos asztrociták és neuronok fokozott gliotransmitter kibocsátását ([[https://www.ncbi.nlm.nih.gov/pubmed/17207662|Halassa és mtsai, 2007]]). == Gliotransmitterek == Az asztrociták három fő gliotransmittert adnak le; glutamát, D-szerin és ATP, melyek a neuronokon található specifikus receptorukhoz kötődve modulálják azok tüzelési frekvenciáját és/vagy a szinaptikus transzmissziót (2. ábra). Ezek sokszínű hatása nagyban függ a speciális idegi környezettől ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em;"> {{attachment:ábra2.png|ábra2.png|width="600"}} || ||'''2. ábra:''' ''Sematikus ábra mutatja a neuro- és gliotransmitterek által mediált „háromoldalú szinapszist" és a komplex jelátadó interakciót. A neurotransmitterek, mint a glutamát, a preszinaptikus terminálisból ürülnek, ezek azonban nem csak a posztszinapszisokon hatnak, hanem az asztrocitákon is. Az aktivált asztrociták gliotransmittereket (glutamát, D-szerin, ATP) ürítenek vezikuláris exocitózissal, de létrejöhetnek [[https://en.wikipedia.org/wiki/Connexon|connexonok]] is az ATP számára. A kiürített gliotransmitter kapcsolódik mind a preszinaptikus, mind a posztszinaptikus receptorokhoz. Így regulálják a szinaptikus transzmissziót. Az asztrociták részt vesznek ezen felül a glutamát transzporton keresztül az extracelluláris glutamát klírenszében.'' || |
| Line 15: | Line 24: |
| Bár az ATP a sejtek elsődleges energia forrása, jelzőmolekulaként is működik a purinerg receptorokon keresztül. Egy újabb tanulmány kimutatta, hogy az astrocitákból tenyésztett tápközeg, amely Ca2 + hullámokat mutat, több ATP-t tartalmaz, mint a kontroll táptalaj. Érdekes módon az összegyűjtött tenyésztőközeg hozzáadása az asztrocitákhoz Ca2 + -hullámokat indukált, amelyeket a purinerg receptor antagonisták gátoltak. Így az asztrocitákból felszabaduló ATP Ca2 + hullámokat indukál, így az asztrociták egymással kommunikálnak. Az ATP felszabadulás mechanizmusai azonban továbbra is ellentmondásosak; a vizsgálat különböző asztrociták ATP-felszabadulásának feltételezett modelljeit javasolta. | Bár az ATP a sejtek elsődleges energiaforrása, jelzőmolekulaként is működik a [[https://en.wikipedia.org/wiki/Purinergic_receptor|purinerg receptorokon]] keresztül. Egy újabb tanulmány kimutatta, hogy az asztrocitákból tenyésztett tápközeg, amely kalcium-hullámokat mutat, több ATP-t tartalmaz, mint a kontroll táptalaj. Érdekes módon az összegyűjtött tenyésztőközeg hozzáadása az asztrocitákhoz kalcium-hullámokat indukált, amelyeket a purinerg receptor antagonisták gátoltak. Így az asztrocitákból felszabaduló ATP kalcium-hullámokat indukál, s az asztrociták egymással kommunikálnak. Az ATP felszabadulás mechanizmusai azonban továbbra is ellentmondásosak; a vizsgálat különböző asztrociták ATP felszabadulásának feltételezett modelljeit javasolta ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5031785/|Koizumi, 2010]]). |
| Line 17: | Line 26: |
| A Connexin 43 (Cx43) egy hemichannelbe épített átjáró, amely az astrocitákban réscsatlakozásokat képez, és a szomszédos asztrociták között jelző molekulákat, köztük Ca2 + és inozitol-1,4,5-triszfoszfátot cserél. Az ATP biolumineszcenciás képalkotása egycsatornás felvételekkel kombinálva azt mutatta, hogy a Cx43 hemichannelek a patkány glioma C6 sejtekben és a CA1 hippokampális asztrocitákban átjárhatók az ATP-re. Ezzel a megállapítással összhangban, a glutamát [Ca2 +] i növekedést okoz a hippokampális asztrocitákban, és ATP felszabadulást idézett elő, melyeket hemichannel blokkoló és Cx43 / Cx30 knockout egerek alkalmazásával gátoltak, ami arra utal, hogy az ATP extracellulárisan szabadul fel a Cx43 hemichanneleken keresztül. (Kazuki és mtsai, 2016) A dnSNARE egérmodellt széles körben alkalmazták az asztrociták ATP felszabadulásának vizsgálatára. A modellt használó számos tanulmányban az ATP-kibocsátás általában csökkent, de az időbeli információ nehezen szerezhető meg. A közelmúltban végzett vizsgálat azonban az astrocitikus ATP exocitózisát észlelte közvetlenül a kéregben, a kvantikus felszabadulás megfigyelésével a P2X4 neuronális receptorokon. Az ATP felszabadulást több száz milliszekundumban detektálták, az asztrocitás aktiválásból és a megfelelő Ca2 + növekedésből. Az észlelt ATP eseményeket kvantitatívan osztották fel, ami arra utal, hogy egy tárolórekesz érintett. (Daniela és mtsai, 2014) | A Connexin 43 (Cx43) egy hemichannelbe épített átjáró, amely az asztrocitákban réskapcsolatokat képez és a szomszédos asztrociták között jelző molekulákat, köztük kalcium-iont és inozitol-1,4,5-triszfoszfátot cserél. Az ATP biolumineszcenciás képalkotása egycsatornás felvételekkel kombinálva azt mutatta, hogy a Cx43 hemichannelek a patkány glioma C6 sejtekben és a CA1 hippokampális asztrocitákban átjárhatók az ATP-re nézve. Ezzel a megállapítással összhangban, a glutamát intracelluláris kalcium-ion koncentráció növekedést okoz a hippokampális asztrocitákban, és ATP felszabadulást idézett elő, melyeket hemichannel blokkoló és Cx43 / Cx30 [[https://en.wikipedia.org/wiki/Knockout_mouse|knockout egerek]] alkalmazásával gátoltak, ami arra utal, hogy az ATP extracellulárisan szabadul fel a Cx43 hemichanneleken keresztül ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). A dnSNARE egérmodellt széles körben alkalmazták az asztrociták ATP felszabadulásának vizsgálatára. A modellt használó számos tanulmányban az ATP-kibocsátás általában csökkent, de az időbeli információ nehezen szerezhető meg. A közelmúltban végzett vizsgálat azonban az asztrocitikus ATP exocitózisát észlelte közvetlenül a kéregben, a kvantikus felszabadulás megfigyelésével a P2X4 (purinerg receptor) neuronális receptorokon. Az ATP felszabadulást több száz milliszekundumban detektálták, az asztrocitás aktiválásból és a megfelelő kalcium növekedésből. Az észlelt ATP eseményeket kvantitatívan osztották fel, ami arra utal, hogy egy tárolórekesz érintett ([[https://www.ncbi.nlm.nih.gov/pubmed/24409095|Lalo és mtsai, 2014]]). |
| Line 19: | Line 28: |
| Néhány tanulmány azonban kimutatta, hogy az asztrocyták szekréciós lizoszómáiból ATP szabadul fel. Valójában az elsődlegesen tenyésztett asztrociták expresszálnak egy szekréciós lizoszóma markert, amit vezikulummal társított membránfehérje-7-nek (vagy TI-VAMP) neveznek. A TI-VAMP-pozitív szekréciós lizoszómák ATP-t tartalmaznak, amely Ca2 + -függetlenül szabadulnak fel. Az elsődlegesen tenyésztett asztrocitákat és C6-sejteket alkalmazó kísérletben a vezikuláris nukleotid transzporter (VNUT) -pozitív lizoszómákat fluoreszcens ATP-vel jelöltük, és a VNUT inhibitor alkalmazása csökkentette a fluoreszcens ATP-tartalmú vezikulumok számát. A teljes belső reflexiós fluoreszcencia mikroszkópiával végzett megfigyelés kimutatta, hogy a sejtekben a szekréciós lizoszómák exocitotikus eseményei kalciumionoforok és ATP, illetve glutamát alkalmazása után következtek be. Így az ATP lizoszómákban tárolodik, és Ca2 + -függő módon szabadul fel. (Kazuki és mtsai, 2016) | Néhány tanulmány azonban kimutatta, hogy az asztrociták szekréciós lizoszómáiból ATP szabadul fel. Valójában az elsődlegesen tenyésztett asztrociták expresszálnak egy szekréciós lizoszóma markert, amit vezikulummal társított membránfehérje-7-nek (vagy TI-VAMP) neveznek. A TI-VAMP-pozitív szekréciós lizoszómák ATP-t tartalmaznak, amely kalcium-függetlenül szabadulnak fel. Az elsődlegesen tenyésztett asztrocitákat és C6-sejteket alkalmazó kísérletben a vezikuláris nukleotid transzporter (VNUT) pozitív lizoszómákat fluoreszcens ATP-vel jelöltük, és a VNUT inhibitor alkalmazása csökkentette a fluoreszcens ATP-tartalmú vezikulumok számát. A teljes belső reflexiós fluoreszcens mikroszkópiával végzett megfigyelés kimutatta, hogy a sejtekben a szekréciós lizoszómák exocitotikus eseményei kalcium ionoforok és ATP, illetve glutamát alkalmazása után következtek be. Így az ATP lizoszómákban tárolodik, és kalcium-függő módon szabadul fel ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). |
| Line 21: | Line 30: |
| === GLUTAMÁT === Bár a glutamát neurotranszmitterként ismert, gliotranszmitterként is működik. A bradykinin alkalmazása tenyésztett asztrocitákra glutamát felszabadulást indukál, és a szomszédos neuronokat N-metil-D-aszpartát (NMDA) receptorokon keresztül befolyásolja. Ezzel ellentétben a clostridium, tetanusz és botulinum neurotoxinok alkalmazása, amelyek differenciálisan hasítják az exocitózist szabályozó oldható N-etil-maleimid-érzékeny faktor kötő fehérje receptor (SNARE) fehérjéket, csökkenti a Ca2 + -függő glutamát felszabadulást. Ezek az eredmények arra utalnak, hogy a SNARE fehérjék, beleértve a vezikulummal kapcsolatos membránfehérje-2 (VAMP2), a szintaxin-1 és a szinaptoszóma-társított fehérje-23, közvetítik a Ca2 + -függő glutamát felszabadulást. |
=== Glutamát === Bár a glutamát neurotransmitterként ismert, gliotransmitterként is működik. A bradykinin alkalmazása tenyésztett asztrocitákra glutamát felszabadulást indukál, és a szomszédos neuronokat N-metil-D-aszpartát ([[https://en.wikipedia.org/wiki/NMDA_receptor|NMDA]]) receptorokon keresztül befolyásolja. Ezzel ellentétben a clostridium, tetanusz és botulinum neurotoxinok alkalmazása, amelyek differenciálisan hasítják az exocitózist szabályozó oldható N-etil-maleimid-érzékeny faktor kötő fehérje receptor (SNARE) fehérjéket, csökkenti a kalcium-függő glutamát felszabadulást. Ezek az eredmények arra utalnak, hogy a [[https://en.wikipedia.org/wiki/SNARE_(protein)|SNARE fehérjék]], beleértve a vezikulummal kapcsolatos membránfehérje-2 ([[https://en.wikipedia.org/wiki/VAMP2|VAMP2]]), a szintaxin-1 és a szinaptoszóma-társított fehérje-23, közvetítik a kalcium-függő glutamát felszabadulást ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). |
| Line 24: | Line 33: |
| A citoplazmatikus glutamát exocytotikus vezikulumokba történő felvételét a vezikuláris glutamát transzporterek (VGLUT) közvetítik, amelyeket a vakuolar típusú H + ATPázok (V-ATPázok) irányítanak. A V-ATPázok gátlása blokkolja a Ca2 + -függő glutamát felszabadulást. Továbbá, a VGLUT1 és 2 szinaptikus jellegű vezikulákkal van kolokalizálva, ami arra utal, hogy a glutamát szinaptikus jellegű vezikulákba van csomagolva és Ca2 + -függő módon szabadul fel az asztrocitáktól. | A citoplazmatikus glutamát exocytotikus vezikulumokba történő felvételét a vezikuláris glutamát transzporterek ([[https://en.wikipedia.org/wiki/Glutamate_transporter#VGLUTs|VGLUT]]) közvetítik, amelyeket a vakuolar típusú H + ATPázok (V-ATPázok) irányítanak. A V-ATPázok gátlása blokkolja a kalcium-függő glutamát felszabadulást. Továbbá, a VGLUT1 és 2 szinaptikus jellegű vezikulákkal van kolokalizálva, ami arra utal, hogy a glutamát szinaptikus jellegű vezikulákba van csomagolva és kalcium-függő módon szabadul fel az asztrocitáktól ([[https://www.ncbi.nlm.nih.gov/pubmed/15156145|Bezzi és mtsai, 2004]]). |
| Line 26: | Line 35: |
| Eközben más kibocsátási mechanizmusokat is azonosítottak: a plazmamembrán glutamát transzporterek fordított működése; sejtduzzadás által indukált anion transzporter nyitás; felszabadulás P2X7 receptorokon keresztül; az astrociták sejtfelületén lévő réscsatlakozó csatornák (azaz hemichannelek). Azonban nem világos, hogy az astrociták milyen gyakran és milyen mértékben alkalmazzák ezeket a különböző mechanizmusokat. További vizsgálatokra lesz szükség annak tisztázása érdekében, hogy vannak-e különleges kibocsátási mechanizmusok, amelyek bizonyos körülmények között működnek. (Kazuki és mtsai, 2016) A glutamát felszabadulásának tanulmányozásának egyik módja a vesicularis glutamát transzporterek (vGluts) jelenlétére és működésére koncentrál. A jelenleg rendelkezésre álló vGlut antagonisták (például Evans Blue és Rose Bengal) gyengén szelektívek. Mindazonáltal, ezeknek az anyagoknak a szövetekben végzett kísérletei érdekes eredményeket hoztak. Az asztrociták infúziója Evans Blue-val megszüntette a tüskés időfüggő hosszú távú depressziót (LTD) a közeli szinapszisokban a kéregben. Ugyanez a hatás érhető el az astrociták „Ca2 + szorítóval” vagy TeNTLC-vel való alkalmazásával. Mindezek az eredmények összhangban vannak az asztrocita felszabadulás vezikuláris jellegével, legalábbis ebben a készítményben. | Eközben más kibocsátási mechanizmusokat is azonosítottak: a plazmamembrán glutamát transzporterek fordított működése; sejtduzzadás által indukált anion transzporter nyitás; felszabadulás P2X7 receptorokon keresztül; az asztrociták sejtfelületén lévő réscsatlakozó csatornák, hemichannelek. Azonban még nem világos, hogy az asztrociták milyen gyakran és milyen mértékben alkalmazzák ezeket a különböző mechanizmusokat. További vizsgálatokra lesz szükség annak tisztázása érdekében, hogy vannak-e különleges kibocsátási mechanizmusok, amelyek bizonyos körülmények között működnek ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). A glutamát felszabadulás tanulmányozásának egyik módja a vezikuláris glutamát transzporterek (vGluts) jelenlétére és működésére koncentrál. A jelenleg rendelkezésre álló vGlut antagonisták (például Evans Blue és Rose Bengal) gyengén szelektívek. Mindazonáltal, ezeknek az anyagoknak a szövetekben végzett kísérletei érdekes eredményeket hoztak. Az asztrociták infúziója Evans Blue-val megszüntette a tüskés időfüggő hosszú távú depressziót (LTD) a közeli szinapszisokban a kéregben. Ugyanez a hatás érhető el az asztrociták „kalcium szorítóval” vagy TeNTLC-vel való alkalmazásával. Mindezek az eredmények összhangban vannak az asztrocita felszabadulás vezikuláris jellegével, legalábbis ebben a készítményben ([[https://www.ncbi.nlm.nih.gov/pubmed/17310248|Jourdain és mtsai, 2007]]). |
| Line 28: | Line 37: |
| A hippokampális dentát girusban az astrocitákból származó glutamát-felszabadulás kimutatta, hogy aktiválja a pre-szinaptikus NMDAR-kat, és ezáltal növeli a transzmitterek kibocsátási valószínűségét a közeli granuláris sejt szinapszisokban. Az asztrocitákat elektromosan stimulálták, és a szinaptikus felszabadulás változásait (például a miniatűr (m) EPSC frekvencia változásait) figyelték meg. A szinaptikus felszabadulás valószínűségének növekedése az asztrocitás stimuláció után másodperceken belül megtörtént. Infúzióval előzetesen blokkolták az astrocitákat Ca2 + kelátképző BAPTA-val vagy TeNTLC-vel. Mivel az asztrociták által kiváltott szinaptikus hatás gyors, és Ca2 + és SNARE függő, arra a következtetésre jutottak, hogy a glutamátot a szabályozott exocitózis szabadította fel ebben a rendszerben. Hasonlóképpen az astrocitás glutamát neuronális felszabadulásának gyors (kb. 10 s) modulációját észleltük az éretlen GABAerg szinapszisokban. (Daniela és mtsai, 2014) | A hippokampális dentát gyrusban az asztrocitákból származó glutamát-felszabadulás kimutatta, hogy aktiválja a preszinaptikus NMDAR-kat, és ezáltal növeli a transzmitterek kibocsátási valószínűségét a közeli granuláris sejt szinapszisokban. Az asztrocitákat elektromosan stimulálták és a szinaptikus felszabadulás változásait (például a miniatűr (m) EPSC frekvencia változásait) figyelték meg. A szinaptikus felszabadulás valószínűségének növekedése az asztrocitás stimuláció után másodperceken belül megtörtént. Infúzióval előzetesen blokkolták az asztrocitákat kalcium kelátképző [[https://en.wikipedia.org/wiki/BAPTA|BAPTA]]-val vagy TeNTLC-vel. Mivel az asztrociták által kiváltott szinaptikus hatás gyors, és kalcium és SNARE függő, arra a következtetésre jutottak, hogy a glutamátot a szabályozott exocitózis szabadította fel ebben a rendszerben. Hasonlóképpen az asztrocitás glutamát neuronális felszabadulásának gyors (kb. 10 s) modulációja volt észlelhető az éretlen GABAerg szinapszisokban ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4173278/|Sahlender és mtsai, 2014]]). |
| Line 30: | Line 39: |
| === D-SZERIN === A D-szerin gliotranszmitterként való felfedezése áttörés volt, mert régóta gondolták, hogy az emlősszövetek csak az aminosavak L-izomerjeit termelik. Tenyésztett asztrocitákban a glutamát fokozta a D-szerin Ca2 + -függő szekrécióját az a-amino-3-hidroxi-5-metil-4-izoxazolepropionsav (AMPA) / kainát receptorok (AMPA / KARs) és metabotróp glutamát receptorokon. Ennek megfelelően az AMPA / KAR és a metabotróp glutamát receptorok agonistái megnövelik a [Ca2 +] i-t, valamint a D-szerin ezt követő szekrécióját. Továbbá, a tetanusz neurotoxinok és a V-ATPáz inhibitorok elnyomják a D-szerin és a VAMP2 / 3 és a VGLUT2 tartalmú vezikulumok agonista által kiváltott szekrécióját, amelyek D-szerinnel kolokalizáltak. Ezek az eredmények arra utalnak, hogy a D-szerin a szinaptikus jellegű vezikulákban tárolódik és Ca2 + -függő módon felszabadul a vezikulákból. (Kazuki és mtsai, 2016) Kimutatták, hogy a hippocampus CA1 régiójában található asztrocitákból származó d-szerin felszabadulása fontos a hosszú távú potencírozáshoz (LTP) a Schaffer kollaterális - piramissejtes szinapszisokban. A kísérletek azt mutatták, hogy az LTP ezt a formáját az astrociták TeNTLC vagy „Ca2 + clamp” oldat szelektív infúziója megszakítja. Fontos megjegyezni, hogy a d-szerin termelés blokkolásával, az astrocita belsejében a szerin racemace inhibitor HOAsp-vel kimutatták, hogy a d-szerin mindazonáltal hosszabb ideig tárolható egy feltételezett asztrocitás rekeszben. Ezen túlmenően ez a d-szerin-medence a stimuláció előtti kísérletekben kimerült, ami az LTP eltörlését eredményezte. Ezek a megfigyelések támogatják a vezikulumot, mint az astrocitákból származó d-szerin felszabadulásának csatorna-közvetített módját az LTP indukció során. (Daniela és mtsai, 2014) |
=== D-szerin === A D-szerin gliotransmitterként való felfedezése áttörés volt, mert régóta gondolták, hogy az emlősszövetek csak az aminosavak L-izomerjeit termelik. Tenyésztett asztrocitákban a glutamát fokozta a D-szerin kalcium-függő szekrécióját az a-amino-3-hidroxi-5-metil-4-izoxazolepropionsav (AMPA) / kainát receptorok (AMPA / KARs) és metabotróp glutamát receptorokon. Ennek megfelelően az AMPA / KAR és a metabotróp glutamát receptorok agonistái megnövelik az intracelluláris kalcium-ion koncentrációt, valamint a D-szerin ezt követő szekrécióját. Továbbá a tetanusz neurotoxinok és a V-ATPáz inhibitorok elnyomják a D-szerin és a VAMP2 / 3 és a VGLUT2 tartalmú vezikulumok agonista által kiváltott szekrécióját, amelyek D-szerinnel kolokalizáltak. Ezek az eredmények arra utalnak, hogy a D-szerin a szinaptikus jellegű vezikulákban tárolódik és kalcium-függő módon felszabadul a vezikulákból ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). |
| Line 33: | Line 42: |
| (Esetleg szerkezeti képletek) | Kimutatták, hogy a hippocampus CA1 régiójában található asztrocitákból származó D-szerin felszabadulása fontos a hosszú távú potencírozáshoz ([[https://en.wikipedia.org/wiki/Long-term_potentiation|LTP]]) a Schaffer kollaterális-piramissejtes szinapszisokban. A kísérletek azt mutatták, hogy az LTP ezt a formáját az asztrociták TeNTLC vagy „calcium clamp” oldat szelektív infúziója megszakítja. Fontos megjegyezni, hogy a D-szerin termelés blokkolásával, az asztrocita belsejében a szerin racemáz enzim inhibitor HOAsp-vel kimutatták, hogy a D-szerin mindazonáltal hosszabb ideig tárolható egy feltételezett asztrocitás rekeszben. Ezen túlmenően ez a D-szerin-medence a stimuláció előtti kísérletekben kimerült, ami az LTP eltörlését eredményezte. Ezek a megfigyelések támogatják a vezikulumot, mint az asztrocitákból származó D-szerin felszabadulásának csatorna-közvetített módját az LTP indukció során ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4173278/|Sahlender és mtsai, 2014]]). |
| Line 35: | Line 44: |
| == GLIOTRANSZMITTEREK LEADÁSA == Az astrocyta- neuron jelátvitel sokszínűsége az astrocyták összetett potenciálszabályozó képességén alapszik. Az astrocyták egyik fontos jellemzője, hogy a különböző neurotranszmitterek nem ugyanolyan hatékonysággal bírnak a gliotransmitterek kibocsátására. Kimutatták, hogy két különböző receptor – a proteáz-aktivált receptor 1 (PAR1) és a purinerg receptor (P2Y1) - aktivációja a hippocampális astrocytákban hasonlóan emeli azok kálcium szintjét. A PAR1 receptor stimulációja hosszabb ideig tartó kalciumszint emelkedést idéz elő. Ugyanakkor csak a PAR1 receptor aktivációja eredményez gliotranszmitter kibocsátást, amely történhet vezikuláris és nem vezikuláris úton. Az, hogy a gliotranszmitter leadásért sejtes és molekuláris mechanizmusok felelősek nagyban vitatott. Egy, az eukarióta sejtek által használt általános mechanizmus alapja, hogy a gliotranszmitterek vezikuláris úton az extracelluláris térbe transzportálódnak, amely SNARE fehérje függő, szabályozott folyamat. Következtetésképpen megállapítható, hogy a gliotranszmitterek felszabadulása az astrocytákból kalcium és SNARE fehérje függő. Ezen fehérje függő folyamat is sokféle lehet a gliotranszmitterek leadásának mechanizmusát tekintve. Az astrocytákban két különálló vezikuláris SNARE függő felszabadítási útvonal ismert. Abban az esetben, ha a vezikula glutamátot tartalmaz, felületén synaptobrevin II (sybII)/VAMP2 foglal helyet, ha NPY-t tartalmaz, akkor cellubrevin (ceb)/VAMP3. (3. kép) Az astrocyták glutamát neurotranszmitterrel történő stimulációja esetén az NPY tartalmú vezikulumok exocitózisa történik meg. Ennek feltétele a mGluR5 aktivációja és a ceb jelenléte. Ha az astrocytákat mGluR1 antagonista DHPG (dihidroxi-fenilglicin) stimuláció éri, a glutamát tartalmú vezikulák ürülése figyelhető meg. Ez a sybII jelenlététől függ. (Durkee és Araque, 2019) 3. kép: Precíz intracelluláris szerkezet vesz részt a glutamát, D-szerin és ATP astrocytákból való ürítésében. A glutamát és a D-szerin vezikuláris transzporttal kerül felvételre (1) VGLUT-on keresztül és (2) vezikuláris D-szerin transzporterekkel (VSERT) külön-külön. Ezek a vezikulák fuzionálnak a plazma membránnal a SNARE fehérjék (VAMP2 vagy VAMP3) által mediáltan. Ezen fehérjék felelősek az intracelluláris kalcium-ion koncentráció növekedéséért. Ezzel szemben az ATP szekretoros lizoszómákkal ürül. Az ATP lizoszómába történő raktározásáéert (3) a VNUT felelős. A SNARE fehérjék, köztük a TI-VAMP kölcsönhatása révén az ATP-tartalmú szekréciós lizoszómák kalcium-ion függvényében exocitózisra kerülnek. Emellett felfedezték a többi felszabadulási mechanizmus létezését is: (4) a plazma membrán glutamát transzporterek fordított működését, (5) a sejt-duzzanat által kiváltott anion transzporter (VRAC) nyílását, (6) P2X7 receptorokon keresztüli felszabadulást, és (7) a gap junction csatornákat (hemichannelek) az astrocyták sejtfelületén. |
== Gliotransmitterek leadása == Az asztrocita- neuron jelátvitel sokszínűsége az asztrociták összetett potenciálszabályozó képességén alapszik. Az asztrociták egyik fontos jellemzője, hogy a különböző neurotransmitterek nem ugyanolyan hatékonysággal bírnak a gliotransmitterek kibocsátására. Kimutatták, hogy két különböző receptor – a proteáz-aktivált receptor 1 ([[https://en.wikipedia.org/wiki/Protease-activated_receptor|PAR1]]) és a purinerg receptor (P2Y1) - aktivációja a hippocampális asztrocitákban hasonlóan emeli azok kalcium szintjét. A PAR1 receptor stimulációja hosszabb ideig tartó kalciumszint emelkedést idéz elő. Ugyanakkor csak a PAR1 receptor aktivációja eredményez gliotransmitter kibocsátást, amely történhet vezikuláris és nem vezikuláris úton. Az, hogy a gliotransmitter leadásért sejtes és molekuláris mechanizmusok felelősek nagyban vitatott. Egy, az eukarióta sejtek által használt általános mechanizmus alapja, hogy a gliotransmitterek vezikuláris úton az extracelluláris térbe transzportálódnak, amely SNARE fehérje függő, szabályozott folyamat. Következtetésképpen megállapítható, hogy a gliotransmitterek felszabadulása az asztrocitákból kalcium és SNARE fehérje függő. Ezen fehérje függő folyamat is sokféle lehet a gliotransmitterek leadásának mechanizmusát tekintve (3. ábra). Az asztrocitákban két különálló vezikuláris SNARE függő felszabadítási útvonal ismert. Abban az esetben, ha a vezikula glutamátot tartalmaz, felületén [[https://en.wikipedia.org/wiki/VAMP2|synaptobrevin II (sybII)/VAMP2]] foglal helyet, ha [[https://en.wikipedia.org/wiki/Neuropeptide_Y|NPY]]-t tartalmaz, akkor [[https://en.wikipedia.org/wiki/VAMP3|cellubrevin (ceb)/VAMP3]]. Az asztrociták glutamát neurotransmitterrel történő stimulációja esetén az NPY tartalmú vezikulumok exocitózisa történik meg. Ennek feltétele a mGluR5 aktivációja és a ceb jelenléte. Ha az asztrocitákat mGluR1 antagonista DHPG (dihidroxi-fenilglicin) stimuláció éri, a glutamát tartalmú vezikulák ürülése figyelhető meg. Ez a sybII jelenlététől függ ([[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee és Araque, 2019]]). ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em;"> {{attachment:ábra3.png|ábra3.png|width="600"}} || ||'''3. ábra:''' ''Precíz intracelluláris szerkezet vesz részt a glutamát, D-szerin és ATP asztrocitákból való ürítésében. A glutamát és a D-szerin vezikuláris transzporttal kerül felvételre (1) VGLUT-on keresztül és (2) vezikuláris D-szerin transzporterekkel (VSERT) külön-külön. Ezek a vezikulák fuzionálnak a plazma membránnal a SNARE fehérjék (VAMP2 vagy VAMP3) által mediáltan. Ezen fehérjék felelősek az intracelluláris kalcium-ion koncentráció növekedéséért. Ezzel szemben az ATP szekretoros lizoszómákkal ürül. Az ATP lizoszómába történő raktározásáért (3) a VNUT felelős. A SNARE fehérjék, köztük a TI-VAMP kölcsönhatása révén az ATP-tartalmú szekréciós lizoszómák kalcium-ion függvényében exocitózisra kerülnek. Emellett felfedezték a többi felszabadulási mechanizmus létezését is: (4) a plazma membrán glutamát transzporterek fordított működését, (5) a sejt-duzzanat által kiváltott anion transzporter (VRAC) nyílását, (6) P2X7 receptorokon keresztüli felszabadulást, és (7) a gap junction csatornákat (hemichannelek) az asztrociták sejtfelületén.'' || |
| Line 38: | Line 49: |
| 3. kép: Sematikus ábra mutatja a neuro- és gliotransmitterek által mediált „háromoldalú” szinapszist és a komplex jelátadó interakciót. A Neurotransmitterek, mint a glutamát, a preszinaptikus terminálisból ürülnek, ezek azonban nem csak a posztszinapszisokon hatnak, hanem az astrocytákon is. Az aktivált astrocyták gliotranszmittereket (glutamát, D-szerin, ATP) ürítenek vezikuláris exocitózissal, de létrejöhetnek connexonok is az ATP számára. A kiürített gliotransmitter kapcsolódik mind a preszinaptikus és mind a posztszinaptikus receptorokhoz. Így regulálják a szinaptikus transzmissziót. Az astrocyták részt vesznek ezen felül a glutamát transzporton keresztül az extracelluláris glutamát klírenszében. | |
| Line 41: | Line 53: |
| A már említett kalciumkoncentráció változás térbeli és időbeli tulajdonságai különböző modulációs hatásokkal befolyásolhatják a neuronális és szinaptikus aktivitást. Például az astrocyták szabályozó hatása korlátozódhat csak egy kis funkcionális részre, ha a szinaptikus átvitel egy bizonyos szint alatt marad. A szinaptikus aktivitás növekedése (vagy többszörös szinapszisok aktivációja) esetén az astrocytában található intracelluláris kalciumszint növekedés, -amely kezdetben csak kis részre korlátozódott-, a helyi alosztályon túl egy másik folyamatra és végül az egész sejtre tovaterjed. Az astrocyta kalciumszintjében fellépő változások térbeli terjedését a különböző neurotranszmitter jelátviteli utak szinaptikus inputjának térbeli és időbeli integrációja befolyásolja. Ezenkívül kontrollálja a szinapszisokra vonatkozó szabályozó hatások térbeli kiterjesztését, feltárva az astrocyták szinaptikus információfeldolgozását. (Araque és mtsai, 2015) Például az astrocyta glutamát leadása fokozza a hyppocampális glutamáterg synaptikus transzmissziót, presynaptikus NMDAR-független mechanizmusokon keresztül. Astrocyta általi glutamát felszabadulás azonban postsynaptikusan is felléphet NMDAR-ek által, ezzel fokozva az idegsejtek ingerlékenységét. Ezenfelül képes presynaptikus metabotrop glutamát receptorhoz kötődni, előidézve heterosynaptikus depressziót. Így a glutamát gliotranszmissziós hatása változó, hisz függ a pre- és postsynaptikus komponensek receptorainak specifikusságától. Már egy gliotranszmitter is lehet egyidejűleg bizonyos szinaptikus terminálokon gátló vagy serkentő, hosszú- vagy rövidtávon a központi amygdalában. ?????? For example, astrocytic ATP/adenosine release depressed excitatory transmission via activation of presynaptic A1 receptors at synaptic inputs from the basolateral amyg- dala, whereas the same gliotransmitter enhanced inhibi- tory transmission via activation of presynaptic A2A receptors at synaptic inputs from the central lateral amyg- dala. The combined effect of this gliotransmission resulted in decreased output from the CeM, which conse- quently reduced fear expression, suggesting that astro- cytes are integral components of the amygdala fear circuit. This study further indicates that the astrocyte–neu- ron communication is not broad and unspecific; rather, the signaling between astrocytes and neurons is a circuit- and synapse-specific phenomenon. The diversity and complexity of the phenomenon has important func- tional implications, given that the coordinated neuronal activity and astrocyte synaptic effects lead to significant behavioral consequences. | A már említett kalciumkoncentráció változás térbeli és időbeli tulajdonságai különböző modulációs hatásokkal befolyásolhatják a neuronális és szinaptikus aktivitást. Például az asztrociták szabályozó hatása korlátozódhat csak egy kis funkcionális részre, ha a szinaptikus átvitel egy bizonyos szint alatt marad. A szinaptikus aktivitás növekedése (vagy többszörös szinapszisok aktivációja) esetén az asztrocitában található intracelluláris kalciumszint növekedés, -amely kezdetben csak kis részre korlátozódott-, a helyi alosztályon túl egy másik folyamatra és végül az egész sejtre tovaterjed. Az asztrocita kalciumszintjében fellépő változások térbeli terjedését a különböző neurotransmitter jelátviteli utak szinaptikus inputjának térbeli és időbeli integrációja befolyásolja. Ezenkívül kontrollálja a szinapszisokra vonatkozó szabályozó hatások térbeli kiterjesztését, feltárva az asztrociták szinaptikus információfeldolgozását ([[https://www.ncbi.nlm.nih.gov/pubmed/24559669|Araque és mtsai, 2014]]). Például az asztrocita glutamát leadása fokozza a hyppocampális glutamáterg szinaptikus transzmissziót, preszinaptikus NMDAR-független mechanizmusokon keresztül. Asztrocita általi glutamát felszabadulás azonban postszinaptikusan is felléphet NMDAR-ek által, ezzel fokozva az idegsejtek ingerlékenységét. Ezenfelül képes preszinaptikus metabotrop glutamát receptorhoz kötődni, előidézve heteroszinaptikus depressziót. Így a glutamát gliotransmissziós hatása változó, hisz függ a pre- és postszinaptikus komponensek receptorainak specifikusságától. Már egy gliotransmitter is lehet egyidejűleg bizonyos szinaptikus terminálokon gátló vagy serkentő, hosszú- vagy rövidtávon a központi amygdalában ([[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee és Araque, 2019]]). |
| Line 43: | Line 55: |
| (Az astrocytákból felszabaduló ATP, mint gliotranszmitter szintén kettős funkcióval rendelkezik. Kibocsátása a basolaterális amygdala szinaptikus bemeneteiben található preszinaptikus A1 receptor aktivációján keresztül csökkenti a transzmisszió serkentését. Ezzel ellentétben a centrolaterális amygdala szinaptikus bemeneteiben lévő preszinaptikus A2A receptor aktiválása esetén növeli a gátló transzmissziót.) | A neurális hálózatok és a különböző szinapszisok által befolyásolt asztrotociták szinapszisokra ható szabályozó tevékenysége további sokszínűséget biztosít az asztrocita-neuron kapcsolatoknak. A dorsalis striatumban található szinapszisok és asztrociták kölcsönhatása, - az amygdalánál leírtakhoz hasonlóan - szintén nagyon specifikus. Ezen az agyi területen két különböző típusú asztrocitapopuláció különíthető el, melyek specifikusan kapcsolatba lépnek közepesen tüskés neuronokkal és a két fő corticalis hálózat szinapszisaival, indirekt vagy direkt módon. Az asztrociták alcsoportjai specifikusan reagálnak a közepesen tüskés neuronok indirekt és direkt típusú útvonalaira, és szelektíven modulálják a corticostrialis szinapszisokat. A neurális hálózatokként eltérő asztrocita-neuron jelátadás funkcionális hatásai és következményei még vitatottak; elképzelhető, hogy koordináló szereppel bírnak ([[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee és Araque, 2019]]). |
| Line 45: | Line 57: |
| A neurális hálózatok és a különböző szinapszisok által befolyásolt astrotocyták szinapszisokra ható szabályozó tevékenysége, további sokszínűséget biztosít az astrocyta-neuron kapcsolatoknak. A dorsalis striatumban található szinapszisok és astrocyták kölcsönhatása, - az amygdalánál leírtakhoz hasonlóan - szintén nagyon specifikus. Ezen az agyi területen két különböző típusú astrocytapopuláció különíthető el, melyek specifikusan kapcsolatba lépnek közepesen tüskés neuronokkal és a két fő corticalis hálózat szinapszisaival, indirekt vagy direkt módon. Az astrocyták alcsoportjai specifikusan reagálnak a közepesen tüskés neuronok indirekt és direkt típusú útvonalaira, és szelektíven modulálják a corticostrialis szinapszisokat. A neurális hálózatokként eltérő astrocyta-neuron jelátadás funkcionális hatásai és következményei még vitatottak; elképzelhető, hogy koordináló szereppel bírnak. | Az asztrocitákról ismert, hogy képesek különböző gliotransmitterek kibocsátására, amelyek a szinapszisokra többféleképpen is hathatnak. Az, hogy vajon egy-egy asztrocita képes-e különböző gliotransmitterek kibocsátására, egy igazán fontos kérdés, ahogy az is, hogy ha igen, akkor mik lehetnek a jelenséget szabályozó körülmények ([[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee és Araque, 2019]])? |
| Line 47: | Line 59: |
| Az astrocytákról ismert, hogy képesek különböző gliotranszmitterek kibocsátására, amelyek a szinapszisokra többféleképpen is hathatnak. Az, hogy vajon egy-egy astrocyta képes e különböző gliotranszmitterek kibocsátására, egy igazán fontos kérdés, ahogy az is, hogy ha igen, akkor mik lehetnek a jelenséget szabályozó körülmények? | Araque és Covelo 2018-ban, - egyetlen, önálló asztrocita sejtet vizsgálva - kísérletileg kimutatták, hogy a [[https://hu.wikipedia.org/wiki/Gamma-aminovajsav|GABA]]erg interneuronok alacsony szinten történő stimulálása (pl.: rövid idejű vagy alacsony gyakoriságú stimuláció) az asztrocita aktivációját eredményezte a [[https://hu.wikipedia.org/wiki/Gamma-aminovajsav|GABA-B]] receptorokon keresztül. Ezen aktiváció az asztrocitából glutamát leadását váltotta ki, mely a preszinaptikus [[https://en.wikipedia.org/wiki/Metabotropic_glutamate_receptor_1|mGluR1]] receptorokhoz kötődve, a szinaptikus hatékonyságot átmenetileg növelte. Ezzel szemben a magasabb stimulációs szintek (pl. hosszú időtartamú vagy magas frekvenciájú stimuláció) kétfázisú választ váltottak ki. Ez esetben az asztrocita nem csak glutamátot, hanem ATP-t is kibocsátott, mely - az mGluR1 receptor mellett - az A1 adenozin receptor aktivációját is előidézte. A hatás ezúttal a szinaptikus hatékonyság kezdeti átmeneti növekedése és későbbi hosszabb ideig tartó csökkenése volt. Összefoglalva mindez azt sugallja, hogy egyetlen asztrocita dekódolhatja a neuronális bemeneti jelet és integrálhatja ezt az információt a specifikus gliotransmitter leadással, amely serkentő vagy gátló hatást gyakorolhat a szinaptikus átvitelre ([[https://www.ncbi.nlm.nih.gov/pubmed/29380725|Covelo és Araque, 2018]]). |
| Line 49: | Line 61: |
| Araque és Covelo 2018-ban,- egyetlen, önálló astrocyta sejtet vizsgálva- kísérletileg kimutatták, hogy a GABAerg interneuronok alacsony szinten történő stimulálása (pl.:rövid idejű vagy alacsony gyakoriságú stimuláció) az astrocyta aktivációját eredményezte a GABA-B receptorokon keresztül. Ezen aktiváció az astrocytából glutamát leadását váltotta ki, mely a presynaptikus mGluR1 receptorokhoz kötődve, a szinaptikus hatékonyságot átmenetileg növelte. Ezzel szemben a magasabb stimulációs szintek (pl. hosszú időtartamú vagy magas frekvenciájú stimuláció) kétfázisú választ váltottak ki. Ez esetben az astrocyta nem csak glutamátot, hanem ATP-t is kibocsátott, mely -az mGluR1 receptor mellett- az A1 adenozin receptor aktivációját is előidézte. A hatás ezúttal a szinaptikus hatékonyság kezdeti átmeneti növekedése és későbbi hosszabb ideig tartó csökkenése volt. Összefoglalva mindez azt sugallja, hogy egyetlen astrocyta dekódolhatja a neuronális bemeneti jelet és integrálhatja ezt az információt a specifikus gliotranszmitter leadással, amely serkentő vagy gátló hatást gyakorolhat a szinaptikus átvitelre. | A leírt eredmények a neuron-asztrocita hálózatok rendkívüli komplexitását támasztják alá. Már egyetlen asztrocita által leadott, egyik típusú gliotransmitternek is lehetnek eltérő hatásai, de egyetlen asztrocita két vagy több típusú gliotransmittert is kibocsáthat, amelyek különböző időbeli dinamikájukkal hatnak. Összességében tehát, ezek a megállapítások rávilágítanak az asztrocita-neuron jelátvitel összetettségére és annak lehetséges változatos hatásaira ([[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee és Araque, 2019]]). |
| Line 51: | Line 63: |
| A leírt eredmények a neuron-astrocyta hálózatok rendkívüli komplexitását támasztják alá. Már egyetlen astrocyta által leadott, egyik típusú gliotranszmitternek is lehetnek eltérő hatásai, de egyetlen astrocyta két vagy több típusú gliotranszmittert is kibocsáthat, amelyek különböző időbeli dinamikájukkal hatnak. Összességében tehát, ezek a megállapítások rávilágítanak az astrocyta-neuron jelátvitel összetettségére és annak lehetséges változatos hatásaira. | == A gliotransmitterek szerepe a rendellenes kórképek kialakulásában == A gliotransmitterek felszabadulása szabályozza a neuronok és az agyi extracelluláris környezet közötti szinaptikus transzmissziót. Ismert, hogy a glutamát és a D-szerin szinaptikus transzmissziót gerjeszt. Ugyanakkor, hogy az ATP erősíti vagy gátolja-e a szinaptikus transzmissziót, részben még mindig vitatott, mert az ATP-ből szintetizált metabolit, az adenozin, általában az adenozin A1 receptorok révén gátolja a szinaptikus aktivitást. Ezért érthető, hogy elméletek vannak azzal kapcsolatban, hogy ezen gliotransmitterek felszabadulásának egyensúlyhiánya megváltozott neuronális aktivitást eredményezhet. Számos kóros állapot, köztük a központi idegrendszeri betegségek, a traumás agyi sérülések, a fejlődési rendellenességek és a prenatális kiszolgáltatottság ártalmas molekuláknak, kimutatott, hogy szorosan kapcsolódnak a gliotransmisszió károsodásához ([[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai, 2016]]). |
| Line 53: | Line 66: |
| == A gliotranszmitterek szerepe a rendellenes kórképek kialakulásában == A gliotranszmitterek felszabadulása szabályozza a neuronok és az agyi extracelluláris környezet közötti szinaptikus transzmissziót. Ismert, hogy a glutamát és a D-szerin szinaptikus transzmissziót gerjeszt. Ugyanakkor, hogy az ATP erősíti vagy gátolja-e a szinaptikus transzmissziót, részben még mindig vitatott, mert az ATP-ből szintetizált metabolit, az adenozin, általában az adenozin A1 receptorok révén gátolja a szinaptikus aktivitást. Ezért ésszerű, hogy elméletek vannak azzal kapcsolatban, hogy ezen gliotranszmitterek felszabadulásának egyensúlyhiánya megváltozott neuronális aktivitást eredményezhet. Számos kóros állapot, köztük a központi idegrendszeri betegségek, a traumás agyi sérülések, a fejlődési rendellenességek és a prenatális kiszolgáltatottság ártalmas molekuláknak, kimutatott, hogy szorosan kapcsolódnak a gliotranszmisszió károsodásához. |
Tény, hogy a gliotransmitter-felszabaduláshoz kapcsolódó fehérjék (például a vezikuláris transzporterek és a vezikulummal kapcsolatos membránfehérjék) diszfunkciója az asztrocitákban súlyos agyi rendellenességeket és rendellenes viselkedést okozhat. Ugyanakkor a traumás sérülések, a stroke és egyes fertőzések [[https://en.wikipedia.org/wiki/Astrogliosis|astrogliózist]] (reaktív asztrociták) okoznak. Ezek a reaktív asztrociták neurotoxikus mennyiségű glutamátot termelnek és szabadítanak fel. Az asztrociták szintén hozzájárulnak a véragygát megfelelő fejlődéséhez az endotheliális sejtek és a pericyták összehangolásával, a véráramból kiválasztott molekulák neuronokba történő átvitelével és védő gátat biztosítanak a mérgező anyagok ellen. Így a krónikus környezeti vegyi anyagoknak vagy az érrendszeri gyulladásos molekuláknak való kitettség potenciálisan befolyásolhatja az asztrociták és a gliotransmitterek felszabadulását ([[javascript:void(0);/*1556959213503*/|Harada és mtsai, 2016]]). |
| Line 56: | Line 68: |
| Tény, hogy a gliotranszmitter-felszabaduláshoz kapcsolódó fehérjék (például a vezikuláris transzporterek és a vezikulummal kapcsolatos membránfehérjék) diszfunkciója az astrocytákban súlyos agyi rendellenességeket és rendellenes viselkedést okozhat. Ugyanakkor a traumás sérülések, a stroke és egyes fertőzések astrogliózist (más néven reaktív astrocyták) okoznak. Ezek a reaktív asztrociták neurotoxikus mennyiségű glutamátot termelnek és szabadítanak fel. Az astrocyták szintén hozzájárulnak a BBB (blood-brain barrier) megfelelő fejlődéséhez az endotheliális sejtek és a pericyták összehangolásával, a véráramból kiválasztott molekulák neuronokba történő átvitelével és védő gátat biztosítanak a mérgező anyagok ellen. Így a krónikus környezeti vegyi anyagoknak vagy az érrendszeri gyulladásos molekuláknak való kitettség potenciálisan befolyásolhatja az astrocyták és a gliotranszmitterek felszabadulását. | == Irodalomjegyzék == [[https://www.ncbi.nlm.nih.gov/pubmed/24559669|Araque, A.; Carmignoto, G.; Haydon, P. G.; Oliet, S. H.; Robitaille, R.; Volterra, A. (2014): Gliotransmitters travel in time and space. Neuron 81:(4) 728-739, doi: 10.1016/j.neuron.2014.02.007.]] |
| Line 58: | Line 71: |
| == IRODALOMJEGYZÉK == | [[https://www.ncbi.nlm.nih.gov/pubmed/15156145|Bezzi, P.; Gundersen, V.; Galbete, J. L.; Seifert, G.; Steinhäuser, C.; Pilati, E.; Volterra, A; (2004): Astrocytes contain a vesicular compartment that is competent for regulated exocytosis of glutamate. Nature Neuroscience 7:(6) 613–620, doi: n10.1038/nn1246]] |
| Line 60: | Line 73: |
| Araque, A.; Carmignoto, G.; Haydon, P. G.; Oliet, S. H.; Robitaille, R.; Volterra, A. (2014): Gliotransmitters travel in time and space. Neuron 81:728-736. | [[https://www.ncbi.nlm.nih.gov/pubmed/29380725|Covelo, A.; Araque, A. (2018): Neuronal activity determines distinct gliotransmitter release from a single astrocyte. eLife 7, pii: e32237. doi: 10.7554/eLife.32237.]] |
| Line 62: | Line 75: |
| Covelo, A.; Araque, A. (2018): Neuronal activity determines distinct gliotransmitter release from a single astrocyte. eLife 7. | [[https://www.ncbi.nlm.nih.gov/pubmed/30458223|Durkee, C. A.; Araque, A. (2019): Diversity and Specificity of Astrocyte-neuron Communication. Neuroscience 396 73-78, doi: 10.1016/j.neuroscience.2018.11.010.]] |
| Line 64: | Line 77: |
| Daniela, A. Sahlender; Iaroslav, Savtchouk; Andrea, Volterra (2014). What Do We Know about Gliotranszmitter Release from Astrocytes? The Royal Society, 369, 1654. | [[https://www.ncbi.nlm.nih.gov/pubmed/17207662|Halassa, M. M.; Fellin, T.; Haydon, P. G. (2007): The tripartite synapse: roles for gliotransmission in health and disease. Trends in Molecular Medicine 13:(2) 54–63, doi: 10.1016/j.molmed.2006.12.0]] |
| Line 66: | Line 79: |
| Durkee, C. A.; Araque, A. (2019): Diversity and Specificity of Astrocyte-neuron Communication. Neuroscience 396: 73-76. | [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada. K.; Kamiya, T.; Tsuboi, T. (2016): Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers in Neuroscience 9 499, doi: 10.3389/fnins.2015.00499.]] |
| Line 68: | Line 81: |
| Kazuki, Harada; Taichi, Kamiya; Takashi, Tsuboi (2016), Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers in Neuroscience, 9: 499. | [[https://www.ncbi.nlm.nih.gov/pubmed/17310248|Jourdain, P.; Bergersen, L. H.; Bhaukaurally, K.; Bezzi, P; Santello, M.; Domercq, M.; Matute, C.; Tonello, F.; Gundersen, V.; Volterra, A. (2007): Glutamate Exocytosis from Astrocytes Controls Synaptic Strength. Nature Neuroscience 10:(3) 331-339, doi: 10.1038/nn1849.]] |
| Line 70: | Line 83: |
| Pascal, Jourdain; Linda, H. Bergersen; Khaleel, Bhaukaurally; Paola, Bezzi; Mirko, Santello; Maria, Domercq; Carlos, Matute; Fiorella, Tonello; Vidar, Gundersen; Andrea, Volterra (2007). Glutamate Exocytosis from Astrocytes Controls Synaptic Strength. Nature Neuroscience, 10, 331-339, doi:10.1038/nn1849. | [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5031785/|Koizumi, S. (2010): Synchronization of Ca2+ oscillations: involvement of ATP release in astrocytes. FEBS Journal 277:(2) 286–292, doi: 10.1111/j.1742-4658.2009.07438.x]] |
| Line 72: | Line 85: |
| Ulyana, Lalo; Oleg, Palygin; Seyed, Rasooli-Nejad; Jemma, Andrew; Philip, G. Haydon; Yuriy, Pankratov (2014). Exocytosis of ATP From Astrocytes Modulates Phasic and Tonic Inhibition in the Neocortex. PLOS Biology, 12(4), e1001857. | [[https://www.ncbi.nlm.nih.gov/pubmed/24409095|Lalo, U.; Palygin, O.; Rasooli-Nejad, S.; Andrew, J.; Haydon, P. G.; Pankratov, Y. (2014): Exocytosis of ATP From Astrocytes Modulates Phasic and Tonic Inhibition in the Neocortex. PLOS Biology 12:(1) e1001747, doi: 10.1371/journal.pbio.1001747.]] [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4173278/|Sahlender, D. A.; Savtchouk, I.; Volterra, A. (2014): What Do We Know about Gliotransmitter Release from Astrocytes? The Royal Society 369:(1654) 20130592. doi: 10.1098/rstb.2013.0592.]] == Képforrás == [[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709856/|Harada és mtsai (2016]]) illusztrációja alapján átrajzolva (1.,2.,3. ábra) |
Gliotransmitters: az asztrocitafunkciók új perspektívája
Contents
Bevezetés
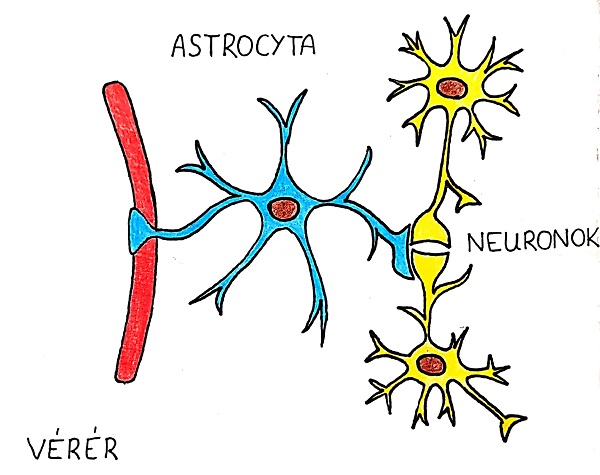
Az asztrocitákról egészen az 1990-es évekig úgy tartották, hogy csupán támasztó szereppel bírnak a központi idegrendszerben. Az akkoriban felfedezett kalcium nyomkövetési technikák (calcium imaging) segítségével új funkciók váltak ismertté. Cikkünk ezek közül a gliotransmitterek kibocsátásával, és ezáltal a szinaptikus folyamatok befolyásolásában betöltött szerepükkel foglalkozik. Bár ezen sejtek nem mutatnak elektromos ingerlékenységet, kimutatták, hogy aktív résztvevői a neurális hálózatnak. Figyelembe véve a viszonyukat az idegsejtekkel, az asztrociták nyúlványai szoros kapcsolatot létesítenek mind a pre- és posztszinaptikus térrel (Harada és mtsai, 2016). Ezt a struktúrát nevezzük „háromoldalú szinapszisnak” (1. ábra).
|
1. ábra: Az asztrocitáknak szoros morfológiai és funkcionális kapcsolatuk van az agyi vérerekkel és a neuronokkal (“háromoldalú szinapszis”). A kép az asztrociták helyzetét ábrázolja a vérerek és a neuronok körül a központi idegrendszerben. Egy asztrocita több vérérrel és neuronnal létesít kapcsolatot a nagy számú nyúlványaikkal. |
Az asztrociták képesek a neurotransmitterekre válaszolni, és hozzájárulnak az ingerület tovaterjedéséhez bizonyos kémiai ingerületátvivő anyagok, gliotransmitterek segítségével. Két fő technikai áttörés született, amelyek segítségével érthetővé vált az asztrociták működési mechanizmusa: az egyre korszerűbb mikroszkópok, illetve a már említett kalcium nyomkövetési technikák. A kezdeti felfedezések kémiai kalcium indikátorok felhasználásával történtek, így mutatkozott meg az asztrocitákban a növekvő intracelluláris kalcium koncentráció, ami átterjed a szomszédos asztrocitákra. Ezen jelenség neve: kalcium hullám. A genetikailag kódolt kalcium indikátorok lehetővé tették az asztrocita funkciók még részletesebb analízisét. Ezeknek a kísérleti áttöréseknek hála bizonyosodott be, hogy az inozitol-1,4,5-triszfoszfát (IP3) mediálta kalcium kiáramlás az endoplazmatikus retikulumból intracelluláris kalcium-ion koncentrációnövekedést okoz az adott asztrocitában. Ez eredményezi a szomszédos asztrociták és neuronok fokozott gliotransmitter kibocsátását (Halassa és mtsai, 2007).
Gliotransmitterek
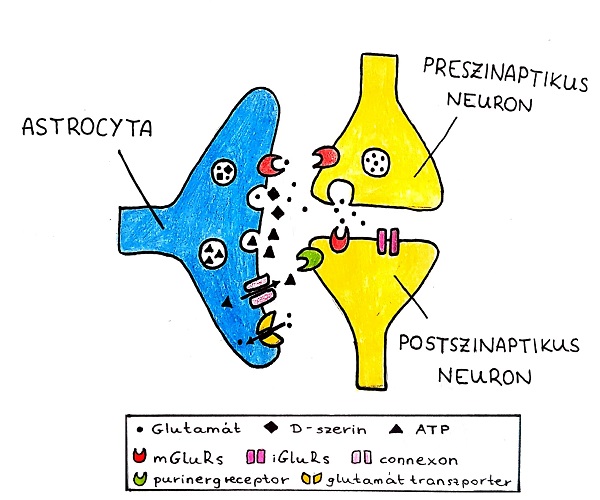
Az asztrociták három fő gliotransmittert adnak le; glutamát, D-szerin és ATP, melyek a neuronokon található specifikus receptorukhoz kötődve modulálják azok tüzelési frekvenciáját és/vagy a szinaptikus transzmissziót (2. ábra). Ezek sokszínű hatása nagyban függ a speciális idegi környezettől (Harada és mtsai, 2016).
|
2. ábra: Sematikus ábra mutatja a neuro- és gliotransmitterek által mediált „háromoldalú szinapszist" és a komplex jelátadó interakciót. A neurotransmitterek, mint a glutamát, a preszinaptikus terminálisból ürülnek, ezek azonban nem csak a posztszinapszisokon hatnak, hanem az asztrocitákon is. Az aktivált asztrociták gliotransmittereket (glutamát, D-szerin, ATP) ürítenek vezikuláris exocitózissal, de létrejöhetnek connexonok is az ATP számára. A kiürített gliotransmitter kapcsolódik mind a preszinaptikus, mind a posztszinaptikus receptorokhoz. Így regulálják a szinaptikus transzmissziót. Az asztrociták részt vesznek ezen felül a glutamát transzporton keresztül az extracelluláris glutamát klírenszében. |
ATP
Bár az ATP a sejtek elsődleges energiaforrása, jelzőmolekulaként is működik a purinerg receptorokon keresztül. Egy újabb tanulmány kimutatta, hogy az asztrocitákból tenyésztett tápközeg, amely kalcium-hullámokat mutat, több ATP-t tartalmaz, mint a kontroll táptalaj. Érdekes módon az összegyűjtött tenyésztőközeg hozzáadása az asztrocitákhoz kalcium-hullámokat indukált, amelyeket a purinerg receptor antagonisták gátoltak. Így az asztrocitákból felszabaduló ATP kalcium-hullámokat indukál, s az asztrociták egymással kommunikálnak. Az ATP felszabadulás mechanizmusai azonban továbbra is ellentmondásosak; a vizsgálat különböző asztrociták ATP felszabadulásának feltételezett modelljeit javasolta (Koizumi, 2010).
A Connexin 43 (Cx43) egy hemichannelbe épített átjáró, amely az asztrocitákban réskapcsolatokat képez és a szomszédos asztrociták között jelző molekulákat, köztük kalcium-iont és inozitol-1,4,5-triszfoszfátot cserél. Az ATP biolumineszcenciás képalkotása egycsatornás felvételekkel kombinálva azt mutatta, hogy a Cx43 hemichannelek a patkány glioma C6 sejtekben és a CA1 hippokampális asztrocitákban átjárhatók az ATP-re nézve. Ezzel a megállapítással összhangban, a glutamát intracelluláris kalcium-ion koncentráció növekedést okoz a hippokampális asztrocitákban, és ATP felszabadulást idézett elő, melyeket hemichannel blokkoló és Cx43 / Cx30 knockout egerek alkalmazásával gátoltak, ami arra utal, hogy az ATP extracellulárisan szabadul fel a Cx43 hemichanneleken keresztül (Harada és mtsai, 2016). A dnSNARE egérmodellt széles körben alkalmazták az asztrociták ATP felszabadulásának vizsgálatára. A modellt használó számos tanulmányban az ATP-kibocsátás általában csökkent, de az időbeli információ nehezen szerezhető meg. A közelmúltban végzett vizsgálat azonban az asztrocitikus ATP exocitózisát észlelte közvetlenül a kéregben, a kvantikus felszabadulás megfigyelésével a P2X4 (purinerg receptor) neuronális receptorokon. Az ATP felszabadulást több száz milliszekundumban detektálták, az asztrocitás aktiválásból és a megfelelő kalcium növekedésből. Az észlelt ATP eseményeket kvantitatívan osztották fel, ami arra utal, hogy egy tárolórekesz érintett (Lalo és mtsai, 2014).
Néhány tanulmány azonban kimutatta, hogy az asztrociták szekréciós lizoszómáiból ATP szabadul fel. Valójában az elsődlegesen tenyésztett asztrociták expresszálnak egy szekréciós lizoszóma markert, amit vezikulummal társított membránfehérje-7-nek (vagy TI-VAMP) neveznek. A TI-VAMP-pozitív szekréciós lizoszómák ATP-t tartalmaznak, amely kalcium-függetlenül szabadulnak fel. Az elsődlegesen tenyésztett asztrocitákat és C6-sejteket alkalmazó kísérletben a vezikuláris nukleotid transzporter (VNUT) pozitív lizoszómákat fluoreszcens ATP-vel jelöltük, és a VNUT inhibitor alkalmazása csökkentette a fluoreszcens ATP-tartalmú vezikulumok számát. A teljes belső reflexiós fluoreszcens mikroszkópiával végzett megfigyelés kimutatta, hogy a sejtekben a szekréciós lizoszómák exocitotikus eseményei kalcium ionoforok és ATP, illetve glutamát alkalmazása után következtek be. Így az ATP lizoszómákban tárolodik, és kalcium-függő módon szabadul fel (Harada és mtsai, 2016).
Glutamát
Bár a glutamát neurotransmitterként ismert, gliotransmitterként is működik. A bradykinin alkalmazása tenyésztett asztrocitákra glutamát felszabadulást indukál, és a szomszédos neuronokat N-metil-D-aszpartát (NMDA) receptorokon keresztül befolyásolja. Ezzel ellentétben a clostridium, tetanusz és botulinum neurotoxinok alkalmazása, amelyek differenciálisan hasítják az exocitózist szabályozó oldható N-etil-maleimid-érzékeny faktor kötő fehérje receptor (SNARE) fehérjéket, csökkenti a kalcium-függő glutamát felszabadulást. Ezek az eredmények arra utalnak, hogy a SNARE fehérjék, beleértve a vezikulummal kapcsolatos membránfehérje-2 (VAMP2), a szintaxin-1 és a szinaptoszóma-társított fehérje-23, közvetítik a kalcium-függő glutamát felszabadulást (Harada és mtsai, 2016).
A citoplazmatikus glutamát exocytotikus vezikulumokba történő felvételét a vezikuláris glutamát transzporterek (VGLUT) közvetítik, amelyeket a vakuolar típusú H + ATPázok (V-ATPázok) irányítanak. A V-ATPázok gátlása blokkolja a kalcium-függő glutamát felszabadulást. Továbbá, a VGLUT1 és 2 szinaptikus jellegű vezikulákkal van kolokalizálva, ami arra utal, hogy a glutamát szinaptikus jellegű vezikulákba van csomagolva és kalcium-függő módon szabadul fel az asztrocitáktól (Bezzi és mtsai, 2004).
Eközben más kibocsátási mechanizmusokat is azonosítottak: a plazmamembrán glutamát transzporterek fordított működése; sejtduzzadás által indukált anion transzporter nyitás; felszabadulás P2X7 receptorokon keresztül; az asztrociták sejtfelületén lévő réscsatlakozó csatornák, hemichannelek. Azonban még nem világos, hogy az asztrociták milyen gyakran és milyen mértékben alkalmazzák ezeket a különböző mechanizmusokat. További vizsgálatokra lesz szükség annak tisztázása érdekében, hogy vannak-e különleges kibocsátási mechanizmusok, amelyek bizonyos körülmények között működnek (Harada és mtsai, 2016). A glutamát felszabadulás tanulmányozásának egyik módja a vezikuláris glutamát transzporterek (vGluts) jelenlétére és működésére koncentrál. A jelenleg rendelkezésre álló vGlut antagonisták (például Evans Blue és Rose Bengal) gyengén szelektívek. Mindazonáltal, ezeknek az anyagoknak a szövetekben végzett kísérletei érdekes eredményeket hoztak. Az asztrociták infúziója Evans Blue-val megszüntette a tüskés időfüggő hosszú távú depressziót (LTD) a közeli szinapszisokban a kéregben. Ugyanez a hatás érhető el az asztrociták „kalcium szorítóval” vagy TeNTLC-vel való alkalmazásával. Mindezek az eredmények összhangban vannak az asztrocita felszabadulás vezikuláris jellegével, legalábbis ebben a készítményben (Jourdain és mtsai, 2007).
A hippokampális dentát gyrusban az asztrocitákból származó glutamát-felszabadulás kimutatta, hogy aktiválja a preszinaptikus NMDAR-kat, és ezáltal növeli a transzmitterek kibocsátási valószínűségét a közeli granuláris sejt szinapszisokban. Az asztrocitákat elektromosan stimulálták és a szinaptikus felszabadulás változásait (például a miniatűr (m) EPSC frekvencia változásait) figyelték meg. A szinaptikus felszabadulás valószínűségének növekedése az asztrocitás stimuláció után másodperceken belül megtörtént. Infúzióval előzetesen blokkolták az asztrocitákat kalcium kelátképző BAPTA-val vagy TeNTLC-vel. Mivel az asztrociták által kiváltott szinaptikus hatás gyors, és kalcium és SNARE függő, arra a következtetésre jutottak, hogy a glutamátot a szabályozott exocitózis szabadította fel ebben a rendszerben. Hasonlóképpen az asztrocitás glutamát neuronális felszabadulásának gyors (kb. 10 s) modulációja volt észlelhető az éretlen GABAerg szinapszisokban (Sahlender és mtsai, 2014).
D-szerin
A D-szerin gliotransmitterként való felfedezése áttörés volt, mert régóta gondolták, hogy az emlősszövetek csak az aminosavak L-izomerjeit termelik. Tenyésztett asztrocitákban a glutamát fokozta a D-szerin kalcium-függő szekrécióját az a-amino-3-hidroxi-5-metil-4-izoxazolepropionsav (AMPA) / kainát receptorok (AMPA / KARs) és metabotróp glutamát receptorokon. Ennek megfelelően az AMPA / KAR és a metabotróp glutamát receptorok agonistái megnövelik az intracelluláris kalcium-ion koncentrációt, valamint a D-szerin ezt követő szekrécióját. Továbbá a tetanusz neurotoxinok és a V-ATPáz inhibitorok elnyomják a D-szerin és a VAMP2 / 3 és a VGLUT2 tartalmú vezikulumok agonista által kiváltott szekrécióját, amelyek D-szerinnel kolokalizáltak. Ezek az eredmények arra utalnak, hogy a D-szerin a szinaptikus jellegű vezikulákban tárolódik és kalcium-függő módon felszabadul a vezikulákból (Harada és mtsai, 2016).
Kimutatták, hogy a hippocampus CA1 régiójában található asztrocitákból származó D-szerin felszabadulása fontos a hosszú távú potencírozáshoz (LTP) a Schaffer kollaterális-piramissejtes szinapszisokban. A kísérletek azt mutatták, hogy az LTP ezt a formáját az asztrociták TeNTLC vagy „calcium clamp” oldat szelektív infúziója megszakítja. Fontos megjegyezni, hogy a D-szerin termelés blokkolásával, az asztrocita belsejében a szerin racemáz enzim inhibitor HOAsp-vel kimutatták, hogy a D-szerin mindazonáltal hosszabb ideig tárolható egy feltételezett asztrocitás rekeszben. Ezen túlmenően ez a D-szerin-medence a stimuláció előtti kísérletekben kimerült, ami az LTP eltörlését eredményezte. Ezek a megfigyelések támogatják a vezikulumot, mint az asztrocitákból származó D-szerin felszabadulásának csatorna-közvetített módját az LTP indukció során (Sahlender és mtsai, 2014).
Gliotransmitterek leadása
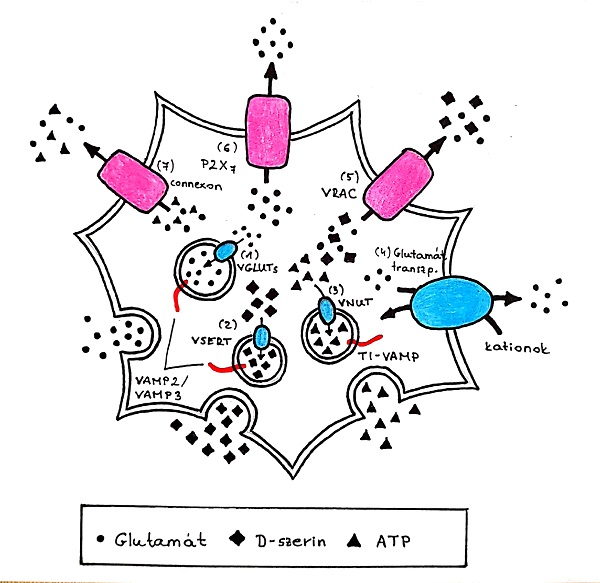
Az asztrocita- neuron jelátvitel sokszínűsége az asztrociták összetett potenciálszabályozó képességén alapszik. Az asztrociták egyik fontos jellemzője, hogy a különböző neurotransmitterek nem ugyanolyan hatékonysággal bírnak a gliotransmitterek kibocsátására. Kimutatták, hogy két különböző receptor – a proteáz-aktivált receptor 1 (PAR1) és a purinerg receptor (P2Y1) - aktivációja a hippocampális asztrocitákban hasonlóan emeli azok kalcium szintjét. A PAR1 receptor stimulációja hosszabb ideig tartó kalciumszint emelkedést idéz elő. Ugyanakkor csak a PAR1 receptor aktivációja eredményez gliotransmitter kibocsátást, amely történhet vezikuláris és nem vezikuláris úton. Az, hogy a gliotransmitter leadásért sejtes és molekuláris mechanizmusok felelősek nagyban vitatott. Egy, az eukarióta sejtek által használt általános mechanizmus alapja, hogy a gliotransmitterek vezikuláris úton az extracelluláris térbe transzportálódnak, amely SNARE fehérje függő, szabályozott folyamat. Következtetésképpen megállapítható, hogy a gliotransmitterek felszabadulása az asztrocitákból kalcium és SNARE fehérje függő. Ezen fehérje függő folyamat is sokféle lehet a gliotransmitterek leadásának mechanizmusát tekintve (3. ábra). Az asztrocitákban két különálló vezikuláris SNARE függő felszabadítási útvonal ismert. Abban az esetben, ha a vezikula glutamátot tartalmaz, felületén synaptobrevin II (sybII)/VAMP2 foglal helyet, ha NPY-t tartalmaz, akkor cellubrevin (ceb)/VAMP3. Az asztrociták glutamát neurotransmitterrel történő stimulációja esetén az NPY tartalmú vezikulumok exocitózisa történik meg. Ennek feltétele a mGluR5 aktivációja és a ceb jelenléte. Ha az asztrocitákat mGluR1 antagonista DHPG (dihidroxi-fenilglicin) stimuláció éri, a glutamát tartalmú vezikulák ürülése figyelhető meg. Ez a sybII jelenlététől függ (Durkee és Araque, 2019).
|
3. ábra: Precíz intracelluláris szerkezet vesz részt a glutamát, D-szerin és ATP asztrocitákból való ürítésében. A glutamát és a D-szerin vezikuláris transzporttal kerül felvételre (1) VGLUT-on keresztül és (2) vezikuláris D-szerin transzporterekkel (VSERT) külön-külön. Ezek a vezikulák fuzionálnak a plazma membránnal a SNARE fehérjék (VAMP2 vagy VAMP3) által mediáltan. Ezen fehérjék felelősek az intracelluláris kalcium-ion koncentráció növekedéséért. Ezzel szemben az ATP szekretoros lizoszómákkal ürül. Az ATP lizoszómába történő raktározásáért (3) a VNUT felelős. A SNARE fehérjék, köztük a TI-VAMP kölcsönhatása révén az ATP-tartalmú szekréciós lizoszómák kalcium-ion függvényében exocitózisra kerülnek. Emellett felfedezték a többi felszabadulási mechanizmus létezését is: (4) a plazma membrán glutamát transzporterek fordított működését, (5) a sejt-duzzanat által kiváltott anion transzporter (VRAC) nyílását, (6) P2X7 receptorokon keresztüli felszabadulást, és (7) a gap junction csatornákat (hemichannelek) az asztrociták sejtfelületén. |
Különböző szinaptikus hatások
A már említett kalciumkoncentráció változás térbeli és időbeli tulajdonságai különböző modulációs hatásokkal befolyásolhatják a neuronális és szinaptikus aktivitást. Például az asztrociták szabályozó hatása korlátozódhat csak egy kis funkcionális részre, ha a szinaptikus átvitel egy bizonyos szint alatt marad. A szinaptikus aktivitás növekedése (vagy többszörös szinapszisok aktivációja) esetén az asztrocitában található intracelluláris kalciumszint növekedés, -amely kezdetben csak kis részre korlátozódott-, a helyi alosztályon túl egy másik folyamatra és végül az egész sejtre tovaterjed. Az asztrocita kalciumszintjében fellépő változások térbeli terjedését a különböző neurotransmitter jelátviteli utak szinaptikus inputjának térbeli és időbeli integrációja befolyásolja. Ezenkívül kontrollálja a szinapszisokra vonatkozó szabályozó hatások térbeli kiterjesztését, feltárva az asztrociták szinaptikus információfeldolgozását (Araque és mtsai, 2014). Például az asztrocita glutamát leadása fokozza a hyppocampális glutamáterg szinaptikus transzmissziót, preszinaptikus NMDAR-független mechanizmusokon keresztül. Asztrocita általi glutamát felszabadulás azonban postszinaptikusan is felléphet NMDAR-ek által, ezzel fokozva az idegsejtek ingerlékenységét. Ezenfelül képes preszinaptikus metabotrop glutamát receptorhoz kötődni, előidézve heteroszinaptikus depressziót. Így a glutamát gliotransmissziós hatása változó, hisz függ a pre- és postszinaptikus komponensek receptorainak specifikusságától. Már egy gliotransmitter is lehet egyidejűleg bizonyos szinaptikus terminálokon gátló vagy serkentő, hosszú- vagy rövidtávon a központi amygdalában (Durkee és Araque, 2019).
A neurális hálózatok és a különböző szinapszisok által befolyásolt asztrotociták szinapszisokra ható szabályozó tevékenysége további sokszínűséget biztosít az asztrocita-neuron kapcsolatoknak. A dorsalis striatumban található szinapszisok és asztrociták kölcsönhatása, - az amygdalánál leírtakhoz hasonlóan - szintén nagyon specifikus. Ezen az agyi területen két különböző típusú asztrocitapopuláció különíthető el, melyek specifikusan kapcsolatba lépnek közepesen tüskés neuronokkal és a két fő corticalis hálózat szinapszisaival, indirekt vagy direkt módon. Az asztrociták alcsoportjai specifikusan reagálnak a közepesen tüskés neuronok indirekt és direkt típusú útvonalaira, és szelektíven modulálják a corticostrialis szinapszisokat. A neurális hálózatokként eltérő asztrocita-neuron jelátadás funkcionális hatásai és következményei még vitatottak; elképzelhető, hogy koordináló szereppel bírnak (Durkee és Araque, 2019).
Az asztrocitákról ismert, hogy képesek különböző gliotransmitterek kibocsátására, amelyek a szinapszisokra többféleképpen is hathatnak. Az, hogy vajon egy-egy asztrocita képes-e különböző gliotransmitterek kibocsátására, egy igazán fontos kérdés, ahogy az is, hogy ha igen, akkor mik lehetnek a jelenséget szabályozó körülmények (Durkee és Araque, 2019)?
Araque és Covelo 2018-ban, - egyetlen, önálló asztrocita sejtet vizsgálva - kísérletileg kimutatták, hogy a GABAerg interneuronok alacsony szinten történő stimulálása (pl.: rövid idejű vagy alacsony gyakoriságú stimuláció) az asztrocita aktivációját eredményezte a GABA-B receptorokon keresztül. Ezen aktiváció az asztrocitából glutamát leadását váltotta ki, mely a preszinaptikus mGluR1 receptorokhoz kötődve, a szinaptikus hatékonyságot átmenetileg növelte. Ezzel szemben a magasabb stimulációs szintek (pl. hosszú időtartamú vagy magas frekvenciájú stimuláció) kétfázisú választ váltottak ki. Ez esetben az asztrocita nem csak glutamátot, hanem ATP-t is kibocsátott, mely - az mGluR1 receptor mellett - az A1 adenozin receptor aktivációját is előidézte. A hatás ezúttal a szinaptikus hatékonyság kezdeti átmeneti növekedése és későbbi hosszabb ideig tartó csökkenése volt. Összefoglalva mindez azt sugallja, hogy egyetlen asztrocita dekódolhatja a neuronális bemeneti jelet és integrálhatja ezt az információt a specifikus gliotransmitter leadással, amely serkentő vagy gátló hatást gyakorolhat a szinaptikus átvitelre (Covelo és Araque, 2018).
A leírt eredmények a neuron-asztrocita hálózatok rendkívüli komplexitását támasztják alá. Már egyetlen asztrocita által leadott, egyik típusú gliotransmitternek is lehetnek eltérő hatásai, de egyetlen asztrocita két vagy több típusú gliotransmittert is kibocsáthat, amelyek különböző időbeli dinamikájukkal hatnak. Összességében tehát, ezek a megállapítások rávilágítanak az asztrocita-neuron jelátvitel összetettségére és annak lehetséges változatos hatásaira (Durkee és Araque, 2019).
A gliotransmitterek szerepe a rendellenes kórképek kialakulásában
A gliotransmitterek felszabadulása szabályozza a neuronok és az agyi extracelluláris környezet közötti szinaptikus transzmissziót. Ismert, hogy a glutamát és a D-szerin szinaptikus transzmissziót gerjeszt. Ugyanakkor, hogy az ATP erősíti vagy gátolja-e a szinaptikus transzmissziót, részben még mindig vitatott, mert az ATP-ből szintetizált metabolit, az adenozin, általában az adenozin A1 receptorok révén gátolja a szinaptikus aktivitást. Ezért érthető, hogy elméletek vannak azzal kapcsolatban, hogy ezen gliotransmitterek felszabadulásának egyensúlyhiánya megváltozott neuronális aktivitást eredményezhet. Számos kóros állapot, köztük a központi idegrendszeri betegségek, a traumás agyi sérülések, a fejlődési rendellenességek és a prenatális kiszolgáltatottság ártalmas molekuláknak, kimutatott, hogy szorosan kapcsolódnak a gliotransmisszió károsodásához (Harada és mtsai, 2016).
Tény, hogy a gliotransmitter-felszabaduláshoz kapcsolódó fehérjék (például a vezikuláris transzporterek és a vezikulummal kapcsolatos membránfehérjék) diszfunkciója az asztrocitákban súlyos agyi rendellenességeket és rendellenes viselkedést okozhat. Ugyanakkor a traumás sérülések, a stroke és egyes fertőzések astrogliózist (reaktív asztrociták) okoznak. Ezek a reaktív asztrociták neurotoxikus mennyiségű glutamátot termelnek és szabadítanak fel. Az asztrociták szintén hozzájárulnak a véragygát megfelelő fejlődéséhez az endotheliális sejtek és a pericyták összehangolásával, a véráramból kiválasztott molekulák neuronokba történő átvitelével és védő gátat biztosítanak a mérgező anyagok ellen. Így a krónikus környezeti vegyi anyagoknak vagy az érrendszeri gyulladásos molekuláknak való kitettség potenciálisan befolyásolhatja az asztrociták és a gliotransmitterek felszabadulását (Harada és mtsai, 2016).
Irodalomjegyzék
Képforrás
Harada és mtsai (2016) illusztrációja alapján átrajzolva (1.,2.,3. ábra)