Itt írjon a(z) Helicobacter-Magen-ról/ről
sdfsdfgsdfgdgf
Die Wirkung von Helicobacter pylori auf die Magenphysiologie
von Antonia Fankhauser, Tanja Stribel und Lara-Janina Bauer
Contents
Allgemeine Einleitung
Helicobacter pylori gehört zu der Gattung der Helicobacter-Stäbchenbakterien und ist vorwiegend im Magen zu finden. Die Bezeichnung leitet sich von dem Wort „Helix“ für Schraube und „Pylorus“ für Magenausgang ab. Es ist Auslöser von einigen Ulkus-Krankheiten sowie von chronischer Gastritis. (Suerbaum et al, 2016)
Systematik und Taxonomie
Die Systematik beschreibt allgemein eine planmäßige Einordung & Benennung von Begriffen. Im Bezug auf biologische Gebiete verwendet man jedoch auch den Ausdruck „Taxonomie“.
Taxonomie ist also ein Teil der Systematik, der sich mit der hierarchischen Klassifikation von Lebewesen beschäftigt.
Systematik & Taxonomie des Helicobacter pylori:
· Abteilung: Proteobacteria
· Klasse: Epsilonproteobacteria
· Ordnung: Campylobacterales
· Familie: Helicobacteraceae
· Gattung: Helicobacter
· Art: Helicopacter pylori
Entdeckung
Lange Zeit ging man davon aus, dass es bakteriellen Organismen nicht möglich sei, im sauren Milieu unserer Magenphysiologie zu überleben. Als ausschlaggebende Faktoren für gastroduodenale Ulkuserkrankungen nannte man Stress, diätische Faktoren, sowie die gastrale Verdauungssaft-Sekretion. Im Jahr 1983 wurde Helicobacter pylori erstmals von Barry Marshall und John Robin Warren in Perth, Western Australia beschrieben. Ihre Forschungen beschäftigten sich intensiv mit Helicobacter pylori als pathogener Faktor diverser gastroduodenaler Beschwerden. Dies stellt bis heute einer der wichtigsten Meilensteine unserer modernen Gastroenterologie dar. 2005 wurden ihre Forschungsarbeiten mit dem Nobelpreis für Medizin oder Physiologie ausgezeichnet. Ursprünglich wurde das Bakterium „Campylobacter pylori“ benannt. Allerdings wurde kurze Zeit später klar, dass eine eindeutige Zuteilung zur Gattung der Campylobacter nicht möglich sei. Daraufhin einigte man sich auf den heutigen Namen „Helicobacter pylori“, wobei der Name als Anspielung auf dessen spiralförmig-helikalen Form zu verstehen ist.
Verbreitung und Epidemiologie
Helicobacter pylori ist eine der am häufigsten vorkommenden, bakteriellen Infektionen. Heutzutage sind weltweit fast 50% der Menschen infiziert. Die Prävalenz variiert geographisch sehr. In Entwicklungsländer liegt die Zahl der Betroffenen bei 80-90%. In entwickelten Ländern ist die Prävalenz deutlich niedriger und liegt bei 10-50%. Auch innerhalb der Bevölkerung kommt es zu Abweichungen. So sind ältere Erwachsene mit über 50% deutlich häufiger betroffen als Jugendliche mit 7%. Dies lässt sich auf den Kohorten Effekt zurückführen, da die meisten Ansteckungen in der Kindheit stattfinden. Gründe dafür waren die geringeren Hygienemaßnahmen sowie eine weitere Verbreitung. Es lassen sich auch Unterschiede der Prävalenz im sozioökonomischen Verhältnis zeigen. Eine erhöhte Verbreitung innerhalb eines Geschlechts wird noch diskutiert (Bornemann und Gaber, 2013).
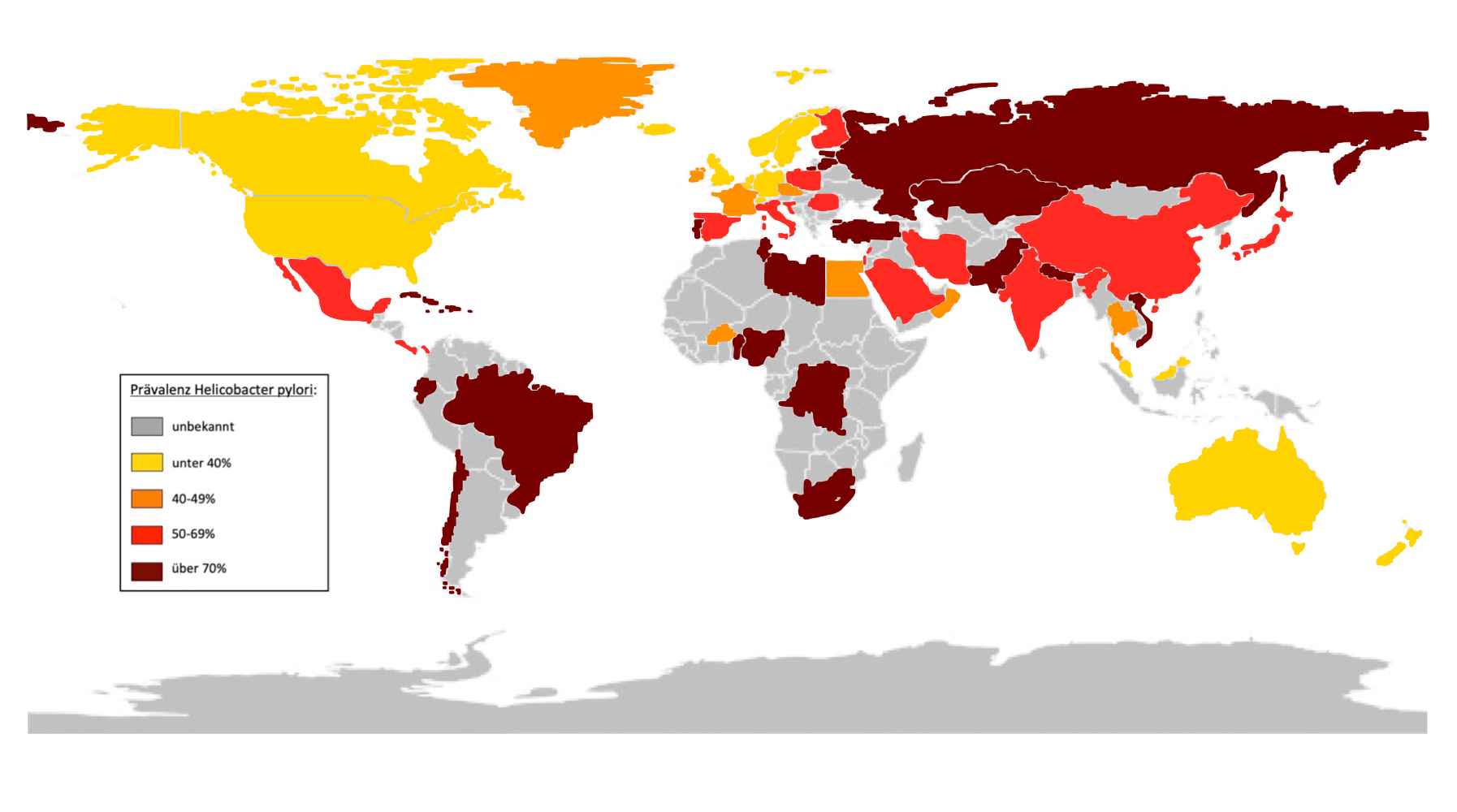
Abb. 1: Verbreitung Helicobacter pylori 2017 (Hooi, et al 2017)
Infektionswege
Obwohl der exakte Übertragungsmechanismus von Helicobacter pylori noch großteils unklar ist, konnte der Mensch als Hauptwirt des Bakteriums identifiziert werden. Die Infektion tritt höchstwahrscheinlich im frühen Kindheitsalter durch nahe Familienmitglieder auf. Primäre Übertragungswege basierend auf nachfolgenden Mensch-Mensch-Übertragungswegen:
- oral-orale-Transmission -oral-fäkale-Transmission
H.pylori konnte bislang aus Speichel, Erbrochenem, Magenrefluxat, sowie Kot isoliert werden. Des Weiteren wurde das Bakterium in Primaten und Haustierarten beschrieben, wobei eine zoonotische Übertragungsweise noch nicht bewiesen wurde (Kusters J. et al, 2006).
Zusätzlich ist ein erhöhtes Infektionsrisiko bei Gastroenterologen und Endoskopie-Personal zu beachten, welche aufgrund ihres Tätigkeitsbereichs engen Patientenkontakt, sowie Kontakt mit den vorherig beschriebenen, potentiellen Infektionsquellen haben (Bornemann R. et Gaber E., 2013).
Pathogenese
Unter physiologischen Umständen ist die Schleimhaut des Magens gut gegen mechanische Einflüsse und chemisch-bakterielle Pathogene geschützt. Bei einer Infektion mit Helicobacter pylori macht sich das Bakterium diese Eigenschaften zu Nutze, um sich erfolgreich in das Magenepithel einzunisten und damit der Immunantwort des Wirtsorganismus zu entkommen. Insgesamt wird das Epithel direkt durch zytotoxische Substanze, sowie indirekt durch Stimulation des Immunsystems beschädigt, was weitreichende Folgen für den Wirtsorganismus nach sich ziehen kann. Für die erfolgreiche Einnistung besitzt H. pylori spezifische Adaptionen.
Urease-Enzym
Nach der Infektion mit Helicobacter pylori ist das erste Ziel die Einnistung in das Magenschleimhautepithel, wobei das saure Milieu die empfindliche Homeostase des Erreger aus dem Gleichgewicht bringen kann. Um dies zu verhindern hydrolisiert H.pylori Harnstoff zu Ammoniak und Kohlenstoffdioxid. Spezifisches Enzym dieser Spaltung ist die Urease. Der entstandene Ammoniak hebt den sauren pH-Wert des Magenmilieus im direkten Bereich des Bakteriums an, sodass ein lokal-schützender Mantel entsteht und das Bakterium überlebt. Die Aktivität der Urease wird durch einen pH-anhängigen Harnstoffkanal gesteuert, dem Urel. Bei niedrigem pH-Wert ist der Kanal geöffnet, Harnstoff kann eintreten und wird gespalten, und damit steigt der pH-Wert an. Dies wirkt sich vorteilhaft aus das Überleben von H. pylori aus. Herrschen allerdings neutrale Verhältnisse ist Urel geschlossen, Harnstoff kann nicht weiter eintreten. Dieser Mechanismus stellt sicher, dass der pH-Wert nicht in das alkalische Milieu abrutscht. Des Weiteren trägt Urease zur Chemotaxis der neutrophilen Granulozyten, sowie der Extravasation bei und stimuliert dadurch die Immunantwort des Wirts. Auch wird das Enzym in der Diagnose einer Infektion mit H.pylori herangezogen (Michetti und Suerbaum, 2002).
Flagella und Adhäsin-Proteine
Mit Hilfe von langen, fadenförmigen Fortsätze, den sogenannten Geißeln oder Flagellen, heftet sich Helicobacter pylori eng an das Zielepithel der Magenschleimhaut. Dieser Vorgang wird ebenfalls durch spezielle Adhäsin-Proteine aus der Oberfläche des Bakteriums begünstigt. Das wohl bekannteste Adhäsin ist BabA, ein 78-kD-Außenmembranprotein. Nach gelungener Anheftung ist es dem Bakterium möglich, mit der aktiven Einnistung in das Epithel zu beginnen (Michetti und Suerbaum, 2002).
VacA
VacA ist ein vakuolisierndes Zytotoxin. Es wird von den meisten H.pylori-Stämmen exprimiert. Jedoch ist es auch VacA-negativen Mutanten möglich, sich ohne größere Probleme zu vermehren. Daher geht man davon aus, dass VacA keine ausschlaggebende Funktion bei der Entwicklung von H.pylori hat. Fest steht jedoch, dass das Exotoxin die bakterielle Fitness erhöht und somit als Virulenzfaktor wirkt. Nach der Sekretion von VacA durch H.pylori bindet das Zytotoxin an die Epithelmembran und bildet einen spannungsabhängigen Kanal. Dieser macht die Freisetzung von Bicarbonat und organischen Anionen möglich. Ferner wird spekuliert, ob das Bakterium mithilfe von VacA Nährstoffe zugeführt werden können. In Kombination mit der Anheftung an die mitochondrielle Membran führt VacA zur Freisetzung von Cytochrome c und induziert den programmierten Zelltod (Apoptose, Vakuolisation) (Michetti und Suerbaum, 2002).
CagA
Die meisten Stämme von Helicobacter pylori besitzen eine sogenannte cag-Pathogenitätsinsel (cag-PAI). Dies ist eine Genom-Frequenz, welche für die Codierung von insgesamt 29 Genen verantwortlich ist. Codiert wird der Typ-2-Sekretionsapparat, welcher für das Einschleusen eines speziellen Proteins in die Wirtszelle verantwortlich ist. Hierbei handelt es sich um das cagA-Protein. Nach dessen Eintritt in die Wirtszelle ist cagA phosphoryliert und bindet anschließend an SHP-2-Tyrosin-Phosphatase. Hierbei entsteht ein Botenstoff, wodurch es zur zellulären Immunantwort und Zytokin-Produktion in dem Wirtsorganismus kommt. Die andauernden Rekrutierungen von neutrophilen Granulozyten und hierdurch produzierte reaktive Sauerstoff- und Stickstoff-Spezies, sowie die Aktivierung von T- und B-Lymphozyten, B-Plasmazellen und Makrophagen durch das Immunsystem führen in Kombination mit Epithelschädigungen zu einer chronischen Gastritis und weiteren Erscheinungen des klinischen Krankheitsbildes der Infektion mit Helicobacter pylori(Michetti und Suerbaum, 2002).
Interleukine
Helicobacter pylori Infizierte weisen oftmals einen erhöhten Spiegel an Interleukinen im Magenepithel auf. Hierbei spielen vorallem Interleukin-1b, -2, -6, -8, sowie erhöhte Tumornekrosefaktoren eine entscheidende Rolle. Besonders Interleukin-8 wirkt stark neutrophil-aktivierend, woraufhin eine starke humorale und zelluläre Schleimhautreaktion ausgelöst wird. Die induzierte Antikörper-Produktion auf humoraler Ebene kann zu weiteren Gewebeschädigungen führen, eine Eradikation des Bakteriums ist nicht möglich. Des Weiteren wird von einer Auto-Antikörper-Reaktion bei infizierten Personen berichtet. Die Reaktion ist hierbei gegen die H+/K+-ATPase der Magenschleimhaut gerichtet. Dies steht im Zusammenhang mit einer erhöhten Atrophie des Corpus ventriculi (Michetti und Suerbaum, 2002).
T-Zell-Subtypen der spezifischen Immunantwort
Auch die Entstehung von diversen Subtypen von T-Zellen treten im Zusammenhang mit einer voranschreitenden Infektion mit H. pylori auf. Unreife T-Zellen werden grundsätzlich in zwei Subtypen unterteilt: Th1- und Th2-Zellen. Während Th1-Zellen vorwiegend Interleukin-2 und Interferon-g sekretieren, somit die Immunantwort auf intrazelluläre Pathogene stimulieren und eine Gastritis fördern, beschäftigen sich Th2-Zellen im Gegensatz dazu primär mit dem Schutz der Magenschleimhaut. Ferner handelt es sich bei den Sekretionprodukten von Th2-Zellen um Interleukin-4, -5, -10. Die Stimulation der B-Zell-vermittelten Immunantwort für extrazelluläre Pathogene wird unterstützt. H.pylori als Pathogen ruft in diesem Kontext die Th1-Zell-Immunantwort hervor, wodurch eine Gastritis gefördert wird. Dies kann im weiteren Verlauf zu schwerwiegenden Krankheitsverläufen führen (Michetti und Suerbaum, 2002).
Klinisches Krankheitsbild
Obwohl im Magen ein saures Milieu herrscht, hat das Helicobacter pylori – Bakterium trotz all der Sicherheitsmaßnahmen der Magenschleimhaut durch mehrfache Anpassungen einen Weg des Überlebens gefunden.
Lange Zeit war dies nicht klar, jedoch gilt eine Helicobacter pylori - Infektion als Auslöser einer chronischen Gastritis plus in weiterer Folge von Magen- & Zwölffingerdarmgeschwüren wie auch von MALT-Lymphomen und von Adenokarzinomen des Magens (auch benannt als Magenkrebs).
Die Symptome dieser Krankheit sind individuell und bei einer akuten Infektion oft mit Übelkeit und Schmerzen im Bauch verbunden. Eine solche akute Erkrankung erfolgt für gewöhnlich in der Kindheit, wird zu diesem Zeitpunkt jedoch selten als eine Helicobacter pylori – Infektion erkannt. Die gesundheitlichen Probleme bilden sich meistens nach ein paar Tagen zurück, dennoch bleibt das Bakterium im Magen und verursacht somit über Jahre hinweg eine chronische Gastritis (Falke et al, 2005).
Chronische Gastritis
Eine Gastritis – Erkrankung, die durch das Helicobacter pylori und das Enzym „Urease“ verursacht wird, wird auch „chronische Gastritis Typ B“ genannt. Dieses Enzym spaltet Harnstoff in Ammoniak (Häussinger, 2018).
Wie bereits erwähnt, bleibt der Keim nach einer akuten Infektion im Magen beständig und löst im Laufe der Zeit häufig eine „symptomlose“, „Entzündungsreaktion“ aus (Falke et al, 2005). Diese Reaktion ist durch „ein Infiltrat aus Granulozyten, Lymphozyten und Plasmazellen“ gekennzeichnet (Falke et al, 2005).
Aus dieser chronischen Gastritis können, wie zuvor besagt, häufig Folgekrankheiten auftreten.
Magen- und Zwölffingerdarmgeschwür (Ulkuskrankheit)
Eine gastroduodenale Ulkuskrankheit gilt als eine der am häufigsten auftretenden Folgeerkrankungen durch das Helicobacter pylori (Falke et al, 2005). Ein Ulkus beschreibt tiefgehende Verletzungen der Schleimhaut, bei der sich durch die Wirkung von in dem Magen enthaltenen Pepsin und Salzsäure, Geschwüre bilden. Derartige Geschwulste kommen hauptsächlich im Magen (= ulcera ventriculi) und im Zwölffingerdarm (= ulcera duodeni) vor (Bornemann et al, 2013).
MALT-Lymphome
Das Marginalzonen-B-Zell-Lymphom „MALT“ ist eine Bezeichnung für „mucosa associated lymphoid tissue”. Bei einer nicht infizierten Magenschleimhaut kommen Lymphfollikel nur sehr selten in dieser Magengegend vor. Jedoch bilden sich als Folge einer chronischen Gastritis „lymphozytäre Aggregate und Lymphfollikel an der Magenschleimhaut“, die die Herstellung von „Lymphozyten und Plasmazellen“ verstärken (Weingart V., 2005). Dies hat zur Folge, dass dieses Gewebe (MALT) einwächst und somit den Beginn eines „malingnen MALT-Lymphoms des Magens“ darstellen kann (Falke et al, 2005).
Magenkarzinome / Adenokarzinome
Für das Auftreten eines Magenkarzinoms in Hinblick auf das Helicobacter pylori werden verschiedene Aspekte aufgefasst und erforscht. Beispielsweise kann eine vermehrte „Proliferation des Magenepithels“ (Proliferation) in Zusammenhang mit dem Bakterium genannt werden (Weingart, 2005).
Diagnostik
Für den Nachweis einer Helicobacter pylori Infektion wurden über die Jahre viele verschiedene Methoden entwickelt. Es werden „invasive von nichtinvasiven Nachweismethoden“ unterschieden (Labenz et al, 2006). Eine invasive Technik stellt der Urease-Schnelltest und eine Biopsie dar. Bei einer nicht-invasiven Methode verwendet man den Harnstoff-Atemtest und den Stuhl-Antigentest (Bolten et al, 2016).
In dem folgenden Abschnitt werden nun verschiedene Methoden beschrieben.
Invasive Nachweisverfahren
Biopsie/Histologie
Bei dieser Methode liegt die Sensitivität bei 80 – 98% und die Spezifität 90 – 98% (Bolten et al, 2016).Für das Verfahren werden Proben von der kleinen und der großen Kurvatur des Magens sowie von dem Antrum entnommen (Bolten et al, 2016). Durch diese Vorgehensweise kann eine Gastritis ermittelt werden. Dadurch wird auch das „Karzinomrisiko“ begutachtet, da eine korpusdominante Gastritis ein weitaus höheres Risiko birgt als die antrumdominante Magenschleimhautentzündung (Bolten et al, 2016). Um das histologische Präparat zu färben, eignet sich am besten die Giemsa- Färbung. Weitere Tönungen wie die Warthin-Starry-Färbungen und die Immunhistochemie werden aufgrund der Kosten und der Laborarbeit nicht bevorzugt (Bolten et al, 2016).
Helicobacter-Urease-Schnelltest
Die Methodik des Urease-Schnelltestes beruht auf einer Biospie, die während einer Endoskopie aus dem Antrum und dem Korpus des Magens entnommen wird. Diese Proben werden getrennt und in ein keimfreies „Eppendorf – Hütchen“ untergebracht. Die Testergebnisse erschließen sich aus der Farbveränderung der Testexemplare. Nach jeweils 10 Minuten, 30 Minuten, 2 Stunden und 24 Stunden wird der Test abgelesen. Positiv auf Helicobacter pylori ist er, wenn das Medium, welches zuvor mit der Indikatorsubstanzen Neutralrot und Bromthymolblau versetzt wurde, sich entweder ganz blaugrün verfärbt oder sich zumindest eine intensive blaugrüne Reflexion um das Biopsie-Teilchen bildet (Adamek et al, 1994). Diese Reaktion ist auf die „hohe Ureaseaktivität der in der Schleimhaut vorhandenen Erreger“ zurückzuführen (Falke et al, 2005). Hingegen wird der Test als negativ gewertet, wenn die Probe bzw. das Umfeld des Partikels eine rote Farbe annimmt.(Adamek, 1994)
Nicht-invasive Nachweisverfahren
C13 Harnstoff Atemtest
Dieser Test eignet sich sowohl für einen Erstbefund einer Heilicobacter pylori- Infektion als auch für die Kontrolle bereits nach einer Eradikation (Eradikation). Die Methode ist sehr hilfreich, wenn man den Verlauf einer Eradikation überprüfen möchte, da durch diese Maßnahme „die Spaltung von dem stabilen Kohlenstoffisotop 13C markierten Harnstoff durch die H. pylori – Urease“ nachgewiesen werden kann (Falke et al, 2005). Wenn eine Infektion vorliegt, kann ein aus dem 13C-Harnstoff freigesetztes 13CO2 bei der Ausatmung festgestellt werden (Falke et al, 2005).
H. pylori-Stuhl-Antigen-Test
Mit diesem Verfahren können Helicobacter pylori – Antigene im Stuhl nachgewiesen werden. Zur Verdeutlichung dieses Testes wird folgend das Testprinzip des Willi Fox- Helicobacter pylori Stuhltest beschrieben.Diese Methode ist ein nicht-invasiver Membrantest, der sehr deutlich und in kurzer Zeit durchführbar ist. Der Willi Fox Test stütz sich auf zwei monoklonalen Antikörper gegen Helicobacter pylori. Der erste Antikörper ist linienförmig auf der Membran angelagert, der zweite hingegen ist mit Goldpartikel versehen, um die Färbung zu garantieren. Wenn das H. pylori Bakterium im Stuhl vorhanden ist, wird sich ein Komplex mit dem farbmarkierten Antikörper bilden. Wenn die Flüssigkeit über die Membran des Teststreifens hinausläuft, wird eine rote Linie entstehen, da der Komplex von dem ersten Antikörper abgefangen wird. Demnach kann dieses Ergebnis als positiv bewertet werden.
Therapie
Für die Eradikation der H.pylori Infektion gibt es verschiedene Therapieschemata. Diese unterscheiden sich vor allem in der Zusammensetzung ihrer Präparate (Abbildung 2). Grundsätzlich bestehen alle Therapien aus mindestens einem Antibiotikum, sowie einem Protonenpumpeninhibitor (PPI). Das Antibiotikum tötet die schädlichen Bakterien ab oder hemmt ihren Wachstum (Stille et al, 2006). Der Inhibitor dient als Magenschutz während der Therapie, in dem es die Bildung der Magensäure durch die Protonenpumpe hemmt (Horvath und Stadlbauer, 2020).
Der Therapieablauf (Abbildung 3) wird danach bestimmt, ob ein Patient einen hohen oder niedrigen Risikofaktor für eine Clarithromycin-Resistenz hat. Der Grenzwert liegt bei 15% (Fischbach et al, 2016). Dieser Risikofaktor setzt sich aus Herkunft und vorherigen Medikationen des Behandelten zusammen. In Europa gibt es eine große Spannweite der Resistenz von 5,6-36,6%. In Deutschland lag die Resistenz im Jahr 2011/2012 bei 10,6% mit steigender Tendenz. In den süd- und osteuropäischen Ländern liegt die Rate über 20%. Metronidazol und Amoxicillin Resistenzen kommen seltener vor.
Die Erstlinien-Therapie bei niedrigem Risikofaktor wird entweder mit einer der Standard-Therapien oder der Bismut-haltigen Quadrupeltherapie durchgeführt. Die Standard-Therapien werden je nach dem welches Antibiotikum verwendet wird, in die französische und italienische Therapie unterteilt. Ihre Dauer beträgt 7-14 Tage, allerdings wird eine Dauer von 10 Tagen empfohlen, da dies die Eradikationsrate erhöht. Die auch Bismut-Vierfachtherapie genannte Behandlung, ist seit Januar 2013 in Deutschland zugelassen und hat Studien zufolge eine höhere Eradikationsrate als die Triple-Therapien. Ihre Dauer beträgt 10 Tage. Schlägt die Erstlinien-Therapie fehl, wird mit anderen Therapien weiterbehandelt. Es wird abgeraten, die Triple-Therapie zu wiederholen, da die Antibiotika-Resistenz über 60% steigen könnte.
Die möglichen Zweitlinien-Therapien sind die Fluorchinolon-haltige Tripletherapie oder die Bismut-haltige Quadrupeltherapie. Kommt es auch hier zu einem Therapieversagen, muss vor dem Beginn der Drittlinien-Therapie ein Resistenz Test gemacht werden, der den weiteren Therapieverlauf bestimmt.
Hat der Patient einen erhöhten Risikofaktor, wird in erster Linie mit der Bismut-haltigen Therapie oder der kombinierten ("konkommitierenden") Vierfachtherapie behandelt. Letztere hat Studien zufolge eine Eradikationsrate von über 90%. Versagt die Erstlinien-Therapie, wird mit der Fluorchinolon-haltigen Therapie weiterbehandelt. Schlägt keine der Therapien an, folgt der gleiche Vorgang wie bei dem Risiko niedrigen Therapieschemata.
Es gibt noch alternative Therapien, wie die Sequenztherapie, die beispielsweise bei Allergikern angewandt wird.
Die Medikamente werden oral eingenommen. In Ausnahmefällen kann es auch intravenös verabreicht werden. Dies hat keinen Effekt auf die Eradikationsrate (Fischbach et al, 2016).
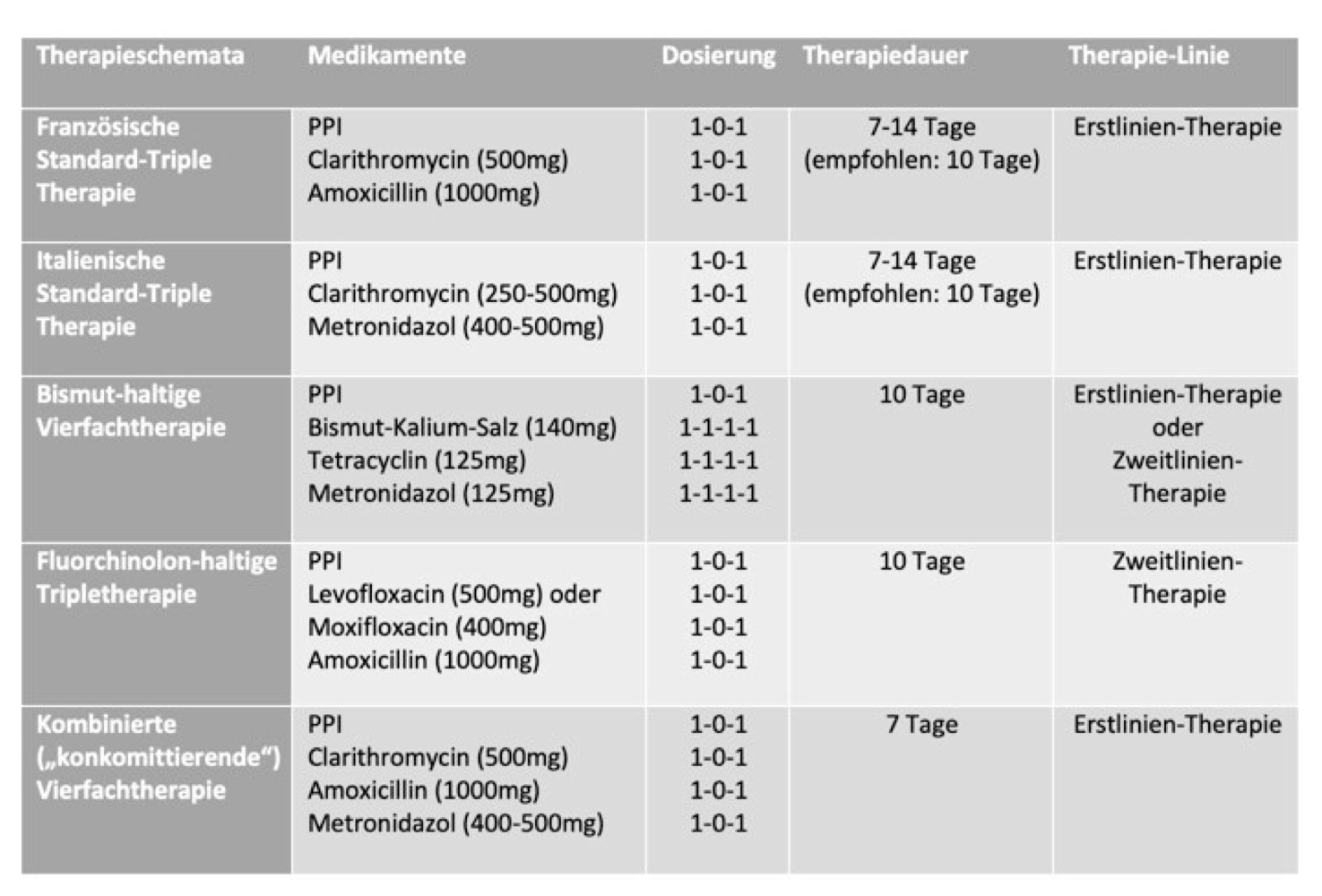
Abb. 2: Informationen zu den Therapien (Fischbach et al, 2016)
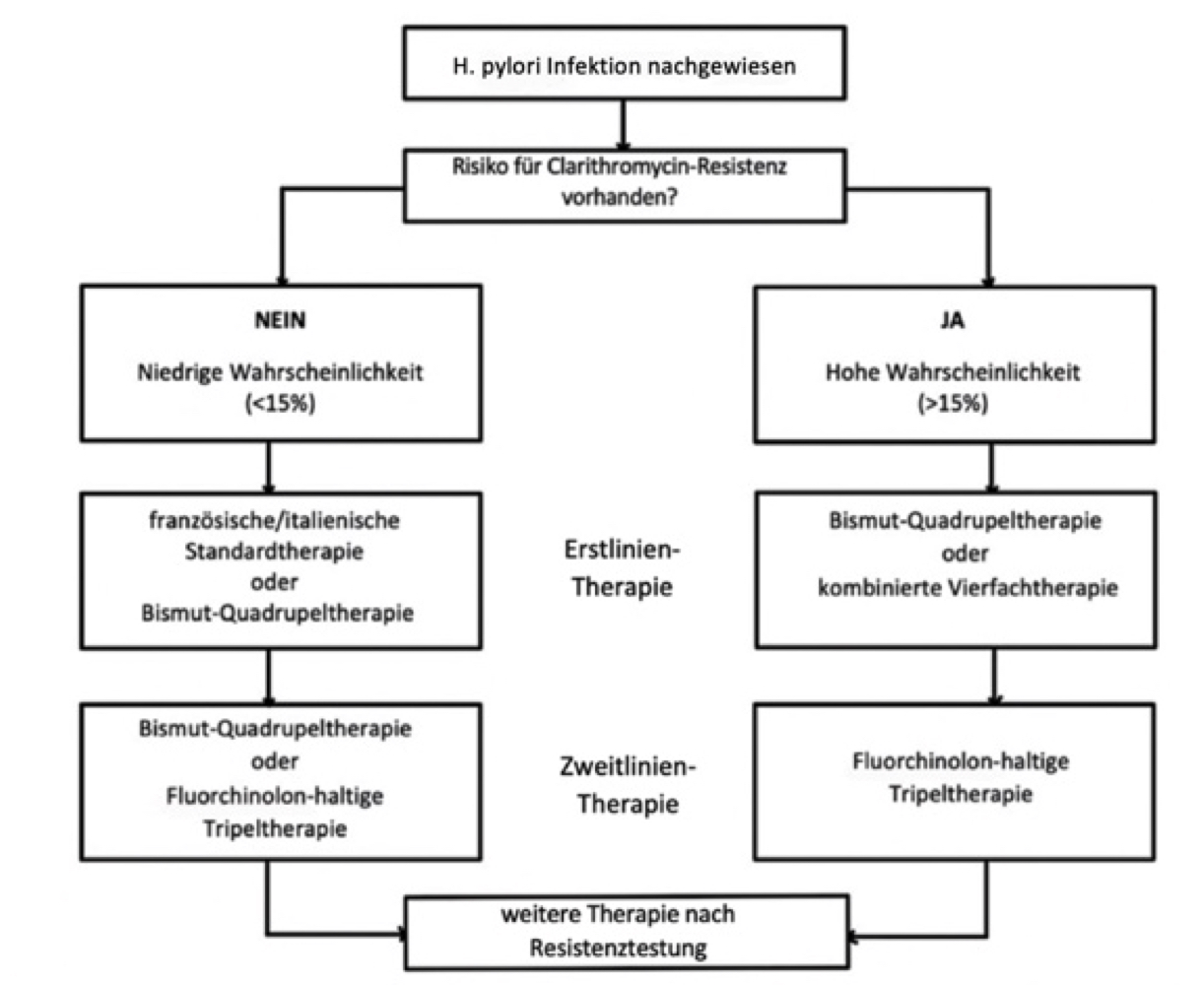
Abb. 3: Therapieverlauf (Fischbach et al, 2016)
Prävention
Um die Infektion mit Helicobacter pylori zu vermeiden, sollten verschiedene Faktoren berücksichtigt werden. Diese dienen der Schonung der Magenschleimhaut, durch die Senkung der Säureproduktion.
- Verminderte Zunahme bestimmter Nahrungsmittel. Hierzu gehören scharfes, geräuchertes sowie süßes Essen. Außerdem sollten Alkohol, Koffein und Fett vermieden werden.
- Einnahme präventiver Mittel, zum Beispiel Heilerde und diverse Kräuter
- Stress minimieren
- bei Einnahme von Medikamenten auf die Nebenwirkungen achten. Nutzen und Risiko abwägen. Zusätzlich kann ein Protonenpumpeninhibitor eingenommen werden.
Im Labor, vor allem bei endoskopischer Arbeit mit Helicobacter pylori müssen die Hygiene- sowie Reinigungsmaßnahmen eingehalten werden.
Einen anwendbaren Impfstoff für H. pylori gibt es noch nicht. Alle bisherigen Ansätze sind bisher im In-vitro- oder Tierversuch - Stadium. Bei künftigen Impfstoffen wird zu unterscheiden sein in einen präventiv sowie akut einsetzbaren Wirkstoff (Bornemann und Gaber, 2013).
Nebenwirkungen
Die Rate der Nebenwirkungen einer Therapie gegen die H. plyori Infektion liegt unter 5%. Generell kann gesagt werden, dass die Behandlung gut verträglich ist und wenige Komplikationen hervorruft (Fischbach, et al 2016).
Sollte es doch zu Nebenwirkungen kommen, werden diese meist durch die Antibiotika ausgelöst, da diese nicht nur gegen die krankheitsverursachenden Bakterien vorgehen, sondern häufig auch die körpereigenen, nützlichen Bakterien angreifen. Antibiotika greifen beispielsweise in die Darmflora ein, was Magen-Darm-Beschwerden wie Durchfall hervorrufen kann (Stille et al, 2016).
Mögliche Nebenwirkungen können durch Probiotika gesenkt werden. Diese haben keinen Einfluss auf die Eradikationsrate.
Prognose
Ein Therapieerfolg kann erst durch diverse Tests, mindestens vier Wochen nach Abschluss der Behandlung festgestellt werden. Mit den angewandten Therapieschemata liegt die Eradikationsrate bei circa 90%. Nach effektiver Therapie ist die Wahrscheinlichkeit einer erneuten Infektion mit H. pylori sehr gering, unter 1% (Fischbach et al, 2016).
Quellverzeichnis
Literaturverzeichnis
Bücher
- Falke D., Hahn H., Kaufmann S.H.E.; Ullmann U. (2005): Medizinische Mikrobiologie und Infektiologie (5): 291 – 295
- Brodt, H.R.; Groll, A.H.; Just-Nübling, G.; Stille, W. (2006) Antibiotika-Therapie. Klinik und Praxis der antiinfektiösen Behandlung. Stuttgart, New York: Schattauer GmbH: 4
- Suerbaum S. (2016). Medizinische Mikrobiologie und Infektiologie. Berlin, Heidelberg: Springer-Verlag: 277
Fachartikel mit weiterführenden Links
Adamek R.J.; Aygen S.; Freitag M.; Hennemann O.; Labenz J.; Opferkuch W.; Rühl G.H.; Wegener M. (1994): 13C-Harnstoff-Atemtest zur Helicobacter – pylori-Diagnostik. DMW: (46) 1569- 1572 https://www.researchgate.net/profile/Sitke-Aygen/publication/15242036_The_modified_13C-urea_breath_test_in_the_diagnosis_of_Helicobacter_pylori_colonization_of_the_gastric_mucosa/links/550988b10cf2d7a2812d0643/The-modified-13C-urea-breath-test-in-the-diagnosis-of-Helicobacter-pylori-colonization-of-the-gastric-mucosa.pdf
- Bolten W.; Bornschein J.; Buderus S.; Fischbach W.; Glocker E.; Hoffmann J.C.; Koletzko S.; Labenz J.; Lynen Jansen P.; Malfertheiner P.; Mayerle J.; Mössner J.; Miehlke S.; Peitz U.; Prinz C.; Selgrad M.; Suerbaum S.; Venerito M.; Vieth M. (2016): S2k-Leitlinie Heilcobacter pylori und gastroduidenale Ulkuskrankheit. S2k-guideline helicobacter pylori und gastroduodenal ulcer disease (54) 327-363
- Bornemann R.; Gaber E. (2013): Gesundheitsberichterstattung des Bundes. Gastritis, Magen- und Zwölffingerdarmgeschwüre 55: 23 – 28
- Häussinger D. (2018): Gastroenterologie, Hepatologie und Infektiologie: Magen 45 – 53
https://www.degruyter.com/document/doi/10.1515/9783110602678-004/html
- Labenz J.; Leodolter A. (2006): Diagnostik der Helicobacter-pylori-Infektion. Wer die Wahl hat, hat die Qual. Der Gastroenterologe (1) 253 – 258
- Weingart V. (2005): Erdadikationskontrolle von Helicobacter pylori mittels Stuhltest unter Verwendung monoklonaler Antikörper
- Bornemann R.; Gaber, E. (2013): Gesundheitsberichterstattung des Bundes. Gastritis, Magen- und Zwölffingerdarmgeschwüre 55: (4) 25 - 28
- Prof.Dr.med Miehlke (2018). Helicobacter-pylori-Infektionen. Arzneimitteltherapie (36): 2 - 6
https://www.arzneimitteltherapie.de/heftarchiv/2018/01/helicobacter-pylori-infektion.html
- Lehours P.; Metis A.; Mégraud F. (2015): The Hellenic Pasteur Institute. Epidemiology and Diagnosis of Helicobacter pylori infection: 1 - 3
- Horvath A,; Stadlbauer V. (2020): Das Mikrobiom als Drehscheibe für Nebenwirkungen der Protonenpumpenhemmer-Therapie. Thieme: 165
https://www.thieme-connect.com/products/ejournals/abstract/10.1055/a-1312-7587
- Bolten W.; Bornschein J.; Buderus S.; Fischbach W.; Glockner E.; Hoffmann J.C.; Koletzko S.; Labenz J.; Lynen Jansen P.; Malfertheiner P.; Mayerle J.; Miehlke S.; Mössner J.; Peitz U.; Prinz C.; Selgrad M.; Suerbaum S.; Venerito M.; Vieth M. (2016) S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit. AWMF-Register-Nr. 021/001: 340-344; 330-332
- Kuipers, E.J.; Kusters, J.G.; Van Vliet, A.H.M. (2006): Pathogenesis of Helicobacter pylori Infection. Clinical Microbiology Reviews 19: (3) 450
- National Institutes of Health (1994): Helicobacter pylori in Peptic Ulcer Disease. Consensus Development Conference Statement
https://consensus.nih.gov/1994/1994HelicobacterPyloriUlcer094html.htm
- Österreichische Ärztezeitung (2005): Helicobacter pylori. Orginalarbeit 23/24: 1-3
- Kuipers, E.J.; Kusters, J.G.; Van Vliet, A.H.M. (2006): Pathogenesis of Helicobacter pylori Infection. Clinical Microbiology Reviews 19: (3) 458
- Michetti, P.; Suerbaum, S. (2002): Helicobacter pylori Infection. The New England Joural of Medicine 347: (15) 1175-1177
Weblinks
Abbildungsverzeichnis
Abbildungen:
Abb.1: selbst angefertigt mit Daten der Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis (05.05.2021)
Abb.2: selbst angefertigt mit Daten der S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit (20.04.2021)
Abb.3: selbst angefertigt mit Daten der S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit (29.04.2021)