|
Size: 24524
Comment:
|
← Revision 60 as of 2018-05-11 07:27:07 ⇥
Size: 24519
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 81: | Line 81: |
| * Mück-Weymann M. (2002): ''Die Herzratenvariabilität als globaler Adaptivitätsfaktor in psycho-neuro-kardialen Funktionskreisen.'' In: Mattke, D. (Hrsg.): Vom Allgemeinen zum Besonderen: Störungsspezifische Konzepte und Behandlung in der Psychosomatik. Frankfurt/Main: Verlag für Akademische Schriften (S. 322-327) | * Mück-Weymann M. (2002): ''Die Herzratenvariabilität als globaler Adaptivitätsfaktor in psycho-neuro-kardialen Funktionskreisen.'' In: Mattke, D. (Hrsg.): Vom Allgemeinen zum Besonderen: Störungsspezifische Konzepte und Behandlung in der Psychosomatik. Frankfurt/Main: Verlag für Akademische Schriften 322-327 |
Herzfrequenzvariabilität
Contents
-
Herzfrequenzvariabilität
- Einleitung
- Geschichtliches
- Forschung
- Physiologische Regulation der Herzratenvariabilität
-
Beeinflussende Faktoren der Herzrhythmusvariabilität
- Die Wirkung von Nikotin und schwarzem Tee auf die HRV
- Entwicklungsunterschiede in den Auswirkungen von Alkohol und Stress auf die Herzfrequenzvariabilität
- Inhalations- / Exspirationsverhältnis moduliert den Effekt der langsamen Atmung auf Herzfrequenzvariabilität und Entspannung
- Herzratenvariabilität bei Typ 2 Diabetes mellitus Patienten
- HRV und das akute Atemnotsyndrom (ARDS)
- Fazit
- Literaturverzeichnis
- Weblinks
- Abbildungsverzeichnis
Einleitung
Die Herzrhythmusvariabilität (HRV) beschreibt die Fähigkeit des Organismus, die Frequenz des Herzrhythmus an unterschiedliche Anforderungen anzupassen. Diese Anpassungen treten in Form von Variationen im zeitlichen Abstand zwischen den einzelnen Herzschlägen auf. Die Größenordnung dieser Variationen bewegt sich im Millisekundenbereich und ist mit herkömmlichen Pulsmessgeräten nicht zu identifizieren. Beeinflussende Faktoren der Herzrhythmusvariabilität können körperliche Beanspruchung und psychische Belastung (Stress) sein. Diese beiden Faktoren können das Herz schneller oder stärker schlagen lassen, in diesem Fall ist es keine Krankheit, sondern eine ganz normale Anpassungsreaktion und ein Zeichen von Gesundheit. Krank ist man erst dann, wenn sich das Herz nicht mehr „flexibel“ äußeren oder inneren Belastungen anpassen kann.
|
Geschichtliches
Die Herzrhythmusvariabilität besitzt eine lange Geschichte, speziell in der traditionellen chinesischen Medizin. Bereits im dritten Jahrhundert nach Christus, erkannte der chinesische Arzt Wang Shuhe (s. Abbildung 1) die Bedeutung eines variablen Herzschlages. Eine seiner Feststellungen war: „Wenn der Herzschlag so regelmäßig wie das Klopfen des Spechts oder das Tröpfeln des Regens auf dem Dach wird, wird der Patient innerhalb von Vier Tagen sterben“ (Wang Shuhe, 300 n. Chr.). Der chinesische Gelehrte hatte offenbar erkannt, dass ein variabler Herzschlag ein Zeichen von Gesundheit ist.
In der modernen Wissenschaft wird die HRV erstmals Mitte der 60er Jahre für die Diagnose wichtiger Phänomene beschrieben. Große Bedeutung erlangte sie von Anfang an in der Geburtshilfe, wo sie in Form der "Kardiotokografie" (stellt das Standardverfahren zur gleichzeitigen Überwachung und Aufzeichnung der fetalen Herztätigkeit und der mütterlichen Wehentätigkeit dar, Kardiotokograph s. Abbildung 2) bis heute eine wichtige Rolle spielt. Methodisch unterscheidet man die Phono-, Elektro- und Ultrasonokardiografie. Die Kardiotokografie operiert zwar (noch) nicht mit den gängigen HRV-Begriffen, misst aber der Variabilität der fetalen Herzfrequenz eine wichtige prognostische Bedeutung zu.
|
Forschung
Die Forschung konzentriert sich auf die folgenden Bereiche. An erster Stelle steht der klinische Einsatz, er dient der Risikostratifizierung und Früherkennung speziell im Bereich der kardiovaskulären Erkrankungen und der Diabetologie. Des Weiteren gibt es die rehabilitative Medizin, die sich mit den Verlaufsdokumentation und individuellen Maßnahmen befasst. Ein ebenfalls wichtiger Faktor in der Forschung ist der Bereich der Stressmedizin und der Psychologie. Hier wird die HRV als Biofeedback im Stress und Konfliktmanagement verwendet. Auch in der Sportmedizin spielt die Analyse der Herzrhythmusvariabilität eine große Rolle im Sinne der Leistungsförderung und der Trainingsoptimierung.
Geräte
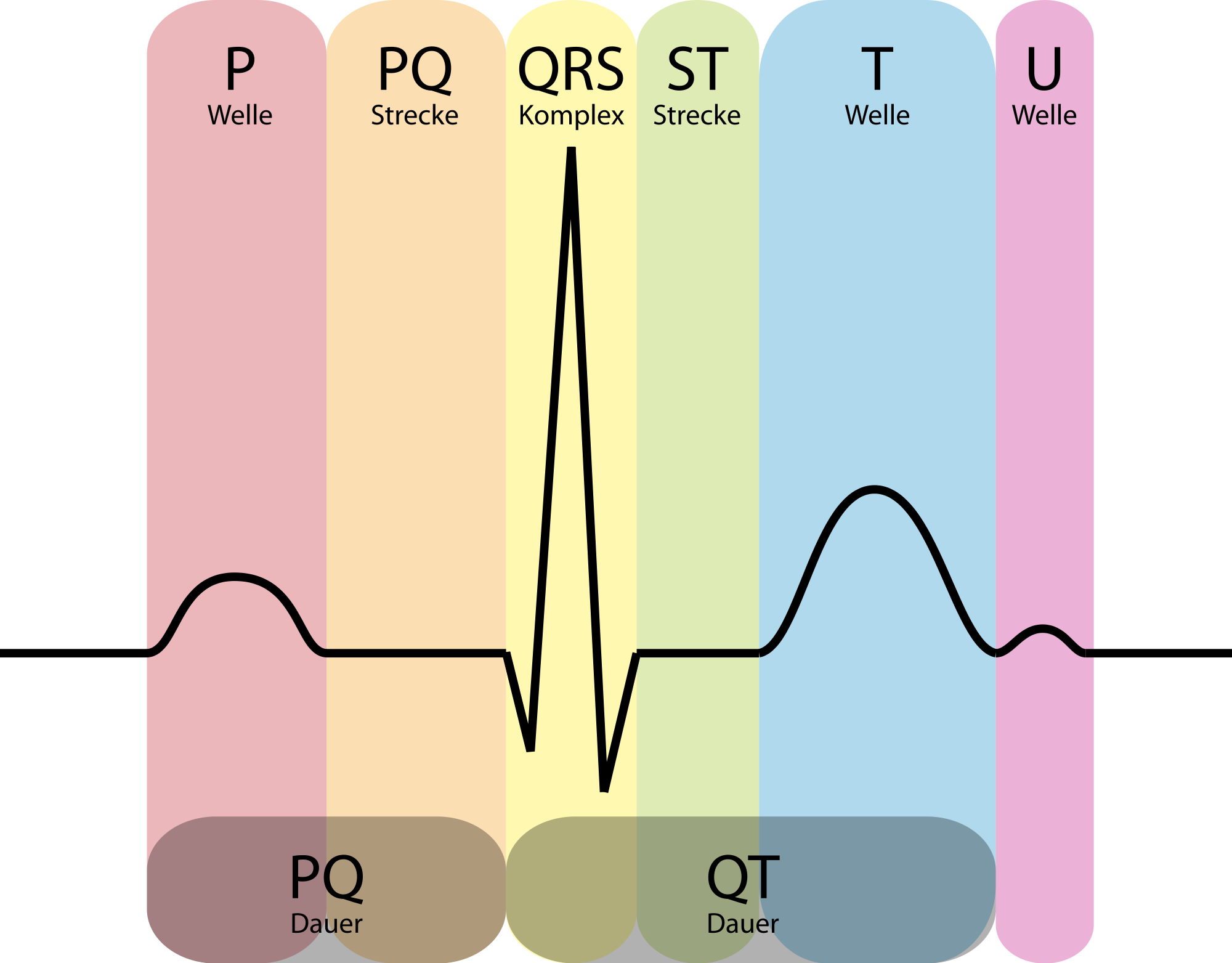
Das bekannteste Werkzeug der Kardiologie ist das EKG, welches eine Zeitreihe von Herzaktionen aufzeigt. Moderne HRV Geräte generieren bis zu 8000 Messwerte pro Sekunde, so sind valide Aussagen über jegliche Veränderungen im Herzrhythmus, besonders auch im Stresszustand, möglich. Für die HRV-Analyse ist das RR-Intervall wichtig, welches sich aus der R-Zacke des QRS-Komplexes ableitet (s. Abbildung 3). Die Intervalle unterscheiden sich in Häufigkeit, Dauer und kohärentem Muster und werden mittels der HRV quantitativ und qualitativ identifiziert.
|
Messverfahren
Die Auswertung der HRV-Messung erfolgt in drei Bereichen, dem Zeitbereich, Frequenzbereich und dem nichtlinearer Bereich.
Der Zeitbereich basiert auf der Berechnung der Standardabweichungen, darüber hinaus werden Häufigkeitsverteilungen und Mittelwerte ermittelt. Abweichende SDNN Werte (Standardabweichung der NN-Intervalle) deuten auf eine gestörte vegetative Balance hin. Je größer die SDNN desto höher ist die HRV. Der Wert des Standardparameter RRNN (Durchschnittliche Dauer aller RR-Intervalle) reflektiert die Summe aller Einflüsse auf die Sinusknoten-Aktivität, somit kann er als Allgemeinwert für die vegetative Balance betrachtet und durch organische Kardiopathien massiv verändert werden (Sayers, 1973).
Der Frequenzbereich analysiert die in der HRV gemessenen Variationen, die in bestimmten Frequenzen auftreten und nach diesen klassifiziert werden. Das Mess-spektrum lässt sich in drei Hauptabschnitte gliedern, die sich wiederum in verschiedene vegetative und endokrine Funktionskreise einteilen. Diese werden als das VLF - Band (very low frequency), das LF-Band (low frequency) und als das HF-Band (high frequency) bezeichnet. Diese Frequenzen repräsentieren:
- VLF: Aktivität wird durch zentrale Thermoregulation verursacht, Teil der endokrinen Regelkreise
- LF: Aktivität wird durch vegetative Baroreflexe determiniert, Teil des sympathischen Nervensystems
- HF: Aktivität wird durch die respiratorische Sinusarrhythmie getragen, Teil des parasympathischer Teils des vegetativen Nervensystems
Der nichtlineare Bereich wird in der Analyse in einer zwei oder mehrdimensionalen Punktwolkengrafik dargestellt. Basis der Darstellung ist die relative Zuordnung der Herzaktionen zueinander. Auf der X-Achse wird der erste Messwert des RR-Intervalls eingetragen, auf der Y-Achse der zweite. So ist nicht nur eine schnelle Analyse des HRV möglich, sondern es können auch Herzrhythmusstörungen gefunden werden (Akselrod et al.,1985).
Ein weiteres Messerfahren ist das Histogramm. Aus der gesamten Messstrecke werden die einzelnen Intervalle in ihrer Dauer bestimmt und in Form eines Balkendiagramms dargestellt. So lässt sich bestimmen welche Herzaktionen in welche Zeitklasse fallen und wie sich diese verteilen. Je höher die Variabilität, desto breiter verteilen sich die Intervalle. Unter Belastung sinkt die HRV und die Verteilung schränkt sich auf wenige Klassen ein (Van Ravenswaaij-Arts et al., 1993).
Physiologische Regulation der Herzratenvariabilität
Die physiologische Regulation der Herzratenvariabilität ist eine Anpassung an die verschiedenen Umwelteinflüsse, die auf einen Organismus einwirken. Ist die Herzratenvariabilität hoch deutet es auf eine gute Anpassungsfähigkeit hin, ist diese dagegen niedrig auf eine schlechtere. Die Umwelteinflüsse wie beispielweise Stresssituationen, körperliche Arbeit oder auch einkehrende Ruhe wirken, über das vegetative Nervensystem und die Hormone des Nebennierenmarks, auf die Herzfunktion. Weiterhin wirken die sympathischen Reize stimulierend und parasympathischen Reize inhibierend. Die Herzratenvariabilität wird unter anderem durch die Atmung reguliert. Diese wiederum ist dem Atmungszentrum unterstellt, welches ein nicht klar abgegrenzter Bereich in der Medulla oblangata ist. Die Kerne des Atmungszentrums liegen in der Formatio reticularis. Die Herzfrequenz steigt bei der Inspiration und während der Exspiration sinkt sie. Weiterhin wird die Herzratenvariabilität über die Depolarisation des Sinusknoten und die Stimulation der Barorezeptoren beeinflusst. Bei einem Anstieg des Blutdruckes werden sie aktiviert und senken zugleich die Frequenz des Herzens. Im Fall eines Blutdruckabfalls werden die Barorezeptoren deaktiviert und die Herzfrequenz steigt (Krüger, 2014).
Das Autonome Nervensystem
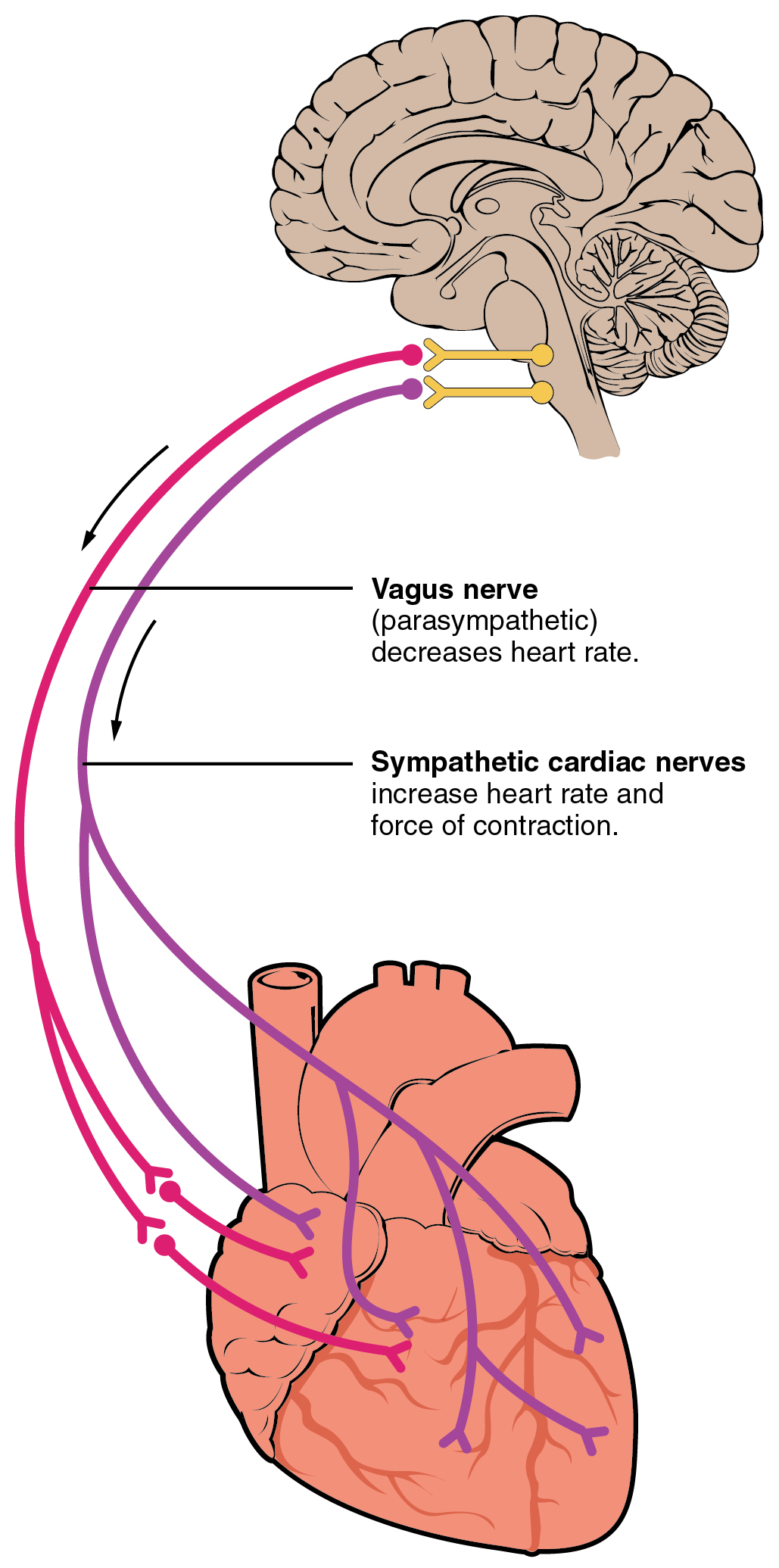
Das autonome Nervensystem (auch bekannt als vegetatives oder als unwillkürliches Nervensystem) ist verantwortlich für die Regulation der Tätigkeit der inneren Organe und des Stoffwechsels. Es besteht aus drei verschiedenen Systemen, die sich in ihrer Funktion stark unterscheiden: Dem Sympathikus, dem Parasympathikus und dem enterischen System. Das enterische System ist für die Darmnerven verantwortlich und spielt für die Herzrhythmusvariabilität keine entscheidende Rolle. Der Sympathikus und der Parasympathikus wirken als Antagonisten. Die Aktivierung des Sympathikus führt zu einer Mobilisierung von Körperreserven um Belastungssituationen zu bewältigen. Der Parasympathikus (s. Abbildung 4) hingegen ist im Ruhezustand für die Aufrechterhaltung der Körperfunktionen zuständig. Trotzdem besitzen sie strukturelle Ähnlichkeiten, wie ihre Anordnung in einer Zwei-Neuronen-Kette (Mück-Weymann, 2002). Zentrale Anteile des autonomen Nervensystems liegen im Hirnstamm und im Rückenmark. Die Peripheren Neurone sind in Ganglien lokalisiert, wobei die des Sympathikus fern und die des Parasympathikus nah der Organe liegen. Zu den Transmittern zählt Acetylcholin, dessen Wirkung wird über cholinerge und nicotinerge Rezeptoren vermittelt. Die M2-Rezeptoren befinden sich unter anderem auf den Schrittmacherzellen im Sinusknoten des Herzens. Sie sind entgegen der M1- und M3-rezeptoren an ein hemmendes G-Protein gekoppelt, was die Adenylatcyclase hemmt. Zwei weitere wichtige Transmitter sind Adrenalin und Noradrenalin, welche sich an den adrenergen Rezeptoren binden. Diese wiederum werden in alpha 1 und 2 und beta 1 und 2 Rezeptoren unterteilt. Adrenalin hat eine höhere Affinität zu den beta Rezeptoren und Noradrenalin zu den alpha Rezeptoren. Viele beta Rezeptoren vom Typ 1 wirken im Herz. Sie werden vor allem bei Stresssituationen über den Sympathikus angesprochen und erhöhen damit über den Sinusknoten die Herzfrequenz und am Arbeitsmyokard die Kontraktionskraft (Von Engelhardt und Breves, 2005).
|
Beeinflussende Faktoren der Herzrhythmusvariabilität
Die Wirkung von Nikotin und schwarzem Tee auf die HRV
Die Wirkung von Nikotin auf die Herzfrequenzvariabilität (HRV) ist umstritten. Das autonome Nervensystem ist der Hauptregulator des Herzrhythmus und die Herzfrequenzvariabilität ist ein geeigneter Index für die Beurteilung der Auswirkungen des autonomen Systems auf das Herz. In einer Studie der Kerman University of Medical Sciences wurde der Kombinationseffekt von Nikotin- und Schwarzteeverzehr auf das sympatho-vagale Gleichgewicht und die Herzfrequenzvariabilität bei Ratten untersucht. Männliche Wistar-Ratten wurden 28 Tage in vier zufälligen Gruppen unterschiedlich gehalten. Die erste Gruppe wurde mit schwarzem Tee behandelt, die zweite mit Nikotin, die dritte mit beidem und die Kontrollgruppe gar nicht. Am 29. Tag ergab die Messung des Elektrokardiogramms, dass der Mittelwert der Hochfrequenzleistung (HF) in Tee, Nikotin und Tee plus Nikotingruppen signifikant höher ist als bei der Kontrollgruppe (P <0,05). Auch das Verhältnis der Niederfrequenzleistung / Hochfrequenzleistung (LF / HF) in der Nikotin und Tee + Nikotingruppen waren signifikant geringer als die Werte der Kontrollgruppe (P <0,05). LF-Werte unterschieden sich nicht signifikant zwischen den Gruppen. Der Mittelwert der Standardabweichung der normalen RR-Intervalle (SDNN) und die Quadratwurzel der mittleren quadratischen Differenzen der aufeinanderfolgenden RR-Intervalle (RMSSD) stieg bei Tee, Nikotin und Tee + Nikotingruppen im Vergleich zur Kontrollgruppe signifikant an (P <0,05). Eine vierwöchige Verabreichung von Schwarztee, Nikotin oder deren Kombination, mit den in dieser Studie verwendeten Dosierungen, kann die Herzfrequenzvariabilität erhöhen und das Sympatho-Vagal-Gleichgewicht bei Ratten verbessern (Joukar und Sheibani, 2017).
Entwicklungsunterschiede in den Auswirkungen von Alkohol und Stress auf die Herzfrequenzvariabilität
Junge Ratten unterscheiden sich in ihren Reaktionen auf Stress und Ethanol von den erwachsenen Tieren, obwohl nicht viel über den Beitrag des autonomen Nervensystems (ANS) zu diesen Unterschieden bekannt ist. In dieser Studie der staatlichen Universität Binghamton, New York wurden die Auswirkungen von Stress, Ethanol und ihrer Kombination auf Parameter der Herzfrequenzvariabilität (HRV) bei jungen und erwachsenen männlichen Sprague-Dawley-Ratten untersucht. Die Tiere wurden an die Testbox und die Nackensensoren gewöhnt, die zur Aufzeichnung der Herzfrequenz (HR) verwendet wurden. Nach 8-10 min der Aufzeichnung der Kontrollwerte wurden die Tiere für 90 Minuten in Ruhe gelassen, gefolgt von einer intraperitonealer Injektion von 0, 0,5, 1,0 oder 1,5 g / kg Ethanol. Die 8-10-minütige Testaufzeichnung erfolgte 30 Minuten nach der Injektion. Ethanol- zusammenhängende Abnahmen des LF (ein Index der sympathischen Aktivität) waren unter nicht-gestressten Bedingungen bei den Jungen Ratten offensichtlich, jedoch erst nach Stress bei den Erwachsenen identifizierbar. Vielleicht zum Teil wegen offensichtlicher Ethanol-induzierter sympathischer Deaktivierung bei den Jungen. Der parasympathische Tonus, der durch HF induziert wurde, war bei den Jungen Ratten sowohl von Ethanol als auch von Stress unbeeinflusst, während wiederum bei den erwachsenen Ratten der Stress sich nach Injektion der 1,0- als auch die 1,5-g / kg-Ethanol-Dosis verringerte. Ethanol senkte auch den Niederfrequenz- / Hochfrequenzton (LF / HF), einen Index des sympathovagalen Gleichgewichts, nur bei jungen Ratten, wobei bei den Erwachsenen keine Abnahme zu beobachten war. Darüber hinaus hatten gestresste Erwachsene Ratten und nicht die Jungen signifikant niedrigere CORT- und PROG-Werte (Kortisol- und Progesteronwerte) als ihre nicht gestressten Gegenstücke. Zusammengefasst zeigen diese Ergebnisse bemerkenswerte Altersunterschiede in der ANS-Reaktion auf Ethanol unter stressigen gegenüber nicht stressigen Umständen, was sich in Ethanol vermittelten autonomen Effekten widerspiegelt, die bei Erwachsenen nach Stressexposition stärker ausgeprägt waren als bei den jungen Ratten ohne Stress (Saalfield und Spear, 2014).
Inhalations- / Exspirationsverhältnis moduliert den Effekt der langsamen Atmung auf Herzfrequenzvariabilität und Entspannung
Langsame Atmung wird häufig angewandt, um die Symptome von Übererregung zu verbessern, aber es ist nicht bekannt, ob ihre vorteilhaften Wirkungen auf die Verringerung der Atmungsrate an sich oder auf ein niedrigeres Verhältnis von Einatmung / Ausatmung (i / e) zurückzuführen sind. Die vorliegende Studie der Fakultät für Psychologie und Erziehungswissenschaft in Löwen (Leuven, Belgien) untersuchte die Auswirkungen von vier Beatmungsmustern auf die Herzfrequenzvariabilität und die selbstberichteten Dimensionen der Entspannung. Dreißig Teilnehmer wurden angewiesen, mit 6 oder 12 Atemzügen pro Minute und mit einem Inhalations- /Exspirationsverhältnis von 0,42 oder 2,33 zu atmen. Die Teilnehmer berichteten über eine erhöhte Entspannung, Stressreduktion, Achtsamkeit und positive Energie beim Atmen mit dem niedrigen Inhalations- /Exspirationsverhältnis im Vergleich zum hohen. Eine niedrigere Atemfrequenz im Vergleich zu einer höheren war nur mit einer erhöhten Punktzahl für positive Energie verbunden. Ein niedriges Inhalations- /Exspirationsverhältnis war auch mit mehr Leistung in der Hochfrequenzkomponente der Herzfrequenzvariabilität verbunden, jedoch nur für das langsame Atemmuster. Die Ergebnisse der Studie zeigen, dass das Inhalations- /Exspirationsverhältnis ein wichtiger Modulator für die autonomen und subjektiven Effekte von instruierten Beatmungsmustern ist (Van Diest et al., 2014).
Herzratenvariabilität bei Typ 2 Diabetes mellitus Patienten
Bei Patienten mit Typ 2 Diabetes mellitus wird zur Messung die Herzfrequenzvariabilität benutzt, weil die kardiale autonome Neuropathie mit einer kardiovaskulären Mortalität zusammenhängt. Dabei wurden in dieser Studie die Auswirkung von Typ 2 Diabetes mellitus auf die HRV-Parameter analysiert. Mit einem Holter-Elektrokardiogramm wurden über einen Zeitraum von 24 Stunden Typ 2 Diabetes mellitus Patienten und gesunde Probanden untersucht. Gemessen wurden: die RR-Intervalle, die Standardabweichung der RR-Intervalle (SDNN), der Anteil benachbarter RR-Intervalle die um mehr als 50 Millisekunden auseinander liegen (pNN50), der Gesamtleistung, der Hochfrequenz (HF), Niedrigfrequenz (LF) und das Verhältnis LF/HF. In der Studie wurden insgesamt 2932 Patienten untersucht. 1356 waren mit Typ 2 Diabetes mellitus erkrankt und die restlichen 1576 waren gesunde Probanden. Bei den Patienten mit Diabetes wurden signifikant (p<0,01) niedrigere RR-Intervalle, SDNN, pNN50, HF und LF Werte gemessen. Das Verhältnis von LF/HF unterschied sich nicht zwischen den Diabetes-Patienten und den gesunden Probanden. Der Blutzuckerspiegel und der HbA1c-Wert hängen mit mehreren HRV-Parametern und der Diagnose von Typ 2 Diabetes mellitus zusammen. Daraus wurde geschlussfolgert, dass die allgemeine Abnahme der HRV-Werte mit der Erkrankung von Typ 2 Diabetes mellitus zusammenhängt. Dabei sind sowohl die sympathische als aus die parasympathische Aktivität vermindert, was zu einer kardio-vaskulären Neuropathie führen kann. Dies kann durch den veränderten Glukosestoffwechsel, der auf die HRV einwirkt, erklärt werden (Benichou et al., 2018).
HRV und das akute Atemnotsyndrom (ARDS)
Die Morbität und Mortalität des akuten Atemnotsyndroms bleibt hoch. Die Studie beschäftigt sich mit der Identifizierung von Patienten mit hohem Sterblichkeitsrisiko im Krankheitsverlauf. Über die HRV wurde versucht zu ermitteln, ob der Patient in die chirurgische Intensivstation aufgenommen werden sollte. Es wurden Patienten die eine Lungen- oder Speiseröhrenkrebsoperation hatten in 2 Gruppen aufgeteilt. Die eine ist die Gruppe bei denen nach der Operation ARDS diagnostiziert wurde, diese wurde weiterhin in Überlebende und Nicht-Überlebende aufgeteilt. Die andere Gruppe waren die Personen, die nach der Operation nicht an ARDS erkrankten. Die Daten zeigten, dass bei ARDS-Patienten das mittlere RR-Intervall (mRRI), die Hochfrequenzleistung (HFP) und das Produkt aus niedrig-/hochfrequenten Leistungsverhältnis und Tidalvolumen signifikant (p<0,05) niedriger war. Währenddessen war die normalisierte Hochfrequenzleistung zum Tidalvolumen ( nHFP/VT) bei den ARDS-Patienten signifikant höher ( P=0,011) war. Für die Nicht-Überlebenden Patienten war die Gesamtleistung (TP), Niederfrequenzleistung (LFP), Hochfrequenzleistung (HFP) und HFP/VT signifikant höher. Aus der Studie schlussfolgerte man, dass die vagale Anpassung von Patienten mit einem thorakal chirurgischem Eingriff und ARDS erhöht war im Vergleich zu den Patienten ohne ARDS. Die nicht-überlebenden Patienten hatten sogar noch eine höhere vagale Aktivität als die überlebenden Patienten. Die Vagusmodulationsparameter Gesamtleistung und Hochfrequenzleistung sind unabhängige Prädikatoren über die Mortalität der Patienten mit ARDS, um die Notwendigkeit einer Aufnahme in die chirurgische Intensivstation dieser Patienten zu klären. Die Hochfrequenzleistung erwies sich als bester Prädikator für die Sterblichkeit von ARDS-Patienten. Somit kann eine erhöhte Vagus-Modulation ein Zeichen für eine schlechte Prognose der Patienten sein, die einem thorakalen Eingriff unterlagen (I-Chen et al., 2018).
Fazit
Nach intensiver Beschäftigung mit dem Thema „ Analyse der Herzfrequenzvariabilität“ kommen wir zu dem Schluss, dass die verschiedensten Faktoren beeinflussend auf die HRV wirken. Stress, Alkohol, Nicotin sowie weitere Lebensmittel und bestimmte Krankheiten haben die größten Auswirkungen auf die Herzratenvariabilität. All diese Faktoren wirken hauptsächlich verändernd über das vagale Nervensystem. Nach heutigem Stand der Medizin kann die Analyse und Auswertung der HRV für medizinische Diagnosen spezieller Krankheiten genutzt werden. Wir sehen großes Potential in der Medizin durch die Analyse der Herzrhythmusvariabilität. Anhand weiterer Forschungen und Verbesserung der Gerätschaften können in den nächsten Jahren noch frühere und weitreichendere Diagnosen erstellt werden.
Literaturverzeichnis
Akselrod S., Gordon D., Madwed J.B., Snidman N.C., Shannon D.C., Cohen R.J. (1985): Hemodynamic regulation: investigation by spectral analysis. In: Am J Physiol, 249: 867–875
Benichou T., Pereira B., Mermillod M., Tauveron I., Pfabigan D., Maqdasy S. et al. (2018): Heart rate variability in type 2 Diabetes mellitus: A systematic review and metaanalysis. PloS ONE 13(4): e0195166
I-Chen C., Chew-Teng K., Ching-Hsiung L., Jane K., Jang-Zern T., Wen-Je K., Cheng-Deng K. (2018): High-frequency power of heart rate variability can predict the outcome of thoracic surgical patients with acute respiratory distress syndrome on admission to the intensive care unit: a prospective, single-centric, case controlled study. BMC Anesthesiology, 18: 34
Joukar S., Sheibani M. (2017): Physiology Research Center, Cardiovascular Research Center, Institute of Basic and Clinical Physiology Sciences, Kerman University of Medical Sciences, Kerman, Iran: Combinatorial effect of nicotine and black tea on heart rate variability: Useful or harmful? In: Auton Autacoid Pharmacol, 37: 44-48
Krüger S. (2014): Einfluss der Entspannungstechniken Progressive Muskelentspannung nach Jacobson und definierte Atmung auf Herzratenvariabilität bei gesunden Freiwilligen. Orginalpublikation. http://www.hrv24.de/Swantje-Krueger-Entspannungstechniken-PMR-Taktatmung-HRV-2014.pdf
Mück-Weymann M. (2002): Die Herzratenvariabilität als globaler Adaptivitätsfaktor in psycho-neuro-kardialen Funktionskreisen. In: Mattke, D. (Hrsg.): Vom Allgemeinen zum Besonderen: Störungsspezifische Konzepte und Behandlung in der Psychosomatik. Frankfurt/Main: Verlag für Akademische Schriften 322-327
Saalfield J., Spear L. (2014): Binghamton University, Binghamton, NY 13902, United States, Developmental differences in the effects of alcohol and stress on heart rate variability, Phyiologie & Behavior, 135: 72-80
Sayers B.M. (1973): Analysis of heart rate variability. In: Ergonomics, 16: 17-32
Van Ravenswaaij-Arts C., Kollee L.A.A., Hopman J.C.W., Stoelinga G.B.A., van Geijn H.P. (1993): Heart Rate Variability. In: Annals of Internal Medicine 118: 436–447
Van Diest I., Verstappen K., Aubert AE., Widjaja D., Vansteenwegen D., Vlemincx E. (2014): Inhalation/Exhalation ratio modulates the effect of slow breathing on heart rate variability and relaxation, 39: 171-80
Von Engelhardt W., Breves G. (2005): Physiologie der Haustiere. Stuttgart, Enke Verlag
Weblinks
www.flexikon.doccheck.com, Antwerpes Dr. F., Krasny I., Levita B., Merz S., Pfeifer E., 2010, Kardiotokographie (10.04.2018)
www.hrv24.de, Löllgen Dr. rer. medic. D., Mück Dr. Dr. med. H., Mück-Weymann Prof. Dr. Dr.med. M., Alles über Herzratenvariabilität (10.04.2018)
www.scio-medical.com, LivinstarAG, 2012, Analyse der Herzrhythmus-Variabilität (HRV-Analyse) (12.04.2018)
Abbildungsverzeichnis
Abbildung 1: https://commons.wikimedia.org/wiki/File:Chinese_woodcut,_Famous_medical_figures;_Wang_Shuhe_Wellcome_L0039321.jpg
Abbildung 2: https://upload.wikimedia.org/wikipedia/commons/a/a7/Kardiotokograf.jpeg
Abbildung 3: https://commons.wikimedia.org/wiki/File:EKG_Complex_en.svg#/media/File:EKG_Complex_de.svg
Abbildung 4: https://upload.wikimedia.org/wikipedia/commons/4/4c/2032_Automatic_Innervation.jpg