Die Bedeutung von Hypoxie/Sauerstoff in der Tumortherapie
Die Bedeutung von Sauerstoff
Sauerstoff ist für Stoffwechselprozesse in jeder Zelle von Lebewesen wichtig. Die Aufnahme des Sauerstoff erfolgt über die Atmung. Bei der Atmung, welches ein biologischer Prozess ist, wird molekularer Sauerstoff aufgenommen, zu den Zellen transportiert und dort in den Mitochondrien durch die Atmungskette zu Wasser reduziert. Gleichzeitig wird Kohlenstoffdioxid produziert und abgegeben. Dabei wird ATP synthetisiert. Die Atmung beginnt mit dem Einatmen durch die Nase oder den Mund, weiter durch den Larynx über die Trachea in die Lunge und die Bronchien, wo dann der Sauerstoffaustausch mit dem Blut stattfindet. Über die Blutbahn gelangt der Sauerstoff anschließend in die Gewebe und die spezifischen Zellen, wo dann die Zellatmung beginnt. Die Energiegewinnung, in Form von ATP, mit Hilfe der Zellatmung ist daher für uns überlebenswichtig. Denn ohne Nahrung können Menschen oder Tiere einige Wochen auskommen, ohne Wasser wenige Tage, ohne Sauerstoff wenige Minuten, aber ohne ATP nur ein paar Sekunden. Zudem unterscheidet man in die aerobe Zellatmung, also im Anwesenheit von Sauerstoff und die anaerobe Gärung, bei der ohne Sauerstoff ATP gewonnen wird. Die Gärung findet im Fall der Hypoxie statt. Unter einer Hypoxie versteht man eine Mangelversorgung des Körpers oder einzelner Körperabschnitte oder Gewebe mit Sauerstoff. Unter diesem Zustand wird auch ATP hergestellt, allerdings ist die Ausbeute deutlich geringer, da die organischen Stoffe, wie Glucose, nur unvollständig zu Laktat abgebaut werden.
Der größte Unterschied im Bezug auf die innere Atmung zwischen malignen und benignen Zellen ist, dass auch unter aeroben Bedingungen, vermehrt glycolytischer Stoffwechsel (Gärung) betrieben wird. Das bedeutet, dass Tumorzellen viel Glucose aufnehmen und Milchsäure abgeben. Daneben wird auch Energie, in Form von ATP, über die beta-Oxidation und Atmungskette gewonnen. Tumorgewebe wird vor allem durch hypoxische Gewebeabschnitte bestimmt. Hypoxie ist ein Merkmal der meisten Tumoren, jedoch mit variierender Intensität. Die Ursache für diese Mangelversorgung im hyopoxischen Gewebe resultiert durch die schneller ablaufende Zellproliferation, verglichen mit der Vaskularisierung des wachsenden Tumorgewebes. So entstehen eine perivasale Struktur, die von einem Mantel aus chronisch hypoxischen Zellen umgeben ist. In noch weiter von den Gefäßen entfernten Gewebe findet man nekrotische Bereiche, da keinerlei Vaskularisierung mehr vorhanden ist, und die Tumorzellen daher weder auf Sauerstoff noch Glucose zugreifen können und somit keine Energiesynthese zulässt.
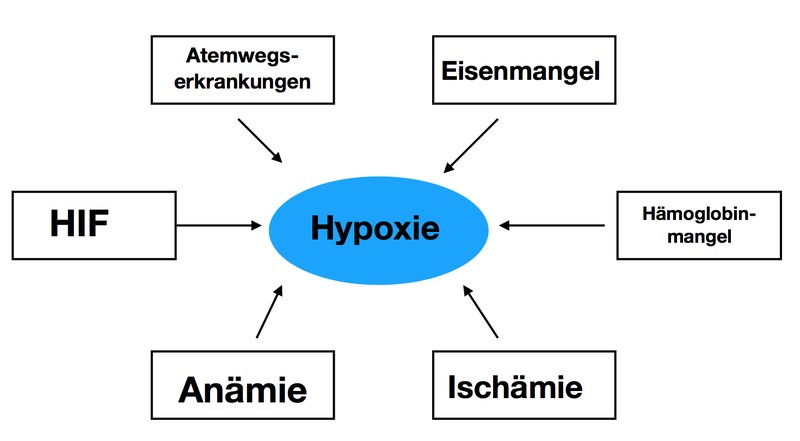
Ursachen der Hypoxie
Eine häufiger Auslöser für Hypoxie ist Eisenmangel, welches zu hypochromen mikrozitären Anämie führt, dies bedeutet, dass die Erythrozyten schrumpfen und dabei auch weniger Hämoglobin enthalten. Das führt zu einer verminderten Sauerstoffaufnahme im Blut und auch zur Gewebshypoxie. Eisenmangel entsteht unter anderem durch Hemmung von Transportvorgängen, beispielsweise kann bei erhöhter Hepcidinkonzentration das Ferroportin der Enterozyten auf der basolateralen gehemmet, wodurch die Aufnahme des Eisens ins Blut gestört ist. Ein anderer Grund für einen Eisenmangel sind auch Blutungen wie zum Beispiel Menometrorrhagie. Auch ein Erythrozytenmangel aufgrund von Blutverlust, also einer Anämie, oder einer verkürzten Lebensdauer der Erythrozyten können zu einer Hypoxie führen. Eine weitere Ursache stellt die Ischämie dar, welche zum Beispiel durch Thrombosen oder Tumore entstehen kann. Auch Atemwegserkrankungen, die wegen gestörter Lungenfunktion Hypoventilation, restriktive oder obstruktive Ventilationsstörungen, Verteilungsstörungen und Diffusionsstörungen verursachen, haben eine Gewebshypoxie zur Folge.
|
HIF – Hypoxie-induzierter-Faktor
Struktur
Bisher sind drei Arten des Transkriptions Faktor HIF bekannt, dabei handelt es sich um HIF-1α, HIF-2α und HIF-3α, wobei über die Wirkung von HIF-1 und HIF-2 am meisten bekannt ist. Die HIF´s sind Heterodimere, die aus einer konstitutiven β-Untereinheit und einer α-Untereinheit, welche durch Sauerstoff reguliert wird, bestehen. Eine Bindung an die DNA wird durch die Lokalisierung der basic helix-loop-helix(bHLH)-Domäne am Ende der aminoterminalen Untereinheit erlaubt. Die weitere aminoterminale PER-ARNT-SIM (PAS)-Domäne erlaubt die Dimerisierung der α- und β- Untereinheit, dabei ist die α-Untereinheit für die HIF spezifisch. Das Enzym FIH-1 (factor inhibiting HIF-1) reguliert sauerstoffabhängig die Aktivität von HIF-1α. Durch die oxygen-dependent degradation domain (ODD) wir die Proteinstabilität der α-Untereinheit reguliert. Unter normalen Sauerstoffzuständen (Normoxie) wird HIF-1α durch Prolylhydroxylasen (PHD´s) an zwei spezifischen Prolylresten (P402 und P564) innerhalb der ODD hydroxyliert (Kaelin und Ratcliffe, 2008; Metzen et al., 2003; Epstein et al., 2001; Jaakkola et al., 2001). Durch die Verfügbarkeit von Eisenionen, Vitamin C und α-Ketoglutarat wir die Aktivität von PHDs limitiert. Nach Hydroxylierung kann die HIF-α-Untereinheit durch das Tumorsuppressor-Protein von-Hippel-Lindau (pVHL) erkannt, ubiquitinyliert und im 26S-Proteasomkomplex degradiert werden (Ohh et al., 2000; Maxwell et al., 1999). Durch die sauerstoffunabhängigen Faktoren wie Zytokine oder durch die Aktivierung von Okogenen bei Tumorerkrankungen kann HIF-1α vermehrt gebildet werden.
|
Bedeutung
Eine schnelle phänotypische Adaption an Hypoxie wird gewährleistet, da HIF-1α vermutlich an der Kontrolle von 2-5% der Genexpression verantwortlich ist. Die eindeutig Identifizierten HIF-1α Zielgene werden in zwei Gruppen geordnet:
- Gene zur Steigerung der anaeroben Glykolyse die somit ATP bereitstellen. Dazu gehören Glukose-Transporter (GLUT-1, GLUT-3), Laktatdehydrogenase A (LDHA) und Phosphoglycerat-Kinase (PGK-1).
- Gene, die die Sauerstoffversorgung der Gewebe gewährleisten; dies wird gewährleistet durch die gesteigerte Gefäß Neubildung, Gefäßweitstellung oder durch die Erhöhung der Sauerstoff Kapazität des Blutes und einen verbesserten Eisenionentransport durch Transferrin.
Des weiteren ist HIF-1α an vielen pathophysiologischen Prozessen beteiligt, dazu gehören Entzündungsprozesse, Ischämie und Tumorgenese. Die Glykolyse ist der wichtigste Aspekt von HIF-1, da diese direkt davon beeinflusst wird. Da diese die Glucosetransporter (GLUT-1 GLUT-2) und einige Enzyme reguliert, zu diesen gehören: Die Aktivierung der Pyruvatdehydrogenase-Kinase 1(PDK1), was zu einer Inaktivierung der Pyruvatdehydrogense(PDH) führt. Dadurch wird weniger Acetyl-CoA in die Mitochondrien befördert und somit weniger NADH+H+ und FADH2 gebildet welches dann in der Atmungskette nicht zur Verfügung steht.
Rolle in der Tumortherapie
Durch die schnelle Ausbildung der Tumor-Zellen und der unregelmäßigen Gefäßneubildung kommt es zu einer mangelhaften Nähr- und Sauerstoffversorgung, wodurch hypoxische Areale entstehen. Die Antwort der Zellen kann zur Hemmung der Proliferation, sowie zur Einleitung der Apoptose führen. Daraus resultiert ein Selektionsdruck, der die Entstehung von adaptierten Subpopulationen fördert, dies kann auch in einem hypoxischen Mikromilieus zum Fortschreiten der Krankheit führen. Durch die Überexpression von HIF-1α wird die Anpassung an intratumorale Hypoxie stabilisiert. Durch die Sekretion von proangiogener Faktoren wie VEGF, die eine tumorinduzierte Angiogenese bewirkt und die vermehrte Sekretion von Wachstumsfaktoren, die ein Zellwachstum und zur Apoptose führen, trägt HIF-1α zur Tumorprogression bei. Somit steht eine gesteigerte HIF-1α-Expression in Zusammenhang mit einer Chemo- und Radioresistenz, sowie genetischer Instabilität, maligner Progression, verstärkter Metastasen Bildung und verminderter Therapierbarkeit.
Reaktive Sauerstoffspezies (ROS)
Reaktive Sauerstoffspezies sind Produkte des normalen Stoffwechsels. Abhängig von ihrer Konzentration kann ROS für Zellen und Gewebe vorteilhaft oder schädlich sein. Bei physiologisch niedrigen Konzentrationen fungieren ROS als "Redox-Botenstoffe" bei der intrazellulären Signalübertragung und Regulation, während überschüssige ROS oxidative Modifikation zellulärer Makromoleküle induzieren, die Proteinfunktion hemmen und den Zelltod fördern. Zellapoptose wird durch extrazelluläre und intrazelluläre Signale über zwei Hauptwege initiiert, den Todesrezeptor- und die Mitochondrien-vermittelten Stoffwechselwege. Verschiedene pathologische Effekte können auf eine durch oxidativen Stress hervorgerufenen apoptotischen Signalgebung resultieren, die auf einen Anstieg der ROS oder eine Verringerung der Antioxidationsmittel, eine Störung der intrazellulären Redox-Homöostase und irreversible oxidative Modifikationen von Lipid, Protein oder DNA zurückzuführen ist.
In vitro produzieren Tumorzellen ROS weitaus schneller als gesunde Zellen, und in vivo wurde bereits konstitutiver oxidativer Stress beim Mammakarzinom nachgewiesen. Erhöhter oxidativer Stress wurde in vielen verschiedenen Arten von Krebszellen gefunden, und die Einführung von Antioxidantien kann die Tumorzellproliferation hemmen, was auf eine wichtige Rolle von ROS bei der Vermittlung des Verlusts der Wachstumskontrolle hinweist Sauerstoffradikale können die Tumorinvasion und -metastasierung erhöhen, indem sie die Zellmigrationsrate erhöhen. Die Behandlung von Säugetierkarzinomzellen mit Wasserstoffperoxid vor der intravenösen Injektion in Mäuse verbessert die Bildung von Lungenmetastasen, was darauf hinweist, dass eine wichtige Funktion für ROS das Impfen von metastatischen Tumorzellen ist
Therapie
Hyperbare Sauerstofftherapie
HBO wurde Jahrzehnte lang benutzt zur Verbesserung und Heilung von Funktionsstörungen, welche Hypoxie und Ischämie beinhalten, durch erhöhen der Anzahl des ungelösten Sauerstoff im Blutplasma und dabei eine Verbesserung des Sauerstoff-Transport in Gewebe bewirkt. Die hyperbare Sauerstofftherapie beinhaltet das intermittierende Inhalieren von 100% Sauerstoff unter einem Druck von mehr als 1 atm. Studien über HBO und Krebs fokussierten sich auf die Frage, ob erhöhter Sauerstoffgehalt als Tumorkatlysator gilt. Sauerstoff ist bereits bekannt als positiver Effektor bei der Wundheilung, man hat allerdings die Befürchtung, dass die Effekte von HBO auch den Tumorwachstum beschleunigt. Außerdem hat man Angst davor, dass die Behandlung von Krebspatienten mit hyperbarem Sauerstoff zu einem Rezidiv führen könnten. Es gibt zum jetzigen Stand keine Beweise, dass HBO weder als Stimulation für Tumorwachstum noch als Förderer eines Rezidive wirkt. Auf der anderen Seite gibt es Studien, die implizieren, dass HBO tumorinhibitorische Effekte in verschiedenen Tumorgruppen haben könnte.
|
Wirkung von HBO in der Strahlentherapie
Die Steigerung des Therapieerfolges in der Strahlentherapie durch die Oxygenierung der Tumore ist schon länger bekannt, da der Sauerstoff direkt für eine Sensibilisierung der Strahlen verantwortlich ist [Gray et al. 1956]. In Geweben mit einem pO2 um 15mmHg bewies Gray et al. 1956 eine 2,5 bis 3fach höhere Strahlenwirkung als in hypoxischen bzw. anoxischen Gewebe. Dies liegt dem Phänomen zugrunde, dass die Röntgenstrahlen indirekt über die Bildung von Radikalen wirken. Da der Sauerstoff zu Peroxiden gespalten wird, verstärkt er somit den Effekt der Strahlentherapie. Da der Sauerstoffmangel in hypoxischen Geweben zum verlangsamen des Zellzyklus führt und diese dann in die G0-Phase eintreten können, in der die Zellen eher unempfindlich gegen die Strahlen sind, ist es nur logisch dass ein Anstieg des pO2 zu einer besseren Strahlenwirkung führt.
Sauerstoff-Ozontherapie
Die Sauerstoff Ozontherapie wird oft als toxisch angesehen, jedoch mit wenig Beweisen, um die Verwendung in der Medizin zu rechtfertigen. Es gibt keinen Zweifel daran, dass Ozon, das drittstärkste Oxidationsmittel in der Chemie wirklich toxisch ist. Das Atmungssystem, Schleimhäute und Haut sollten nie dem Ozon ausgesetzt sein, denn sie werden nur wenig von den Antioxidantien geschützt, die in der wässrigen Lipidschicht vorhanden sind. Während der Sommermonate ist die bronchiale Alveolarauskleidung 90-100 ppbozon ausgesetzt und produziert deshalb toxische Verbindungen, wie ROS, LOPs (Lipidoxidationsprodukte), proinflammatorische Zytokine und Proteasen, welche die Lunge schädigen. Nach Absorption in die Lymphe und Blutkapillaren sind auch andere Organe betroffen.
Darüber hinaus werden Erythrozyten in Salzlösung und Zellen in Kulturen auch bei geringen Ozonkonzentrationen geschädigt. Es kommt zu Hämolyse und Apoptose, da natürliche Antioxidantien, wie Ascorbinsäure, Harnsäure, Albumin und alpha-Tocopherol fehlen. Die gewaschenen Erythrozyten, sowie die Zellen, welche in einem antioxidans- armen Medium kultiviert wurden, reagieren sehr sensibel auf Ozonierung. Menschliches Blut hingegen ist mit einem wirksamen Antioxidans System ausgestattet.
In den 1990er Jahren erfolgte die direkte intravenöse (iv) Verabreichung von Sauerstoff-Ozon bei Patienten, die mit dem Human Immundefizienz Virus (HIV) infiziert sind, in dem Glauben, dass Ozon das Virus zerstören würde, jedoch resultierte dies oft in einer Lungenembolie. Dies führte zum Verbot der Ozontherapie in mehreren US- Bundesstaaten. Zusätzlich trug eine missbräuchliche Verwendung der Ozontherapie zur Defamierung dieser bei.
Außerdem ist zu beachten, dass Ozon gegensätzliche Effekte hat. Zum einen ist es in der Troposphäre toxisch, oder wenn es während einer Entzündung erzeugt wird. Aber es ist sehr nützlich in der Stratosphäre, wo es UV- Strahlung blockiert. Des Weiteren wird es heutzutage zur Sterilisation von Wasser, zur Lebensmittelverarbeitung und in der Veterinärmedizin genutzt. Wenn Ozon in einem genau definierten Therapiefenster verwendet wird, wird seine oxidative Aktivität durch das antioxidative System (Enzyme, hydro- und lipophile Stoffe) im Blut und Gewebe, gelöscht.
Ozon gilt heutzutage als Medikament, welches mit Vorsicht angewendet werden muss, nach sorgfältiger Definition seines therapeutischen Fensters (10µg/ml- 80µg/ml Blut). Deshalb ist es wichtig, die Ozondosis genau anhand der antioxidative Kapazität des Patientenbluts zu kalibrieren, um die potentielle Toxizität des Ozons zu limitieren. Klinische Applikationen demonstrieren, dass die klassische Behandlung, ozonierte Autohämotherapie (o3-AHT), welche daraus besteht, ein bestimmtes Blutvolumen einer, präzise kalibrierten Menge an Ozon, für ein paar Minuten auszusetzen. Darauf folgt eine Re-Infusion von aktiviertem Blut an den Empfänger, dieses stimuliert diverse biochemische Vorgänge ohne akute oder chronische Toxizität zu verursachen.
Sobald das Ozon ungelöst im wässrigen Teil des Plasmas ist, reagiert es sofort mit den Antioxidantien und mehrfach-ungesättigten Fettsäuren eine Kaskade aus definierten Verbindungen erzeugend, wie Wasserstoffperoxid, Lipid- Peroxidationsprodukte. Diese sind fähig Blut, Endothel- und parenchymale Zellen zu aktivieren, welche für biologische und therapeutische Antworten diverser Erkrankungen verantwortlich sind. Die Vielseitigkeit des Ozons ist abhängig der Generation chemischer Stoffe. Einige haben desinfizierende Wirkung, während andere mit verschiedenen Funktionen auf Zellen reagieren und mit einer Vielzahl an biologischen Antworten reagieren. Das erklärt, warum die Ozontherapie in Kombination mit konventioneller Medizin nur bei bestimmten Krankheiten angewendet werden kann und darf nicht als Allheilmittel für alle Krankheiten angesehen werden.
Im Folgenden ein Bespiel - metastasierende Tumore:
Obwohl Krebszellen selbst unter aeroben Bedingungen die Glykolyse hochregulieren, wachsen sie auch unter Hypoxie. Je stärker die Hypoxie in der neoplastischen Umgebung ist, desto klinisch aggressiver ist der Krebs. Es ist allgemein bekannt, dass die Hypoxie die Metastasierung begünstigt, daher sollte die Verabreichung von anti-angiogenen Proteinen oder Antikörpern den vaskulären endothelialen Wachstumsfaktor (VEGF) und das Tumorwachstum stoppen.
Aus physiologischer Sicht erscheint es logisch, die Normoxie im neoplastischen Umfeld wiederherzustellen. Es wurden Studien an einer kleinen Anzahl von früherkrankten Darmkrebspatienten durchgeführt, bestehend aus zwei ozonierten-HAT´s und zwei kleineren AHTs (via intramuskulärer Verabreichung) wöchentlich für sechs Monaten. Dabei wurde die Wirkung von Strahlen- und Chemotherapie durch den verbesserten Sauerstofftransport und die verbesserte Sauerstoffabgabe gesteigert. Darüber hinaus wirkt die Ozon-Therapie als immunsuppressiver Effekt und verringert die Müdigkeitserscheinungen, die fast 90% der Patienten plagen.
Quellen
Peter Storz, Department of Pathology, Beth Israel Deaconess Medical Center, Harvard Medical School, 330 Brookline Avenue, Boston, MA 02215, USA,REACTIVE OXYGEN SPECIES IN TUMOR PROGRESSION
Inaugural-Dissertation zur Erlangung des Doktorgrades Dr. rer. nat.,
Eisenmangel und seine Folgen Dr. med. Alexander Voigt, Würzburg
Pamela S. Grim, MD; Lawrence J. Gottlieb, MD; Allyn Boddie, RN; et al, Hyperbaric Oxygen Therapy, April 25, 1990
Magdalena L. Circu, Reactive oxygen species, cellular redox systems, and apoptosis,Department of Molecular & Cellular Physiology, Louisiana University Health Sciences Center, Shreveport, LA 71130, USA, Received 2 March 2009, Revised 21 December 2009, Accepted 27 December 2009, Available online 4 January 2010
V. BOCCI Department of Physiology, University of Siena, via Moro 2, 53100, Siena, Italy, Accepted: 29 December 2006, The case for oxygen-ozonetherapy
Engelhardt W., Breves G. (2015): Physiologie der Haustiere. Stuttgart: Enke
Inauguraldissertation zur Erlangung der Doktorwürde der Universität zu Lübeck, Medizinische Fakultät, vorgelegt von Tim Peter Cordes aus Rotenburg/Wümme, Lübeck 2008, Hyperbare Sauerstofftherapie bei MX-1 und S117-Tumorxenograften
Soon-Sun Hong1*, Hyunseung Lee1* and Kyu-Won Kim1 1Research Institute of Pharmaceutical Sciences and College of Pharmacy, Seoul National University, Seoul 151-742, Korea, Cancer Research and Treatment 2004;36(6):343-353, HIF-1α: a Valid Therapeutic Target for Tumor Therapy
H.J.Feldmann • Klinik und Poliklinik für Strahlentherapie und Radiologische Onkologie der Technischen Universität München, Onkologe 1999 · 5:1000–1007 © Springer-Verlag 1999, Tumoroxygenierung und Hypoxie
Abbildungen
Abbildung 1: Selbstanfertigung Laura Ling
Abbildung 2: https://upload.wikimedia.org/wikipedia/commons/0/05/PBB_Protein_HIF1A_image.jpg
Abbildung 3: https://upload.wikimedia.org/wikipedia/commons/1/16/Mobile_Hyperbare_Sauerstofftherapie_Druckkammer.jpg