|
Size: 21638
Comment:
|
Size: 21637
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 101: | Line 101: |
| {{attachment:GluR- Schema.jpg|Abbildung 4|align="right"}} | {{attachment:GluR-Schema.jpg|Abbildung 4|align="right"}} |
Kainate – Rezeptoren
Allgemeine Worterklärung der Kainatrezeptoren: Kainatrezeptoren (Kainat = Kainsäure ist Agonist dieser Rezeptoren) gehören zu den Glutamatrezeptoren und können, auf Grund ihres Stroms, in drei Untergruppen eingeteilt werden. Diese Untergruppen sind, schnell desensibilisierender Strom, langsam desensibilisierender Strom und gar nicht desensibilisierender Strom.
Contents
1 Glutamatrezeptoren allgemein
Die Non NMDA inotrophe Rezeptoren reagieren auf den Neurotransmitter Glutamat (eine Aminosäure) und werden durch ihn aktiviert. Die Rezeptoren lösen postsynaptisch eine exzitatorische Neurotransmission aus und präsynaptisch eine Inhibierende. Allgemein betrachtet bezeichnet man Glutamat deshalb als exzitatiorischer Transmitter.
Ein Überschuss an Glutamat kann toxisch wirken (Glutamatexzitatoyizität). Dem wird durch Wiederaufnahme des Glutamates in Neuronen und Gliazellen (Astrozyten) mit Hilfe von Na-abhängigem Aminosäurentransport entgegengewirkt. Generell wirkt das Glutamat auf Ionenkanäle und metabotroph gekoppelte Rezeptoren und spielen eine zentrale Rolle bei Regulation synaptischer Prozesse im ZNS. Unter Anderem beteiligt sich das Glutamat an Vorgängen langanhaltender synaptischer Prozesse im Gehirn und Rückenmark.
1.1 Exzitatorisches Neurotranmittersystem
Spezifische Mediatoren des exzitatorischen Neurotransmittersystems spielen eine wichtige Rolle bei Neurogenerativen Krankheiten. Diese sind folgende:
- Ischämie
- Rasmusens Enzephalitis
- Chinarestaurantsyndrom
- Alzheimer
- Autismus
- Epilepsie
- Parkinson
- Morbus Cushing
- Corea Huntington
- Amytrophe Lateralsklerose
1.2 Long Term Potention
LTP (long term potention) ist der Hauptmechanismus für die Speicherung von erlernten Fähigkeiten im Gehirn, besonders an den Pyramidalzellen des Hypocampus. Dieser Mechanismus steht durch wiederholte Aktivierung von den glutamatergenen zentralen Synapsen mit der Amplitudenzunahme des EPSP´s (Exzitatiorisches Postsynaptisches Potential) in Verbindung. Dieses ist die einfachste Gedächtnisform, welche auch als Engrammbildung (Eingravieren von Lerninhalten) bezeichnet wird. Durch Wiederholen des gelernten Musters kommt es zu Konsolidierung des Gedächnisinhaltes. So entstehen zum Beispiel auch chronische Schmerzzustände, welche durch anhaltende Übererregung der nocizeptiven Neuronen ausgelöst werden. Damit ist die Beteiligung an kognitiven Funktionen im Gehirn wie Gedächtnis und Lernen bewiesen.
Die Aufgabe der Kainatrezpetoren ist ein lagsames EPSP, wohingegen AMPA ein schnelles EPSP hervorrufen. Erstaunlicherweise zeigen exogene Kainatrezeptoren eine deutlich schnellere kinetik auf, als native Rezeptoren im Gehirn. Besonders GluK2/5 Rezeptoren sind erstaunlich langsam. Welche Rolle diese Rezeptoren allerings in der exitatorischen, synaptischen Transmission spielen ist bisher unklar.
AMPA Rezeptoren und Kainat Rezeptoren werden in der selben Region, aber nie in der selben Synapse gefunden. Daraus lässt sich schließen, dass beide Rezeptor- Typen mit den Intrazellulären Abläufen auf eine sehr spezifische Art und Weise interagieren. Dies könnte bedeuten, dass sie auf spezifische Proteine wirken und so direkt ihre Bewegunge bestimmen.
2 Einteilung
Glutamatrezeptoren werden in Introphe und metabotrphe Glutamatrezeptoren eingeteilt. Unterschieden werden dies jeweils aufgrund ihrer Agonisten.
Inotrope Glutamatrezeptoren
Nicht NMDA – Rezeptoren
- AMPA – Rezeptoren: GluR 1-4
- Kainat – Rezeptoren
- Niederaffine: GluR 5-7
- Hochaffine: KA 1-2
NMDA – Rezeptoren
- NR1
- NR2 A- D
- NR3 A und B
Waisen – Rezeptoren
Kainatbindeproteine
- KBP – frog, - cick, - fish-a, -fish-b, - toad
Metabotrophe Glutamatrezeptoren
PI/Ca – gekoppelt
- mGluR 1 und mGluR 5
cAMP – gekoppelt
- tACPD- Rezeptoren
- mGluR 2 und 3
- AP4- Rezeptor
- mGluR 4, 6, 7, 8
Die Kainatrezeptoren gehören sowie die AMPA Rezeptoren zu den nicht NMDA Rezeptroen und damit zu den inotrophen Glutamatrezeptoren. Sie sind überall in der prä- und postsynaptischen Membran des zentralen Nervensystems aufzufinden. Die kaintionenspezifische Ionenporen öffnen sich bei Agonistbindung, es entsteht ein Ionenstrom.
3 Kainate – Rezeptoren
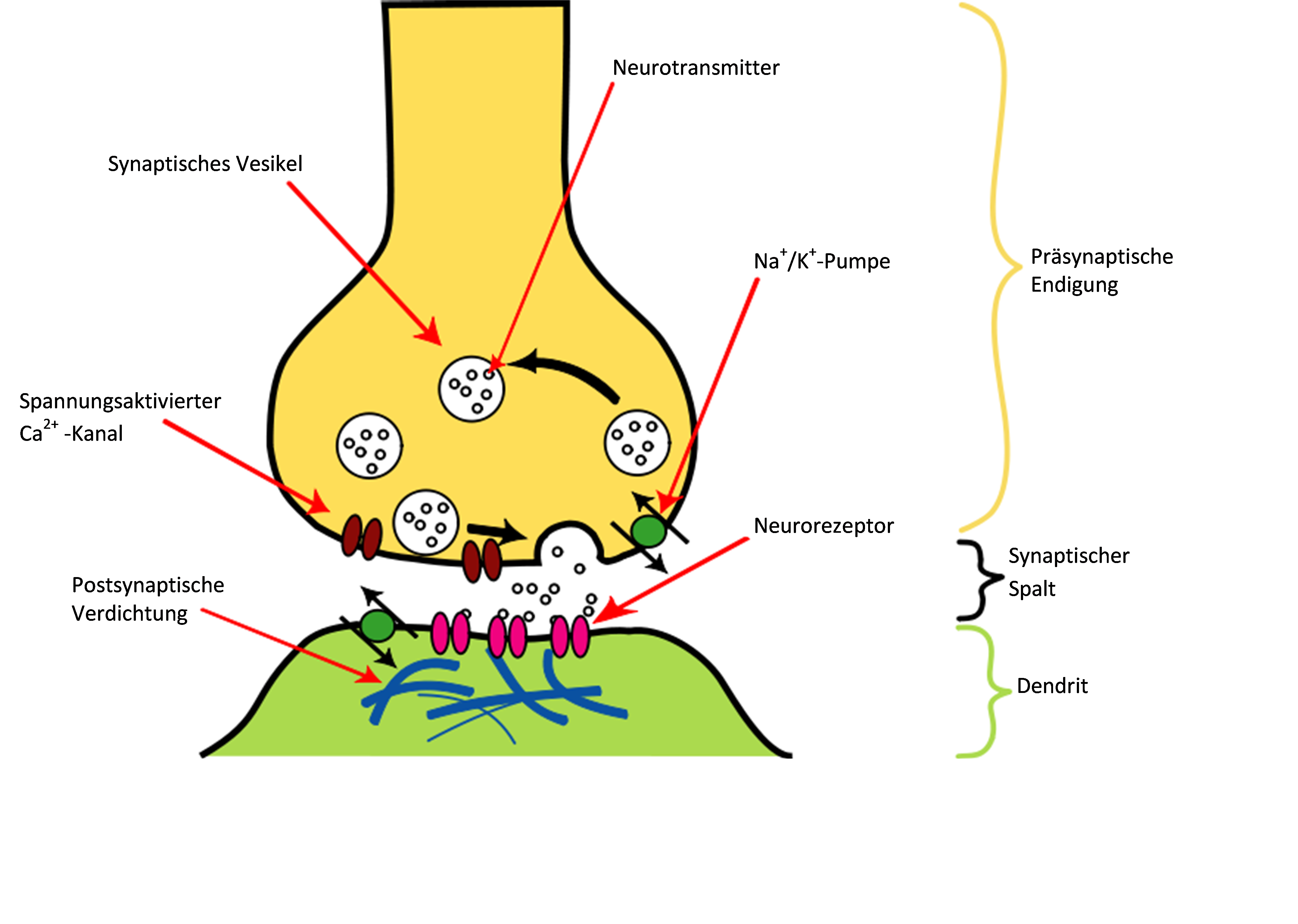
Während der Ontogenese des Gehirns entwickeln sich Kainate Rezeptoren durch neuronale Aktivität. Sie sind Kationenkanäle mit einer schnellen Kinetik,, welche für Na+, K+Ionen und Wasser permeabel sind, jedoch nicht für Ca++ Ionen. Im Ruhezustand sind sie durch Mg++ blockiert. Dieses gibt die Poren nach der Depolarisation an der Zellmembran frei. Allgemein bewirken Kainatrezeptroen eine schnelle Depolarisation an gluterminergenen Synapsen. Der Mechanismus dafür ist die Permeabilitätssteigerung für Calcium- und Natriumionen. Die Kainatrezeptoren lassen sich entsprechend ihrer Untereinheiten in niederaffine und hochaffine
Gruppen einteilen. So wie die Glutamatrezeptoren, kommen auch die Kainatrezeptoren überall im ZNS vor. Durch öffnen des Ionenkanals der Kainatrezeptoren entsteht ein EPSP, zusätzlich modulieren sie die Neurotransmitterfreistzung durch präasynaptische Mechanismen. Dieser Rezeptor ist mittels Glutamat, dem strukturell starren glutamatanologe Kainat, sowie Domoat und Quisqualat aktivierbar und bindet diese. Ihre Aufgabe ist unter anderem die Übertragung von Hitzeempfindung und Schmerz von der Peripherie zum Gehirn und Vermittlung der synaptischen Transmission zwischen den Photorezeptoren und den off-Bipolarzellen der Retina. Eine Besonderheit dieser Rezeptoren ist es, dass sie nicht nur durch ihre Agonisten, sondern auch durch andere erregende Synapsen aktiviert werden oder ein rückläufiges Aktionspotential.
3.1 Post-synaptische Kainatrezeptoren
Postsynaptische Kainatrezeptoren sind im Hippokampus, im Rückenmark, im somatosensorischen Cortex, dem Cerebellum und dem medialen Cortex.
Die Moosfasern CA3 im Hippocampus sind die warscheinlich am besten untersuchten Kainatrezeptoren. Kleine Stromstöße (ca. 1 mal 100Hz) verursachen ein EPSP, welches sensibel auf Kainatantagonisten reagieren, wenn AMPA und NMDA Rezeptoren blockiert sind. Das passiert nicht, wenn auf anderem Wege die CA3 Regionen des Hippocampus stimuliert werden
3.2 Struktur / Untereinheiten
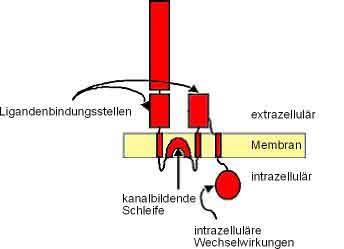
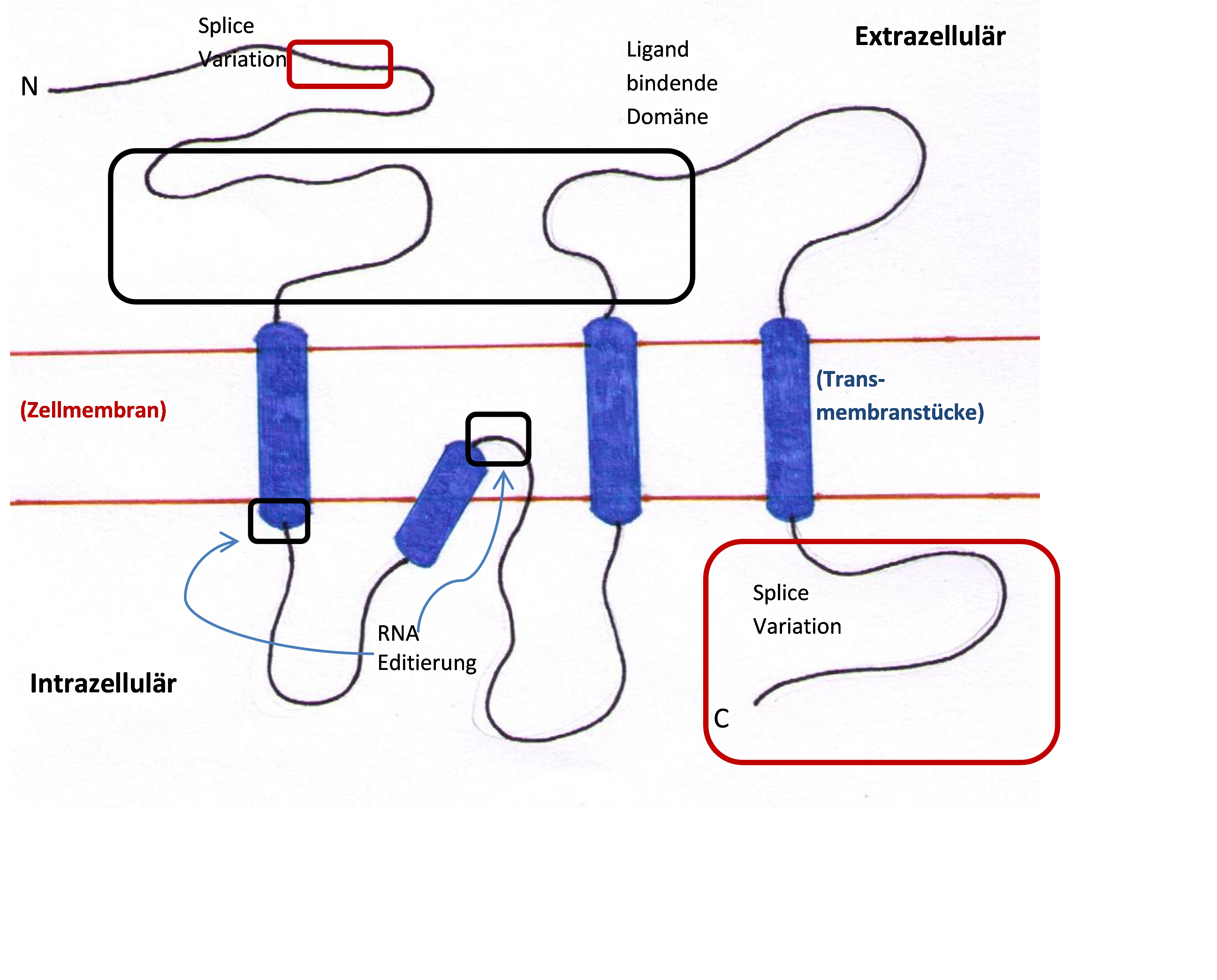
Der Kainatrezeptor besteht aus fünf Untereinheiten. Diese Sind GluR 5, 6 und 7, sowie KA 1 und 2.
GluR 5, 6 und 7 kommen in heteromerer und homomerer Anordnung vor. Wohingegen KA1 und 2 nur in Kombination mit GluR 5 und 6 einen funktionellen heterokomplex bilden kann. Alleine hätten sie keine Ionenkanalfunktion. Diese können in unterschiedlichen Variationen angeordnet werden. Jede dieser Untereinheiten hat 400- N- terminale Domains, pro Domain gibt es drei Membranen. M1, M2, welche sich aus dem Zytoplasma durch die Zellmembran halb durch drückt und dann zurück ins Zytoplasma geht (p-loop). Die M2 bestimmt die Ca++ Durchlässigkeit der Rezpetoren. M3 entsteht aus M2 und legt sich über die transzelluläre Seite des Rezeptors und bildet so die neurotransmittierbindende Seite. Diese Membran ist für die Unterschiede der Untereinheiten GluR 6 und GluR 7 verantwortlich. Die Membran 4 (M4) ist das C- terminale Ende der Untereinheit. Das C-terminale und N-terminale Ende jeder Untereinheit liegen extrazellulär. Diese Membranen bilden einen intrinischen Kationenkanal mit hoher Konduktanz für Natriumionen und Kaliumionen. Neuste Forschungen zeigen, dass diese nicht zu ligandenabhängigen Ionenkalälen gehören.
GluR 5,6 und 7 sind Nieder Affine Untereinheiten. Ihr KD- Wert für Kainat liegt bei:
- GluR 5 = 70nM
- GluR 6 = 95nM
- GluR 7 = 77nM
KA1 und KA2 sind Hoch Affine Untereinheiten. Ihr KD- Wert für Kainat liegt bei:
- KA1 = 4,7nM
- KA2 = 15 nM
Die Untereinheiten GluR 7 weisen in HEK- 293- Zellen (HEK = Humen Embrionik Kidneycells) Ionenkanalfunktionen auf. Es können Punktmutationen in der dritten Membran auftreten. Der GluR sieben wird als nichtfunktionell, sondern als Rezeptor mit geringer Porenöffnung betrachtet.GluR 6 und 7 werden im Gehirn an ähnlicher Stelle expremiert. Wenn GluR 6 mit GluR 7 in heteromerer Form expremiert wird hat GluR 7 eine negativ modulierende Wirkung auf den ganzen Kainatrezeptor
3.3 Funktion/ Funktionsweise
Kainatrezeptoren sind in Gehirnarelen extrem oft vorhanden, die für Lernen- und Gedächnisfunktionen wichtig sind z.B. im Hippocampus. Die für Motorik- und Motivationsausprägung zuständigen Kainatrezeptoren sind z.B. in basalen Ganglien und dem Kleinhirn zu finden. Sie haben eine wichtige Funktion bei der synaptischen Übertragung. Das postsynaptische Potential läuft bei Kainaten REzeptren schneller ab als bei AMPA Rezeptoren. Unter normalen Umständen ist die Ca2 Permeabilität sehr gering, kann sich aber durch Subunits und RNA Editing ändern. Die wichtigste Aufgabe der Kainatrezeptoren außerhalb des Hypocampus ist die synaptische Plastizität im somatosensorischen Cortex. Eine Überstimulation kann zum Zelltod führen, sofern die Dosis hoch genug oder die Inkubationszeit lang genug ist. Bei Hyperpolarisation kommt es zum Ca++ Einstrom in die Zelle, dieser Einstrom ist jedoch von schlechter Qualität. Durch die Erhöhung des Ca++ Spiegels in der Zelle, werden die Mitochondrien in ein höheres Aktivitätslevel gebracht. Allerdings kann durch den angestiegenen Ca++ Spiegel eine Gewöhnung an das erhöhte Membranpotential entstehen, durch diese Habituation bildet sich keine signifikante Differenz zum Normalzustand.
4 Aufgabe des Kainat- Rezeptoren
Kainate Rezeptoren befinden sich in Prä- und Postsynaptischen Neuronen. Ihre Funktion ist im Zusammenhang mit AMPA und NMDA nicht geklärt. Ihre sensorische Transduktion steht in engem Zusammenhang mit Epilepsie. Die Kainate Rezeptoren in der präsynaptischen Zellen können die Menge der freigesetzten Neurotransmitter bestimmen. Wir unterscheiden zwischen schnell und langer und additiver Wirkung. Photorezeptoren nutzen den Neurotransmitter Glutamat um mit anderen Zellen zu kommunizieren. So wird zum Beispiel im Dunkeln ein Neurotransmitter für die postsynaptische Kainaterezeptoren freigelassen, dadurch ändert sich die präsynaptische Spannung innerhalb von 500 ms. Bei Blitzlicht kommt es nicht zur einer Depolarisation, sondern gleich zu einer Hypopolarisation. Eine Begrenzung des postsynaptischen Stroms verhindert eine Desensibilisierung der Rezeptoren.
5 Regulation
5.1 Allgemeine Regulation
Die Transmitterfreisetzung wird unter Einfluss von Magnesiumionen abgeschwächt. Einen Einfluss auf die postysnaptische Rezeptromembran hat unteranderem der Agonist Kainat (Kainsäure), Glutamat, Domoat, AMP, so wie AP5 und CNQX eine kompetitive Hemmung auslösen. Eine Nicht- kompetitive Hemmung wird durch Magnesium Ionen, Kynureninsäure und Katamin induziert. Die Anatgonisten des Kainatrezeptors sind: CNQX, DMQX, NS 102, Kynurenic Acid (endogener Ligand), Tezampanel. Der ständige Reiz der Rezeptromembran durch 300 MikroMol Kainat wird durch CNQX gehemmt, diese Inhibition ist Dissotiationsabhängig. Die Antworten auf die Reizung, welche von Kainat ausgelöst wird, können konstant oder trasient sein. Sie werden durch NS 102 gehemmt, diese verursachen eine schlechte Selektivität für das Impulsverhalten. Die Hemmung des Antagonisten NS244 ist sehr stark bei von stationären Kainate Induzierte Strömen, so werden Peakantworten verhindert. Die Kainat- Antworten werden nicht durch Cyclotiazid direkt beeinflusst, da sie keine spezifischen Bindungsstellen dafür aufweisen, aber es entsteht ein potentierter Strom durch Aktivierung von AMPA Rezeptoren. Es existiert keine vollständige Selektivität gegenüber einigen kompetitiven Antagonisten für AMPA- und Kainat- Rezeptoren. Das ATPA ist ein Kainat Agonist für GluR 5- beinhaltende Rezeptorkomplexe, allerdings ist es relativ uneffektiv an den Untereinheiten GluR 6 und 7. Die Aktivität der Rezeptoren wird ebenfalls durch Proteinphsophorilierung reguliert. Für die Untereinheit GluR 6 werden bestimmte Modulatorproteine unterschieden, diese sind: NDRG1, NDRG2 dieses hemmt in Kombination mit SGK1 die Funktion von GluR 6, mTOR hemmt ebenfalls die Aktivität, RIL hemmt GluR 6, kann aber auch GluR 1 regulieren, Yotiao ist für die Aktivierung von GluR 6 verantwortlich, genau so wie Grb2, Rab-Proteine sind Regulatoren der GluR 6 Aktivität durch ihre Unterformen Rab5 und 11
5.2 Gulkokortokoide
Glukokortikoide haben eine Wirkung auf fast alle Organe. Diese kann sehr vielfältig sein. Sie wirken auf den Kohlenhydrat- und Aminosäurenstoffwechsel indem die Glukosekonzentration im Blut durch Proteinabbau erhöht wird. Außerdem haben sie haben sie eine Antiallergische Wirkung, sie hemmen die Synthese von Lymphokinen und Histaminfreisetzung und stabilisieren zusätzlich Lysosome. Des weiteren haben sie einen Einfluss auf das Gehirn. Sie wirken auf den Hypotalamische Funktionen und können so eine Änderung im EEG sowie in der Psyche induzieren. Glukokortikoide werden bei physischem und psychischen Stress ausgeschüttet. In dieser Stresssituation können sie durch Stimulation des neuronalen lernens die Gedächniskapazität erhöhen. Bei vermehrter Ausschüttung kommt es zu einer Steigerung der GluR 6- Expression im gyrus dentatus und in dem Hypocampus. Die Glukokortikoide haben nachweisbare Wirkung auf die in Gehirn aufzufindenden Astrozyten.
6 Funktionsstörungen
6.1 Klinische Aspekte
Die AMPA Rezeptoren setzten Neurotransmitter frei, die essentiell für Lern- und Erinnerungsprozesse sind. Eine Überaktivität kann das Nervensystem schädigen und den Neuronentod hervorrufen. Die Kainatrezeptoren sind für die Feinabstimmung bzw. die Balance zwischen Neuronaler Inhibition und Exzitation verantwortlich.
6.2 Autismus
Die Ursache für Autismus wird in dem“ several nucleotid polymorphism“ im GluR 6 Transkript gesehen, so soll eine Kontaktstörung der synaptische Übertragung entstehen. Es können Punktmutationen durch Nukleotid Austausch verursacht werden. Entdeckt wurden drei Punktmutation, welche im Exon lokalisiert sind und drei welche in Introns zu finden sind. Diese Mutationen zeigen einen konservativen Aminosäuretausch. Die Mutation M8361 in Exon lokalisiert, dabei kommt es zum Tausch von Methionin gegen Isoleucin im C-Terminalem Teil, welcher verantwortlich ist für die Organisation und elektrophysiologische Eigenschaften. Durch die Veränderung im C-Terminalen Teil GluR 6 Proteins kann SAP90/PSD95 nicht mehr gebunden werden. Dadurch entsteht eine Veränderung der Rezeptorfunktion, z.B. Desensitisierung wird vermindert, damit ist nachgewiesen dass M8361 einen funktionellen Effekt hat.
6.3 Epilepsie
Wenn Glutamin in größeren Mengen in den medialen Kortex abgegeben wird, beschränkt sich das entstehende Potential auf diese Region. Das entstehende Potential kann durch AMPA- und Kainat- Rezeptoren leicht abgeschwächt werden, außerdem wird die neuronale Glutaminaufnahme gehemmt. Im Laborversuch wurden die Neuronen von Tieren mit Kainat behandelt, danach zeigten diese ein langanhaltendes EPSP, welches zum Auftreten von vielen Aktionspotentialen kurz hinter einander führte. Bei epileptischen Tieren zeigte sich nach der Unterbrechung der gluatmatergenen Transmission ein IPSP. Während eines epileptischen Anfalls kommt es zu einer massiven Hyperaktivität der kortikalen Neuronen. Ein stark erhöhter Anstieg von extrazellulären Kaliumionen sorgt für eine Depolarisation der Neuronen und eine Absenkung des Schwellenpotentials. Dies kann nur geschehen, weil die Glia die große Menge an Kaliumionen nicht mehr aufnehmen kann. Dadurch entstehen generalisierte Krämpfe.
6.4 Spreading Depression
Nach einer starker lokaler Reizung z.B. einem Trauma kann es zu einer Ansammlung von Kaliumionen kommen, welche von den Gliazellen in diesen großen Mengen nicht abfangen werden können. Das Ruhepotential kehrt nicht mehr in den Normalzustand zurück und immer mehr Neuronen werden depolarisiert. Durch diesen Vorgang entsteht eine neue Zone von unerregbareren Neuronen. Nach solch einer Reizung kann es bis zu einigen Minuten dauern bis sich die normale Erregbarkeit wieder einstellt.
7 Neurotoxizität
7.1 Allgemein
Eine Natrium- und Chloridaufnahme lässt Zelle anschwellen. Unter dem Einfluss von Stress kommt es zu einem vermehrten Einstrom von Kalziumionen. Dies hat einen „Overload“ zur Folge, welcher im Umkehrschluss zu einer Exitotoxizität führt. Wie Glutamat wirken Endogene exzitatorische Transmitter in hohen Dosen und Aktivitäten neurotoxisch. Sie haben einen Einfluss auf Mitochondrien, Enzyme, Ionenströme. In den Mitochendrien kann es zu einer Akkumulierung von Ca++- Ionen kommen. Dieser Transport hat als treibende Kraft den Ionenkonzentrationsgradienten. Die ATP- Synthese wird reduziert, da ATP in den Mitochendrien wichtig ist um Ca++ aus der Zelle abzutransportieren (aktiver Ionentransport). Die vorliegende reduzierte ATP- Synthese und der wie oben beschriebene erhöhte Verbrauch von ATP sind die primären Gründe für Apoptose. Das Mitochondrium wird geschädigt, obwohl die Neuronen noch gesund erscheinen. Auch Enzyme können eine negative bzw, schädigende Wirkung auf die Zellen haben. Das Enzym Phospholipase A aktiviert Arachnidonsäure, diese verursacht eine ROS Produktion (Reaktive Oxigen Species),daraus entsteht wiederum das Phänomen des „Elektronenleakings“. Dieses hat als Folge eine Schwellung der Zelle bis hin zur Apoptose.
7.2.) Verteidigungsmechanismen der Zelle
Die Zellen aktivieren Antioxidantien diese können Rezeptorantagonisten wie MK801 sein. Außerdem fangen diese spezifischen Stoffe das ROS mit relativ großer Wirksamkeit ab. EGTA bindet Ca2+ und verhindert somit das Anschwellen der Zelle. Neben der aktivierung der Antioxidantien kommt es ebenfalls zu der Verminderung von freiem Glutamat.
7.3.) Protektiver Effekt von Antioxidantien
Diese Verteidunungsmechanismen der Zelle beschützen Neuronen vor giftigen Effekten. Die Aktivierung von Antioxidantien beeinflusst die Rezeptorantagonisten wie MK 801. Sie können ROS abfangen und somit das Elektronenleaking verhindern. Des weiteren werden durch EGTA (ethylene glycol tetraacetic acid) Ca 2+ Ionen gebunden und dadurch ein Überschuss an Ionen und die Überfüllung der Zelle verhindert. Forschungen zeigten, dass eine Behandlung von Neuronen mit SOD (74) oder SOD mimik die Wirkung von Kainatgiften drastisch reduzierte. Ebenso kann eine Behandlung mit Vitamin E und Trolox die Neuronen vor Neurotoxizität schützen. Daraus lässt sich schließen, dass oxidativer Stress eine Schlüsselkomponente für alle Formen der Glutamattoxizität darstellt. Eine besonders wichtige Rolle spielt hierbei das O2 in der Zelle, es ist eine kritische Komponente, die die Neurotoxizität unterstützt. Die Mitochondrien sind die primären Quellen für den reaktiven Sauerstoff.
· Keinate Recepor – Wikipedia
· University of Bristol – BRC Centre for synaptic plasticity
· Progress in Neurobiology – Kainate receptors and synaptic transmission
· Department of cell Biology and Physiology Washington University 2003
· Biochemie des Menschen, Florian Horn, 4. Auflage
· Taschenatlas der Physiologie Stefan Silbernagel, Agamemnon Despopoulos, 6. Auflage
· Die Rolle der metabotropen Glutamatreptoren der Gruppe 1 und 2 in Türmodellen des Schizophrenie der Fakultät für Biologie der Universität Tübingen, Dissertation 2010
· Subunit-assembly of AMPA-type glutamate receptors, Dissertation von Wulf Dirk Luschner 1998
· Die Rolle der metabotroper Glutamatrezeptoren bei der Modulation der erregenden und hemmmenden synaptischen Übertragungen in der Substantia nigra reticulata, Dissertation Marion Wottmann 2001
· Taschenatlas Physiologie Ch. Fahlke, W. Linke, B. Raßler, R. Wiesner
· Physiologe, Jan C. Behrendus und Co, MLP Duale Reihe
· Medizinische Biochemie systematis, Prof. D. Eberhrd Hofmann, Uni Med
· Biochemie und Pathobiochemie, Detlef Donecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok
· Wikipedia.org/wiki/kainate_receptor
· www.ncbi.nlm.hih.gov/pubmed/9923677
· www.nature.com/npp/journal/v34/n1/full/Npp2008158a.html
· www.nbci.nlm.gov/pubmed/892134
