|
Size: 35985
Comment:
|
← Revision 45 as of 2018-05-13 07:38:33 ⇥
Size: 35985
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 238: | Line 238: |
| Wang, S. ; He, H.; Han, R. ; Zhu, J. ; Kou, J. ; Ding, X. ; Qin, Z. (2013):The Protective Effects of Cobra Venom from Naja naja atra on Acute and Chronic Nephropathy. Evid Based Complement Alternad Med; 2013(2013): 478049; doi:[[http://dx.doi.org/10.1155/2013/478049|10.1155/2013/478049]] | Wang, S. ; He, H.; Han, R. ; Zhu, J. ; Kou, J. ; Ding, X. ; Qin, Z. (2013):The Protective Effects of Cobra Venom from Naja naja atra on Acute and Chronic Nephropathy. Evid Based Complement Alternat Med; 2013(2013): 478049; doi:[[http://dx.doi.org/10.1155/2013/478049|10.1155/2013/478049]] |
Contents
Kígyóméreg terápia bevezetés
A világon több mint 2500 mérgeskígyó faj él, amely több családba sorolhatók és mérgeik hatásai sokrétűek. A világon évente 5.5 millió embert marnak meg mérgeskígyók az esetek jelentős részében halálos végkimenetellel vagy életre-szóló egészségkárosodással. Ezen fajok toxinjainak felhasználása a gyógyászatban nem mondható új trendnek, de hatalmas lehetőségeket rejt az orvostudomány jövőjére nézve.
Neurotoxinok
A fekete mamba mérgében található fehérjék a sav-érzékelő ion csatornákra hatva szüntetik meg a fájdalmat
Bevezető:
A polipeptid toxinoknak központi szerepe volt az ioncsatornák élettani és a kórélettani funkcióinak feltárásában. A toxinok a fájdalom területén kiemelkedő fontosságú előrelépést jelentettek a klinikai alkalmazásoknál és az alapkutatásoknál.
A fekete mambából kinyert egy új a központi vagy perifériás idegekben expresszált 3 ujjú fehérje osztály képes megszűntetni a fájdalmat az ASICs-ok (acid-sensing ion channels) gátlásával. Ezek a peptidek (mambalginok) nem toxikusak egerekre, de a morfinhoz hasonló erős fájdalomcsillapító hatásuk van központi és perifériás injektálás esetén. Ez a hatás azonban naloxone-ra rezisztens és a mambalginok kevesebb toleranciát okoznak, mint a morfin, valamint nem okoznak légzési nehézséget.
A mambalginok által okozott farmakológiai gátlás kombinálva a knockdown vagy knockout állatokkal azt mutatja, hogy az ASIC1a és ASIC2a alegységekből álló heteromer csatornák a központi neuronokban és az ASIC1b-t tartalmazó csatornák a nociceptorokban részt vesznek a mambalginok fájdalomcsillapító hatásában.
Csatornablokkoló hatások
A fekete mamba (Dendroaspis polylepis polylepis) mérge egy erős és reverzibilis gátlója a Xenopus nembe tartozó faj oocytájában expresszált ASIC1a csatornának. Liofilizált méregből degenerate PCR-rel egy részleges aminosav szekvenciát használtak ahhoz, hogy klónozzák a megfelelő complementer DNS-t (cDNS).
Két izopeptidet azonosítottak és el is nevezték őket mambalgin-1 és mambalgin-2-nek. Ez a két izopeptid 57 AS-ból épül fel és csak egy a 4-es pozícióban elhelyezkedő alkilláncban térnek el egymástól.
Központi injektálás:
A legtöbb 3 ujjú toxin - mint pl. az alfa-neurotoxinok is - blokkolják a nikotinos acetil-kolin receptorokat és neurotoxikus hatásokat váltanak ki. Azonban a mambalginoknál nem ez a helyzet, ők nem okoznak motoros diszfunkciót, érzéketlenséget, petyhüdt bénulást, görcsöt vagy halált központi injektálás során, egérben. Helyette fájdalomcsillapító hatásokat indukál az akut és gyulladáskeltő fájdalom ellen, ami van olyan erős, mint a morfin, de rezisztens naloxone ellen, kevesebb toleranciával jár, és nem okoz légzési nehézségeket.
A tail-flick és paw-flick teszteknél intrathecalisan mambalgin-1 injektálása során megnőtt a mancs és farok visszahúzás reflexek látenciája. Az ASIC1a csatornáknál teljesen elmaradtak ezek a hatások, ezzel demonstrálva az ASIC1a-t tartalmazó csatornák fontosságát.
A mambalgin-1 továbbá sikeresen elfojtott gyulladásos hővel járó hyperalgesiát és erős fájdalomcsillapító hatással bírt carrageenan intraplantáris injektálását követően a paw-flick teszt során, valamint csökkentette az akut és a gyulladással járó fájdalmat a formalin tesztnél, a morfinhoz hasonlóan.
Perifériás injektálás:
Azon oknál fogva, hogy a mambalginok képesek a különböző ASIC csatornák altípusait expresszálni a nociceptorokban, interplantáris injektálást követően nézték meg az ő perifériás hatásaikat.
Perifériás hatás hasonlít a központira, azzal a különbséggel, hogy itt már nem marad el a hatás az ASIC1a-nál. Az ASIC1b nociceptorokban expresszálódik leginkább; fájdalomban betöltött szerepe ismeretlen, de kiderült, hogy ő vesz részt a perifériás hatások kialakításában (mambalgin-1 hatására) (Diochot és mtsai, 2012).
Béta-bungarotoxin regeneráló hatása motoros axon végződésekre botulinum neurotoxin okozta bénítás után:
Fájdalomcsillapítás mellett vannak kígyómérgekből izolált toxinoknak egyéb ígéretes hatásai is. Egy 2015-ben publikált kutatás során kiderült, hogy egyes neurotoxinok képesek stimulálni axonok regenerációját.
A kísérletek során botulinum neurotoxinokat használtak a taiwani krait (Bungarus multinctus) mérgével kombinálva. A botox snare proteineket hasít a szinaptikus végbunkókon, ezzel meggátolva az acetilkolint hordozó vezikulumok létrejöttét. Ezen neurotoxin beadása bénulással jár, melynek hossza függ a toxin altípusától. A béta-bungarotoxin kalcium-ion túltöltöttséget okoz az axon terminálisban, ami intenzív vezikulum ürítést eredményez és végül a végbunkó degenerációjához vezet. Ezen hatását myelin-hüvely nélküli végeken tudja kifejteni és mitokondrium illetve a cytoskeleton szétesésével egészül ki.
A kísérletek során (rágcsálokon végzett) bebizonyosodott, hogy a toxin okozta károsodást napokon belül regeneráció követi. A botulinum toxin (BoNT/A és B okozta paralízis a kontroll csoportoknál 24 (A) és 7 (B) napig tartott. Viszont ha a botulinum toxin mellett bungarotoxint is adtak az alanyoknak a bénulás időtartama jelentősen megrövidült, mindkét esetben nagyjából a felére csökkent (A=12nap, B=3nap).
Ezek a kísérletek bizonyítják, hogy a botulizmusban szenvedő alanyok sikeresen kezelhetők bungarotoxinnal. Ezen kívül kilátásba helyezi olyan betegségek gyógyíthatóvá válását, amelyeknél a patológiás elváltozások a neuromuscularis junctionál történnek, például az ALS, autoimmun betegségek és egyéb külső anyagok okozta elváltozások (Duregotti és mtsai, 2015).
Citotoxinok
A kígyóméreg proteinek tumorellenes aktivitása: Új trendek a daganatok elleni terápiában
Bevezető:
A rák egy krónikus degeneratív betegség, ami a fejlődő országokban a 2. leggyakoribb halálozási ok. Az IARC (International Agency for Research on Cancer) legutóbbi felmérése alapján jelenleg évente világszerte több mint 10 millió daganatos eset van és a WHO szerint ez a szám még nőni is fog.
A tumor felgyorsult és irányíthatatlanul osztódó abnormális sejtekből áll, amelyek elveszítik apoptotikus képességüket. Kutatások folynak annak érdekében, hogy megtalálják azokat a faktorokat, amelyek segítik a sejtek kontrollálatlan osztódását, és hogy hogyan befolyásolják a rákos sejtek a sejtek közötti kommunikációt, a kromatin és epigenetikus regulációt, az RNS splicing-ot, a fehérje homeosztázist, a metabolizmust és sejtek érési folyamatait.
A kígyómérgek toxikus hatása nagyban összefügg azok sejtekhez és szövetekhez köthető nagymértékű specifitásával és affinitásával. Ezen mérgek annak ellenére, hogy toxikológia hatásuk van, számos belőlük izolált proteinnek és peptidnek van gyakorlati alkalmazhatósága, mint gyógyszerhatóanyag.
A kígyómérgek tumorellenes aktivitása:
A kígyóméreg egy peptidekből, proteinekből, enzimekből, szénhidrátokból és ásványi anyagokból álló komplex keverék. A legfontosabb kígyómérgekben előforduló enzimek az acetilkolin-észterázok, L-aminosav-oxidázok, szerinproteázok, metalloproteinek és a foszfolipáz A2-k (PLA2). (1. Ábra)
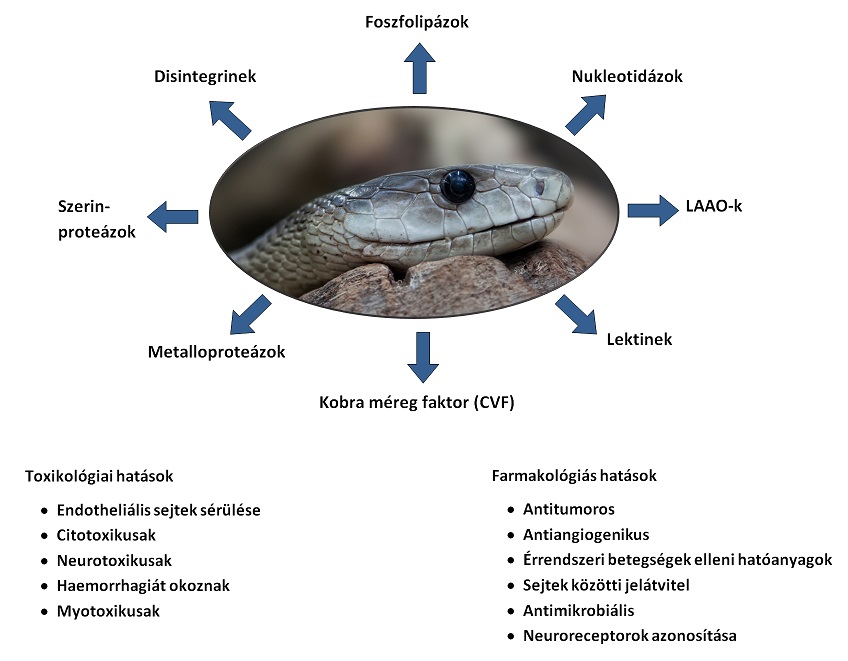
1. Ábra A kígyóméreg összetevői, valamint toxikológiás és farmakológiás hatásai
A kígyómérgek toxikussága kapcsolatban áll azzal a ténnyel, hogy a tumorsejtek metabolizmusát nagyobb mértékben képesek módosítani, mint a normál sejtekét, így különböző cytotoxikusságon alapuló kemoterápiás gyógyszerek kifejlesztését tették lehetővé.
Az első bejelentett kutatás, ami a kígyómérgek tumorsejtek ellenében irányult a defibrináció folyamata volt; ez a kutatás az Agkistrodon rhodostoma nevű kígyó mérgében található polipeptid, az Ancord, ami defibrináció során fibrinolízissel képes csökkenteni a tumor tömegét ezzel hozzájárulva a tumor leválásához és csökkent terjedéséhez.
A kígyómérgeket áttétképződések gátlójaként is vizsgálták; daganat során a halál egyik leggyakoribb oka az áttétképződés, ami a kóros sejtek nyirokerekben vagy vérerekben történő adhézióján, vándorlásán és azok invázióján alapul. Yang és munkatársai egy integrin nevű receptor gátlásával foglalkozott, aminek kritikus szerepe van a sejt-sejt és a sejt-mátrix közötti interakciókban. A tumor terjedésében és inváziójában az integrinek két alcsaládja, a β1 és β3 vesznek részt. Az Agkistrodon contortix contortix mérgéből kivont kontorsztatin (ami egy disintegrin) erős gátlója a β1-integrin közvetítette adhéziónak emberi metasztatizáló (áttétképző) melanoma sejtekben. Jokhio és Ansari a Naja naja atra nevű kígyóból kivont Cardiotoxin III (CTX-III) antimetasztatizáló hatását vizsgálta, ami képes csökkenteni az expresszióját és aktivitását a mátrix metalloproteáznak (MMP-9). Az MMP-9-nek nagy szerepe van a mellrák inváziójában és migrációjában. Van egy olyan cardiotoxin, ami képes indukálni mitokndrium diszfunkció esetén a benne található K562 sejtekben (humán mieloid leukémia sejtvonal) az apoptózist, valamint colorectális carcinománál egy kaszpáz függő mechanizmuson keresztül is képes apoptózist kiváltani.
A kígyómérgek azon tulajdonsága, hogy képesek rosszindulatú sejteket elpuszítani valamint az, hogy cytotoxikus aktivitással bírnak felkeltette az immunológia érdeklődését is. A Naja naja siamensis-ből izolált nem toxikus CVF-et (cobra venom factor – Yoshida sarcomán létrehozott sejtek) kapcsoltak monoklonális tumorellenes antitestekhez, így a nem toxikus antitestek átkonvertálódtak cytotoxikus vegyületekké. Az így létrejött antitest-CVF konjugátumok bíztató terapeutás lehetőséggel kecsegtetnek a humán melanóma, leukémia és neuroblastoma kezelésére, ami később be is bizonyosodott, hiszen ugyanebből a kígyófajból kinyert cytotoxin P4 in vivo és in vitro is képes volt histopatológiás változásokat előidézni leukémiás sejtekben.
A mérgek célpontja a tumosejtekben:
- az egyik ilyen célpont az integrinek:
Az integrinek sejtfelszíni adhéziós molekulák, amelyek képesek összekapcsolni az extracelluláris teret a citoszkeletonnal valamint fontos receptor funkciókkal is bírnak, mint pl. a sejtek migrációjához, inváziójához, osztódásához és túléléséhez kapcsolható jeleket továbbítanak. Ezen molekuláknak számos fontos szerep jut a daganat patológiában, beleértve: a tumorsejtek proliferációját, az angiogenesis-t (új vérerek képződésének folyamata a már meglévőkből), a sejtek invázióját és attétképződést.
- neuroendokrin tumor:
A hipofízis adenóma egy neuroendokrin daganat, ami különböző endokrin és metabolikus módosulatokat termel, többek között hyperprolactinaemiát, akromegáliát, és Cushing kór okozva. Ezek a különböző betegségeket okozó tumorok a hipofízis különböző sejtjei által termelt eltérő kóros hormonok következményei. A hipofízis sejtjeiben található hormontermelést irányító jelátviteli útvonalak kiváló terapeutás lehetőséget rejtenek magukban.
A kígyóméregben fellelhető L-aminosav-oxidázok (Snake Venom L-Amino Acid Oxidases (svLAAOs)) hatása:
Az L-aminosav-oxidázok (LAAOs) sokféle organizmusban megtalálhatóak, mint pl. a baktériumokban, gombákban, algákban és a kígyókban. LAAO-k a dimer flavoenzimek csoportjába tartoznak, amik katalizálják az L-aminosavak oxidatív dezaminálását ammóniává, α-ketosavvá és H2O2-dá.
Jelentőséggel bíró tulajdonságaik: specifikus szubsztrát preferenciájuk van, apoptózist indukálók, cytotoxikusak, hemolízist okoznak, vagy aktiválják, vagy gátolják a vérlemezkék aggregációját, és haemorrhagiát is képesek kiváltani. Továbbá ödémát is kiválthatnak és baktericidként is viselkedhetnek.
Araki és társai megfigyelték, hogy cytotoxikusságot okoz a C. atrox, T. flavoviridis, G. h. blomhoffi, V. ammodytes és a B. arietans LAAO tartalmú mérge a különböző sejtvonalaknál, valamint rájöttek, hogy az LAAO apoptotikus hatása független a H2O2 termelő hatásától.
Zhang és munkatársai a Trimeresurus stejnegeri fajból kinyert LAAO antivirális és cytotoxikus hatását vizsgálták lymphocytás leukémia C8166 sejteken, megkérdőjelezve a H2O2 szerepét a cytotoxikusságot illetően. Kataláz enzimet használva (ami a H2O2-ot H2O-zé és O2-né alakítja), ezzel kiiktatva a H2O2-ot, megfigyelték, hogy az LAAO nagyban elveszítette aktivitását, de még H2O2 hiányában is szignifikáns cytotoxikusságal bírt, alátámasztva azt a hipotézist, hogy más mechanizmus is részt vesz a hatás kiváltásában.
Lektinek:
A lektinek olyan proteinek, amelyek szénhidrátokhoz kapcsolódnak és megtalálhatóak számos állat- és növényfajban. Beleavatkoznak a tumorsejtek proliferációjába, így pl. a BJcuL (Bothrops jararacussu-ból) képes csökkenteni a humán mellrák és petefészek daganat sejtvonalak, egyéb humán sejtvonalak, szarvasmarha agyi endotheliális sejtvonalak életképességét. A Macrovipera lebetina-ból származó „lebectin” pedig képes megakadályozni számos tumorsejt proliferációját adhézióját, migrációját és invázióját, csak úgy mint a vérlemezke aggregációt.
Metalloproteázok:
A metalloproteázok azzal, hogy megváltoztatják a vér koagulációját vagy azzal, hogy interakcióba lépnek az extracelluláris mátrix fő komponenseivel (pl. a kollagénnel, lamininnel és a fibronectinnel), képesek haemorrhagiát kiváltani. Ezek a kígyóméreg metalloproteázok (snake venom metalloproteases – SVMPs) autoproteolízisen keresztül képesek több biológiailag aktív molekulát létrehozni.
Az, hogy az SVMP-k képesek haemorrhagiát kiváltani olyan kutatásokat eredményezett, amelyek a disintegrin domain és a vér koagulációjában fő szerepet játszó vérlemezkék, valamint az α és a β integrinek közötti kapcsolatot vizsgálják.
Számos mátrix metalloproteáznak szerepe van a tumor növekedése során az új erek létrejöttében, de ezen kívül mind a rákos sejtek proliferációjában, mind a sejt-sejt és a sejt-extracelluláris mátix közötti adhézióban. A strukturális hasonlóság az emlős MP-k és a SVMP-k között megerősíti azt az elképzelést, miszerint ezeket a kígyóméreg komponenseket fel lehetne használni az állatok daganatos megbetegedésének kezelése terén is.
Szerinproteázok:
A szerinproteázoknak számos biológiai funkciója van, részt vesznek az emésztésben, a komplementrendszer (az immunrendszer inaktív állapotban jelenlévő, egymást láncreakcióban aktiváló faktorai) aktiválásában, a sejt differenciációban, a homeosztázisban és további élettani folyamatokban. Hatással vannak a véralvadás több lépésére is, így pl. képesek inaktiválni a véralvadási faktorokat, a vérlemezke aggregációt és a fibrinolízist (Calderon és mtsai, 2014).
A tunéziai kígyó mérgében található PLA2 potenciálja a daganatok ellen
Bevezető:
A kígyóméreg többféle neurotoxint, cardiotoxint, citotoxint, és más egyéb különböző aktív összetevőt tartalmaz. Ennek a sokszínű biológiai funkciónak köszönhetően, ezek a biomolekulák több száz tudományos cikk tárgyát képezik különböző kutatási területeken, többek között a biokémia, a biofizika, a farmakológia, a toxikológia és az orvostudomány területén. Az A2-es típusú foszfolipáz a leggyakrabban előforduló protein a viperafélék mérgében. Amellett, hogy a szekretált foszfolipáz A2-k (sPLA2) hidrolázok, fontos tagjai a toxinoknak, amiknek a molekuláris szinten végzett aktivitása, még mindig vita tárgyát képezi. Ezek a fehérjék különböző mechanizmusokkal képesek toxikus hatásokat elérni. A neurotoxicitás, myotoxicitás, a hemolitikus aktivitás, az antibakteriális, az antikoaguláns, az anti-HIV, az antimaláriás, és az anti vérlemezke hatások mellett, egyes PLA2 mérgek antitumor és antiangiogenikus aktivitást mutatnak, függetlenül az enzimatikus aktivitásuktól.
Szekretált foszfolipáz A2:
A viperafélék mérgében található sPLA2-k a II-es PLA2-es csoportba tartoznak. Ezek a PLA2-k általánosságban véve Ca2+-dependens enzimek, amik a foszfolipidek sn-2-es zsírsavas kötés (sn – sztereospecifikus számozás (stereospecific numbering) – egy olyan módszer, ami a glicerin alapú lipidek sztereokémiájának jelölésére szolgál; sn-2-es jelölés pedig a glicerin középső szénatomját, illetve az ahhoz kapcsolódó zsírsavat jelöli) hidrolízisét katalizálják, így felszabadítva három zsírsavat és három lizofoszfolipidet.
A tunéziai viperafélék mérgének fehérjéi:
A disintegrinek és a C-típusú lektinek (CLP-k) egyikei a leggyakrabban kutatott fehérjéknek, amelyek értékes komponensnek bizonyultak az orvoslás és a biotechnológia számára. Ezt alátámasztandó ezek a fehérjék erős és specifikus antagonistái számos integrinnek, mint pl. az alfa-v-béta-3-nak és az alfa-5-béta-1-nek, de ezen felül sok más egyéb biológiai folyamatban is részt vesznek, csak úgy, mint a vérlemezke aggregációban, az angiogenesisben, a tumor invázióban, és a csontok degradációjában.
A CLP-k modulátorai a trombocitáknak, de emellett antiadhezív aktivitással bírnak, sőt képesek gátolni az integrin-dependens proliferációt, a sejtek migrációját, invázióját és az angiogenesist.
A disintegrinek az integrin-ligand interakciók erős gátlóinak bizonyulnak. Ez az integrin-gátló tulajdonság nagyban függ egy tripeptid szekvencia helyeződésétől.
Az utóbbi időben a PLA2-k azon tulajdonságára derült fény, hogy képesek a komplex, többlépéses folyamatokban igen jelentős szereppel rendelkező integrinek módosítására. Ilyen folyamat az angiogenesis, ami jelenleg a fő célpontja a rákellenes terápiákat kifejlesztő kutatásoknak. (2.Ábra)
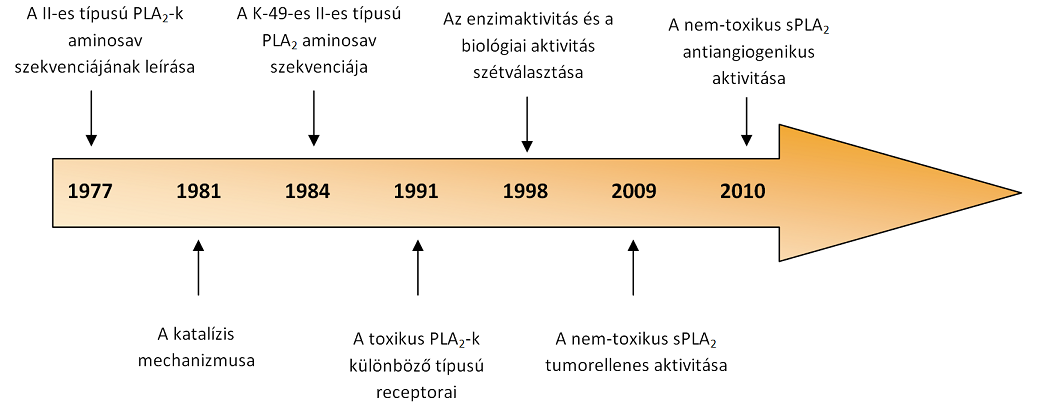
2. Ábra A PLA2 enzimek kutatásában elért mérföldkövek
A tunéziai viperákban fellelhető sPLA2-k és azok farmakológiás aktivitása:
Három savas, nontoxikus PLA2-t izoláltak tunéziai viperákból: CC-PLA2-1-t és CC-PLA2-2-t a Cerastes cerastes-ből, és MVL-PLA2-t a Macrovipera vipera-ból.
sPLA2 hatásai a hemosztatikus rendszerre:
A PLA2-k képesek gátolni a vér koagulációját, aminek mértéke dózisfüggő és ez alapján meg is különböztetünk erős, gyenge és nem-antikoaguláns enzimeket. Az erős antikoaguláns PLA2 gátolni tudja a X-es és Xa véralvadási faktorok aktiválódást mind enzimatikus és nem-enzimatikus módon, valamint ezen kívül a prothrombin thrombinná történő átalakulását is gátolni képes. A trombocita aggregáció fontos szereplője a véralvadékok visszahúzódásának és a sebek gyógyulásának folyamatát tekintve. Kashima és munkatársai megfigyelték, hogy a Bothrops jararacussu-ból kinyert BthA-I-PLA2 - ami egy nem-toxikus, savas PLA2 – képes gátolni az ADP-indukálta trombocita aggregációt. Ezen kívül az Ophiophagus hannah-ból kinyert savas OHVA-PLA2 is erősen gátolni tudja a vérlemezke aggregációt arachidonsav vagy ADP jelenlétében. Ezek alapján pedig úgy tűnik, hogy a PLA2 vérlemezke aktivitását nem annak savas tulajdonsága vagy épp antikoaguláns aktivitásának köszönheti.
sPLA2-k hatása az angiogenesis-re:
Az angiogenesis nélkülözhetetlen a normál gyógyulási folyamatokhoz, a reprodukcióhoz, és az embrionális fejlődéshez. Mivel az angiogenesis folyamata elengedhetetlen a rosszindulatú sejtek tápanyagokkal és oxigénnel való ellátásához, így lényeges szerepet kap a daganatellenes terápiában.
Mind az alfa-v-béta-3, mind az alfa-5-béta-1 szerepet játszik az angiogensis-ben, így in vitro kísérletekkel mind a három enzim (CC-PLA2-1, CC-PLA2-2, MVL-PLA2) károsítani tudta humán agyból származó microvasculáris endotheliális sejtek és microvasculáris endotheliális sejtek adhézióját, valamint migrációját. Továbbá csirke chorioallantois membrán (CAM - Chick chorioallantoic membrane) ex vivo vizsgálatával ezek a sPLA2-k nagymértékben képesek voltak csökkenteni az érrendszer fejlődését. A kezelés pedig csökkentette az új kapillárisok és azok elágazásainak számát anélkül, hogy hatással lett volna a már érett vérerekre (Zouari-Kessentini és mtsai, 2013).
Antibiotikus és gyulladáscsökkentő hatású cathelicidinek tengeri kígyók mérgéből
Bevezető
Egyes kígyó fajok mérgei olyan antibakteriális hatású peptideket tartalmaznak, amelyeket a cathelicidinek csoportjába sorolhatók be. Ezek azoligo- illetve polipeptidek heterogén szerkezetet mutatnak, de általánosan tartalmaznak konzervatív szakaszokat is. 12-80 aminosavból állnak. Feladatuk a gazdaszervezet védelme kórokozóktól. A baktériumok sejtmembránját teszik permeábilisabbá, ezzel lízisüket idézik elő.
A Hydrophis cyanocinctus, egy ázsiai tengeri kígyó faj mérge tartalmaz egy Hc-CATH nevű cathelicidint, amely 30 aminosavat tartalmaz és alfa-hélix szerkezetű. Az aminosav sorrendje ismer és az, azt kódoló gén is be lett azonosítva. Antibakteriális hatását a bakteriális sejtmembrán károsításán keresztül éri el. Jelentős gyulladáscsökkentő hatását az LPS indukált nitrogén monoxid produkció és egyes cytokinek gátlásán keresztül fejti ki. A Hc-CATH igéretes antibiotikum lehet rezisztens baktériumok, gombák és akár paraziták ellen és használható az immunrendszer túlműködésének kivédésére is.
Kísérlet és eredmények
A kígyókat Kínából Beihaiból fogták be, méregmirigy, lép, tüdő, bőr, izom mintákat vettek belőlük. Antimikrobiális próbákat végeztek 48 baktériumtörzsön, ampicillin és meropenem antibiotikum kontrollal. Ezek mellett 11 tengeri patogénen is elvégezték a próbákat. A peptid a 48 törzsből 35-ön hatásosnak bizonyult, ezzel messze túlszárnyalja az ampicillin antibakteriális tevékenységét és alacsony koncentrációban is igen hatásos volt. Egyéb tesztek kiértékelése során bebizonyosodott, hogy a peptid pozitív töltése és szerkezete is komoly jelentőséggel bír az antibakteriális hatásban, a töltés csökkenés a hatás csökkenését eredményezi. Az E. coli baktériumokat mindössze 60 perc alatt pusztította el, a meropenemnek ennek a kétszerese kellett. A cathelicidin kivételesen jól szerepelt a só és hő tolerancia teszteken, bebizonyosodott, hogy kiválóan használható magasabb hőmérsékleten és bőven a fiziológiásat meghaladó só koncentráció mellett. Mindezek mellett a Hc-CATH rezisztensnek mondható a szérum proteázokkal szemben, a próbákon hat inkubációs ciklus után is megőrizte antibakteriális tulajdonságait. A cytotoxicitást és a hemolitikus hatást vizsgálva kiderült, hogy a Hc-CATH enyhe citotoxicitást mutat, de ezzel nem veszélyezteti komolyan az emlős testi épségét. A próbákat Hep62, Pc3 és L929 sejtvonalakon végezték el. További vizsgálatokkal kimutaták, hogy a végleges alak egy 187 aminosavat tartalmazó prekurzorból keletkezik, van egy konzervatív és egy erősen variábilis szakasza (C-terminális). Az eddig ismert cathelicidinek közül a legnagyobb hasonlóságot a királykobra mérgében található cathelicidin-OH-val mutatta. A peptid a mérgessiklófélék cathelicidinjeiből származtatható. Jelenlétét a méregmirigyből, a lépből, a tüdőből és bőrből lehetett kimutatni, az izmokban nem volt jelen.
A Hc-CATH kimutatott tulajdonságai kiváló lehetőséget biztosítanak a gyógyszerként való felhasználására és szintetikus analógok gyártására. A tengeri kígyó környezetében uralkodó viszonyok komoly hatással voltak az evolúciójára, ezzel egy potenciális ’szuper antibiotikumot alkotva’ (Wei és mtsai, 2015).
Hemotoxinok
Ezek a mérgek a keringési rendszeren keresztül fejtik ki halálos hatásukat, de kis adagban használva vagy struktúrájukat szintetikus anyagokkal lemásolva gyógyszergyártásra lehet használni őket. Hatásuk lehet vérnyomás csökkentő és növelő, megakadályozhatják vagy elősegíthetik a véralvadást.
Egyes mérgek vérnyomás esést idéznek elő azzal, hogy az erek basalis membránját permeábilisabbá teszik. A méreg membránkárosító hatása ezzel ödémát okoz, miközben gyors vérnyomás eséshez vezet. Hasonló hatásuk van azoknak a peptideknek (bradykinin potentiating peptides), amelyek a bradykinin rendszeren keresztül a vazodilatációt segítik elő. Várnyomás csökkentés történhet az angiotensin rendszerben az ACE inhibícióján keresztül is.
A haemostaticus mérgek a véralvadási kaszkádba avatkoznak, ezzel meggátolva vagy elősegítve a vér alvadását. A kaszkádot összetettsége miatt rengeteg helyen tudják toxinok szabotálni. Lehet faktorok aktiválásán és gátlásán keresztül (pl. V., X.) vagy vérfehérjék bontásával vagy aktiválásával. Az ilyen mérgeket termelő kígyók marása után a megmart állat belső és külső vérzésektől szenved és többnyire intracranialis vérzéstől vagy kritikusan alacsony vérnyomástól pusztul el.
A fent említett toxinokat és analógjaikat már évtizedek óta használják a gyógyászatban és az orvosi diagnosztikában. Ilyen gyógyszer például a Captopril, amelyet a Jararaca (Bothrops jararaca) lándzsakígyó mérgében található ACE inhibitorból szintetizáltak. Ez a hatóanyag meggátolja az angiotensin I. angiotensin II.-vé alakulását, így csökkenti a vérnyomást.
A Tirofiban és az Eptifibatide diszintegrin proteineket tartalmaz, amelyeket az arab efa (Echis carinatus) mérgében fedeztek fel. Ezek a diszintegrinek képesek integrin receptorokat blokkolni a thrombocyták felszínén, ezzel meggátolva a lemezkék közötti hidak létrejöttét (thrombocyta aggregációt) és meggátolják az aktiváló faktorok illetve a kollagén szálak kötődését. A vér alvadásának gátlása felhasználható myocardialis ischaemia illetve infarktus esetén.
A Batroxobint a brazil lándzsakígyó (Bothrops moojeni) mérgében található fibrinogén specifikus szerin proteázból készítik. A vérben található szerin proteáz inhibitorok (pl. antithrombin 3) nem hatnak rá, ez rendkívül potens antikoagulánssá teszi. Myocardiális és cerebrális infarktus kezelhető vele.
A textilmintás barnakígyó (Pseudonaja textilis) mérgében egy Kunitz típusú szerin proteáz inhibitor a Textilinin 1 található. Ez a plazmin inhibíciója révén fejti ki anti-fibrinolitikus hatását. Bonyolult esetlegesen belső vérzésekhez vezető műtéteknél használják a vérveszteség elkerülése érdekében. A kígyó mérge tartalmaz emellett aktivált ötös és tízes faktor-szerű anyagokat. Az utóbiakat a Haempatch és a CoVase nevű gyógyszerekben használják külső sérülések és el nem szorítható vérzések csillapítására.
Az ecarin nevű kalcium independens prothrombin aktivátor az efák mérgében található meg. Ezt az anyagot kicsapódási tesztekben használják thrombin inhibitorok kvantitatív meghatározására. Fontos szerepe van emellett antikoaguláns terápiák kontrollálásában (Slagboom és mtsai, 2017). (3. Ábra)
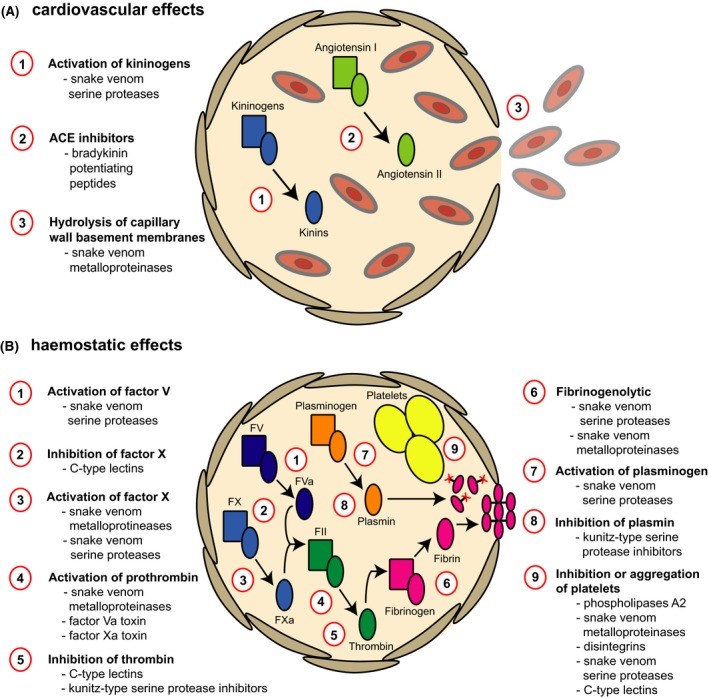
3. Ábra Hemotoxinok élettani hatásai (Julian Slagboom és munkatársai: British Journal of Haematology)
Kígyómérgek vesevédő hatásai az akut és krónikus veseelégtelenség előidézésekor
Bevezető
Kínai kobra (Naja Naja atra) méreg (NNAV) hatásai az akut és krónikus vesekárosodásra patkányban. A patkányok 6mg/kg-os dózisban kaptak adriamycint (ADR), amíg az kiváltotta a krónikus vesekárt, vagy 8ml/kg 50%v/v glycerolt, ami akut veseelégtelenséget okoz.
NNAV orálisan adagolva naponta, a két kiváltóanyag beadását megelőző 5 napon és a kísérlet végéig folyamatosan.
Az állatok vizelet gyűjtőkkel ellátó ketrecekben voltak. Veseműködésük folyamatosan ellenőrizve volt.
Eredmények: NNAV könnyítette az ADR hatásait és csökkentette a glycerol okozta tüneteket, mint proteinuria, hypoalbuminemia, hyperlipidemia, szérum elekrolit egyensúlyzavar, oxidatív stressz és patológiai elváltozások. NNAV csökkentette a TNF-α és IL-1β szintet és emelte a IkB-α és gátolta az NF-kB p65 nukleáris lokalizációját. NNAV akár még egy értékes terápiás gyógyszer lehet az akut és krónikus vesebajok kezelésére.
Az ADR okozta vesekár
Egy klasszikus kísérleti modell a krónikus vesebajra, amit a humán minimal lesion nephrotic syndrome analógjaként tartanak számon.
Tünetek: hypoalbuminemia, hyperlipidemia, proteinuria és nem normális veseműködés.
Oxidatív stressz és gyulladási folyamatok kritikus szerepet játszanak a vese kóros működésében. Reactive oxigen species (ROS) a legfontosabb mediátorai a nephrosis kialakulásának ADR hatására. Oxidatív stressz hatására, a szuperoxid dizmutáz (SOD) eliminálja a reaktív oxidokat és csökkenti a helyi gyulladásos reakciót. Malondialdehid (MDA) a lipidperoxidáció és a tromboxán A2 egyik terméke, továbbá az egyik legjobb markere az oxidatív stressznek.
Megállapították, hogy ADR felelős a fokozott mennyiségű gyulladásos citokin jelenlétéért, mint TNF-α és IL-1β. Ezek aktiválják a IkB kinázokat (IKKs).
Normális körülmények között NF-kB gátlóan kötődik az IkB proteinekhez, amik IkB-α által vannak tipizálva a citoplazmában. Az IkB-α proteolízise okozza a szabadon vált NF-kB transzlokációját a sejtmagba, aktiválva a gén transzkripcióját például a TNF-α és az IL-1β-nek.
Hypertóniás glycerol injekció
Egyike a leggyakrabban használt kísérleti modelleknek, ami szemlélteti az akut veseelégtelenséget (ARF). Glycerol okozta ARF tünetei: RF csökkenése a vesében és reaktív oxigén metabolitok engedése az izmokba.
NNAV hatásai a proteinuriára
A glomerulusok károsodásának egyik legjobb markere a fehérje exkréció a vizeletbe. A vizsgálat kimutatta, hogy a kígyóméreg mérsékelte a protein ürítését az ADR injekció után. Bár átlagos proteinuria fokozatosan nőtt az ADR injekció után, de az NNAV jelentősen csökkentette a vizeletben megjelenő proteinek mennyiségét.
NNAV hatása a vesefunkciókra
Vesebaj esetén emelkedik a szérum keratinin és a vér karbamid szintje is. NNAV-al kezelt állatok esetében ez a szint jóval alacsonyabb volt, mint az ADR vagy glycerollal injekciózott egyedeknél.
NNAV hatása a hyperlipidémiára és a hyperalbuminemiára
Hyperlipidemia okozhat proteinuriát ami elősegíti a vesebajok kialakulását. A szérum koleszterin és triglicerid koncentrációja leesett az ADR-el és glycerollal kezelt egyedeknél. A kígyóméreg megvédte a szérum albumin szintet a leeséstől, de csak igen nagy dózisban (90µg/kg)
NNAV hatása a szérum elektrolit egyensúlyra
Normál körülmények között a patkányok képesek fenntartani az elektrolit egyensúlyt, azonban szélsőséges körülmények között a homeosztázis fenntartása nehézkessé válik és az egyedek fogékonyak lesznek a metabolikus acidózisra.
Korábbi vizsgálatok kimutatták, hogy ADR-el injektált egyedekben a szérum kálium és foszfor koncentrációja emelkedik. NNAV kissé csökkentette az emelkedett káliumkoncentrációt és csillapította a foszfor emelkedését.
NNAV hatása az oxidatív stresszre
A szuperoxid dizmutáz (SOD) aktivitása alacsonyabb volt a vesekárosult egyedekben, mint a kontrolban, ugyanakkor nagy MDA (Metiléndioxi-amfetamin) növekedés figyelhető meg a beteg állatokban. NNAV növelte a SOD koncentrációt a szérumban és csökkentette a vesekéregben az MDA mennyiségét (Wang és mtsai, 2013).
Irodalomjegyzék
Calderon, L. A. ; Sobrinho, J. C. ; Zaqueo, K. D.; Moura, A. A ; Grabner, A. N. ; Mazzi, M. V. ; Marcussi, S. ; Nomizo, A. ; Fernandes, C. F. C. ; Zuliani, J. P. ; Carvalho, B. M. A. ; Silva, S. L. ; Stábeli, R. G. ; Soares, A. M. (2014): Antitumoral Activity of Snake Venom Proteins: New Trends in Cancer Therapy. BioMed Research International 2014: 203639 doi: 10.1155/2014/203639
Diochot, S. ; Baron, A. ; Salinas, M. ; Douguet, D.; Scarzello, S. ; Dabert-Gay, A. ; Debayle, D. ; Friend, V. ; Alloui, A. ; Lazdunski, M. ; Lingueglia, E. (2012): Black mamba venom peptides target acid-sensing ion channels to abolish pain. Nature 490: 552–555 doi: 10.1038/nature11494
Duregotti, E. ; Zanetti, G. ; Scorzeto, M. ; Megighian, A. ; Pirazzini, M. ; Rigoni, M.(2015): Snake and Spider Toxins Induce a Rapid Recovery of Function of Botulinum Neurotoxin Paralysed Neuromuscular Junction. Toxins (Basel), 2015, 7(12), 5322-5336. doi: 10.3390/toxins7124887
Slagboom, J. ; Kool, J. ; Harrison, R. A. ; Casewell, N. R. (2017): Haemotoxic snake venoms: their functional activity, impact on snakebite victims and pharmaceutical promise. British journal of hematology, 2017 Jun; 177(6): 947–959. doi: 10.1111/bjh.14591
Wang, S. ; He, H.; Han, R. ; Zhu, J. ; Kou, J. ; Ding, X. ; Qin, Z. (2013):The Protective Effects of Cobra Venom from Naja naja atra on Acute and Chronic Nephropathy. Evid Based Complement Alternat Med; 2013(2013): 478049; doi:10.1155/2013/478049
Wei, L. ; Gao, J. ; Zhang, S. ; Wu, S. ; Xie, Z. ; Ling, G. ; Kuang, Y. ; Yang, Y. ; Yu, H ; Wang, Y. (2015): Identification and Characterisation of the First Cathelicidin from Sea Snakes with Potent Antimicrobial and Anti-inflammatory Activity and Special Mechanism. Journal of biological chemistry, 2015 Jul 3; 290(27): 16633–16652. doi: 10.1074/jbc.M115.642645
Zouari-Kessentini, R. ; Srairi-Abid, N. ; Bazaa, A. ; El Ayeb, M. ; Jose Luis; Naziha Marrakchi (2013): Antitumoral Potential of Tunisian Snake Venoms Secreted Phospholipases A2. BioMed Research International 2013: 391389 doi: 10.1155/2013/391389
