|
Size: 28488
Comment:
|
Size: 28488
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 36: | Line 36: |
| In mehreren Studien zeigt sich die Schlussfolgerung, dass das alpha-Synuclein Protein akute Mangan-Expositionen abschwächen kann. So berichten Bornhorst et al. (4), dass bei Mutanten unter Mangan-Exposition mit zugeführten alpha-Syn-Proteinen eine verminderte Akkumulation des Mangans zu beobachten war. Ebenso erbrachte das Vorliegen von alpha-Syn-Proteinen in der Studie von Yan et al. (5) bei Mäusen, die mit verschiedenen Mangan-Konzentrationen behandelt wurden, eine Milderung der induzierten Neurotoxizität. Dieser positive, [[https://de.wikipedia.org/wiki/Neuroprotektion|neuroprotective Effekt]] der Entfernung frei zirkulierender Mangan-Moleküle bei akuter Exposition lässt sich durch die Metall-bindende Fähigkeit des Proteins erklären. Es ist anzunehmen, dass dieses Prinzip auch als intrazellulärer Manganspeicher fungieren kann. | In mehreren Studien zeigt sich die Schlussfolgerung, dass das alpha-Synuclein Protein akute Mangan-Expositionen abschwächen kann. So berichten Bornhorst et al. (4), dass bei Mutanten unter Mangan-Exposition mit zugeführten alpha-Syn-Proteinen eine verminderte Akkumulation des Mangans zu beobachten war. Ebenso erbrachte das Vorliegen von alpha-Syn-Proteinen in der Studie von Yan et al. (5) bei Mäusen, die mit verschiedenen Mangan-Konzentrationen behandelt wurden, eine Milderung der induzierten Neurotoxizität. Dieser positive, [[https://de.wikipedia.org/wiki/Neuroprotektion|neuroprotektive Effekt]] der Entfernung frei zirkulierender Mangan-Moleküle bei akuter Exposition lässt sich durch die Metall-bindende Fähigkeit des Proteins erklären. Es ist anzunehmen, dass dieses Prinzip auch als intrazellulärer Manganspeicher fungieren kann. |
Itt írjon a(z) Mn_Neuroinflammation_De-ról/ről
Mangan-induzierte Neuroinflammation
Mangan gehört zu den Übergangsmetallen; es ähnelt dem Eisen, ist silberweiß, hart und sehr spröde. Natürlicher Weise findet man Mangan in Braunstein und in bestimmten Lebensmitteln wie Hülsenfrüchten und Vollkornprodukten. Als essentielles Spurenelement für den Organismus von Lebewesen ist Mangan ein Bestandteil verschiedener Enzyme. Zudem wirkt es zentral bei der Oxidation von Wasser zu Sauerstoff in der Photosynthese.
Contents
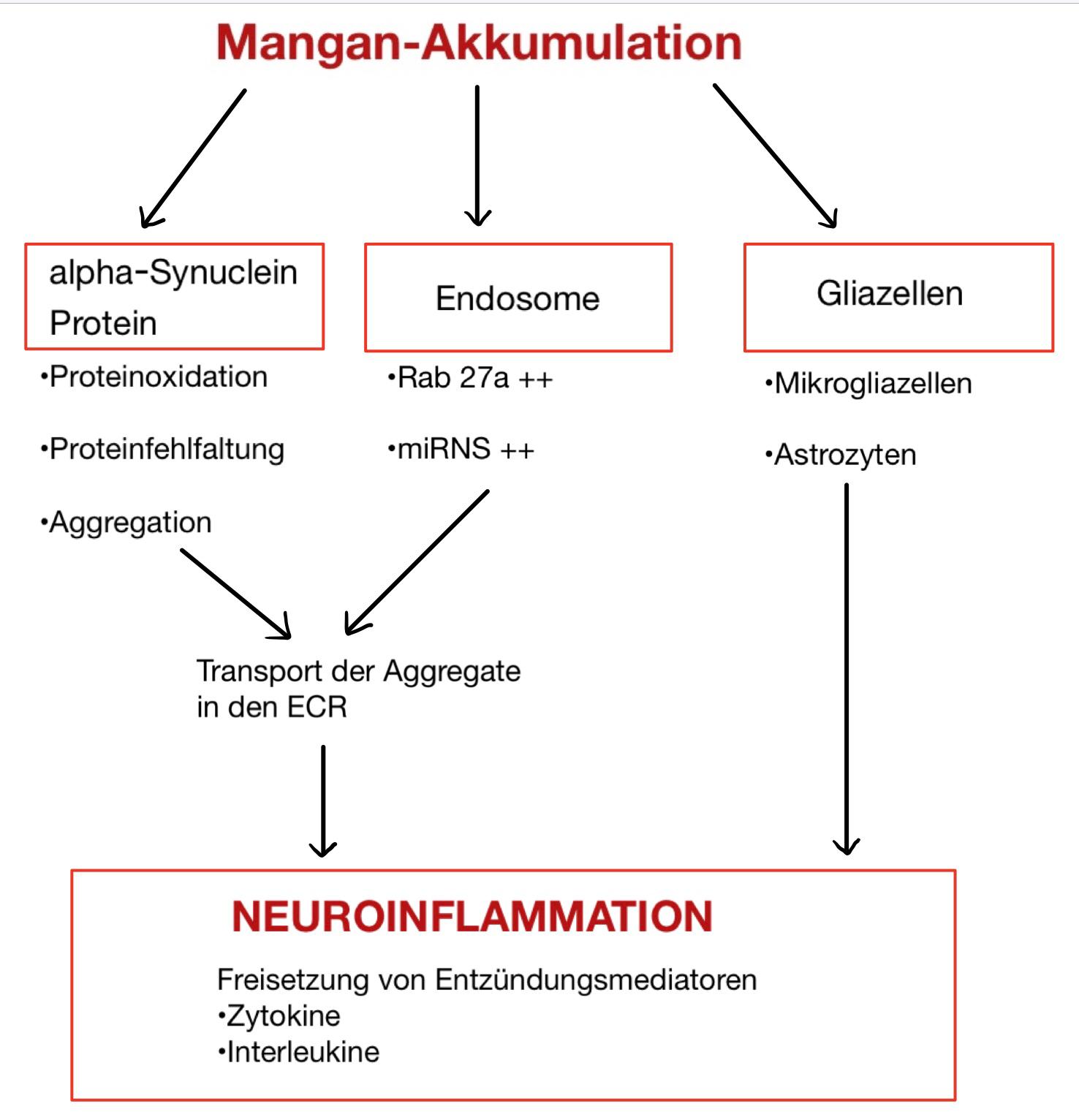
Mangan-Akkumulation
Eine übermäßige, chronische Aufnahme von Mangan führt zur Anreicherung des Spurenelementes in den dopaminreichen Regionen der Basalganglien. Die Studie von Morello et al. (1) zeigte folgende Ergebnisse nach chronischer Exposition. Die höchsten Konzentrationen wurden in den Mitochondrien der Astrozyten (+700 %) gemessen. Ebenfalls erhöhte Konzentrationen zeigten sich in den Mitochondrien der Neuronen (+200 %) und auch in den Nuclei der Neuronen und Astrozyten (+ 100 %). Die Mangan-Akkumulation im Gehirn führt zu Schädigungen an den Kernen der Basalganglien im Telencephalon und somit zu Abnormalitäten der extrapyramidalen, motorischen Bahnen. Auch Störungen der Stoffwechsellage in Form von der Produktion freier Radikale spielen eine entscheidende Rolle.
|
Abbildung 1: Übersicht der neuroinflammatorischen Prozesse |
Wirkung auf das alpha-Synuclein-Protein
Bei dem Alpha-Synuclein handelt es sich um ein an präsynaptischen Endigungen im Gehirn von Wirbeltieren vorkommendes Protein. Zu seinen Funktionen zählen der Membranaufbau, die Regulierung von Dopamin und die neuronale Plastizität.
Harischandra et al. (2) fassen in ihrem Artikel die pathologischen Wirkungen von Mangan auf das neuronale Protein zusammen.
Unter Synucleinopathie versteht man allgemein die Entstehung von neurodegenerativen Erkrankungen, die als gemeinsames Merkmal das Vorliegen von unlöslichem, fehlgefaltetem alpha-Synuclein aufweisen. Die bei der Proteinfaltung entstehende dreidimensionale Struktur ist ausschlaggebend für die fehlerfreie Funktion eines Proteins. Das alpha-Syn-Protein verfügt über drei Bindungsstellen für Metalle. Durch die Metallbindung erfolgt eine Konformationsänderung, die dazu führt, dass das alpha-Syn-Protein Aggregate in Form von Fibrillen bildet Uversky et al (3). Besonders Mangan hat neben einigen anderen Metallen einen starken, nachweisbaren Effekt auf die Stimulation zu der Fibrillen-Anordnung. Die Mangan-Bindung an das Protein zeigt eine sofortige Bildung von Quervernetzungen durch die Bildung von Dityrosin aus zwei Tyrosin-Molekülen. Diese molekulare Veränderung wird als Proteinoxidation bezeichnet und führt, wenn sie nicht vom Organismus repariert werden kann, zur Aggregation der geschädigten Proteine.
akute Mangan-Exposition
Infolge einer akut bestehenden, hohen Konzentration von Mangan und der Bindung des Metalls an die Metallbindungsstellen des Proteins entsteht ein Chelatkomplex. Dadurch werden Mangan-Moleküle durch koordinative Bindungen an das alpha-Syn-Protein gebunden, was zu einer Senkung der frei zirkulierenden Mangan-Moleküle führt. Liegen nun mehr Mangan-Moleküle vor als von dem alpha-Syn-Proteinen gebunden werden können, kommt es zu einer zusätzlichen Anlagerung des Mangans an die Proteine. Dies führt zu der Fehlfaltung der Proteine.
langandauernde Mangan-Exposition
Eine chronisch bestehende Konzentration von Mangan bewirkt ebenso durch die oben beschriebenen Mechanismen die Fehlfaltung und anschließende Aggregation der Proteine.
protective Rolle des alpha-Syn-Moleküls
In mehreren Studien zeigt sich die Schlussfolgerung, dass das alpha-Synuclein Protein akute Mangan-Expositionen abschwächen kann. So berichten Bornhorst et al. (4), dass bei Mutanten unter Mangan-Exposition mit zugeführten alpha-Syn-Proteinen eine verminderte Akkumulation des Mangans zu beobachten war. Ebenso erbrachte das Vorliegen von alpha-Syn-Proteinen in der Studie von Yan et al. (5) bei Mäusen, die mit verschiedenen Mangan-Konzentrationen behandelt wurden, eine Milderung der induzierten Neurotoxizität. Dieser positive, neuroprotektive Effekt der Entfernung frei zirkulierender Mangan-Moleküle bei akuter Exposition lässt sich durch die Metall-bindende Fähigkeit des Proteins erklären. Es ist anzunehmen, dass dieses Prinzip auch als intrazellulärer Manganspeicher fungieren kann.
Dagegen abgegrenzt werden muss die chronische Mangan-Exposition. In dem Fall kommt es zu einer beschleunigten Fehlfaltung der alpha-Syn-Proteine, wie Harischandra et al. (6) berichten.
Transport der Protein-Aggregate und Wirkung auf die Endosomen
Die aus den fehlgefalteten Proteinen entstandenen Aggregate werden in Form von endosomalen Vesikeln aus den Zellen des Gehirns in den Extrazellulärraum transportiert, wo sie die Bildung von inflammatorischen Stoffen auslösen.
Exosome bestehen aus Enzymkomplexen und werden durch Exozytose in den ECR freigesetzt und zirkulieren in Form von Vesikeln durch den Körper. Dieser Proteinkomplex tritt mit anderen Proteinen in Verbindung und kann Substrate abbauen. Eine wichtige Rolle dabei spielen die Rab-Proteine, die an der Vesikelsortierung zwischen den verschiedenen Kompartimenten beteiligt sind.
Studien von Hairschandra et al. (6) und Pfeffer (7) zeigen, dass die Mangan-Exposition die Konzentration von GTPase Rab27a signifikant erhöht. Rab 27 bewirkt Membranfusionen von Vesikelkörpern, sodass Exosome in die extrazelluläre Umgebung freigesetzt werden. Die durch Mangan induzierten neuronalen Exosome führen zu einer erhöhten Expression von bestimmten microRNAs. Diese miRNAs kontrollieren biologische Mechanismen wie Entzündungen, Autophagozytose, Protein-Aggregation und Hypoxie. Es wurde beschrieben, dass Mangan die exosomale Sekretion von alpha-Syn-Aggregaten in den ECR fördert. Diese exosomale Freisetzung von den fehlgefalteten alpha-Syn-Aggregate löst neuroinflammatorische Prozesse aus, bestätigt die Studie von Sarkar et al. (8).
Wirkung auf Gliazellen
Gliazellen
(Harischandra et al., 9) berichten darüber, dass Gliazellen eine wichtige Rolle in der Mangan induzierten Neuroinflammation spielen, da sie entzündungsvermittelnde Mediatoren wie zum Beispiel Zytokine freisetzen. Die zwei bedeutenden Typen von Gliazellen im ZNS, die hierbei eine Rolle spielen, sind Astrozyten und Mikrogliazellen. Sie stellen circa 10 % aller Gliazellen im ZNS dar.
Wirkung auf Mikogliazellen
Mikrogliazellen spielen physiologisch eine große Rolle bei der Aufgabe des Immunsystems, indem sie exzessive Neurotoxine bekämpfen, sterbende Zellen beseitigen und entzündungsfördernde Zytokine freisetzen (Carson et al., 10; Tansey et al., 11). Desweiteren setzten Mikrogliazellen als Antwort auf inflammatorische Mediatoren induzierbare NO-Synthetasen (iNOS) frei, die eine große Menge Stickstoffmonoxid (NO) produzieren. Studien an Nagetieren und nicht menschlichen Primaten, die Mangan ausgesetzt waren, haben gezeigt, dass die Expression von diesen entzündungsfördernden iNOS durch die Mangan-Exposition bei ihnen anstieg (Zhao et al., 12; Verina et al., 13).
Wirkung auf Astrozyten
Astrozyten spielen eine sehr wichtige Rolle in der Mn-induzierten Neuroinflammation (Wedler and Denman, 14). Sie besitzen eine steigende Affinität für Mangan durch die Transferrin-Rezeptoren der Astrozyten. Diese verbinden sich sehr leicht mit dem Mangan zu einem Transferrin-Mn3+ Komplex (Tf-Mn3+). Aus diesem Grund ist es nicht überraschend, dass sich Mangan in Astrozyten stärker anreichert, als in anderen neurologischen Zellen.
Mn3+ lässt die Astrozyten oxidativ und nitrosativ anschwellen (Rama Rao et al., 15).
Morena et al (1) berichten darüber, dass ein hoher extrazellulärer Manganspiegel die Calcium-Bindungsstellen von Astrozyten besetzt. Diese Auswirkungen auf die mitochondriale Calcium-Homöostase können eine Astrogliosis auslösen, die im Rahmen von entzündlichen Vorgängen in Zellen des Nervensystems zu beobachten ist.
Hazell and Norenberg (16) konnten anhand ihrer in vitro Versuchen nachweisen, dass Mangan-ausgesetzte Astrozyten größere Mengen von L-Arginin als Substrat für die NO-Produktion verbrauchen. Diese Reaktion geschieht physiologisch in der frühzeitigen Antwort eines Körpers auf neuronalen Stress oder Zellschädigung. In pathologischen Fällen kann eine extreme NO-Produktion zu einem toxischen Schlaganfall führen.
Moderne molekularbiologische Untersuchungssysteme von menschlichen Mangan-ausgesetzten Astrozyten zeigen eine Upregulation von Genen, die entzündungsfördernde Zytokine codieren. Dieser Vorgang steht im Zusammenhang mit einer konkurrierenden Downregulation von Genen, die an der Zellregulation, der DNA-Replikation und der DNA-Reparatur beteiligt sind (Sengupta et al., 17). Diese Mangan-induzierte Upregulation auf der einen Seite und die Dowenregulation auf der anderen Seite führen zu einer Gleichgewichtsverschiebung der codieren Gene, sodass im Körper mehr inflammatorische Zytokine vorliegen.
Angestiegene Mn-Konzentrationen in Astrozyten führen zur Expression von entzündungsfördernden Signalen (Morello et al., 1).
Nach der Studie von Santos et al. (18) nahm die Konzentrationen von FS-Isoprostan (F2-IsoP) und Prostaglandin-2 in Gehirnen von Ratten, die mit Mangan behandelt wurden, zu. Der Anstieg dieser Entzündungsmediatoren deutet als Biomarker auf das Vorhandensein von oxidativem Stress hin. Ebenso wurde in der Studie von Milatovic et al. (19) ein erhöhter F2-IsoP-Spiegel in vitro und in vivo gemessen. In vitro wurden cortikale Neurone für 2 Stunden mit 500 um Mn behandelt. Die Vorbehandlung mit Antioxidantien, Vitamin-E Analog, Trolox oder Entzündungshemmern über 30 min ergab eine Hemmung der neuroinflammatorischen Effekte des Mangans.
Im in vivo Versuch zeigte sich neben der signifikanten Erhöhung des F2-IsoP-Spiegels eine Veränderung des Dornenfortsatzes auf der Oberfläche von Neuronen sowie Schädigungen an Dendriten des mittelgroßen Projektionsneurons des Striatums (MSN), die eine bedeutende Rolle bei der motorischen Kontrolle darstellen.
Eine orale Vorbehandlung mit Vitamin-E oder Iboprofen über das Trinkwasser über zwei Wochen brachte eine Milderung der erhöhten F2-IsoP-Konzentration im Gehirn und schütze die Mäuse vor Atrophie der MSN und Degeneration der Dornenfortsätze auf Nervenzellen.
Die größte Rolle der freigesetzten inflammatorischen Stoffe durch die Gliazellen stellen dar:
iNOS |
Nitric oxide synthase: induziert Gewebeschädigungen (Galea et al., 20) |
Interleukine-6 |
Aktivator der Akute-Phase-Proteine, wirkt Lymphozyten stimulierend |
Interleukine 1-ß |
induziert Fieber, bewirkt den Anstieg von neutrophilen Granulozyten, Thrombozyten und Akut-Phasen-Proteine |
Prostaglandin-2 |
Gewebeschwellungen, Röte, Schmerzen, Fieber |
Tabelle 1: Entzündungsmediatoren |
Bildung von reaktiven Sauerstoffspezies
|
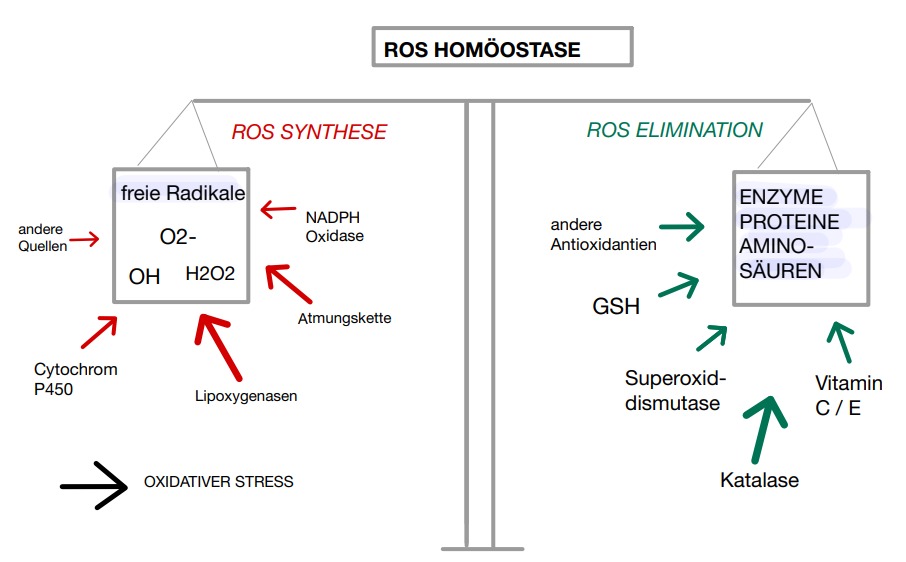
Abbildung 2: Homöostase der ROS |
Auf physiologisch bewirkt Mangan als Cofaktor die Bildung des Enzyms Superoxiddismutase. Durch das hohe Reduktionspotential kann Mangan als redoxaktives Metall die Nebenprodukte des Sauerstoffstoffwechsels, Superoxid (O2-) und Wasserstoffperoxid (H2O2), aus dem Organismus entfernen.
Durch die Ansammlung von größeren Mn-Mengen findet eine Bioakkumulation statt. Für den dadurch entstehenden oxidativen Schaden ist das Gehirn, als metabolisch aktives Organ, besonders anfällig.
Bekannterweise sammelt sich Mangan, aufgrund des hohen Sauerstoffverbrauches hauptsächlich im Globus pallidus und im Striatum an. Außerdem finden sich in sind diese Regionen des Gehirns ein hoher Gehalt von Dopamin und nicht-häm-Eisen-Proteinen wie NADH-Dehydrogenase, die die Anfälligkeit für oxidative Verletzungen vergrößert (Harischandra et al., 9).
Mangan wirkt auf den Transport von Dopamin und in hoher Konzentration verhindert Mn die Wiederaufnahme des Dopamins über den Dopamintransporter (DAT) in die Zelle. Das löst eine Dopamin-induzierte Zytotoxizität aus (Roth et al., 21). Außerdem kann Mn dann über DAT in dopaminerge Neuronen transportiert werden, wodurch Zellsignalmechanismen ausgelöst werden, die eine Produktion von reativen Sauerstoffspezies (ROS) erhöht (Harischandra et al., 6). Nacheinander werden Prozesse gestartet, die zur Apoptose der Zelle führen.
Dopamin ist ein Neurotransmitter und gehört zur Familie der Katecholamine. Durch die chemische Struktur ist es für die Reaktion der Oxidation prädisponiert. Dabei können freie Radikale entstehen, wodurch das Stoffwechselprodukt des Dopamins als Neurotoxin wirken kann und zu neurodegenerativen Prozessen beiträgt.
Beim Abbau von Dopamin entsteht Wasserstoffperoxid(H2O2), das bei einem hohen Gehalt von Mangan via Fenton- Reaktion, durch zwei- oder dreiwertiges Mangan zu freien Radikalen umgewandelt wird.
Unter physiologischen Bedingungen werden diese freien Radikale durch Antioxidantien beseitigt. Glutathion (GSH) ist sowohl in Neuronen als auch in Astrozyten vorhanden. Unter Beeinträchtigung der zellulären Funktion der Antioxidantien entsteht ein Ungleichgewicht zwischen der ROS-Synthese und ihrer Beseitigung. Folglich ist das Gehirn durch ein gestörtes Antioxidationssystem anfällig für Mn-induzierte Neurotoxizität (Chen and Liao, 22).
Im Fall des Neurotransmitters Glutamat kann ein hoher Mangan-Spiegel im Gehirn eine grundlegende Aktivierung des Glutamat-abhängigen NMDA-Rezeptor auslösen, die zu einem neuronalen Tod durch Excitotoxizität führt, sobald es in den synaptischen Spalt freigesetzt wird (Harischandra et. al, 9).
Mangan ist auch an der Neurotransmitterregulation beteiligt sind und die chronische Exposition eines hohen Mn-Spiegels kann die Aktivität von Acetylcholinesterase (AChE) hemmen, wodurch sich ACh in der synaptischen Spalte ansammelt. Deshalb werden die muskarinische und nikotinische ACh-Rezeptoren überstimuliert. Der genaue Mechanismus ist bisher unbekannt, aber die Folge ist durch die erhöht die Hemmung von AChE, ist die ROS- Produktion (Milatovic et al., 23; Santos et al., 24).
Darüber hinaus gibt es von Dopamin abgeleitete Chinone, die Proteine wie alpha-Synuclein und das Enzym Ubiquitin-Protein-Ligase Parkin, binden und verändern kann. Diese Art von Makromolekülen sind besonders von oxidativem Stress gefährdet, da beschädigte Sequenzen der Nukleinsäuren und Mutationen in der Basenanordnung das Protein irreparabel schädigen und funktionsunfähig machen. Guanin ist am anfälligsten der fünf Nukleinbasen für die Oxidation durch Hydroxylradikale (Cooke et al., 25; Cerchiaro et al., 26). Mangan ist in der Lage durch Autoxidation oxidative Schäden an Thiamin- und Guanin-DNA-Basen zu katalysieren (Stephenson et al. 27).
Überschüssiges ROS führt außerdem zur Oxidation von mehrfach ungesättigten Membranfettsäuren (PUFA). Dabei entstehen zahlreichen Oxidationsprodukte der Peroxide. Aus PUFA bestehen die meisten biologischen Membranen von Zellen und Organellen. Eine strukturelle Schädigung der Neuronen entsteht durch Lipidperoxidation, bei der das Lipid ein Elektron an freie Radikale abgibt (Harischandra et. al, 9).
Die Anreicherung von Mangan in den Mitochondrien findet hauptsächlich über den mitochondrialen Ca2 + -Uniporter statt. Es ist so an mitochondriale Membranproteine gebunden ist (Gavin et al., 1999). Für die in der inneren Mitochondrienmembran ablaufende Atmungskette sind Succinat, Malat und Glutamat sind wichtige Substrate. In hohen Konzentrationen bindet Mn2+ an diese Substrate und hemmt wirksam die Mitochondrienatmung (Gavin et al., 28). Dabei führt der Abbau der mitochondrialen oxidativen Kaskade des Energiestoffwechsel zum dopaminergen Zelltod. Die Störung der oxidativen Phosphorylierung löst die nachgeschaltete Freisetzung von Entzündungssignalen aus, was letztendlich zur Apoptose führt (Harischandra et al., 9).
Neurodegeneration
Manganismus
Letztendlich kann aus der Entzündung eine Zelldegenration und damit der Verlust von dopaminergen Neuronen entstehen. Das sich daraufhin zeigende klinische Krankheitsbild wird als Manganismus bezeichnet. Es tritt in der Regel berufsbedingt bei Arbeitern auf, die durch ihre Tätigkeit im Bergbau oder beim Elektroschweißen über längere Perioden dem Neurotoxin ausgesetzt sind.
Olanow (29) berichtet über folgende Symptome, die sich bei Fortschritt der Erkrankung irreversibel ausbreiten:
physisch |
Muskelschwäche, gebeugte Haltung, leise Sprache, Gliederzittern, Speichelfluss |
psychisch |
Halluzinationen, Psychosen, Verhaltensstörungen (akut auftretend) |
Spätfolgen |
motorische Defizite, Gangstörungen mit Neigung nach rechts, Gleichgewichtsstörungen, Bradykinese, Rigor, Mikrographie, maskenartiger Gesichtsausdruck, Sprachstörungen |
Tabelle 2: Symptome Manganismus |
Parkinson
Die meist erwähnte, klinisch ähnlich verlaufende Erkrankung stellt die Parkinson-Krankheit dar. Ähnlich wie beim Manganismus zeigt sich die Parkinson-Erkrankung mit Beeinträchtigung der Mimik und der Motorik. Obwohl es sich um unterschiedliche Krankheiten handelt, teilen sie viele Gemeinsamkeiten.
Bowman et al. 30 stellen unter anderem die beiden Krankheitsbilder gegenüber.
An Parkinson erkrankte Patienten zeigen einen charakteristischen Tremor in Ruhe. Im Gegensatz dazu tritt ein Ruhetremor bei Manganismus nur selten auf. Beide Erkrankungen gehen mit einem Verlust von Neuronen in der Substantia nigra einher. Bei Parkinson in der Pars compacta und bei Manganismus in der Pars reticulata. Das Transportprotein α-Synuclein kommt im Gehirn von Wirbeltieren vor. Mutationen führen zu erblich bedingten Formen der Parkinson-Krankheit. Mangan verstärkt die Bildung dieses Proteins durch Bildung von Fibrillen. Genauso wie bei einer Manganintoxikation kennzeichnet sich Parkinson durch eine Schädigung der Mitochondrien und der Bildung von oxidativem Stress.
Literaturverzeichnis
Fachartikel
- Marlena
- Marlena
- Marlena
- Marlena
- Marlena
- Marlena
- Marlena
- Marlena
- Dilshan S. Harischandra, Shivani Ghaisas, Gary Zenitsky, Huajun Jin, Arthi Kanthasamy, Vellareddy Anantharam, Anumantha G. Kanthasamy (2019); Manganese-Induced Neurotoxicity: New Insights Into the Triad of Protein Misfolding, Mitochondrial Impairment, and Neuroinflammation; Frontiers in Neuroscience
https://www.frontiersin.org/articles/10.3389/fnins.2019.00654/full#B161
- Monica J. Carson, Tina V. Bilousova, Shweta S. Puntambekar, Benoit Melchior, Jonathan M. Doose, Iryna M. Ethell (2007); A rose by any other name? the potential consequences of microglial heterogeneity during CNS health and disease; Neurotherapeutics The Journal of the American Society for Experimental Neurotherapeutics
https://link.springer.com/article/10.1016/j.nurt.2007.07.002
- Malu G. Tansey, Melissa K. Mccoy, Tammy Frank-Cannon, Jae Kyung Lee (2008); Neuroinflammation in Parkinson's disease: is there sufficient evidence formechanism-based interventional therapy?; Frontiers in Bioscience
- Fang Zhao, Tongjian Cai, Mingchao Liu, Gang Zheng, Wenjing Luo, Jingyuan Chen (2008); Manganese Induces Dopaminergic Neurodegeneration via Microglial Activation in a Rat Model of Manganism; Toxicological Sciences
- Tatyana Verina, Samara F. Kiihl, Jay S. Schneider, Tomas R. Guilarte (2010); Manganese exposure induces microglia activation and dystrophy in the substantia nigra of non-human primates; Neuro Toxicology
https://www.sciencedirect.com/science/article/abs/pii/S0161813X10002214
- Frederick C. Wedler, Robert B. Denman (1984); Glutamine Synthetase: The Major Mn(II) Enzyme in Mammalian Brain; Current Topics in Cellular Regulation
https://www.sciencedirect.com/science/article/pii/B9780121528249500216
- K.V. Rama Rao, P.V.B. Reddy, A.S. Hazell, M.D. Norenberg (2007); Manganese induces cell swelling in cultured astrocytes; Neuro Toxicology
https://www.sciencedirect.com/science/article/abs/pii/S0161813X07000496
- Alan S. Hazell, Michael D. Norenberg (1989); Ammonia and Manganese Increase Arginine Uptake in Cultured Astrocytes; Neurochemical Research
- Amitabha Sengupta, Sarah M. Mense, Changgui Lan, Mei Zhou, Rory E. Mauro, Lisa Kellermann, Galina Bentsman, David J. Volsky, Elan D. Louis, Joseph H. Graziano, Li Zhang (2007); Gene expression profiling of human primary astrocytes exposed to manganese chloride indicates selective effects on several functions of the cells; Neuro toxicology
https://www.sciencedirect.com/science/article/abs/pii/S0161813X06002555
- Santos et al.
- Milatovic et al.
- Elena Galea, Douglas L. Feinstein (1999); Regulation of the expression of the inflammatory nitric oxide synthase (NOS2) by cyclic AMP; The Faseb Journal
- Jerome A. Roth, Zhezheng Li, Swetha Sridhar and Habibeh Khoshbouei(2013); The effect of manganese on dopamine toxicity and dopamine transporter (DAT) in control and DAT transfected HEK cells, Science Direct
- Chun-Jung Chen and Su-Lan Liao (2002); Oxidative Stress Involves in Astrocytic Alterations Induced by Manganese, Science Direct
https://www.sciencedirect.com/science/article/abs/pii/S0014488602978945
- Dejan Milatovic, Ramesh C. Gupta and Michael Aschne (2006); Anticholinesterase Toxicity and Oxidative Stress, The Scientific World Journal
- Dinamene Santos, Dejan Milatovic,Vanda Andrade, Camila Batoreu, Michael Aschner and A.P.Marreilha dos Santos (2012); The inhibitory effect of manganese on acetylcholinesterase activity enhances oxidative stress and neuroinflammation in the rat brain, Science Direct
- Marcus S. Cooke, Miral Dizdaroglu, Mark Evans and Joseph Lunec (2003); Oxidative DNA damage: Mechanism, mutation, and disease, Research Gate
Giselle Cerchiaro, Celeste Bolin & Fernando Cardozo-Pelae (2009); Hydroxyl radical oxidation of guanosine 5′triphosphate (GTP): requirement for a GTP–Cu(II) complex, Redox Report, https://www.tandfonline.com/doi/pdf/10.1179/135100009X392520
- Adrienne P.Stephenson, Jeffrey A.Schneider, Bryant C.Nelson, Donald H. Atha, Ashok Jain, Karam F.A.Soliman , Michael Aschner, Elizabeth Mazzio and R. Renee Reams (2013); Manganese-Induced Oxidative DNA Damage in Neuronal SH-SY5Y Cells: Attenuation of thymine base lesions by glutathione and N-acetylcysteine, Science Direct
- Gavin CE, Gunter KK, Gunter TE (1999); Manganese and calcium transport in mitochondria: implications for manganese toxicity, Europe PMC
Abbildungen
Abbildung 1: Übersicht der neuroinflammatorischen Prozesse
Abbildung 2: Homöostase der ROS
Tabellen
Tabelle 1: Entzündungsmediatoren
Tabelle 2: Symptome Manganismus