Nanoplastik beeinflusst das endokrine System
Lena Rudolph, Niclas Winkler
Contents
Einleitung
Seit den frühen 1950er Jahren, wächst die weltweite Plastikproduktion stetig. Wurden vor siebzig Jahren noch ca. 1.7 Millionen Tonnen jährlich produziert, befand sich 2016 das jährliche Produktionsvolumen bereits bei 322 Millionen Tonnen (Revel et al., 2018)39. Diese Entwicklung zeigt deutlich, dass Plastik zu einer der wichtigsten Materialien des 21. Jahrhunderts geworden ist. Auf Grund der immer weiter ansteigenden weltweiten Plastik Produktion, wächst somit auch die anfallende Menge an Plastikmüll. Die Problematik besteht darin, dass der Plastikmüll nur bedingt recycelt wird und in marinen und terrestrischen Lebensräumen in immer größeren Mengen zu finden ist. Dort wird er von den Organismen aufgenommen und gelangt früher oder später über die Nahrungskette in den Körper von Mensch und Tier. Schon jetzt ist sicher festzustellen, dass Nanoplastik einen signifikanten Einfluss auf den menschlichen und tierischen Organismus besitzt. Besonders die bisher nachgewiesenen toxischen Wirkungen einzelner Bestandteile und Additive, verursachen Erkrankungen des Endokrinen Systems.
Vorkommen
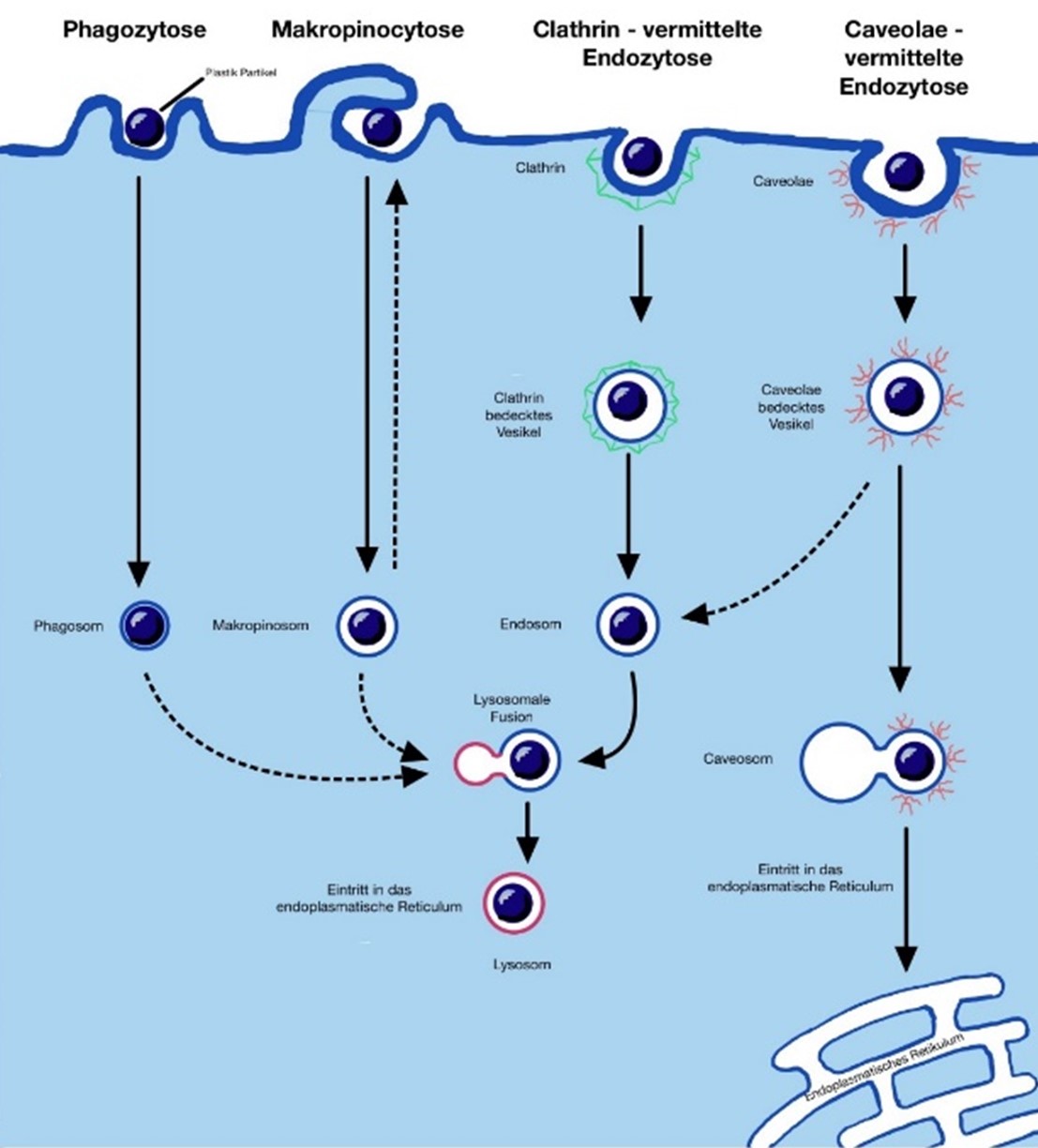
Abbildung 1. Möglichkeiten der zellulären Aufnahme von Plastikpartikeln |
|
von Niclas Winkler |
In den letzten Jahren wurden Plastikfragmente, auch Mikroplastik (kleiner als 5mm) genannt, in den weltweiten marinen Lebensräumen immer präsenter. Laut der Forschungsergebnisse von Lehner et al. (2019)26 gelangten im Jahr 2010 4.8 - 12.7 Millionen Tonnen Plastikmüll, welcher von 192 küstennahen Staaten verursacht wurde, in die Ozeane.
Auf Grund der kontinuierlichen Fragmentierung des Mikroplastiks, zerfällt es zu Nanoplastik (< 5mm). Durch die Kombination von chemischen sowie physikalischen Vorgängen, zB. durch Photoabbau, Oxidation, hydrolytischen Abbau, mechanischen Einwirkungen und Sonnenlicht allgemein, beginnt das Plastik spröde zu werden und in immer kleinere Teilchen zu zerfallen, indem die chemischen Bindungen aufgehoben werden. Studien ergaben, dass sich Polystyrenepartikel auf Nanogröße nach 4 Wochen in der Versuchswetterkammer gebildet haben (Lehner et al., 2019)26.
Die organischen Polymere, wie Polyethylene (PE), Polystyren (PS), Polypropylen (PP), Polyvenyl Chlorid (PVC), Polyurethan (PUR) und Polyethylenterephthalat (PET), sind die Hauptbestandteile von Plastik. So genannte Additive, wie beispielsweise Phthalate und Bisphenol A, werden den organischen Polymeren beigemischt, um das Plastik entweder hitzebeständiger, widerstandsfähiger, zug-, oder druckfester zu gestalten (Revel et al., 2018)39. Diese Zusatzstoffe (Additive) gehen jedoch keine besonders starke chemische Bindung mit den organischen Polymeren ein, sodass eine Abspaltung oder Herauslösung dieser Additive möglich ist (Yee et al., 2021)51.
In Abhängigkeit von der Größe der Plastikpartikel, können diese von verschieden Spezies als Nahrung verwechselt werden. Davon betroffen sind Seevögel und Fische, aber auch die primären Konsumenten der Nahrungskette, wie Zooplankton. Forscher fanden heraus, dass Textilfasern, mit Dimensionen im Mikrometerbereich, welche sich beim Waschen der Kleidung lösen, von den Filtersystemen in den Kläranlagen nicht gefiltert werden können und somit unweigerlich in der Umwelt landen. Ergänzend ist zu erwähnen, dass Hygiene Produkte, wie beispielsweise Zahnpasta oder Gesichts Cremé, oft Polyethylen basiert sind und mit dem Abwasser als Vektor in die Umwelt gelangen können. Überall auf dem Planeten fand man Beweise für die Anwesenheit von Mikroplastik. Die organischen Polymere wurden in dem arktischen Eis, der Polar Regionen, über Küstenregionen, bis hin zur Tiefsee nachgewiesen (Lehner et al., 2019)26. Den Ergebnissen von Yee et al. (2021)51 zu Folge, gibt es drei Schlüsselwege, wie Mikro- und Nanoplastik in den menschlichen Körper aufgenommen werden kann: Inhalation, Verdauung und die Aufnahme über die Haut.
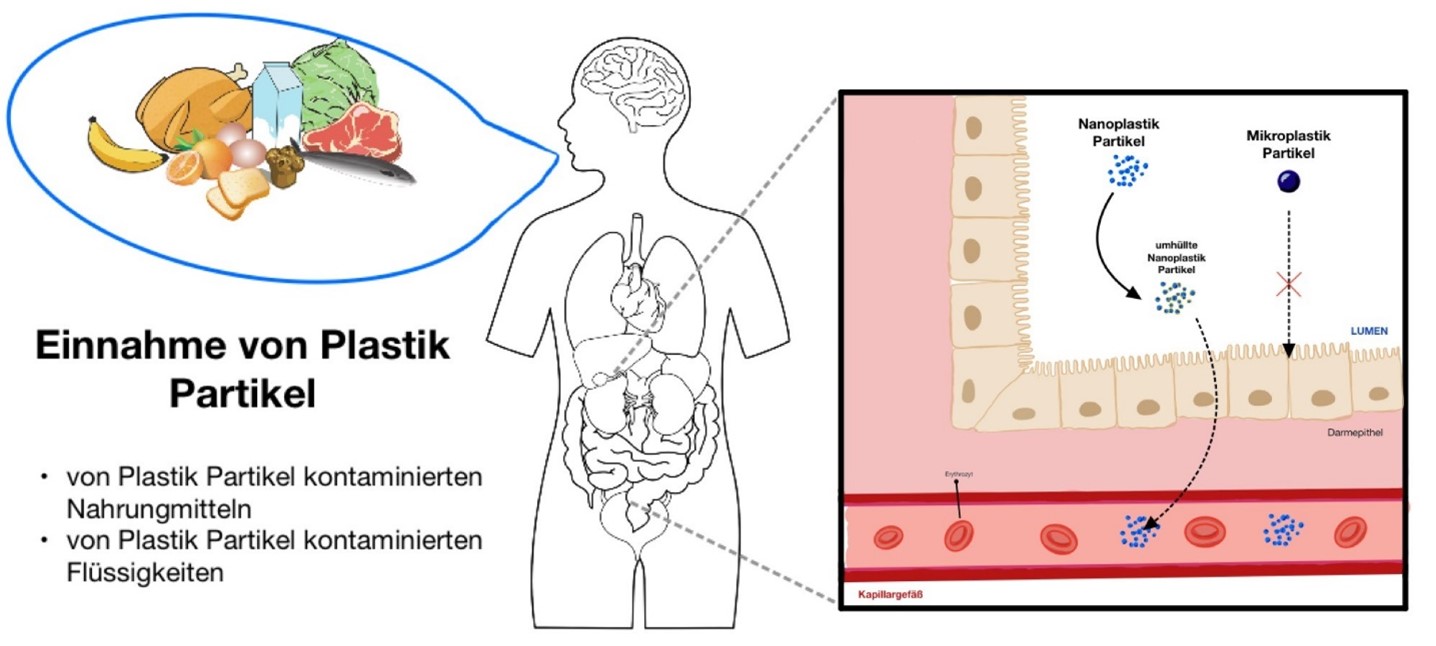
So wurden bei menschlichen Stuhlproben Plastikpartikel identifiziert, was zu der Annahme führt, dass Menschen regelmäßig Mikroplastik und Nanoplastik mit der Nahrung, oder dem Trinkwasser aufnehmen (Ge et al., 2018)16. Es wird nicht davon ausgegangen, dass Nanoplastik die Tight Junctions der Epithelzellen des Darmes mit einer Größe von 1,5nm überwinden kann. Laut Bergmann et al. (2015) ist es eher wahrscheinlich, dass Nanoplastik über das Lymphatische System, via Phagozytose, oder Endozytose in die Zellen der Peyerschen Flecken eindringen kann und somit schlussendlich in den Körperkreislauf gelangt. Ist das Nanoplastik erst einmal aufgenommen, vollzieht es eine Art Transformation, welche sich stark auf die Absorbationsrate und -fähigkeit auswirkt. Es gibt zahlreiche Moleküle in dem menschlichen Darmtrakt, mit denen die Nanopartikel interagieren können. So zeigt es sich, dass Nanopartikel eine Art Proteinkranz um sich herum entwickeln, was dazu führt, dass die Translokation viel besser und schneller durchgeführt wird (Walczak et al., 2014)45.
Abbildung 2. Aufnahme der Plastikpartikel über den Darm |
|
von Niclas Winkler |
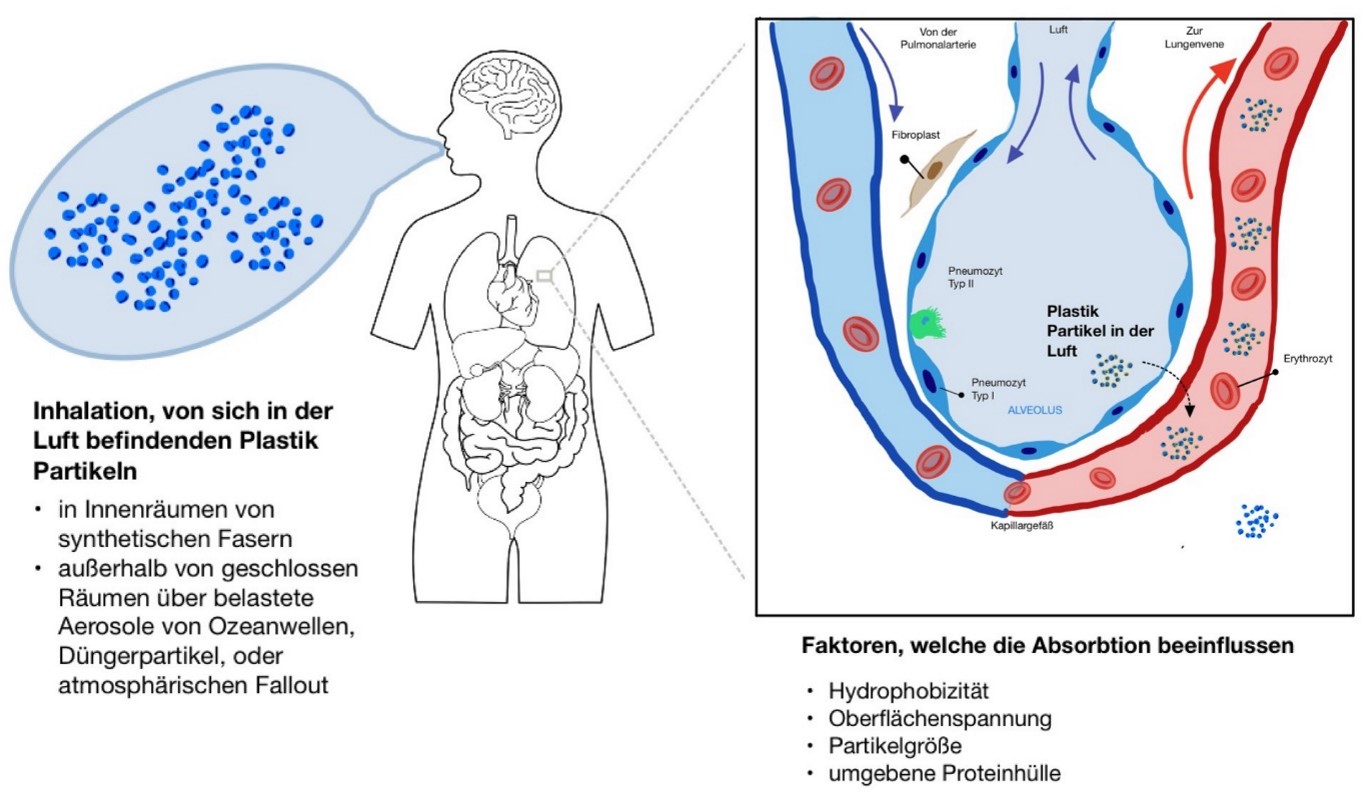
Abbildung 3. Aufnahme der Plastikpartikel über die Lunge |
|
von Niclas Winkler |
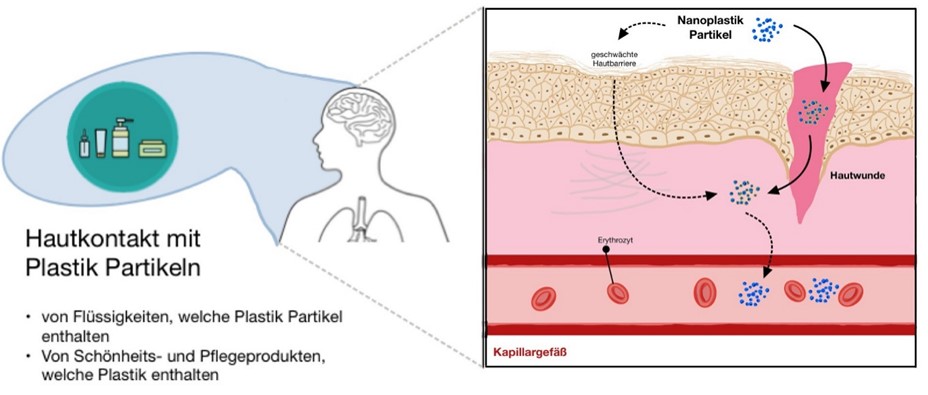
Abbildung 4. Aufnahme der Plastikpartikel über die Haut |
|
von Niclas Winkler |
Die zweithäufigste Nanoplastik Aufnahme geschieht über die Inhalation dieser Partikel in die Lunge. In den meisten Fällen werden in Innenräumen die Nanoplastikpartikel von synthetischen Textilien durch Inhalation aufgenommen (Stapleton, 2019)43. Laut den Forschungsergebnissen von Lehner et al. (2019)26 ist belegt worden, dass auch außerhalb von geschlossenen Räumen, Nanopartikel über die Lunge aufgenommen werden können. Dies geschieht beispielsweise über die Inhalation von kontaminierten Aerosolen. Diese stammen einerseits aus der Gischt von gebrochenen Wellen aus dem Ozean, oder es handelt sich um Düngerpartikel von ausgetrockneten Abwässern. Die Oberfläche der Alveoli in der menschlichen Lunge ist riesig. Man schätzt, dass sich die Fläche auf 150 m² beläuft, mit einer sehr geringen gewebten Grenze, welche dünner ist als 1 µm. Diese Barriere ist dünn genug, damit das Nanoplastik diese durchdringen kann und nun in der Lage ist das Kapillarsystemes der Lunge zu erreichen. Somit können sich die Partikel, mit Hilfe des Blutkreislaufes, sich im kompletten Organismus verteilen.
Neue Studienergebnisse zeigen, dass besonders in urbanen, als auch suburbanen Regionen ein atmosphärischer Fallout zu beobachten ist. Der Hauptbestandteil seien Nanopartikel, welche durch die menschliche Lunge inhaliert werden können. In den suburbanen Regionen von Paris identifizierte man Partikel, stammend von synthetischen Fasern. 29% dieser Partikel enthielten Petrochemikalien. Betrachtet man den durchschnittlichen atmosphärischen Fluss aller Fasern, die Fasergröße und Faserdichten, schätzt man, dass es sich um 3 - 10 Tonnen von Mikroplastik handelt, welcher sich auf Grund des atmosphärischen Fallouts in der Luft befindet (Dris et al., 2016)10.
Die Dritthäufigste Nanoplastik Aufnahme geschieht über Hygiene und Schönheitsprodukte, welche primär auf der Haut angewendet werden (Hernandez et al., 2017)21. Eine weitere Möglichkeit, dass Nanoplastik über die Haut aufgenommen werden kann, ist mit Wasser, welches mit Nanoplastik kontaminiert ist. Mikro- und Nanoplastik verhält sich hydrophob, auf Grund dessen wird davon ausgegangen, dass es nicht das Stratum Corneum der Haut durchdringen kann. Wahrscheinlicher ist eher, dass Nanoplastik über die Schweißdrüsen, Wunden in der Haut, oder Haarfolikel in den Körper eindringen kann (Schneider et al., 2009)41. Verschiedene Studien zeigten, dass es für Polystyrol Partikel möglich ist, die Hautbarriere zu durchbrechen und somit in den Körper zu gelangen. Jedoch müssen weiterführende Forschungen, mit anderen Mikro- und Nanoplastikarten, welche beispielsweise in der Umwelt gewonnen wurden, durchgeführt werden. Nur so kann man den Mechanismus des Überwindens, der menschlichen Haut, vollends verstehen (Yee et al., 2021)51.
Chemikalien
Phthalate, Bisphenol A und Parabene gehören zu den sogenannten endokrinen Disruptoren, die in unser fein ausbalanciertes Hormonsystem eingreifen können und hormongesteuerte Prozesse wie den Stoffwechsel, das Wachstum, das Immunsystem, sowie die Organentwicklung stören.
Die täglich verwendeten Produkte, wie Pestizide, die Bisphenol A und Phthalate enthalten, werden regelmäßig in der Industrie hergestellt. Dies sind einige der potentiellsten Kandidaten für endokrine Disruptoren. Aus diesen Industrien werden Chemikalien leicht in die Umwelt freigesetzt, beispielsweise durch Auswaschen in den Boden und in das Wasser. Diese werden dann von Mikroorganismen, Algen und Pflanzen aufgenommen, die dann von Tieren aufgenommen werden. Danach finden endokrine Disruptoren ihren Weg in die Nahrungskette von den Tieren bis zum Menschen (Gore et al., 2014)18.
Die Mechanismen, durch die endokrine Disruptoren, welche aus den Chemikalien im Plastik stammen, das endokrine System unterbrechen und hormonelle Funktionen verändern können, wurden von den Forschern mit Tierstudien erforscht. Sie imitieren natürlich vorkommende Hormone im Körper wie Östrogene (das weibliche Sexualhormon), Androgene (thematisches Sexualhormon) und Schilddrüsenhormone, die möglicherweise eine Überstimulation hervorrufen. Außerdem wirken sie als Antagonisten, wo sie an die Rezeptoren des endogenen Hormons in einer Zelle binden. Somit kann das normale endogene Hormon nicht an die Rezeptoren binden und es tritt kein Signal auf. Gleichmäßig reagiert der Körper nicht richtig (National Institute of Environmental Health Sciences, 2010)11.
Sie können direkt auf Hormonrezeptoren, sowie auf eine beliebige Anzahl von Proteinen einwirken, die die Abgabe eines Hormons an seine normalen Zielzellen oder -gewebe steuern. Die Auswirkungen von endokrinen Disruptoren sind gewebespezifisch. Endokrine Disruptoren können auf Membran- oder Kernrezeptoren wirken (UNEP and WHO, 2013)44.
Bisphenol A
Mechanismen im Körper, die durch Bisphenol A passieren sind Folgende: Veränderung von Insulin und Leptin, Veränderung von TNF-alpha und IL-1-beta, Abnehmendes Adiponektin, Störung der Glukosetoleranzinduktion, Veränderung der Adipogenese, Ansammlung von Lipiden in Adipozyten und Hepatozyten, Zunehmender oxidativer Stress, Verminderte Antioxidationskapazität (Polyzos et al., 2012)1.
Es wurde gezeigt, dass Bisphenol A aufgrund seiner östrogenen Aktivität beim Menschen nachteilige Auswirkungen hat, einschließlich mehrerer Stoffwechselerkrankungen sowie reproduktiver und entwicklungsbedingter Auswirkungen. Neugeborene haben ein viel höheres Erkrankungsrisiko als Erwachsene, da eine höhere innere Körperbelastung erwartet wird, aufgrund einer erhöhten Absorption oder einer verringerten Elimination im Vergleich zur inneren Körperbelastung von Erwachsenen (Miao et al., 2011)32.
Wichtig ist, dass Studien gezeigt haben, dass Bisphenol A aus Polycarbonat in Lebensmittel und Getränke auslaugt (Galloway et al., 2015)15 und dass die Toxizität von BPA Veränderungen der Leberfunktion und Insulinresistenz, Schäden eines sich entwickelnden Fötus und Veränderungen des Fortpflanzungssystems und der neurologischen Funktionen verursacht (Srivastava et al., 2013)42. BPA wirkt als Agonist für Östrogenrezeptoren und hemmt die durch Schilddrüsenhormon vermittelte Transkription, indem es hier auch als Antagonist wirkt und verändert die Betazellfunktion der Bauchspeicheldrüse. Eine erhöhte Wahrscheinlichkeit für die Entwicklung von Fettleibigkeit und Herz-Kreislauf-Erkrankungen, sowie verschiedene andere reproduktive und entwicklungsbedingte Probleme wurden festgestellt, wenn Menschen BPA in Konzentrationen von 0,2–20 ng / ml ausgesetzt sind (Galloway et al., 2015)15.
Phthalate (Weichmacher)
Die Exposition des Menschen gegenüber Phthalatestern ist potenziell schädlich und kann zu abnormaler sexueller Entwicklung und Geburtsfehlern führen. Zusätzlich wurde Butylbenzylphthalat (BBP) als wahrscheinliches Karzinogen genannt, und Di-2-ethylhexylphthalat (DEHP) wurde von der US-amerikanischen EPA als mögliches Karzinogen genannt (Karbalaei et al., 2018)24.
Der Zusammenhang zwischen endokrin wirkenden Chemikalien und der Qualität menschlicher Spermien ist umstritten. Eine kürzlich durchgeführte und systematische Überprüfung mit Metaanalyse hat jedoch ergeben, dass das Risiko einer abnormalen Spermienqualität sowohl bei der Phthalatestergruppe als auch bei Organochlor konsistent zunimmt. Eine frühe Phthalatexposition bei schwangeren Frauen ist auch mit Veränderungen der Schilddrüsenhormone verbunden (Huang et al., 2016)23, die zu Autismus-Spektrum-Störungen und Entwicklungsverzögerungen führen. Darüber hinaus können Phthalate die Hodenfunktion beeinträchtigen (Philippat et al., 2015)37, indem sie die Testosteron- und insulinähnlichen Faktor-3-Spiegel senken. Mechanismen im Körper, die durch Phthalate passieren sind Folgende: Erhöhte Lipidperoxidation, Erhöhter oxidativer Stress, Störung des Insulinrezeptors, Veränderte Induktion der Glukosetoleranz, Reduzierte Glukoseoxidation (Polyzos et al., 2012)1.
Parabene
Tierversuche haben gezeigt, dass Parabene eine schwache östrogene Aktivität aufweisen. Es wurde festgestellt, dass die Wirkung von Butylparaben ungefähr 100.000-mal schwächer als die von Östradiol ist und nur bei einer Dosis beobachtet wurde, die ungefähr 25.000-mal höher ist als die Menge, die typischerweise zur Konservierung von Produkten verwendet wird. Die östrogene Aktivität von Parabenen nimmt mit der Länge der Alkylgruppe zu. Basierend auf der aktuellen Position von Arzneimitteln, die Methyl- und Propylparaben enthalten, würden Konzentrationen von 0,2% und 0,06% einer maximalen Aufnahme von ungefähr 140 mg / Tag bzw. 50 mg / Tag entsprechen (Monneret, 2017)33.
In geringerem Umfang werden auch andere Parabene in Pharmazeutika verwendet, wie Ethylparaben und Butylparaben. Nach Angaben der Europäischen Arzneimittel-Agentur wurde Methylparaben nicht mit nachteiligen Auswirkungen auf die männlichen und weiblichen Fortpflanzungsorgane bei jungen Ratten oder in Studien zur Entwicklung des fetalen Embryos in Verbindung gebracht. Dies lässt den Schluss zu, dass die Verwendung von Methylparaben in oralen Formulierungen bis zu 0,2% des Produkts (innerhalb der empfohlenen wirksamen Konzentrationen als Konservierungsmittel) für den Menschen, einschließlich der pädiatrischen Bevölkerung, unabhängig von der Altersgruppe kein Problem darstellt. In Bezug auf Propylparaben wurde in verschiedenen experimentellen Umgebungen eine bestimmte östrogene Aktivität beobachtet, jedoch mit einer viel geringeren Aktivität als die von Östradiol in pharmakologischen In-vitro-Modellen (Monneret, 2017)33.
Wirkweise auf den Organismus
Schilddrüsenhormone
Es gibt viele endokrin wirkende Chemikalien, die die regulären Funktionen der Schilddrüse direkt stören können. Die primären Umweltchemikalien, die als Schilddrüsenstörungen identifiziert werden, können Chemikalien umfassen, wie beispielsweise Bisphenol A, Perchlorat, polychloriertes Dibenzofuran [PCDF], Pentachlorphenol, Triclosan und Phthalate, die als Kunststoffweichmacher in Ernährungssonden und Kunststoffbehältern verwendet werden. Diese haben in Tierversuch ebenfalls gezeigt, dass sie die Schilddrüsenfunktion verändern. Es gibt auch Hinweise darauf, dass Parabene, die in Kosmetika und Pestiziden verwendet werden, bei Tieren und Menschen eine Schilddrüsenstörung verursachen (Patrick, 2009)36.
In einer Studie wurden die Hormone Triiodthyronin (T3), Thyroxin (T4) und Schilddrüsen-stimulierendem Hormon (TSH) in Larven durch ELISA-Testkits gemessen. Im Vergleich zur Kontrolle wurden durch Nanoplastik-Behandlungen keine signifikanten Änderungen des T3-Spiegels induziert. T4 wurde durch Mikropartikel Exposition leicht erhöht, obwohl statistisch nicht signifikant. Diese Ergebnisse zeigten, dass einzelne Mikro- und Nanopartikel Schilddrüsenhormone stören könnten und ihre Gemische die Wirkungen verstärkten (Zhao et al., 2020)52.
In einem Experiment mit männlichen Ratten wurden die Tiere mit verschieden hohen Konzentrationen von Polystyrol Nanoplastik behandelt, um die zellulären und molekularen Mechanismen in Verknüpfung mit der Umweltverschmutzung und möglicher Störungen besser zu verstehen. Triiodothyronin (T3), Thyroxin (T4) und ihre frei aktiven zirkulierenden Formen (FT3 und FT4, jeweils) sowie das Schilddrüsen-stimulierendes Hormon (TSH) Konzentrationen in Serumproben wurden unter Verwendung von enzymgebundenen Immunosorbens-Assay (ELISA) gemessen. Cholesterol, HDL, LDL, Kreatinin, GOT und GPT wurden unter Verwendung eines automatischen Trockenchemie-Analysesystems bestimmt. Die Schilddrüsenhormonspiegel wurden im Blutserum der Tiere analysiert. Obwohl die Serumkonzentration von T3 durch Polystyrol Nanoplastik beeinflusst wurde, denn die T3-Werte nahmen mit zunehmender Nanoplastikbelastung ab, gab es keine statistischen signifikanten Unterschiede. Die T4 Konzentrationen wiesen im Vergleich zu der Kontrollgruppe keine Veränderungen auf, zeigend, dass das Nanoplastik keine wesentlichen Auswirkungen auf die Synthese dieses Hormons hat (Amereh et al., 2019)3.
Die Behandlung der männlichen Ratten im gleichen Versuch mit Polystyrol Nanoplastik hatte einen leicht störenden Effekt im Bezug auf den FT3-Spiegel, da dieser mit zunehmender Nanoplastikkonzentration immer weiter abnahm. Im Vergleich dazu waren die gemessenen FT4-Werte im Vergleich zu denen der Kontrollgruppe niedriger. Die Aktivität des frei zirkulierenden Thyroxins war stabil, bis auf die Ratten, welche der höchsten Nanoplastikdosis ausgesetzt waren. Hier war eine signifikante Erniedrigung zu sehen. Änderungen der TSH Werte im Blutserum zeigen bei Ratten, die einer niedrigeren Nanoplastikdosis ausgesetzt waren, keine Änderungen. Bei Tieren, die einer höheren Dosis ausgesetzt waren, stiegen die TSH Werte sehr stark. Nanoplastik hat somit einen stimulierenden Effekt auf die TSH Aktivität (Amereh et al., 2019)3.
HDL-Werte im Blutplasma wurden durch die Polystyrol Nanoplastik Aussetzung signifikant gesenkt und im Vergleich dazu wurden LDL- und Kreatininkonzentration, sowie Cholesterol, GOT und GPT signifikant erhöht. T3 korreliert negativ mit LDL, Cholesterol, GPT und GOT, aber korreliert positiv mit HDL. Eine Korrelation von T4 mit anderen Parametern konnte nicht nachgewiesen werden (Amereh et al., 2019)3.
In einer ähnlichen Versuchsreihe mit Goldfischen wurden die Erhöhten Werte von T3 und T4 festgestellt, nachdem die Tiere Nanoplastik ausgesetzt waren. FT3, FT4 und Thyroxin waren erniedrigt (Gong et al., 2016)17.
Zum Beispiel reduzieren PCBs das Thyroxin und das Schilddrüsen-stimulierende Hormon (TSH) als Reaktion auf das Thyrotropin-Releasing-Hormon, was zu einer Deregulierung des Hypothalamus und der Hypophyse führt (Gore, 2010)19.
Mechanismen und Auswirkungen der Schilddrüsenstörer |
||
Phthalate |
Blockieren die Aufnahme von Jodid in die Schilddrüsenzellen |
Erniedrigte Synthese von T3 und T4 |
Phthalate |
Binden sich an Transthyretin |
Effekt auf die T4 Produktion im fötalen Gehirn |
Methimazole |
Blockieren die Produktion von TPO in den Schilddrüsenfollikeln |
Erniedrigte Synthese von T3 und T4 |
Dioxin |
Ändern den Transport durch die Zellmembran |
Erhöhte Eliminierung von T3 und T4 durch Gallensaft |
Acetochlor |
Gehemmter Leber Metabolismus |
Erhöhte Eliminierung von T3 und T4 durch Gallensaft |
Pentachlorophenol |
Hemmung der Sulfatierung |
verminderte Sulfatierung von Schilddrüsenhormonen, was zu einer möglichen Abnahme der peripheren T3-Synthese führt |
PCBs |
Hemmung der Deiodinase Aktivität |
Erniedrigte periphere T3-Synthese |
PCBs |
Hemmung der TSH Rezeptoren |
Erniedrigte T3 und T4 Produktion |
Bisphenol A |
Veränderung der Bindung an den Schilddrüsenrezeptor |
Veränderung der Schilddrüsenhormon-gerichteten Gentranskription |
Nebennierenhormone
Studien haben gezeigt, dass die Hormonfunktion des Kortikoids durch endokrine Störungen beeinträchtigt werden kann. Beispielsweise induziert Hexachlorbenzol oxidativen Stress, eine Störung des Arachidonsäuremetabolismus und Porphyrie (Lelli et al., 2007)27.
Der Peroxisom-Proliferator-aktivierte Rezeptor (PPAR) besteht aus drei Arten von Isotypen, Alpha, Beta und Gama, die eine sehr wichtige Rolle bei der Steuerung der zellulären Differenzierungsprogramme und bei der Transkriptionskontrolle des Lipid- und Kohlenhydratstoffwechsels spielen (Casals-Casas et al., 2008). PPARalpha verursacht, wenn es mit dem Vorhandensein von endokrinen Disruptoren assoziiert ist, hauptsächlich die Stoffwechselstörungen (Feige et al., 2006)13.
Das potenzielle Risiko von Kunststoffpartikeln für die menschliche Gesundheit wird in einer Studie unter Verwendung menschlicher Podozyten als hochspezialisierter Nierenzelltyp untersucht. Da die Nieren am Filtrationsprozess beteiligt sind und ihre Zellen nicht kontinuierlich regenerieren, akkumulieren sie wahrscheinlich über ihre gesamte Lebensdauer mit Nanoplastik. Es wurde festgestellt, dass die Zytotoxizitätsreaktion vom Polymertyp abhängt. Für die meisten Partikel wie ist eine höhere Konzentration erforderlich, um eine Zellsterblichkeitsrate zu erzielen. Die Partikel können sich an der Zelloberfläche anlagern und die Nährstoffaufnahme begrenzen. Der Grad der Anlagerung hängt von den Adhäsionseigenschaften der Partikel und Größe ab. Im Gegensatz zu nicht behandelten Kontrollgruppen fehlen Podozyten, die mit Nanoplastik inkubiert wurden, tendenziell die üblichen Zelleigenschaften wie heterogene Oberflächen und Nukleusprozesse, was bestätigt, dass das potenzielle Risiko von Kunststoffpartikeln für die Lebensfähigkeit von Zellen bestätigt (Sarau et al., 2020)40.
Beim Menschen wird aufgenommenes BPA durch Modifikationen nicht weitgehend metabolisiert, sondern schnell mit Glucuronsäure konjugiert. Geringe Mengen an BPA können auch mit Sulfat konjugiert sein. Infolgedessen wird BPA als Konjugat fast vollständig im Urin ausgeschieden (Ye et al., 2005)50.
Geschlechtsorgane
Die Krankheiten, die wir im Laufe unseres Lebens erleben und von denen einige mit Nanoplastik, auch endokrinen Disruptoren (EDs) genannt, zusammenhängen, können sexuell dimorph sein. Es ist bekannt, dass Östrogen und Androgen die männliche sexuelle Differenzierung weitgehend vermitteln, während die weibliche Differenzierung weitgehend unabhängig von Östrogen und Androgen erfolgt. Daher ist zu erwarten, dass endokrine EDs bei Männern und Frauen unterschiedliche Störungen hervorrufen können, bei denen EDs als Östrogen- und / oder Androgenantagonisten wirken können (Diamanti-Kandarakis et al., 2009)9.
Zu den Erkrankungen des weiblichen Fortpflanzungssystems, die mit EDs assoziiert sein könnten, gehören frühreife Pubertät, polyzystisches Ovarialsyndrom und vorzeitiges Ovarialversagen. Bei Frauen können einige unerwünschte Nebenwirkungen wie ein erhöhtes Wachstum des Endometriums und ein höheres Brustkrebsrisiko auch aufgrund der EDs auftreten (Costa et al., 2014)8.
Primäres Ovarialversagen: Studien zeigten, dass primäres Ovarialversagen bei etwa 1% der weiblichen Bevölkerung auftritt, die nicht älter als 40 Jahre ist. Es wurden mehrere Ursachen untersucht, und endokrine Disruptoren könnten einen gewissen Zusammenhang damit haben (Costa et al., 2014)8.
Unregelmäßigkeiten im Menstruationszyklus: Endokrine Disruptoren können die hormonelle Regulation des Menstruationszyklus beeinträchtigen und dadurch Unregelmäßigkeiten verursachen, wie z. B. lange Zyklen, die die Fruchtbarkeit verringern können (Fähigkeit, in einem Menstruationszyklus zu empfangen) (Costa et al., 2014)8.
Syndrom der polyzystischen Eierstöcke (PCOS): Dies ist eine häufige endokrine Störung bei Frauen. Die Krankheit ist durch Anovulation und Hyperandrogenismus gekennzeichnet und mit einer höheren Prävalenz von Fettleibigkeit, Insulinresistenz und Stoffwechselstörungen verbunden, auch durch endokrine Disruptoren verursacht (Costa et al., 2014)8.
Männer können auch an Funktionsstörungen der Geschlechtsorgane wie Spermienanomalien, Hypospadien und ektopischen Hoden leiden. Es besteht eine starke Möglichkeit, dass diese Krankheiten durch perinatale Exposition gegenüber endokrinen Disruptoren in sensiblen Stadien der sexuellen Differenzierung des sich entwickelnden Fötus verursacht wurden (Fechner et al., 2011)12.
Fruchtbarkeit: Bei Männern hat die Fruchtbarkeit in den letzten Jahrzehnten abgenommen, zumindest in einigen Ländern. Ähnliche Beobachtungen wurden auch von Comhaire et al. (2007)7 in Dänemark, in Frankreich (Bay et al., 2006)5 und im Vereinigten Königreich. Einige Studien an Menschen und Versuchstieren haben gezeigt, dass berufliche oder umweltbedingte Exposition gegenüber hohen Konzentrationen bestimmter Chemikalien wie Pestiziden und Polycarbonaten die Fruchtbarkeit beeinträchtigen kann (Nicolopoulou-Stamati und Pitsos, 2001)34.
Phthalat Syndrom
Über die letzten zehn Jahre, konnten mehrere Studien beweisen, dass bestimmte Phthalate (besonders erwähnenswert DEHP, DBP und BzBP), einen signifikanten Einfluss auf die Entwicklung des Fortpflanzungstraktes, sowohl auch auf den anti-androgenen Signalweg, haben (Akingbemi et al., 2004 2; Borch et al., 2005 6; Foster, 200614; Gray, 200020). Kürzlich beschrieb Lee et al. 200725, den anti-androgenen Effekt von sieben Phthalaten (DEHP, seine Metabolite, MEHP, DBP, BzBP, als auch DINP, DIDP und DnHP) auf den Hershberger-Test in männlichen kastrierten SD Ratten. Diese antiandrogene Wirkung führt zu einer Störung der normalen Kaskade androgenabhängiger Ergebnisse, welche durch eine verkürzte anogenital Entfernung sichtbar wird (AGD). Die AGD, welche in Nagetierjungtieren, die Entfernung zwischen After und Genitaltuberkulum ist, hat bei männlichen Tieren die doppelte Länge, im Vergleich zu den weiblichen Tieren. Die AGD kann als sensitiver Marker für die Belastung mit Antiandrogenen, wie Phthalate, Vinclozilin und Flutamide, in der Fetalperiode herangezogen werden. Mehrere Studien an Tieren berichten, dass DBP, DEHP und BzBP eine deutliche Reduktion des fetalen Testosterons (produziert von Leydig Zellen) und des Insulin ähnlichen Wachstumsfaktor 3, induzieren. Dies führt zu einem Syndrom von Abnormitäten der männlichen Geschlechtsorgane und zu einer Verkürzung der AGD. Außerdem wird von Hypospadie, Kryptorchismus und Fehlbildungen des Nebenhodens, des Vas deferens, der Samenbläschen und der Prostata, berichtet. Zusammenfassend bilden sie das „Phthalat-Syndrom“ (Welsh et al., 2008)46.
Das durch die Androgenrezeptor-Antagonisten induzierte Syndrom unterscheidet sich von dem durch die Phthalate induzierten Syndrom, welches die Synthese von fetalem Testosteron und Insl-3 hemmt (Wilson et al., 2004, 2008)4847.
Neuroendokrines System
Endokrin störende Chemikalien, können Störungen der neuroendokrinen Homöostase verursachen und es gibt Hinweise darauf, dass eine neuroendokrine Störung des hypothalamischen Hypophysen-Schilddrüsensystems bestimmte Auswirkungen auf den Stoffwechsel und den Energiehaushalt hat. Zum Beispiel reduzieren Polycarbonatene (Bisphenol A) das Thyroxin und das Schilddrüsen-stimulierende Hormon (TSH) als Reaktion auf das Thyrotropin-Releasing-Hormon, was zu einer Deregulierung des Hypothalamus und der Hypophyse führt (Gore, 2010)19.
Das Nervensystem kann durch endokrine Disruptorchemikalien exponiert und beeinflusst werden und dieser Effekt kann durch verschiedene Mechanismen induziert werden. Das hormonelle Gleichgewicht und die Funktion im Körper können durch die direkte Wirkung von endokrin wirkenden Chemikalien auf endokrine Drüsen verändert werden. Die Verbindungen können anfänglich das Zentralnervensystem (ZNS) beeinflussen, beispielsweise neuroendokrine Disruptoren, die folglich das endokrine System beeinflussen können. Veränderungen der sexuellen Differenzierung im Gehirn, die sich auf sexuell dimorphe reproduktive und nichtreproduktive neuronale Endpunkte sowie auf einige neuroteratogene Effekte auswirken können. Es gibt einige Studien und Literatur für Menschen oder Tiere, die Beispiele für die Exposition von EDCs und deren Auswirkungen auf Verhalten, Lernen, Gedächtnis und Aufmerksamkeit liefern, sensorische Funktion und neurologische Entwicklung. Beispiele für neuroendokrine Disruptoren, die direkt oder indirekt oder beides wirken können, umfassen einige PCBs, Dioxine, DDT und verwandte chlorierte Pestizide und Metaboliten, Schwermetalle wie Quecksilber, Blei, Organozinn, Insektenwachstumsregulatoren, Dithiocarbamate, synthetische Steroide, Tamox-Ifen, Phytoöstrogene und Atrazinherbizide (Mellanen et al., 1996)31.
Frühere Studien identifizierten das (zentrale) Nervensystem als wichtiges Ziel für die toxischen Wirkungen von Metall- und Metalloxid-Nanopartikeln. Metall- und Metalloxid-Nanopartikel können durch Überqueren der Blut-Hirn-Schranke (BBB) in das Gehirn gelangen oder diese Schranke durch retrograden Transport durch die Nerven des Geruchsinns. Nanopartikel wandern auch in das Gehirn von Fischen, wo sie Veränderungen, wie oxidative Schädigung, Zelltod, oder Veränderungen der Neurotransmitterspiegel, des Bewegungsverhaltens und des räumlichen Erkennungsgedächtnisses hervorrufen können, sowie Beeinträchtigung des Lernens und des Gedächtnisses (Prüst et al.,2020)38.
Eine neurologische Verhaltensstudie an Ratten, die mit Nanopartikeln gefüttert wurden, ergab allerdings keine signifikanten Verhaltensänderungen oder Abnormalitäten (Nutting et al., 2018)35.
In einem Experiment mit Süßwasserzebramuscheln wurden zwei verschiedene Größen von Polysteren Nanopartikeln ausgesetzt. Obwohl beide Gemische die Dopaminspiegel erhöhten, veränderte die Exposition weder die Serotonin- und Glutamatspiegel noch die Aktivität von Monoaminoxidase und AChE. Die niedrig dosierte Mischung war in der Lage, die Katalaseaktivität zu erhöhen und die Glutathionperoxidase zu verringern, was auf (mäßigen) zellulären Stress hindeutet (Magni et al., 2018)29.
Die Aussetzung von Wolfsbarsch mit Nanoplastik führte zu einer Hemmung der AChE-Aktivität in dem Gehirn (Prüst et al.,2020)38. Eine Studie untersuchte die Auswirkungen der Exposition von fünf murinen neuronalen Zelltypen gegenüber kernmarkierten Polystyrol-Nanokunststoffen und zeigte, dass Nanokunststoffe die mitochondriale Aktivität und die Laktatdehydrogenase neuronaler Zellen beeinflussen können, wenn auch nur bei sehr hohen Konzentrationen (Prüst et al.,2020)38.
In menschlichen Neuronen zweigten Polyethylen-Nanopartikel eine Veränderung der Genexpression, sowie einen erhöhtes Malondialdehyd Niveau, beides Indikatoren für oxidativen Stress. Bei hohen Dosen führte es zu einer verminderten Lebensfähigkeit der Zellen und zu einer Schädigung der GABA Neurotransmitter (Hoelting et al., 2013)22.
In seltenen Fällen wurden Nanopartikel auch im Fischhirn gefunden und verursachte Veränderungen im Erscheinungsbild des Gehirns bzw. dessen Morphologie (Gyri-Größen), sowie Gewichtänderungen des Gehirns oder zeigten eine signifikant inhibierte Acetylcholinesterase (AChE) -Aktivität (Mattsson et al., 2017)30.
Herunterregulierung von Genen, die mit beteiligt sind an neuronaler Entwicklung und Funktion wurde an einem Versuch mit Fischen bewiesen (LeMoine et al., 2018)28.
In einem anderen Versuch wurden Polystyrol-Nanopartikel im Gehirngewebe aller gefütterten Fische mittels hyperspektraler Bildgebung nachgewiesen. Dieser Befund beweist erstmals, dass Kunststoffnanopartikel in Fischen über die Blut-Hirn-Schranke transportiert werden können (Mattsson et al., 2017)30.
Die Blut-Hirn-Schranke ist eine hochselektive Barriere, die die unkontrollierte Diffusion von Molekülen in das Gehirn reguliert. Yang et al. (2004)49 zeigten die BHS-Permeabilität mit Polystyrol-Nanopartikeln mit einem Durchmesser von 20 nm unter Verwendung eines In-vivo-Rattenmodells durch Implantation einer Mikrodialysesonde in die Großhirnrinde anästhesierter Ratten, denen fluoreszierende Polystyrol-Nanopartikel injiziert wurden.
Quellen
Literaturverzeichnis
1. A. Polyzos, S., Kountouras, J., Deretzi, G., Zavos, C. & S. Mantzoros, C. (2012). The Emerging Role of Endocrine Disruptors in Pathogenesis of Insulin Resistance: A Concept Implicating Nonalcoholic Fatty Liver Disease. Current Molecular Medicine, 12(1), 68–82. https://doi.org/10.2174/156652412798376161
2. Akingbemi, B. T., Ge, R., Klinefelter, G. R., Zirkin, B. R. & Hardy, M. P. (2004). Phthalate-induced Leydig cell hyperplasia is associated with multiple endocrine disturbances. Proceedings of the National Academy of Sciences, 101(3), 775–780. https://doi.org/10.1073/pnas.0305977101
3. Amereh, F., Eslami, A., Fazelipour, S., Rafiee, M., Zibaii, M. I. & Babaei, M. (2019). Thyroid endocrine status and biochemical stress responses in adult male Wistar rats chronically exposed to pristine polystyrene nanoplastics. Toxicology Research, 8(6), 953–963. https://doi.org/10.1039/c9tx00147f
4. B., Bergmann, M., Gutow, L. & Klages, M. (2015). Marine Anthropogenic Litter (English Edition) (2015. Aufl.). Springer.
5. Bay, K., Asklund, C., Skakkebaek, N. E. & Andersson, A. M. (2006). Testicular dysgenesis syndrome: possible role of endocrine disrupters. Best Practice & Research Clinical Endocrinology & Metabolism, 20(1), 77–90. https://doi.org/10.1016/j.beem.2005.09.004
6. BORCH, J., DALGAARD, M. & LADEFOGED, O. (2005). Early testicular effects in rats perinatally exposed to DEHP in combination with DEHA?apoptosis assessment and immunohistochemical studies. Reproductive Toxicology, 19(4), 517–525. https://doi.org/10.1016/j.reprotox.2004.11.004
7. Comhaire, F. H., Mahmoud, A. M. & Schoonjans, F. (2007). Sperm quality, birth rates and the environment in Flanders (Belgium). Reproductive Toxicology, 23(2), 133–137. https://doi.org/10.1016/j.reprotox.2006.11.001
8. Costa, E. M. F., Spritzer, P. M., Hohl, A. & Bachega, T. A. S. S. (2014). Effects of endocrine disruptors in the development of the female reproductive tract. Arquivos Brasileiros de Endocrinologia & Metabologia, 58(2), 153–161. https://doi.org/10.1590/0004-2730000003031
9. Diamanti-Kandarakis, E., Bourguignon, J. P., Giudice, L. C., Hauser, R., Prins, G. S., Soto, A. M., Zoeller, R. T. & Gore, A. C. (2009). Endocrine-Disrupting Chemicals: An Endocrine Society Scientific Statement. Endocrine Reviews, 30(4), 293–342. https://doi.org/10.1210/er.2009-0002
10. Dris, R., Gasperi, J., Saad, M., Mirande, C. & Tassin, B. (2016). Synthetic fibers in atmospheric fallout: A source of microplastics in the environment? Marine Pollution Bulletin, 104(1–2), 290–293. https://doi.org/10.1016/j.marpolbul.2016.01.006
11. Editorial Submission, Haworth. "National Institute of Environmental Health Sciences." Journal of Consumer Health on the Internet 12.2 (2008): 174. https://scholar.google.com/scholar?q=National%20Institute%20of%20Environmental%20Health%20Sciences#d=gs_qabs&u=%23p%3DxTHP1g9DYTsJ
12. Fechner, P., Damdimopoulou, P. & Gauglitz, G. (2011). Biosensors Paving the Way to Understanding the Interaction between Cadmium and the Estrogen Receptor Alpha. PLoS ONE, 6(8), e23048. https://doi.org/10.1371/journal.pone.0023048
13. Feige, J. N., Gelman, L., Michalik, L., Desvergne, B. & Wahli, W. (2006). From molecular action to physiological outputs: Peroxisome proliferator-activated receptors are nuclear receptors at the crossroads of key cellular functions. Progress in Lipid Research, 45(2), 120–159. https://doi.org/10.1016/j.plipres.2005.12.002
14. FOSTER, P. M. (2006). Disruption of reproductive development in male rat offspring following in utero exposure to phthalate esters. International Journal of Andrology, 29(1), 140–147. https://doi.org/10.1111/j.1365-2605.2005.00563.x
15. Galloway, T. S. (2015). Micro- and Nano-plastics and Human Health. Marine Anthropogenic Litter, 343–366. https://doi.org/10.1007/978-3-319-16510-3_13
16. Ge, H., Yan, Y., Wu, D., Huang, Y. & Tian, F. (2018). Potential role of LINC00996 in colorectal cancer: a study based on data mining and bioinformatics. OncoTargets and Therapy, Volume 11, 4845–4855. https://doi.org/10.2147/ott.s173225
17. Gong, Y., Tian, H., Dong, Y., Zhang, X., Wang, J., Wang, W. & Ru, S. (2016). Thyroid disruption in male goldfish (Carassius auratus) exposed to leachate from a municipal waste treatment plant: Assessment combining chemical analysis and in vivo bioassay. Science of The Total Environment, 554–555, 64–72. https://doi.org/10.1016/j.scitotenv.2016.02.188
18. Gore, A.C., et al., 2014. Introduction to Endocrine Disrupting Chemicals(EDCs) – A Guide for Public Interest Organizations and Policy-makers.Endocrine Society https://ipen.org/documents/introduction-endocrine-disrupting-chemicals-edcs
19. Gore, A. (2010). Neuroendocrine targets of endocrine disruptors. HORMONES, 9(1), 16–27. https://doi.org/10.14310/horm.2002.1249
20. Gray, L. E. (2000). Perinatal Exposure to the Phthalates DEHP, BBP, and DINP, but Not DEP, DMP, or DOTP, Alters Sexual Differentiation of the Male Rat. Toxicological Sciences, 58(2), 350–365. https://doi.org/10.1093/toxsci/58.2.350
21. Hernandez, L. M., Yousefi, N. & Tufenkji, N. (2017). Are There Nanoplastics in Your Personal Care Products? Environmental Science & Technology Letters, 4(7), 280–285. https://doi.org/10.1021/acs.estlett.7b00187
22. Hoelting, L., Scheinhardt, B., Bondarenko, O., Schildknecht, S., Kapitza, M., Tanavde, V., Tan, B., Lee, Q. Y., Mecking, S., Leist, M. & Kadereit, S. (2012). A 3-dimensional human embryonic stem cell (hESC)-derived model to detect developmental neurotoxicity of nanoparticles. Archives of Toxicology, 87(4), 721–733. https://doi.org/10.1007/s00204-012-0984-2
23. Huang, P. C., Tsai, C. H., Liang, W. Y., Li, S. S., Huang, H. B. & Kuo, P. L. (2016). Early Phthalates Exposure in Pregnant Women Is Associated with Alteration of Thyroid Hormones. PLOS ONE, 11(7), e0159398. https://doi.org/10.1371/journal.pone.0159398
24. Karbalaei, S., Hanachi, P., Walker, T. R. & Cole, M. (2018). Occurrence, sources, human health impacts and mitigation of microplastic pollution. Environmental Science and Pollution Research, 25(36), 36046–36063. https://doi.org/10.1007/s11356-018-3508-7
25. Lee, B. M. & Koo, H. J. (2007). Hershberger Assay for Antiandrogenic Effects of Phthalates. Journal of Toxicology and Environmental Health, Part A, 70(15–16), 1365–1370. https://doi.org/10.1080/15287390701432285
26. Lehner, R., Weder, C., Petri-Fink, A. & Rothen-Rutishauser, B. (2019). Emergence of Nanoplastic in the Environment and Possible Impact on Human Health. Environmental Science & Technology, 53(4), 1748–1765. https://doi.org/10.1021/acs.est.8b05512
27. Lelli, S. M., Ceballos, N. R., Mazzetti, M. B., Aldonatti, C. A. & San Martín de Viale, L. C. (2007). Hexachlorobenzene as hormonal disruptor—studies about glucocorticoids: Their hepatic receptors, adrenal synthesis and plasma levels in relation to impaired gluconeogenesis. Biochemical Pharmacology, 73(6), 873–879. https://doi.org/10.1016/j.bcp.2006.11.012
28. LeMoine, C. M., Kelleher, B. M., Lagarde, R., Northam, C., Elebute, O. O. & Cassone, B. J. (2018). Transcriptional effects of polyethylene microplastics ingestion in developing zebrafish (Danio rerio). Environmental Pollution, 243, 591–600. https://doi.org/10.1016/j.envpol.2018.08.084
29. Magni, S., Gagné, F., André, C., Della Torre, C., Auclair, J., Hanana, H., Parenti, C. C., Bonasoro, F. & Binelli, A. (2018). Evaluation of uptake and chronic toxicity of virgin polystyrene microbeads in freshwater zebra mussel Dreissena polymorpha (Mollusca: Bivalvia). Science of The Total Environment, 631–632, 778–788. https://doi.org/10.1016/j.scitotenv.2018.03.075
30. Mattsson, K., Johnson, E. V., Malmendal, A., Linse, S., Hansson, L. A. & Cedervall, T. (2017). Brain damage and behavioural disorders in fish induced by plastic nanoparticles delivered through the food chain. Scientific Reports, 7(1), 7. https://doi.org/10.1038/s41598-017-10813-0
31. Mellanen, P., Petänen, T., Lehtimäki, J., Mäkelä, S., Bylund, G., Holmbom, B., Mannila, E., Oikari, A. & Santti, R. (1996). Wood-Derived Estrogens: Studiesin Vitrowith Breast Cancer Cell Lines andin Vivoin Trout. Toxicology and Applied Pharmacology, 136(2), 381–388. https://doi.org/10.1006/taap.1996.0046
32. Miao, M., Yuan, W., Zhu, G., He, X. & Li, D. K. (2011). In utero exposure to bisphenol-A and its effect on birth weight of offspring. Reproductive Toxicology, 32(1), 64–68. https://doi.org/10.1016/j.reprotox.2011.03.002
33. Monneret, C. (2017). What is an endocrine disruptor? Comptes Rendus Biologies, 340(9–10), 403–405. https://doi.org/10.1016/j.crvi.2017.07.004
34. Nicolopoulou-Stamati, P. (2001). The impact of endocrine disrupters on the female reproductive system. Human Reproduction Update, 7(3), 323–330. https://doi.org/10.1093/humupd/7.3.323
35. Nutting, J. E., Rafiee, M. & Stahl, S. S. (2018). Tetramethylpiperidine N-Oxyl (TEMPO), Phthalimide N-Oxyl (PINO), and Related N-Oxyl Species: Electrochemical Properties and Their Use in Electrocatalytic Reactions. Chemical Reviews, 118(9), 4834–4885. https://doi.org/10.1021/acs.chemrev.7b00763
36. Patrick L. Thyroid disruption: mechanism and clinical implications in human health. Altern Med Rev. 2009 Dec;14(4):326-46. Erratum in: Altern Med Rev. 2010 Apr;15(1):58. PMID: 20030460. https://pubmed.ncbi.nlm.nih.gov/20030460/
37. Philippat, C., Bennett, D. H., Krakowiak, P., Rose, M., Hwang, H. M. & Hertz-Picciotto, I. (2015). Phthalate concentrations in house dust in relation to autism spectrum disorder and developmental delay in the CHildhood Autism Risks from Genetics and the Environment (CHARGE) study. Environmental Health, 14(1), 56. https://doi.org/10.1186/s12940-015-0024-9
38. Prüst, M., Meijer, J. & Westerink, R. H. S. (2020). The plastic brain: neurotoxicity of micro- and nanoplastics. Particle and Fibre Toxicology, 17(1). https://doi.org/10.1186/s12989-020-00358-y
39. Revel, M., Châtel, A. & Mouneyrac, C. (2018). Micro(nano)plastics: A threat to human health? Current Opinion in Environmental Science & Health, 1, 17–23. https://doi.org/10.1016/j.coesh.2017.10.003
40. Sarau, G., Yarbakht, M., & Kling, L. (2020). Context Microscopy and Fingerprinting Spectroscopy of Micro- and Nanoplastics and Their Effects on Human Kidney Cells Using nanoGPS and ParticleFinder. https://static.horiba.com/fileadmin/Horiba/Company/About_HORIBA/Readout/R54E/R54E_05_023.pdf
41. Schneider, M., Stracke, F., Hansen, S. & Schaefer, U. F. (2009). Nanoparticles and their interactions with the dermal barrier. Dermato-Endocrinology, 1(4), 197–206. https://doi.org/10.4161/derm.1.4.9501
42. Srivastava, R. & Godara, S. (2013). Use of polycarbonate plastic products and human health. International Journal of Basic & Clinical Pharmacology, 2(1), 12. https://doi.org/10.5455/2319-2003.ijbcp20130103
43. Stapleton, P. (2019). Toxicological considerations of nano-sized plastics. AIMS Environmental Science, 6(5), 367–378. https://doi.org/10.3934/environsci.2019.5.367
44. UNEP and WHO, 2013. United Nations Environment Programme and the World Health Organization, 2013. State of the Science of Endocrine Dis-rupting Chemicals-2012 https://www.who.int/ceh/publications/endocrine/en/
45. Walczak, A. P., Kramer, E., Hendriksen, P. J. M., Tromp, P., Helsper, J. P. F. G., van der Zande, M., Rietjens, I. M. C. M. & Bouwmeester, H. (2014). Translocation of differently sized and charged polystyrene nanoparticles in in vitro intestinal cell models of increasing complexity. Nanotoxicology, 9(4), 453–461. https://doi.org/10.3109/17435390.2014.944599
46. Welsh, M., Saunders, P. T., Fisken, M., Scott, H. M., Hutchison, G. R., Smith, L. B. & Sharpe, R. M. (2008). Identification in rats of a programming window for reproductive tract masculinization, disruption of which leads to hypospadias and cryptorchidism. Journal of Clinical Investigation, 118(4), 1479–1490. https://doi.org/10.1172/jci34241
47. Wilson, V. S., Blystone, C. R., Hotchkiss, A. K., Rider, C. V. & Gray, L. E. (2008). Diverse mechanisms of anti-androgen action: impact on male rat reproductive tract development. International Journal of Andrology, 31(2), 178–187. https://doi.org/10.1111/j.1365-2605.2007.00861.x
48. Wilson, V. S., Lambright, C., Furr, J., Ostby, J., Wood, C., Held, G. & Gray, L. (2004). Phthalate ester-induced gubernacular lesions are associated with reduced insl3 gene expression in the fetal rat testis. Toxicology Letters, 146(3), 207–215. https://doi.org/10.1016/j.toxlet.2003.09.012
49. Yang, C. S., Chang, C. H., Tsai, P. J., Chen, W. Y., Tseng, F. G. & Lo, L. W. (2004). Nanoparticle-Based in Vivo Investigation on Blood−Brain Barrier Permeability Following Ischemia and Reperfusion. Analytical Chemistry, 76(15), 4465–4471. https://doi.org/10.1021/ac035491v
50. Ye, X., Kuklenyik, Z., Needham, L. L. & Calafat, A. M. (2005). Quantification of urinary conjugates of bisphenol A, 2,5-dichlorophenol, and 2-hydroxy-4-methoxybenzophenone in humans by online solid phase extraction–high performance liquid chromatography–tandem mass spectrometry. Analytical and Bioanalytical Chemistry, 383(4), 638–644. https://doi.org/10.1007/s00216-005-0019-4
51. Yee, M. S. L., Hii, L. W., Looi, C. K., Lim, W. M., Wong, S. F., Kok, Y. Y., Tan, B. K., Wong, C. Y. & Leong, C. O. (2021). Impact of Microplastics and Nanoplastics on Human Health. Nanomaterials, 11(2), 496. https://doi.org/10.3390/nano11020496
52. Zhao, H. J., Xu, J. K., Yan, Z. H., Ren, H. Q. & Zhang, Y. (2020). Microplastics enhance the developmental toxicity of synthetic phenolic antioxidants by disturbing the thyroid function and metabolism in developing zebrafish. Environment International, 140, 105750.https://doi.org/10.1016/j.envint.2020.105750
Abbildungsverzeichnis
Abbildung 1: Niclas Winkler
Abbildung 2: Niclas Winkler
Abbildung 3: Niclas Winkler
Abbildung 4: Niclas Winkler