Neurogenese im Hinblick auf die Gesangsentwicklung der Singvögel
Was ist Neurogenese?
Als Neurogenese bezeichnet man die Entwicklung von Nervenzellen aus bestimmten Stammzellen oder Progenitorzellen. Man unterscheidet dabei zwischen adulter und embryonaler Neurogenese. Obwohl bei Singvögeln ( s. Abbildung 1) bereits nachgewiesen wurde, dass auch noch nach der Geschlechtsreife immer wieder neue Nervenzellen gebildet werden, wurde Neurogenese beim adulten Menschen bis vor einigen Jahren ausgeschlossen. (Momma, 2005)
Contents
Entdeckung der Neurogenese?
Abbildung 1 |
|
Zebrafink1 |
Zunächst wurde angenommen, dass die Neurogenese im adulten Gehirn ausschließlich charakteristisch für die niederen Wirbeltiere ist, die lebenslang ihre Körpergröße wechseln können. Weiterhin wurde -trotz früheren Berichten von Neurogenese im Hippocampus von Nagern - festgestellt, dass Neurogenese durch das olfaktorische Epithel eingeschränkt wird. (Hofman et al., 2002)
Studien an Singvögeln inspirierten in den 80er Jahren dazu, die Neurogenese auch im zentralen Nervensystem von Säugetieren zu erforschen. Nottebohm zeigte 1983, dass - entgegen aller bisheriger Lehrmeinungen - im Gehirn von adulten Singvögeln neue Nervenzellen produziert werden, die auch funktionelle Aufgaben übernehmen können. Diese Fähigkeit ist wichtig, um ihre saisonal unterschiedlichen Lieder zu verbessern. Nottebohm fand heraus, dass die Neubildung der Nervenzellen über bestimmte Hormone reguliert wird und sich deshalb auch an die Paarungszeit anpasst. 2
Es gibt verschiedene Eigenschaften, die Singvögel zu einem sehr vorteilhaften Modell machen um die Neurogenese zu erforschen. Die Diversität von natürlich auftretenden, auf dem Gedächtnis basierenden Verhalten und die Tatsache, dass Vögel sowohl in der freien Wildbahn, als auch unter künstlichen Bedingungen im Labor erforscht werden können, machen sie ideal zum Untersuchen von neuronalen Prozessen, die dem Lernen unterliegen. Die Vögel erlernen Lieder, die jahreszeitlichen Schwankungen unterliegen, beispielsweise in der Paarungszeit im Frühjahr und zu anderen Zeiten. Diese jahreszeitlichen Schwankungen stehen im Kontakt mit der Hormonregulation, die die Liederkontrollgehirnkerne beeinflusst, die wiederum die adulte Neurogenese regulieren. (Barnea und Paravosudov, 2011)
Gesangsentwicklung des Vogels
Singvögel (z.B. Kanarienvögel und Zebrafinken) lernen ihren Gesang durch Nachahmung ihrer älteren Gruppenmitglieder der eigenen Spezies. Dies geschieht dadurch, dass sie solange einen modifizierten Gesang ausgeben, bis er dem memorierten Modell gleicht und sie eine positive Rückmeldung erlangen. Bei einigen Vögeln führt das Erlernen von Gesang zu leicht erkennbaren Gesangsdialekten, die dann als lokale kulturelle Traditionen gehandelt werden. Bei den meisten Singvögeln dauert die Beherrschung eines Gesang Modells viele Wochen. Gesangslernen beginnt mit einem „subsong“ (eng.), der mit dem menschlichen Säuglingslallen vergleichbar ist. Währenddessen werden hochgradig variable, niedrige Amplituden Töne in einem nicht kommunikativen Zusammenhang hergestellt. Oft während der juvenile Vogel zu dösen scheint. Die Klänge der sogenannten „subsongs“ liefern das Rohmaterial, aus dem Imitationen entstehen. Sobald diese Imitationen erkennbar werden, werden sie als "plastic-song" bezeichnet. Wenn die Imitationen perfektioniert sind, wird der Gesang weniger und weniger variabel. Der stabile Gesang der typischen Erwachsenen wird durch die Zeit der Geschlechtsreife des Vogels gestartet, dann wenn er bereit ist ein Territorium zu verteidigen und ein Weibchen zu umwerben. Interessanterweise kann sowohl bei Vögeln - als auch bei menschlichen Säuglingen - der Weg des Gesangs in eigenwilligen Veränderungen gipfeln, die mit der Imitation eines Modells vergleichbar sind, so als ob dies eine Übung bei der Problemlösung ist, für die es keine einheitliche Lösung gibt. (Konishi, 1965; Liu et al., 2004; Marler, 1970; Marler und Tamura, 1964; Nottebohm, 2005; Thorpe, 1958)
Physiologische Grundlagen
Einführung
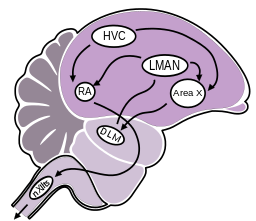
Neurogenese im adulten Vogelgehirn ist ein generelles Merkmal von weiblichen und männlichen Vögeln. Ziel ist die Kontrolle von erlerntem Verhalten. Der Hippocampus scheint eine wichtige Rolle in der Formation der räumlichen Erinnerung während des Futter-Lagerungs-Verhalten und des Gesangskontrollsystems für die Gesangerlernung zu spielen. Der Erwerb und die Produktion der erlernten Gesänge ist möglich, durch eine Gruppe von Gehirnkernen und ihrer Verbindungswege, die als "Gesangs-System" bezeichnet werden. Dieses System, das sehr detailliert bei Singvögeln beschrieben werden kann, hat zwei Hauptzweige. Der hintere absteigende Weg ("posterior descending pathway", PDP), der sowohl für den Erwerb und die Produktion der gelernten Lieder verantwortlich ist und die Vorderhirnschleife ("anterior forebrain pathway", AFP), die hingegen nur für den Erwerb des Gesangs zuständig ist (s. Abbildung 2). Das Gesangskontrollzentrum, auch „high vocal center“ (HVC) genannt, ist der Ausgangspunkt der beiden Bahnen. Aber die HVC-Zellen, die zum PDP und AFP projizieren unterscheiden sich. Bei Säugetieren ist der PDP homolog zu einer motorischen Bahn, die in der Hirnrinde beginnt und durch den Hirnstamm absteigt, während die AFP homolog zu einer kortikalen Bahn durch die Basalganglien und den Thalamus ist. (Barnea und Paravosudov, 2011; Bottjer et al., 1997; Jarvis et al., 2000; Luo und Perkel, 1999; Nottebohm, 2005; Nottebohm et al., 1976; Paton et al., 1981; Vates et al., 1997)
Abbildung 2 |
|
HVC speist auf zwei Wege Informationen ein, die dann letztlich zu den Neuronen der tracheosyringealen Hälfte des Hypoglossus Kern (nXIIts) führen. Dieser Kern ist für die motorische Weiterverarbeitung verantwortlich und reguliert die für den Gesang verantwortlichen Muskeln. HVC projiziert direkt zu RA (PDP) und indirekt über Area X, den dorsolateralen vorderen Thalamuskern (DLM) und LMAN (AFP) in einer ähnlichen Weise wie beim Säugetier (Cortex-Basalganglien-Thalamus-Cortex)(Nottebohm, 2005)3. |
Grundprinzip
Viel von dem, was über den Ursprung und Migration der neuenNeuronen im adulten Vogelgehirn bekannt ist, kommt aus den Studien des Gesangs – Kontroll – Systems des Kanarienvogels. Die Neuronen stammen von der ventrikulären Zone(VZ) und wandern zu den telencephalischen Bereichen, wo sie später siedeln. Nottebohm und seine Studenten zeigten, dass die neuen Zellen im VZ geboren und entlang der radialen Glia ins HVC wanderten, wo sie sich in Neuronen differenzierten, die für den robusten Kern des Arcopallium (RA) geplant waren oder werden zu Interneuronen. Es wird angenommen, dass Neurogenese ein mehrstufiger Prozess ist. Er ist zusammengesetzt aus der Produktion von neuen Zellen aus Stammzell-Progenitoren, der Differenzierung dieser Zellen in neurale Phänotypen, ihrer Migration zu den Zielgehirnbereichen und schließlich ihrer Integration in vorhandene neurale Kreisläufe ,wo sie die alten sterbenden Neuronen ersetzen. Deshalb wird angenommen, dass der neuronale Tod und Ersatz als Grundbestandteile der adulten Gehirnplastizität gelten. (Barnea und Paravosudov, 2011)
Gesangskerne
Einige dertelencephalen Kerne, die in der Produktion und Akquisition vom gelehrten Gesang teilnehmen, sind bei Nestlingen klein. Nach dem Einsetzen der Gesangsentwicklung wachsen das Volumen, die Zellzahl, Zellgröße und die Verbindungen in den folgenden Wochen und Monaten an. Als ein Ergebnis dieser Veränderungen, sind viele Komponenten der Schaltungen für den Erwerb und für die Produktion der erlernten Gesänge gebildet und verbunden worden. Dies geschieht während der Periode, in der sich erstmalig der Gesang entwickelt. Eine weitere Besonderheit dieses Systems ist, dass die rechte und linke Seite des Gehirns, zu einem gewissen Grad unabhängig voneinander arbeiten können. Dies ist ausschlaggebend für die jeweils unterschiedliche Anordnung von Klängen. Bei Vögeln, wie dem Kanarienvogel, Buchfink und dem weiß-gekrönten Spatz, wird eine Mehrheit der Klänge des Liedes von der linken syringeal Hälfte produziert, unter der Kontrolle der linken Gehirnhälfte. Dieses Phänomen wird als "links hypoglossus" oder "links hemisphärische" Dominanz bezeichnet. (Nottebohm, 1977; Nottebohm, 1999; Nottebohm, 2005)
HVC: ( Hyperstratium ventrale, pars caudalis) oder High vocal center, ist ein Nucleus (Kern) der verantwortlich für das Erlernen und die Produktion von Vogelgesang ist und daher auch als Gesangskontrollzentrum bezeichnet wird.
RA: Nucleus robustus acropalli, wird auch als Gesangskern bezeichnet und ist verantwortlich für die Gesangsmotorik.
Area X: Ist der Kern, der als Lernregion bezeichnet wird - bisher wurde dieser Kern nur bei männlichen Individuen beobachtet. (Walton et al., 2012)
Einblicke in die Mechanismen des Gesangserlernens
Zusammenspiel von HVC und RA
Von Anfang an weckte das Liedsystem die Aufmerksamkeit der Neurophysiologen. Es wurde bekannt, dass Läsionen der HVC und des robusten Kerns des Arcopallium (RA) die Organisation des Gesangs beeinflussen, wobei Läsionen des Ersteren noch verheerender sind als Läsionen des Letzteren. Die Stimulation der HVC unterbrach den Gesang und setzte das Lied-Programm zurück, das nicht passierte, wenn sich die stimulierende Elektrode im RA befand. Diese hierarchische Beziehung zwischen HVC und RA wurde durch die Aufnahme, bei einem singenden Vogel, von HVC und RA bestätigt. Aber die Art und Weise, wie die Töne des Liedes in HVC vertreten wurden, blieb unklar. Dieses Problem wurde durch die Aufnahme von einzelnen HVC Neuronen gelöst, die in den RA-Kern projizieren. Diese Neuronen, die gezeigt wurden, projizierten sehr dünn und in einem eng definierten Zeitraum. Jedes Neuron projizierte immer in den gleichen sechs Millisekunden-Fenster, während der Vogel ein einziges erlerntes Lied produzierte. Die Folgerung, dass diese Neuronen-und der PDP, von denen sie ein Teil sind, die gelernten Muster des Gesangs durchführt, scheint unausweichlich. Da dies die HVC Neuronen sind, die ersetzt werden, wenn Vögel ihr Lied ändern, folgt daraus, dass die Ersatz-Zellen ihre Aufgabe erlernen. (Nottebohm, 2005; Nottebohm et al., 1976; Vu et al., 1994; Yu und Margoliash, 1996)
Rolle der Vorderhirnschleife
Aber was ist dann die Rolle der Vorderhirnschleife (AFP) beim Lieder erlernen? Es war bekannt, dass die AFP für die Akquisition, aber nicht für die Produktion des erlernten Liedes verantwortlich ist. Es war ebenfalls bekannt, dass das variable Lied, typisch für jugendliche Singvögel, nach bilateralen Läsionen des lateralen magnozellulären Kerns des Nidopallium (LMAN) (Teil der AFP) sehr stereotyp wurde. Daraus leitet sich ab, dass LMAN eine entscheidende Rolle in der Förderung von Schaltung und Plastizität übernimmt, die notwendig für das Lernen ist. Aber der Mechanismus für diesen Effekt blieb unbekannt. Zwei neuere und unabhängige Studien zeigen nun, wie dieser Effekt zustande kommt. In einer Ausgabe von PLoS Biology zeigen Ölveczky und Kollegen, dass die LMAN Neuronen in RA nach einem quasi zufälligen Muster projizieren, wenn ein variables Lied bei Jungvögeln produziert wird. Während also die HVC → RA Projektion, das erlernte Lied trägt, ist die LMAN → RA Projektion der Tackt Geber, der die Variabilität der Motorik angibt und wichtig für die Induktion einer Modellimitation ist. Wenn die LMAN Neuronen schweigen (oder nicht vorhanden sind), produziert der HVC → RA Bahn, ein stereotypes Muster; wenn die LMAN → RA Neuronen projizieren, ist das Lied variabler. Dies ist ein bedeutender Durchbruch. Allerdings ist nicht klar, wie genau diese Signalbahnen beim Erlernen eines Liedes funktionieren. Eine Möglichkeit ist, dass Vögel versuchen nachzuahmen. Dies ist ein Modell, das zum Erfolg führt und aus der Streuung erzeugt wird. Die Muster werden an das Modell angenähert und der Rest verworfen, wodurch über einen Zeitraum hinweg die perfekte Imitation entsteht. Eine zweite Möglichkeit ist, dass die Variable Diskrepanz zwischen einem Modell und der versuchten Nachahmung zu einer Veränderung der Ausgabe wird, so dass Muster, die bisher nicht aufgetreten sind erst jetzt erscheinen. Beide Mechanismen gehen auf auditive Rückmeldung zurück. (Bottjer et al., 1984; Kao et al., 2005; Nottebohm, 2005; Scharff und Nottebohm, 1991; Ölveczky et al., 2005)
Neurogenese bei Singvögeln
Adulte Variationen
Das Lied der Vögel ist geschlechtsdimorphistisch: es ist besser bei männlichen Individuen entwickelt, die in der Regel mehr Gesang produzieren und über ein komplexeres Repertoire als die Weibchen verfügen. Zum Beispiel ist der HVC Kern der männlichen Kanarienvögel dreimal größer als bei den Weibchen. Bei Zebrafinken ist er achtmal größer. Die saisonalen Sänger, wie der Kanarienvogel und die Singammer haben im Frühjahr deutlich größere Gesangskontrollkerne (HVC) als im Spätsommer nach der Fortpflanzung. In vielen der Gesangs-Kerne sind die Zellen Androgen-und Östrogen-sensitiv. Der HVC-Kern der erwachsenen weiblichen Kanarienvögel, der mit physiologischen Dosen von Testosteron behandelt wurde, verdoppelt sein Volumen. Außerdem beginnen diese Vögel auf männliche Art an zu singen. Zunächst galten solche Änderungen ausschließlich als Folge des Wachstums von dendritischen Bäumen und Synapsenbildung. Anschließend wurde aber herausgefunden, dass neue Neuronen aufgenommen wurden. Diese neuen Neuronen werden, wie in Embryonen, in der Wand des Vorderhirns der lateralen Ventrikel geboren. Interessanterweise traten die neuen Neuronen im HVC-Kern auch bei männlichen und weiblichen erwachsenen Kanarienvögeln auf, die keine hormonelle Behandlung erhalten hatten. (Brenowitz et al., 1991; Nottebohm, 2005; Walton et al., 2012)
Neuronaler Ersatz
Wir wissen jetzt, dass die Rekrutierung von neuen HVC Neuronen Teil eines Prozesses des ständigen Austausches ist. Dieser Austausch ist besonders bei Kanarienvögeln während saisonalen Veränderungen im Lieder-Repertoire aktiv. Männliche Kanarienvögel entwickeln jedes Jahr ein neues Lieder-Repertoire. Neue Neuronen werden ständig hinzugefügt. Vor allem in vielen Regionen des erwachsenen Telencephalon, wo sie wahrscheinlich an einer Vielzahl von Hirnfunktionen beteiligt sind. Innerhalb der Bereiche des adulten Gesangs-Kontroll-Kreislaufs sind neue Neuronen im gestreiften Zellkern Area X und im Neostratium-Kern des HVC gefunden worden. Andere Gesangs-Kontroll-Zentren sind im Neostratium lokalisiert, wie L-MAN (lateraler Teil des Nucleus magnocellularis anterioris), m-MAN (mittlerer Teil), NIF (Nucleus interfacialis) und sogar über die gesamte caudorostrale Erweiterung des Neostratium. Diese Bereiche stellen keine neuen Neuronen her. Innerhalb eines definierten Gehirnbereichs kann die Neurogenese nur bestimmte Neuronpopulationen betreffen. Man weiß jetzt, dass adulte Neurogenese und neuronaler Ersatz bei allen Wirbeltieren wahrscheinlich ist. Das Lied der Vögel gibt uns zu verstehen, wie Schaltkreise im Gehirn funktionieren und das Potenzial für die Verjüngung und Reparatur von Neuronen uns neue Möglichkeiten in der Neurologie öffnen. Genauso wichtig ist, dass die Entdeckung des neuronalen Ersatzes, grundlegende Fragen über die Variabilität des Gehirns und die Grenzen zu lernen aufgeworfen haben. (Barnea und Paravosudov, 2011; Hofman et al., 2002; Nottebohm, 2005)
Fallbeispiel der adulten Neurogenese bei Kanarienvögeln
Einführung
Bei der Erforschung der Neurogenese, gibt es verschiedene Ansätze und Methoden um neue Neuronen darzustellen. Im Folgenden handelt es sich um ein Forschung von A. Paton et al., 1985, im „ Journal of Neuroscience “ veröffentlicht wurde. Thymidine Autoradiographie und retrograder Transport von HRP (Horse radish peroxydase/ Meerrettichperoxidase) wurden kombiniert eingesetzt, um herauszufinden wie neue Neuronen im erwachsenen Singvogel- Vorderhirn entstehen. Autoradiographie mit Thymidin: Dabei handelt es sich um eine Nachweismethode für proliferierende Zellen. Dabei wurde mit radioaktivem Tritium (3H) markiertes Thymidin verwendet, welches analog zum DNS-Bestandteil Thymidin von in der S-Phase des Zellzyklus befindlichen Zellen kompetitiv in die DNS eingebaut wird. Somit wurde [3H]-Thymidin zum ersten selektiven Marker für die DNS-Synthese. Dadurch lässt sich das inkorporierte [3H]-Thymidin photographisch darstellen und quantitativ erfassen. (Paton et al., 1985)
Methode und Vorgehensweise
Sieben Männliche und sieben weibliche Kanarienvögel (Serinus Canarius), im Alter von 14-21 Monaten, wurden einem saisonalem Tag/Nacht- Lichtzyklus ausgesetzt im Zeitraum von Juni bis Februar. Den weiblichen Vögeln wurde einen Tag, bevor sie das erste Mal mit Thymidin behandelt wurden, Testosteronimplantate implantiert, um den männlichen Blutspiegel von Testosteron zu simulieren. Daraus folgt ein männlich ähnlicher Gesang und die Zunahme von der Größe der Gesangs-Kontroll-Kerne, einschließlich HVC und RA. Mehr als die Gesang-Kontroll-Kerne zu erweitern, werden HVC-Grenzen (anatomisch) passierbar und RA stellt eine größere Zielgruppe für HRP da. Dann wurden die Vögel einer Autoradiographie mit Thymidin , zur Markierung der Zellen, unterzogen. Alle 12 Stunden wurde 14 Tage lang, Thymidin injiziert. Nach etwa 30-60 Tagen, nach letzter Thymindininjektion, wird HRP in den RA-Kern (im Vorderhirn des Vogels) oder die Area-X(Lernregion) injiziert. Daraufhin durften sich die Vögel einige Tage lang regenerieren. Anschließend wurden sie getötet und die Gehirnabschnitte histologisch fixiert und behandelt. (Paton et al., 1985)
Histologie
Um die Zellen, die HRP enthalten, sichtbar zu machen wurden die Präparate mit Diaminobenzidin (DAB) und Wasserstoffperoxid behandelt und anschließend in Paraffin fixiert. Die Gehirnabschnitte wurden via Autoradiographie bearbeitet, um die im selben Gewebe mit Thymidin markierten Zellen ebenfalls, mittels Kresylviolett-Färbung, sichtbar zu machen. Kresylviolett-Färbung hat keinen Einfluss auf die bereits HRP markierten Zellen. Somit können beide Methoden zusammen verwendet werden um den Zeitpunkt der Entstehung neuer Neuronen zu bestimmen. In der folgenden mikroskopischen Untersuchung werden die Neuronen gezählt. (Paton et al., 1985)
Erwartetes Resultat
Es wurde erwartet, dass wenn 5 % aller Neuronen im Körper mit Thymidin markiert sind, dass dann auch 5 % jedes Typs von HVC Zellen markiert sein sollte. Aber dem war nicht so. RA-Injektion= 692 Doppelt markierte Zellen erwartet, aber nur zwölf wurden entdeckt. Area-X-Injektion= 825 Doppelt markierte Zellen erwartet, aber nur vier wurden entdeckt.
Erzieltes Resultat
9 % aller Neuronen in HVC waren Thymidin markiert aber nur 0,1% der Projektionshormone waren auch mit HRP doppelt markiert. Alle Neuronen hatten Dendriten und Axone, sind aber auf HVC ortsbeschränkt. Fazit ist, dass es sich bei neuen Nervenzellen in HVC um lokale Interneuronen handelt. (Paton et al., 1985)
Proliferation
Weitere Forschungen von A. Barnea und V. Paravosudov, die im Jahre 2011 im “ European Journal of Neuroscience“ veröffentlicht wurden, geben Einblicke in die Proliferation und Migration neuer Neuronen auf der Forschungsbasis von Goldman und Nottebohm, 1983, und Alvarez – Bullya ,1990 und 1998.
Man injizierte 7 männlichen und weiblichen Kanarienvögeln Thymidin (siehe oben: selbe Methode und Vorgehensweise nur ohne HRP Injektion). Ein Teil der Vögel wurde 30 Tage später getötet und man fand viele, HVC-markierte, Neuronen ähnliche Zellen. Der andere Teil wurde schon nach 1-2Tagen getötet und man fand keine HVC-markierte, Neuronen ähnliche Zellen. Jedoch gab es in jenem kurzen Zeitraum viele markierte Zellen an der Wand des VZ, welches das HVC überlagert. Daraus schlossen Goldman und Nottebohm, dass während der embryonalen Phase neue Neuronen im VZ geboren werden, die ins Telecephalon wanderten, wo sie sich niedersetzten und differenzierten. Tatsächlich wissen wir heute, dass die Neuronen bei den Singvögeln nach dem Schlüpfen gebildet werden und sich ausschließlich zu Zellen im VZ begeben. Alvarez – Buylla et al. (1998) identifizierten 3 Hauptzelltypen in adulten Vogel – VZ:
- Primäre Vorläufer (Typ – B – Zellen) behalten einen Endfuß auf der ventrikulären Oberfläche und bewegen sich in Richtung des Ventrikels um sich dort zu teilen (Mitose).
- Typ – B – Zellen geben Anlass zur Vermutung, dass es auch Typ – A – Zellen gibt, die den jungen wandernden Neuronen entsprechen. Diese bewegen sich vom Ventrikel weg und orientieren sich parallel zur Wand.
- Ependymale Zellen ( Typ – E – Zellen) teilen sich die ventrikulären Oberfläche mit den Typ–B–Zellen, die sich aber keine Mitose durchmachen.
Alvarez – Buylla et al. (1990) bemerkten, dass die markierten VZ – Zellen besonders reich in den „hot spots“ im dorsalen und ventralen Bereich von der lateralen Ventrikelwand waren. Dies zeigt, dass es sich bei diesen Zellen um radiale Glia handelt. Sie vermuteten, dass diese Zellen neurale Stammzellen sind und entstehen, wenn sich radiale Glia teilen und eine der Tochterzellen die Identität eines jungen Migrationsneurons annimmt. Wir wissen zurzeit jedoch nicht, wie oft sich Stammzellen teilen können und neue Neuronen entstehen. Es gibt immer noch Unklarheiten bei der Auswertung der Ergebnisse, z.B. könnte es sein das sich die Zellen überlagern oder versehentlich doppelt gezählt wurden. (Barnea und Paravosudov, 2011; Walton et al., 2012)
Migration
Die meisten Neuronen werden weit weg von dem Ort geboren, wo sie sich letztendlich niederlassen und müssen deshalb in der Lage sein zu ihrem Zielort zu gelangen. Man zeigte, dass viele radiale Glia-Zellen mit schmalem Zellkörper, die in der Wand des VZ untergebracht sind, lange, unverzweigte Fortsätze haben, die ins benachbarte Parenchym eindringen. Man fand ebenfalls heraus, dass junge Neurone, die in dieser Phase klein und länglich sind, entlang der radialen Fasern über beträchtliche Abstände durch reifes Gehirngewebe wandern und verschieden Regionen im Endhirn erreichen. Neuronale Wanderung folgt auch einer mit radialer Glia verbundenen Pfadsenkrechten (tangentiale Migration). In diesem Modus wandern die Zellen, vor der Auflösung, nahe oder innerhalb der Wände vom seitlichen Ventrikel entlang der radialen Gliafasern, um den Abstand zu vergrößern. An einem bestimmten Tag können sich viele junger Neuronen im adulten Gehirn anhäufen und differenzieren. 3 Tage nach dem Schlüpfen beginnen die jungen länglichen Zellen ihre Reise und erreichen 20 Tage später, weit entfernte Bereiche im Telencephalon, wo sie sich differenzieren. Die Migrationsraten sind am höchsten, wenn junge Neuronen durch Bereiche wandern, die reich an radialer Glia sind. Sobald die Neuronen ihren Zielort erreicht haben, bilden sich Dendriten und axonale Äste zu festen Verbindungen aus. Je nach Standort innerhalb des Gehirns kann der Prozess der Geburt eines jungen Neurons bis zu seiner postmigratorischen Differenzierung von 7 Tagen im VZ, 8 Tage im HVC und bis zu 20 bis 40 Tage im Endhirn andauern. (Barnea und Paravosudov, 2011)
Literaturverzeichnis
- Barnea A., Paravosudov V. (2011): Birds as a model to study adult neurogenesis: bridging evolutionary, comparative and neuroethological approaches. European Journal of Neuroscience: (Vol. 34): pp.884-907
- Bottjer SW., Johnsons F.(1997):Circuits, hormones, and learning: Vocal behavior in songbirds. J. Neurobiol.: (Vol. 33): 602 - 618
- Bottjer SW., Miesner EA., Arnold AP. (1984): Forebrain lesions disrupt development but not maintenance of song in passerine birds. Science: (Vol. 224): pp. 901 - 903
- Brenowitz EA., Nalls B., Wingfield JC., Kroodsma DE. (1991): Seasonal changes in avian song nuclei without seasonal changes in song repertoire. J. Neurosci.: (Vol. 11): pp. 1367 - 1374
- Hofman M.A., Boer G. J., Holtmaat A. J. G. D., van Someren E. J. W., Verhaagen J. (2002): Progress in Brain Research. Elsevier Science B.V.: (Vol. 138): pp. 223 - 254
- Jarvis ED., Ribeiro S., da Silva ML., Vielliard Ventura D, et al. (2000): Behaviorally driven gene expression reveals song nuclei in hummingbird brain. Nature: (Vol. 406): pp. 628 - 632
- Kao HM., Doupe AJ., Brainard MS. (2005): Contributions of an avian basal ganglia - forebrain circuit to real - time modulation of song. Nature.: (Vol. 433): pp. 638 - 643
- Konishi M. (1965): The role of auditory feedback in the control of vocalization in the white-crowned sparrow. Z Tierpsychol.: (Vol. 22): pp.770-783
- Liu WC., Gardner TJ., Nottebohm F. (2004): Juvenile zebra finches can use multiple strategies to learn the same song. Proc. Natl. Acad Sci USA: (Vol. 101): pp. 18177-18182
- Luo M., Perkel DJ. (1999): A GABAergic, strongly inhibitory projection to a thalamic nucleus in the zebra finch song system. J. Neurosci.: (Vol. 19): pp. 6700 - 6711
- Marler P. (1970): A comparativ approach to vocal learning: Song learning in white-crowned sparrow. J Comp Physiol Psychol.: (Vol. 71): pp. 1-25
- Marler P., Tamura M. (1964): Culturally transmitted patterns of vocal behavior in sparrows. Science: (Vol. 164): pp.1483-1486
- Momma Dr. S. (2005): Das dynamische Gehirn. Forschung Frankfurt: (Vol. 1): pp. 69-70
- Nottebohm F., Stokes TM., Leonard CM. (1976): Central control of song in the canary, Serinus canaria. J. Comp. Neurol.: (Vol. 165): pp. 457-486
- Nottebohm F. (2005): The Neural Basis of Birdsong. PLoS Biol.: (Vol. 3, Issue 5): pp. 759 - 761
- Nottebohm F. (1999): The anatomy and timing of vocal learning in birds. In: Hauser MD., Konishi M., editors. The design of animal communication. Cambridge (Massachusetts): MIT Press: pp. 63 - 110
- Nottebohm F. (1977): Asymmetries in neural control of vocalization in the canary. In. Harnad S., editor. Lateralization in the nervous system. New York: Academic Press: pp. 23 - 44
- Paton. A., O'Loughlin B. E., Nottebohm F. (1985): Cells Born in Adult Canary Forebrain are Local Interneurons. The Journal of Neuroscience: (Vol. 5, No. 11): pp.3088-3093
- Paton Ja., Manogue Kr., Nottebohm F. (1981): Bilateral organization of the vocal control pathway in the budgerigar. Melopsittacus undulates. J. Neurosci.: (Vol. 1): pp. 1279 - 1288
- Scharff C., Nottebohm F. (1991): A comparative study of the behavioral deficits following lesions of various parts of the zebra finch song system: Implication for vocal learning. J. Neurosci.: (Vol. 11): pp. 2896 - 2913
- Thorpe WH. (1958): The learning of song patterns by birds, with special reference to the song of the chaffinch. Fringilla coelebs. Ibis.: (Vol. 100): pp. 535-570
- Vates GE.,Vicario DS., Nottebohm F. (1997): Reafferent thalamo- "cortical" loops in the song system of oscine songbirds, J. Comp. Neurol.: (Vol. 380): pp. 275 - 290
- Vu ET., Mazurek MK., Kuo YC. (1994): Identification of a forebrain motor programming network for the learned song of zebra finches. J Neurosci.: (Vol. 14): pp. 6924 - 6934
- Walton C., Pariser E., Nottebohm F. (2012): The Zebra Finch Paradox: Song Is Little Changed, But Number of Neurons Doubles: The Journal of Neuroscience: (Vol. 32 (3)): pp. 761 - 774
- Yu AC., Margoliash D. (1996): Temporal hierarchical control of singing in birds. Science: (Vol. 273): pp.1871 - 1875
- Ölveczky BP., Andalman AS., Fee MS. (2005): Vocal experimentation in the juvenile songbird requrire a basal ganglia circuit. PLoS Biol.: (Vol. 3):pp. 903 - 908
Webverzeichnis