|
Size: 24163
Comment:
|
← Revision 97 as of 2014-12-07 19:40:39 ⇥
Size: 24161
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 93: | Line 93: |
| ==Irodalmi jegyzék== |
= Irodalmi jegyzék = |
Az orexin és az alvás kapcsolata
Contents
Bevezetés
Az orexin általános jellemzése
Az orexin-A és orexin-B (1. ábra) hipotalamikus neuropeptidek, melyek kiemelkedő szerepet játszanak az ébrenlét fenntartásában, továbbá hatással vannak az érzelmekre, homeosztázisra és a jutalmazási rendszerre. Hatásukat két szoros kapcsolatban lévő G protein-függő receptoron, az orexin-1 (OX1R) és orexin-2 (OX2R) receptorokon keresztül fejtik ki. (Sakurai és mtsai, 1998) Ezek a receptorok az agy különböző alvás-ébrenlétet szabályozó területein helyezkednek el. Az orexin neuronok hiánya emberben narkolepsziához vezet, amely fokozott nap közbeni álmossággal és katapleksziával (hirtelen fellépő kétoldali izomgyengeség) jár. (Chemelli és mtsai, 1999; Lin és mtsai, 1999; Peyron és mtsai, 2000; Thannickal és mtsai, 2000; Hara és mtsai, 2001)
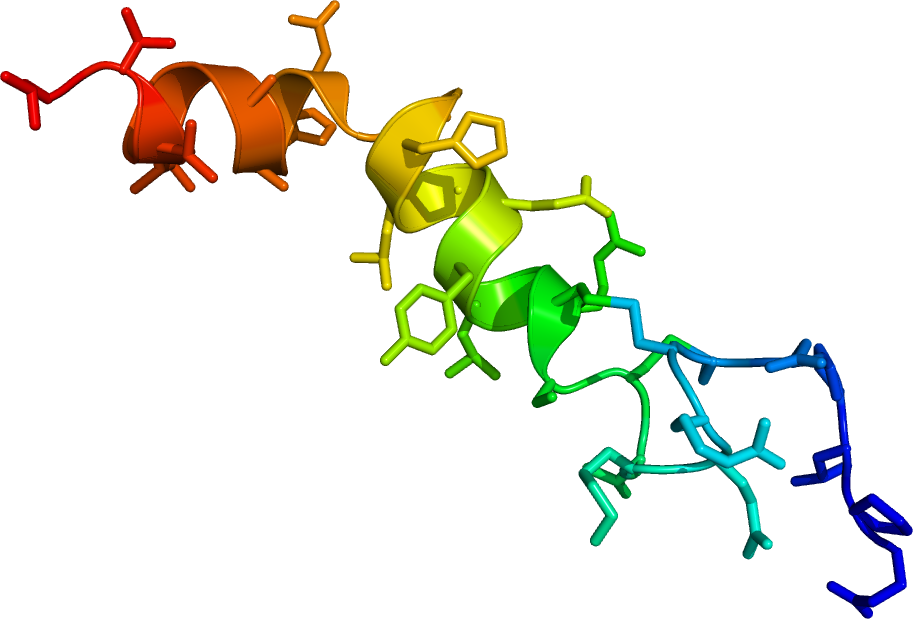
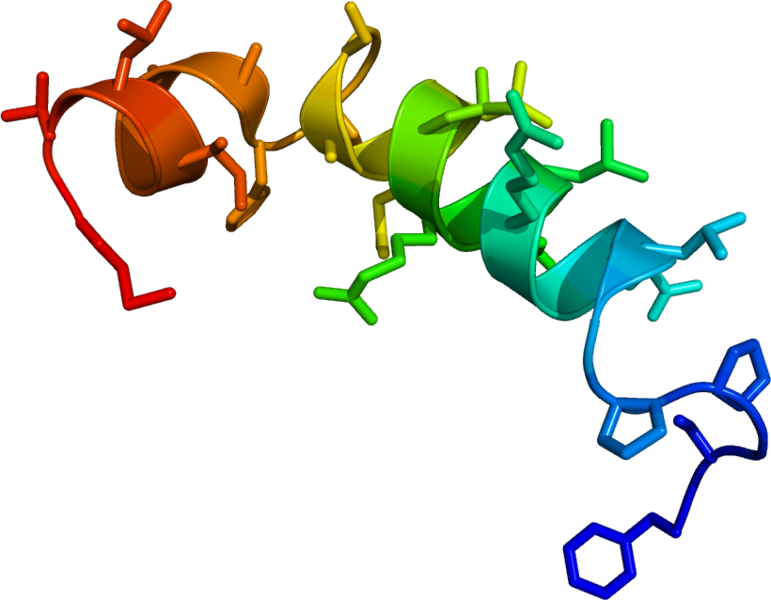
1. ábra Orexin-A és orexin-B
Narkolepszia és kataplekszia leírása
- A narkolepszia idegrendszeri betegség, mely rendszerint felnőtt korban jelentkezik. Legjellemzőbb tünetei az örökös fáradtság, aluszékonyság és a hirtelen fellépő elalvás. További tünetként jelentkezhet kataplekszia, mely során a beteg – rendszerint erős érzelmi behatásra – elveszti izomtónusát és összeesik.
Alvás fázisai (REM és non-REM)
Az alvás egy létfontosságú folyamat, ami az emberi élet körülbelül egyharmadát teszi ki. Elektrofiziológiás tanulmányok azt mutatták ki, hogy az alvás egy heterogén állapot, melyen belül elkülöníthetünk REM (rapid eye movement - gyors szemmozgás) és non-REM fázist (Dement, 1994) (2. ábra). A REM fázisra élénk álmok, izom atónia, deszinkronizált EEG aktivitás és gyors szemmozgás a jellemzőek, a non-REM fázis során pedig szinkronizált EEG aktivitás, részleges izomrelaxáció és a környezeti ingerek iránti csökkent fogékonyság figyelhető meg. A REM és a non-REM fázis egyaránt elengedhetetlenek a túléléshez. Mind a REM fázis, mind pedig az alvás teljes megvonása letális emlősöknél.
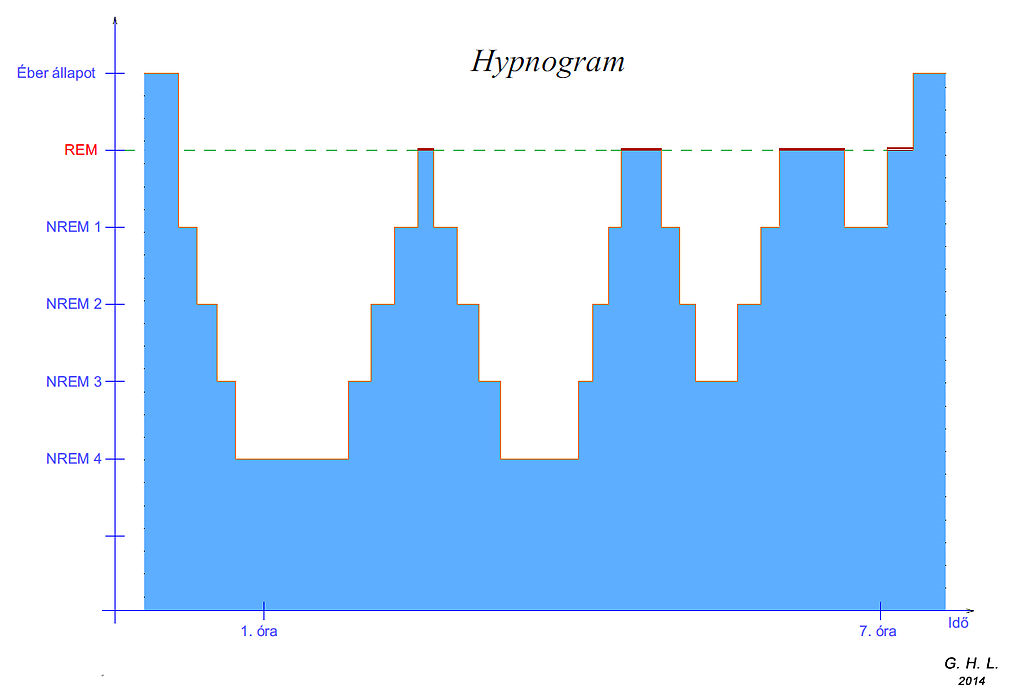
2. ábra Hypnogram. Alvási stádiumok mélység szerint
Orexin részletes leírása
Az orexinnek A és B fajtáját különítjük el. Az orexin-A 33 aminosavból álló, 3562 Da molekulatömegű peptid, melyet diszulfid-hidak stabilizálnak, és N-terminális végén pyroglutamil-származék található. Elsődleges szerkezete (aminosav szekvenciája) a legtöbb emlősben (ember, kutya, disznó, patkány, egér) megegyezik. Az orexin-B nagyon hasonló az A-hoz, de csak 28 aminosavból áll, 2937 Da molekulatömegű, és N-terminális vége variábilis. A fajok közötti eltérés itt is elhanyagolható. (Shibahara és mtsai, 1999; Alvarez and Sutcliffe, 2002; Sakurai, 2005) (1. ábra)
Az orexint (hipokretint) termelő neuronok a laterális hipotalamuszban találhatóak, melyek az orexint annak prekurzorából, a pre-pro-orexinből állítják elő. Kísérletek kimutatták, hogy azok az egerek, melyekben célzottan irtották a pre-pro-orexin gént, a narkolepsziához feltűnően hasonló tüneteket produkáltak: megszakított ébrenlétek, direkt átmenet ébrenlétből REM alvásba. (Chemelli és mtsai, 1999) Az orexin-termelő neuronok továbbá glutamát-szállító vezikulumokat exocitálnak és gátolják a GAD67 (glutaminsav-dekarboxiláz) kibocsátást. (Rosin és mtsai, 2003; Torrealba és mtsai, 2003) A GAD67 hatására a glutaminból GABA (gamma-amino-vajsav) keletkezik, mely az adrenalin, szerotonin és dopamin mellett gátolják az orexin-termelő neuronok működését. (Az adrenalin, a szerotonin és a dopamin alfa-2 adrenoceptorokon keresztül hat.)(Yamanaka és mtsai, 2003b,2006). A glutamát receptorok agonistái serkentik, míg antagonistái gátolják az orexin termelést. (Li és mtsai, 2002; Yamanaka és mtsai, 2003b) Továbbá a kolecisztokinin, az oxitocin és az ADH (antidiuretikus hormon) is serkentőleg hat az orexin-termelő neuronokra. (Tsujino és mtsai, 2005; Tsunematsu és mtsai, 2008) Ingerelhetőségüket a szén-dioxid szint befolyásolja. Ez acidózis esetén nő, míg alkalózis fennállásakor csökken, ennek következtében az orexin a légzőműködésre is hatást gyakorol. (Nakamura és mtsai, 2007)
Orexin receptorok
Az orexinek a hatásukat orexin-1 (OX1R) és orexin-2 (OX2R) receptorokon keresztül fejtik ki (Peyron és mtsai, 1998; Sakurai és mtsai, 1998; Marcus és mtsai, 2001). Működésük G protein-függő, mivel ezek a fehérjék vesznek részt az orexin receptorok által közvetített extracelluláris jel által szabályozott kináz aktivitásában. (Tang és mtsai, 2008) Míg az OX1R-hez főleg az orexin-A kapcsolódik, addig az OX2R-hez az A és a B típusú orexin ugyanolyan affinitással köt. (Sakurai és mtsai, 1998) Ezek a receptorok az agy ébrenlétért felelős monoaminerg és kolinerg rendszereiben találhatóak. Ide tartozik a tuberomamilláris mag, a locus coeruleus, a dorzális raphe és a laterodorzális tegmentális mag (Sakurai és mtsai, 1998; Marcus és mtsai, 2001).
A monoaminerg rendszeren belül a locus coeruleus neuronjai kizárólag OX1R-t expresszálnak, a tuberomamilláris magban pedig az OX2R-ok helyezkednek el densen, a dorzális raphe neuronjai pedig egyaránt expresszálnak OX1R és OX2R-okat is. Kimutatták, hogy a locus coeruleusban lévő OX1R szabályozza a REM alvást. Patkányokban a locus coeruleusba történő orexin-A beadása a REM alvás elnyomását eredményezte (Bourgin és mtsai, 2000). Az orexin ICV (intracerebroventriculáris) beadása hatékonyan fokozza az ébrenlétet és elnyomja mind a REM, mind pedig a non-REM alvást az orexin-1 és orexin-2 receptorokon keresztül hatva. Patkányokon végzett kísérleti eredmények azt mutatták ki, hogy az OX2R sokkal hatékonyabban támogatja az ébrenlétet és nyomja el a non-REM fázist, mint az OX1R. Ugyanakkor valószínűsíthető, hogy a REM fázis gátlásában pedig az OX1R játszik jelentősebb szerepet. Feltételezhető, hogy az orexin receptorok gátlása az insomnia (álmatlanság) egy újszerű gyógyszeres kezelését jelenthetné.
Orexin receptorok gátlása, antagonisták
- Mint a fentiekben ismertetésre került, az OX1R és OX2R eltérő módon szabályozzák az alvás-ébrenlét fázisait, így három különböző orexin antagonistát vizsgáltak patkányokon:
- 1) az OX1R és OX2R-ra egyaránt ható almorexant: (2R)-2-[1(S)-6,7-dimetoxi-1-{2-[4-(triflórmetil)fenil]etil}-dihidrosoquinolin-2(1H)-il]-N-metil-2-fenieletánamid (3. ábra)
- 2) szelektív OX1R antagonista SB-408124: 1-(6,8-difluoro-2-metilquinolin-4-il)-3-[4-(dimetilamino)fenil]urea
- 3) szelektív OX2R antagonista JNJ-10397049: 1-(2,4-dibromofenil)-3-[(4S,5S)-2,2-dimetil-4-fenil-1,3-dioxán-5-il]urea
- Kimutatták, hogy az almorexant sötétedéskor való beadása egyaránt hatásos volt a REM és a non-REM alvás elősegítésében, de nem hatott magára az elalvásra, viszont a világosodáskor beadott almorexant egyaránt stimulálóan hatott az elalvásra és az alvás idejét is meghosszabbította. A szelektív OX2R antagonista teljességgel hatékonynak bizonyult mind az alvás előidézésében, mind pedig a REM és a non-REM alvás időtartamának növelésében a világos és sötét fázisban egyaránt. Az OX1R antagonista egyik alvási paraméterre sem volt hatással. Az is megfigyelhető volt, hogy a szelektív OX2R antagonista tízszer hatékonyabb az alvás előidézésében és fenntartásában, mint az almorexant, viszont az OX1R és OX2R szelektív antagonisták együttes beadásakor az OX1R blokkolása csökkentette az OX2R antagonista alvás-fenntartó hatását. Az OX2R gátlása mind szelektív OX2R antagonistával, mind pedig almorexanttal a hisztamin extracelluláris koncentrációjának csökkenését eredményezte a laterális hipotalamuszban. Az OX1R gátlása pedig megnövekedett dopamin kibocsátást eredményezett a prefrontális kéregben. A fenti kísérletek eredményeiből feltételezhető, hogy az OX2R antagonisták megoldásként szolgálhatnak az insomnia kezelésére, az OX1R antagonisták pedig dopamin-függő viselkedésminták szabályozására, mint például a függőség és jutalmazás.
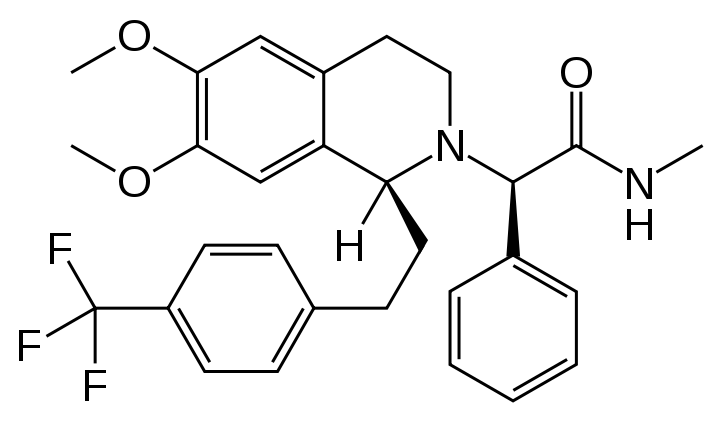
3. ábra Almorexant szerkezeti képlete
Orexin és narkolepszia kapcsolata
- A narkolepsziának (katapleksziával kísérve) legfőbb ismérve az orexin-termelő neuronok nagyjából 90%-ának az elvesztése. Viszont a narkolepsziában szenvedőknek több, mint negyedénél nem kíséri kataplekszia a betegséget, és az orexin szintjük az agy-gerincvelői folyadékban normális. Ez alapján feltételezhető, hogy az utóbbi kórt más okozza.
A hivatalos kórtan szerint azok a páciensek számítanak narkolepsziásnak, akiknek rövid az alvásidejük, és minimum kettő megkezdett REM fázisuk van a többszörös alvások során (Billiard, 2007). A definíció alapján narkolepsziásnak minősülő betegeknek több, mint negyede nem katapleksziás (Benca, 2007; Longstreth és mtsai, 2007). A kataplekszia intenzitása igen változó a katapleksziával kísért narkolepsziás betegeknél. Néhányuknál ez a legzavaróbb tünet, ami a teljes izomtónus elvesztésével, és ennek következtében napi többszöri összeeséssel jár; míg másoknál a kataplekszia csak ritkán jelentkezik, akkor is csak az arcizmok átmeneti gyengesége észlelhető (Guilleminault és mtsai, 1976). A katapleksziával kísért narkolepsziát az orexin fehérje mennyiségének, illetve az orexin-termelő sejtek mennyiségének radikális csökkenése jellemzi (Blouin és mtsai, 2005; Nishino és mtsai, 2000; Peyron és mtsai, 2000; Thannickal és mtsai, 2000). Viszont minden vizsgált emberi agyban található volt néhány túlélő, megközelítőleg normális szerkezetű orexin-termelő sejt (Thannickal és mtsai, 2003).
Kísérleti megfigyelések
- Egy 2009-es tanulmányban az orexin kórbonctanát vizsgálták narkolepsziás, de nem katapleksziás eseteknél. A boncolást postmortem emberi agymintákon végezték, melyek tartalmazták a hipotalamuszt is. Ezek közül 5 minta narkolepsziás és katapleksziás pácienshez, 2 minta narkolepsziás, de nem katapleksziás beteghez tartozott (egyiknek csak az anterior hipotalamusza állt rendelkezésre), 6 minta pedig egészséges agyból származott. A hipotalamikus szövetek immunhisztokémiai módszerrel lettek megjelölve, többek között orexin-A kimutatására. A narkolepsziás, de nem katapleksziás betegek közül egyikben sem volt kimutatható az orexin neuronok axonjainak számának csökkenése az anterior hipotalamuszban. Emellett összesen 33%-nyi orexin-termelő sejt veszteség jellemezte azt a pácienst, akinek a teljes agya a kutatók rendelkezésre állt, viszont a posterior hipotalamuszban teljes volt az orexin-termelő sejtek hiánya. Ebből következik, hogy a kataplekszia nélküli narkolepsziát ezen sejtek részleges elvesztése okozhatja.
- Az orexin-termelő sejtek számának, megoszlásának és méretének meghatározása sztereológiai módszerekkel történt a különböző hipotalamusz szeleteken. Az anterior hipotalamuszban felszálló axonok találhatóak, ezért a sejtek helyett az axonokat számolták. Ez pontosabb becslést adott az orexin-termelő sejtek nyúlványainak számáról. A katapleksziával kísért narkolepsziás betegeknél az orexin-termelő sejtek száma 92%-kal kevesebb, mint az egészséges mintákban. Ezzel szemben az anterior hipotalamuszban csak 65%-os axonszám csökkenés következett be, ami a maradék sejtek sarjadzását jelentheti. Egy másik elmélet szerint a rosztrálisan helyeződő orexin-termelő sejtek kevésbé lehetnek hajlamosak az elhalásra, mint a caudálisabban lévők. Az egyik - a teljes hipotalamusszal megmaradt - kataplekszia nélküli narkolepsziás betegnek csupán 33%-kal volt kevesebb orexin-termelő sejtje az egészségesekhez viszonyítva. A legnagyobb mértékű sejtszám csökkenés a posterior hipotalamikus magban következett be. Az anterior, a dorzális és a dorzomediális magban nem volt sejtszám csökkenés. Az anterior hipotalamuszban lévő axonok száma nem különbözött az egészségesekétől. A kataplekszia nélküli narkolepsziás pácienseknél az anterior hipotalamuszban található axonok mennyisége normális, bár a posterior hipotalamuszban orexin-termelő sejtek hiánya volt kimutatható abban a betegben, akinek a teljes hipotalamusza a kutatók rendelkezésére állt.
A kimutatások azt sugallják, hogy egyes területeken történő orexin-termelő sejtek elvesztése kataplekszia nélküli narkolepsziát okozhat. Korábbi, állatokon végzett megfigyelések szintén erre a megállapításra jutottak. Az orron keresztüli orexin adagolás hatásosnak tűnt, amikor alvástól megvont majmoknál akarták megszüntetni az álmosságot (Deadwyler és mtsai, 2007). Nemrég megfigyelték, hogy a Parkinson-kóros betegekben csökken az orexin-termelő sejtek száma, bár kisebb mértékben, mint a katapleksziás-narkolepsziás betegekben (Fronczek és mtsai, 2007). A Parkinson kórban szenvedők számos narkolepsziás tünetet mutatnak, bár a katapleksziás rohamok nem jelentkeznek. Ez összefüggésben állhat a mostani megfigyelésekkel, miszerint a csak bizonyos helyeken történő sejtveszteség kataplekszia nélküli narkolepsziát okozhat. A jelenlegi eredmények alapján a részleges sejtvesztés közrejátszhat az agyvérzés vagy neurodegeneratív betegségek kialakulásában, de talán kezelhető orexin szint növelő készítményekkel.
Alvás-ébrenlét ciklus: melanin és hisztamin szerepe
Az alvásért és ébrenlétért felelős központok kölcsönhatása
A preoptikus területen, különösen a VLPO (ventrolaterális praeoptikus magjában) található neuronok fontos szerepet játszanak az alvás megkezdésében és annak fenntartásában, valamint a REM és non-REM fázisok kialakításában. A VLPO gátló hatást fejt ki az ébrenlétért felelős neuronokra, melyek az ébrenlétet elősegítő neurotranszmittereket termelnek (hisztamin, noradrenalin, acetilkolin) (Sherin és mtsai, 1998; Lu és mtsai, 2002). A VLPO idegsejtjei aktív működésük során (alvás alatt) GABA-t (gamma-amino-vajsav) termelnek, mellyel gátolják a monoaminerg és kolinerg, ébrenlétért felelős rendszert. Utóbbinak tagja az acetilkolin és a noradrenalin is, amik a GABAerg neuronokra fejtenek ki gátló hatást. A két terület egymásra ható, ugyanakkor ellentétes működése instabil állapotot eredményez az alvás és ébrenlét között (Sakurai és mtsai, 2005; Yoshida és mtsai, 2006). Ezen felül a GABA gátolja az orexin neuronokat is. Ha ezeken az idegsejteken nem jelennek meg GABA receptorok, az alvás-ébrenlét szabályozása zavart szenved (Matsuki és mtsai, 2009). Az ébrenlét fenntartásában elengedhetetlen szerepet játszik a hipotalamusz, és az agytörzs egyes területei: tuberomamilláris mag (TMN), locus coeruleus (LC), dorzális raphe (DR). Ezen területek idegsejtjeinek aktivitása éber állapotban a legjelentősebb, az alvás non-REM fázisában csekélyebb, REM fázisában pedig szinte nullára csökken (Lee és mtsai, 2005). Rajtuk orexin receptorok expresszálódnak, melyeken keresztül az ébrenlét alatt termelődő orexin stimulálja működésüket. Ezen felül az orexin a laterodorzális tegmentum (LDT) kolinerg neuronjaira is hatást gyakorol. Macskák laterodorzális tegmentumába injektált orexin-A hatására az ébren töltött idő nőtt, míg a REM fázis időtartama csökkent. Vagyis a beadott orexin-A tartósan ingerelte az LDT idegsejtjeit (Ta- kahashi és mtsai, 2002). Ugyanakkor indirekt módon gátolja is aktivitásukat a helyi GABAerg interneuronokon keresztül (Takakusaki és mtsai, 2005). Így az orexin, direkt és indirekt hatásán keresztül megfelelően tudja befolyásolni az ébrenlétet. Továbbá a szerotonerg és noradrenerg neuronok gátolják az orexin termelő idegsejteket, melyek működését többek között ez a mechanizmus is stabilizálja (Yamanaka és mtsai, 2006).
Az ébrenlét stabilizálása
A fent említett éberségért és alvásért felelős központok egymásra gyakorolt negatív hatása miatt ez a két állapot feleslegesen gyakran váltaná egymást, ha az orexin nem stabilizálná ezt az érzékeny rendszert. Az orexin neuronokat a hipotalamusz oldalsó régiója tartalmazza, mely anatómiailag kedvezően helyezkedik el a VLPO és az agytörzs között. Ezen idegsejtek nyúlványai összekötik az agy két említett területét, és stabilizálják az ébrenlétet az agytörzs egyes területeinek aktiválásával. Ennek az összeköttetésnek elvesztésekor az alvás-ébrenlét rendszer zavara léphet fel, melynek leggyakoribb megjelenési módja a narkolepszia (Saper és mtsai, 2001).
Melanin
A melanin ellentétes szerepet tölt be az orexinnel szemben, ugyanakkor ki is egészítik egymás működését, hiszen a melanin az alvásért, míg az orexin az ébrenlétért felel. A melanin termelésében az MHC-t (melanint sűrítő hormon) tartalmazó neuronok vesznek részt. (Broberger és mtsai, 1998) Működésük az SWS-be (lassú hullám alvás) forduláskor még csekély, SWS alatt már számottevő, de maximális MCH kibocsájtás csak a REM fázis alatt mérhető. Koncentrációja az ébredékor drasztikusan lecsökken. (Modirrousta és mtsai, 2005) MHC hatására lassul az anyagcsere, az izomtónus mérséklődik (különösen a törzsizmokban), melyet az EMG (elektromiogram) amplitúdójának csökkenése jelez. Az EEG (elektroenkefalogram) azonban nem mutat változást, tehát az MHC nem befolyásolja az agyi elektromos tevékenységet (Lee és mtsai, 2005). Koplalás előrehaladottabb szakaszában, amikor már a zsír kezd leépülni, az MHC szekréció növekszik, de ilyenkor is főleg alvás alatt. Ebben az esetben az idegsejtek MHC mRNS tartalma, és a transzkripció mértéke is emelkedik (Qu D és mtsai, 1996).
Hisztamin
- Ahhoz, hogy meghatározzák a hisztamin (4. ábra) és az orexin szerepét az ébrenlét fenntartásában, a viselkedési és az alvás-ébrenlét ciklus fenotípusát vizsgálták számos kísérleten keresztül orexin-irtott és HDC- (hisztamin-szintetizáló hormon) irtott egerekben. Hisztamin-termelő sejtek a tuberomamilláris magban és az azzal szomszédos posterior hypothalamusban helyeződnek. A tapasztalatok alapján feltételezhető, hogy az orexin és a hisztamin egymással szinergisták, komplementer módon fejtik ki hatásukat az ébrenlét szabályozására. Az orexin inkább a viselkedést, míg a hisztamin inkább a kognitív képességet és a kéreg EEG aktivitását befolyásolja. A katapleksziát emberben és kutyában úgy definiálják, mint az izomtónus hirtelen elvesztését ébrenlét alatt. Ezt egerekben egyszer sem észlelték.
A posterior hypothalamus egyelőre az egyetlen olyan tanulmányozott terület, ahol több ébrenlétre ható anyagot, illetve az azokat szekretáló sejtet is találtak, ezért kulcsszerepet játszik a kérgi aktivitás és az ébrenlét fenntartásában (Sakai és mtsai, 1990, Steininger és mtsai, 1999, Vanni-Mercier és mtsai, 2003, Lee és mtsai, 2005, Mileykovskiy és mtsai, 2005, Takahashi és mtsai, 2006, 2008, 2009). Az orexin-termelő és a hisztamin-termelő sejtek egymással szomszédosan helyezkednek el. Hatásuk igen kiterjedt, főbb szerepük az ébrenléti állapot elősegítésében és a narkolepszia megelőzésében van (Chemelli és mtsai, 1999, Sakurai, 2007). A hisztamin-termelő sejtek az ébrenléti ciklus alatt rendszeresen, szabályos időközönként ürítik a hisztamint (Sakai és mtsai, 1990; Vanni-Mercier és mtsai, 2003; Takahashi és mtsai, 2006) . Az adatok azt jelzik, hogy a hisztamin-termelő sejtek működésképtelensége (Nishino és mtsai, 2001, Mignot és Nishino, 2005) folyamatos, nappali álmossághoz vezet.
4. ábra Hisztamin 3D-s szerkezete
Összefoglalás
- Az orexinek a laterális hipotalamuszban termelődő neuropeptidek, melyek rendkívül fontos szerepet töltenek be az alvás szabályozásában.
- Hatásukat orexin-1 és orexin-2 receptorokon keresztül fejtik ki, melyek közül az OX1R-hez elsősorban az orexin-A kötődik, az OX2R-hez pedig az orexin-A és -B is hasonló affinitással kapcsolódik. Az OX2R hatékonyabban támogatja az ébrenlétet, és elsősorban a non-REM fázis elnyomásában játszik szerepet, míg az OX1R valószínűleg a REM fázist gátolja. Patkánykísérletek alapján az OX2R gátlása jelentheti a leghatékonyabb módot az insomnia kezelésére.
- Az orexin termelő neuronok elvesztése narkolepsziával járhat, melynek főbb tünetei a túlzott mértékű aluszékonyság és hirtelen elalvás. A narkolepsziát gyakran kataplekszia kíséri, mely az izomtónus elvesztését jelenti.
- Az alvás szabályozásában továbbá elengedhetetlen szerepet tölt be a melanin és hisztamin is. A melanin az orexinnel ellentétes hatást fejt ki, azaz lassítja az anyagcserét és mérsékli az izomtónust, ezzel elősegítve az elalvást. Ezzel szemben a hisztamin az orexin synergistája, az orexinnel komplementer módon fenntartja az ébrenlétet.
- A posterior hypothalamus egyelőre az egyetlen olyan tanulmányozott terület, ahol több ébrenlétre ható anyagot, illetve az azokat szekretáló sejtet is találtak, ezért kulcsszerepet játszik a kérgi aktivitás és az ébrenlét fenntartásában.
Irodalmi jegyzék
1) Anaclet C.; Parmentier R.; Ouk K.; Guidon G.; Buda C.; Sastre J.P.; Akaoka H.; Sergeeva O.A.; Yanagisawa M.; Ohtsu H.; Franco P.; Haas H.L.; Lin J.S. (2009): Orexin/Hypocretin and Histamine: Distinct Roles in the Control of Wakefulness Demonstrated Using Knock-Out Mouse Models. The Journal of Neuroscience, 29: (46) 14423–14438
2) Dugovic C.; Shelton J.E.; Aluisio L.E.; Fraser I.C.; Jiang X.; Sutton S.W.; Bonaventure P.; Yun S.; Li X.; Lord B.; Dvorak C.A.; Carruthers N.I.; Lovenberg T.W. (2009): Blockade of Orexin-1 Receptors Attenuates Orexin-2 Receptor Antagonism-Induced Sleep Promotion in the Rat. The Journal of Pharmacology and Experimental Therapeutics, 330: 142–151
3) Hassani O.K.; Lee M.G.; Jones B.E. (2009): Melanin-concentrating hormone neurons discharge in a reciprocal manner to orexin neurons across the sleep–wake cycle. PNAS, 106: (7) 2418-2422
4) Lin L.; Faraco J.; Li R.; Kadotani H.; Rogers W.; Lin X.; Qiu X.; de Jong P.J.; Nishino S.; Mignot E. (1999): The Sleep Disorder Canine Narcolepsy Is Caused by a Mutation in the Hypocretin (Orexin) Receptor 2 Gene. Cell, 98: 365-376
5) Mieda M.; Hasegawa E.; Kisanuki Y.Y.; Sinton C.M.; Yanagisawa M.; Sakurai T. (2011): Differential Roles of Orexin Receptor-1 and -2 in the Regulation of Non-REM and REM Sleep. The Journal of Neuroscience, 31: (17) 6518–6526
6) Thannickal T.C.; Nienhuis R.; Siegel J.M. (2009): Localized loss of hypocretin (orexin) cells in narcolepsy without cataplexy. SLEEP, 32: (8) 993-998
7) Tsujino N.; Sakurai T.: Orexin/Hypocretin (2009): A Neuropeptide at the Interface of Sleep, Energy Homeostasis, and Reward System. Pharmacological Reviews, 61: 162–176
Ábrák: 1., 2., 3., 4. ábra: en. wikipedia.org
