A peroxidazin
Contents
Filogenetika
A peroxidazin a peroxidazin-ciklooxidázok főcsaládjának 2-es számú alcsaládjába tartozik.
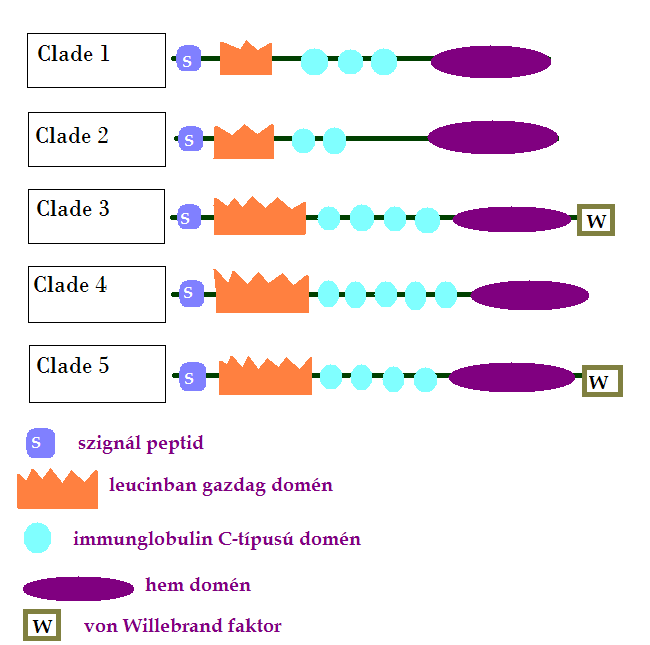
Ezt az alcsaládot további 5 ágra (clade) lehet osztani, az első 4 a gerinctelenekre, az 5. pedig a gerincesekre jellemző. A fejlődés kezdeti szakaszát az 1. ág peroxidazinjai képviselik, ezek állnak a legközelebbi rokonságban a gerinchúrosok peroxidázaival, ebbe a csoportba tartoznak a félgerinchúrosok és előgerinchúrosok fehérjéi. A 2. ágba a fonálférgek, a 3. ágba az ízeltlábúak, a 4. ágba pedig a fél- és előgerinchúrosok peroxidazinjainak második csoportja tartozik (1. ábra).
A gerincesek peroxidazinjai az 5. ágba tartoznak, ezek további két ágra oszthatók, 1-es és 2-es típusú peroxidazinokra. Köztük is pontosan elkülönülnek a halak, kétéltűek, madarak és emlősök fehérjéi. A humán genom háromféle peroxidazint kódol, melyek közül a 3. majdnem teljesen megegyezik a másodikkal, ezeket szokták vaskuláris peroxidázoknak is nevezni (VPO1).
(összefoglalóan lsd. Soudi M., et al., 2012)
|
1. ábra: Peroxidazin szerkezete az egyes fejlődési ágakban |
Struktúra
A peroxidazin egy szekretált fehérje, mely peroxidáz és extracelluláris mátrix fehérje funkciókat is mutat (Tindall A. J., et al., 2005). Több doménből épül fel. A mátrix proteinekre jellemző alkotói a kezdő szignál peptid, a C-típusú von Willebrand factor, leucinban gazdag domének, és immunglobulin domének (Brandes R. P., 2011). Csupán egyetlen enzimatikus tulajdonságokkal rendelkező domént tartalmaz, ez a hem-peroxidáz domén (Soudi M., et al., 2012). (1. ábra)
Szignál peptid
Hidrofób tulajdonságú. A fehérje N-terminális végén található, a leucinban gazdag domének után.
(összefoglalóan lsd. Nelson R. E., et al., 1994)
Leucinban gazdag domén (LRR-leucine-rich repeat)
A homofil és heterofil fehérje-fehérje interakciókban (Péterfi Z., et al., 2009) vesznek részt (pl.: sejtkapcsolatok, immunválasz). A peroxidazinokban megtalálható típusa szolenoid felépítést mutat, az egyes fordulatok 20-30 aminosavból állnak. A konkáv fele β-redőzött, a konvex fele pedig α-hélix, poliprolin II és β-kanyar konformációkat tartalmaz. A hidrofób váz szoros struktúrát alkot a szolenoid belsejében (Soudi M., et al., 2012).
Immunglobulin domén
A peroxidazinokat immunglobulin domén tartalmuk miatt a heterogén immunglobulinok főcsaládjába is lehet sorolni. Az immunglobulinok konstans és variábilis doménből állnak. A peroxidazinok Ig doménje az IMGT (International ImMunoGeneTics Information System) szerinti besorolás alapján a C-szerű Ig domének közé tartozik (nem immunglobulin vagy T-sejt receptor fehérjék) (Soudi M., et al., 2012).
Alapvetően a sejtkapcsolatokért és a minta felismerésért felelősek (Soudi M., et al., 2012). A leucinban gazdag doménekkel egy fehérjében való megjelenésük igen ritkaságnak számít (Péterfi Z., et al., 2009).
C-típusú von Willebrand faktor
Körülbelül 60-80 aminosavból álló fehérje, meghatározó része egy 10 ciszteinből álló egység. A neve egy vér glycoproteintől származik, mely a véralvadásban játszik szerepet. A peroxidazinban található egység a C-terminálison található, az extracelluláris mátrixban található ciszteinben gazdag fehérjékhez hasonlatos.
Leggyakoribb funkciói a csont morfogenetikus fehérjék kötése és szabályozása, és a β- szövet növekedési faktor átalakítása.
Két aldoménből épül fel, melyeket egy rövid kapcsoló rész köt össze. A C-terminális aldomén szabálytalan, rugalmas struktúrájú, míg az N-terminális aldomén két dupla fonalú antiparallel lefutású β-redőből áll.
(összefoglalóan lsd. Soudi M., et al., 2012)
Hem domén
A peroxidazin enzimatikus, peroxidáz típusú egysége. Mind funkcionálisan, mind strukturálisan elengedhetetlen része a fehérjének. A peroxidázok másodlagos struktúrájában egy hem-et tartalmazó váz található középen, melyet 5 α-hélix rész vesz körül.
A distalis és proximális hisztidinek az α-hélixekben találhatóak. A peroxidázokra jellemző és a peroxidazinokban is megtalálható fontosabb állandó egységek: a distális His-Arg pár, mely a H2O2 hasításban játszik szerepet; a szomszédos distalis His95 (Asp-His-Asp), az Asp94(2-es típusú peroxidazinokban nincs), melynek az észter-kötés létrehozásában; Asp96, melynek a Ca2+ kötésében van szerepe; proximális His az Asp-vel a hem-vas érzékenységet szabályozza.
(összefoglalóan lsd. Soudi M., et al., 2012)
Élettani szerepe
A peroxidazin fehérjék élettani hatásai már régóta foglalkoztatják a kutatókat, ennek ellenére kevés in vivo, azaz élő szervezetben végzett kísérlet eredményéről tudunk.
Ha csak a szerkezetét figyeljük meg, enzim doméneket (tartományokat) tartalmaz, ezért feltételezhetően enzim funkciókat is ellát. Elsősorban oxidációs folyamatokban vesz rész, ahol 1 vagy 2 elektron vándorol a reakcióban. Katalizál például hipotalamicus savak és hypotiocanát termékeket, amelyek hidrogén-peroxid (H2O2) és halogén tartalmú savakból keletkeznek (Soudi M., et al., 2012).
Immunológia
Gerincshúrosok a peroxidazin fehérjék veleszületett (öröklött) immunvédelmi funkciót látnak el. Ezek a fehérjék szemcsékben tárolódnak eosinophil- és neutrophil granulocytákban. Gyulladás vagy valamilyen kórokozó megjelenésekor ezek a granulocyták aktiválódnak és lactoperoxidazint szekretálnak, amely sejten kívüli bakteriális hatóanyagként funkcionál az immunvédekezésben (Soudi M., et al., 2012).
Extracellulátis mátrix
A peroxidazin fehérjék részt vesznek az extracelluláris mátrix és a sejtek közötti adhézió kialakításban, elsősorban gerinchúrosokban. Emlősökben azonban kimutatták, hogy a kationt tartalmazó peroxidazinok extracelluláris oxidánsokat termelnek, amelyek védő és károsító hatásúak az extracelluláris mátrixra nézve. A peroxidazin fehérjék tartalmaznak olyan proteonektineket, amelyek, mint metalloenzimek, elősegítik a sejt és extracelluláris mátrix közötti adhéziót. Az extracelluláris mátrixban azonban nem csak egy, hanem többféle funkciót betöltő peroxidazint fedeztek fel. A CelPxd02-nek nevezett peroxidazin fehérje gátló hatással bír a Caenorhabditis elegansban (fonálféregben) az axonok (idegsejtek nyúlványok) a regenerációjára (Soudi M., et al., 2012).
A Drosophila melanogasterben 1994-ben először kimutatott peroxidazin fehérjék szerepe hasonló az ízeltlábúakban megtalálható hemo- és plasmacytáékkal. A hemocyták funkciója megegyezik a neutrophyl granulocyátékkal, tehát olyan sejtek, amelyek bekebelezik a szervezet számára idegen és elpusztult sejteket. A bekebelezés után a hemocyta áthelyezi ezeket a sejteket az extracelluláris mátrixba. Ez a felfedezés rendkívül fontos, hisz a peroxidazin fehérjéket molekuláris markerként (jelölőként) is tudják hasznosítani a korai hemocyták vizsgálatánál. A korai hemocytáknak pedig kiemelkedő szerepe van a hasi idegköteg kialakításában. Ha a hemocyták mozgása akadályozott, akkor az extracelluláris mátrix anyagainak áramlása nem történik meg, így a hasi idegköteg kialakulása is megakad. A Xenophus tropicalisban szintén fejlődésbéli feladatot látnak el, amely során a farok növekedését serkentik (Soudi M., et al., 2012).
Fejlődésben játszott szerep
A közelmúltban fedezték fel, hogy egyes élőlények fejlődésében (morfogenesisben) nélkülözhetetlen a peroxidazin, mert az epidermális izomi összeköttetések és a postembrionális alaphártya kialakítását végzik.
Apoptózis-Programozott sejthalál
A humán kutatások során fény derült arra, hogy a peroxidazin fehérjéknek köze van az apoptózis (programozott sejthalál) létrehozásában. A hsPxd01 az mRNSben található meg, viszont létezik egy rövidebb formája is a molekulának, ami sejtek apoptózisát indukálja az emberi vastagbélben. Ennek oka a rövidebb mRNS szerkezetében rejlik, mert itt az mRNS-ben hiányzik a szignál fehérje. A hiány miatt a fehérje felhalmozódik a citoplazmában, ezzel növelve a sejtben termelődő ROS-t (Reactive Oxydative Species). A ROS erőteljesen gátló hatású a tumorsejtekben található suppressor fehérjékre, így az apoptózisra serkentőleg hat. De mindez még csak feltételezés (Soudi M., et al., 2012). A ROS egyéb kutatások szerint hat a simaizomsejt proliferációra (sejt-szaporodásra) és az extracelluláris mátrix kialakítására is. A megnövekedett ROS produkció hozzájárul a hypertenzió (értágulat), restenózis (érszűkület) és arteriosclerosis (artéria elmeszedés) kialakulásához (Brandes R. P., 2011).
LDL bontás
A halogén aktivitású peroxidazinok vizsgálatakor kimutatták, hogy a hsPxd01-es kölcsönös viszonyban van az LDL bontással. (Low Density Lipoprotein = Alacsony Sűrűségű Lipoprotein, “rossz-kolesztein”) A hsPxd01 funkciója függ a NADPH oxidáz aktivitásától. A NADPH (nikotinamid-adenin-dinukleotid-foszfát), amely egy olyan enzimkomplex, ami elektronszállítást végez (Soudi M., et al., 2012).
Sebgyógyulás, rákos sejtekben jelenléte
A hsPxd01-es peroxidazin megtalálható a myofirbroblastokban. A myofibroblastok olyan sejtek , amelyek sebgyógyuláskor jelennek meg, miközben a peroxidazin domént antimikrobiális funkció elvégzésére serkentik, miközben az egyéb domének részt vesznek az extracelluláris mátrix kialakításában. A hsPxd01-es sejtek változatosságát még növeli, hogy feltételezhetően patogén hatású is. Végül, de nem utolsó sorban a hsPxd01 felszabadul rákos sejtekben is. (Melanoma, mellrák és bélrák esetében a legjellemzőbb.)
(összefoglalóan lsd. Soudi M., et al., 2012)
Azonosítása, szerepe Drosophilában
A peroxidazint elsőként az ecetmuslincákban (Drosophila melanogaster) (3. ábra) mutatták ki. Embrionális koruktól egészen halálukig jelen van az állatok testében. A muslincákkal folytatott kísérletek során a kutatók azt vették górcső alá, hogy milyen szereppel bír a peroxidazin az embrionális fejlődés során. Jelentősége ezeknek a kísérleteknek abban rejlik, hogy genetikai állományuk nagyon hasonlít az emberi DNS-hez, így a humán kutatások számára is fontos információkkal szolgálnak.
Az ecetmuslincában található peroxidazin molekula igen nagyméretű (~500 kDa), három azonos egységből álló - úgynevezett trimer - molekula. Az immunválaszban résztvevő antigénekkel mutatják ki. A többi fehérjétől ülepítés, ioncserélés és elektroforézis útján választják el.
Már a korai embrionális fejlődés során megjelennek a peroxidazin-termelő sejtek – a hemocyták – a feji tájékon. Az enzim mind a hemocytákon belül, mind az emésztésért felelős sejtszervecskékben (fagoszómákban, lizoszómákban), mind a sejteken kívüli, extracelluláris térben aktív.
Ezen sejtek felelősek az extracelluláris mátrix termeléséért, a programozott sejthalálon átesett sejtek bekebelezéséért, illetve a kifejlett alakban az immunvédekezésért.
A peroxidazin mindezen funkciók ellátásában részt vesz. Az extracelluláris mátrixban csak késői stádiumban jelenik meg, a szöveteket elválasztó alaphártyák megjelenése után. Stabilizáló kötéseket alakít ki az egyes alkotók között (pl. kollagén, laminin). Kovalens kötéseket alakít ki makromolekulák között, mely az egyik legerősebb kémiai kötés, szerepe így igen jelentős.
A programozott sejthalál nagy jelentőséggel bír az embrionális fejlődés során, hisz így szabadul meg az embrió a számára szükségtelen sejtektől. A peroxidazint termelő hemocyták kebelezik be az elhalt sejteket, ezáltal biztosítva a következő sejtgenerációk számára a helyet.
A kifejlett állatokban nem csak a hemocyták rendelkeznek peroxidazin-aktivitással. A bélcsőben és a zsírszövetekben is mutattak ki az enzimből, sőt bizonyos eredmények azt sejtetik, hogy peroxidazin épül be az alaphártyákba, ahol megjelöli a bekebelezendő, öreg sejteket, ezáltal gyorsítva a fagocitózis folyamatát.
(összefoglalóan lsd. Nelson R. E., et al., 1994)
|
|
2. ábra: Nyugati karmos béka (Xenopus tropicalis) |
3. ábra: Ecetmuslinca (Drosophila melanogaster) |
Azonosítása gerincesekben
Azonosítása, szerepe Xenopus tropicalisban
A nyugati karmos béka (Xenopus tropicalis) (2. ábra) egy Dél-Afrikában őshonos kétéltű faj. Számos kutatást végeznek az állatokkal, hiszen genetikai állománya nagyon hasonlít az emberéhez, és emellett jól tűri mind a jelentős génmódosításokat, mind a nagy koncentrációjú hatóanyagokkal elvégzett biokémiai kísérleteket, így lehetőség nyílik egyes élettani, kórélettani folyamatok élő szervezetben történő megfigyelésére.
Az emberi thyroid peroxidáz enzim DNS-szekvenciáját felhasználva keresték fel a peroxidazint kódoló gént a béka génállományában. A karmos békában talált gén fejlődéstanilag az emberi és az ecetmuslincákban található gén között helyezkedik el. Szoros rokonságot mutat a humán peroxidazin molekulával: az egyezés 84%-os. Ez arra enged következtetni, hogy a gén erősen konzerválódott az evolúció során.
A peroxidazin már a megtermékenyített petesejtben is megjelenik. Koncentrációja magas a korai embrionális fejlődés során. Megfigyelhető a fejlődő idegrendszerben, a farok-formáló régióban és a fejlődő vesében. Valószínűleg részt vesz a vesecsatornácskák kialakításában, azáltal, hogy átrendezi az extracelluláris mátrixot. Később szerepet játszik a szem fejlődésében, különös tekintettel a szemlencse kialakulására. A postembrionális korban egyre több helyen található meg, főleg az agyvelőben és a vesében marad koncentrációja jelentős. Feltételezik, hogy szerepet játszik a vese méregtelenítő funkcióiban, jelentősége így igen nagy az állat élete folyamán.
(összefoglalóan lsd. Tindall A. J., et al., 2005)
Azonosítása, szerepe emberben
Emberben a peroxidazin két válfaja jelent meg, melyek neve vascular peroxidae 1 (VPO1) és vascular peroxidase 2 (VPO2) (Soudi M., et al., 2012). Szerepük jelenleg tisztázatlan, ám az eddigi kutatások két fő területre világítanak rá, ahol komoly szerepet játszhat, ám a pontos mechanizmusok még tisztázatlanok.
A VPO1 szerepet játszik a simaizomsejtek osztódásában. Elválasztását több faktor is befolyásolja, többek között a vesében termelődő hormon, az angiotensin II, mely a vérnyomás emelkedés kialakításáért felelős (Brandes R. P., 2011).
Kimutatták, hogy szerepe van a vese fibrosisának kialakításában (Péterfi Z., et al., 2009), és különösen nagy koncentrációban van jelen a bőr, illetve a tüdő kötőszöveti sejtjeiben (Péterfi Z., et al., 2009).
A VPO2-t gyakran szív-peroxidázként is emlegetik, ugyanis főleg a szívizomban van jelen. Szerepe egyelőre tisztázatlan (Soudi M. et al., 2012).
Irodalomjegyzék
Brandes R. P.: Vascular perocidase 1/peroxidasin: a complex protein with a simple function? Cardiovascular Research 91:1-2, 2011 Többet szeretnél tudni? Olvasd ezt!
Nelson R. E., Fessler L. I., Takagi Y., Blumber B., Keene D. R., Olson P. F., Parker C. G., Fessler J. H.: Peroxidasin: a novel enzyme-matrix protein of Drosophila development. The EMBO Journal 13:(15) 3438-3447, 1994 Többet szeretnél tudni? Olvasd ezt!
Péterfi Z., Donkó Á., Orient A., Sum A., Prókai Á., Molnár B., Veréb Z., Rajnavölgyi É., Kovács K. J., Müller V., Szabó A. J., Geiszt M.: Peroxidasin is secreted and incorporated into the extracellular matrix of myofibroblasts and fibrotic kidney. The American Journal of Pathology 175:(2) 725-735, 2009 Többet szeretnél tudni? Olvasd ezt!
Soudi M., Zamocky M., Jakopitsch C., Furtmüller P. G., Obinger C.: Molecular evolution, structure and function of peroxidasins. Chemistry & Biodiversity 9:1776-1793, 2012 Többet szeretnél tudni? Olvasd ezt!
Tindall A. J., Pownall M. E., Morris I. D., Isaacs H. V.: Xenopus tropicalis peroxidasin gene is expressed within the developing neural tube and pronephric kidney. Developmental Dynamics 232:377-384, 2005 Többet szeretnél tudni? Olvasd ezt!