RNS készítmények a tumorterápiában
Contents
Bevezetés
Az orvostudomány fejlődésével egyre szélesebb körben ismerjük meg az egyes tumor eredetű megbetegedéseket, ezzel együtt egyre hatékonyabb lehetséges kezelési módszerek látnak napvilágot. A napjainkban alkalmazott klasszikus daganatterápiák röviden összegezve három kategóriába sorolhatók. Ezek a műtéti eltávolítás, a sugár kezelés, valamint a kemoterápia, illetve ezek különböző mértékű ötvözése. Mára a hagyományos cytotoxicus kemoterápiás módszerek mellett a hormon- valamint az immunterápia is egyre nagyobb teret hódít. Ezt a palettát szélesíthetik az alább ismertetett különböző ribonukleinsav alapú technológiák is. Ezek javarészt a génelnémítás különböző módszereit használják fel. Az alább ismertetett RNS technológiák közé tartoznak az RNS interferenciát kihasználó siRNS-ek, a miRNS-ek, illetve a diagnosztikában alkalmazható circRNS-ek, valamint az RNS alapú immunterápás módszerek. Célunk az ilyen irányú tanulmányok egy helyen történő összefoglalása a könnyebb tájékozódás érdekében.
RNSi kis interferáló RNS-ek által
Az RNS interferencia
Az RNS interferencia (RNSi) tényét Wingard (1928) tanulmánya óta ismerjük, mely lényege abban mutatkozik meg, hogy bizonyos RNS-ek egyes gének kifejeződését akadályozzák meg (Zamore és mtsai, 2000). Ennek eukarióta sejtekben a különböző vírusfertőzések elleni védekezésben van igen fontos szerepe. Ugyanis a sejtbe kerülő (vagy a vírusok eklipszisében intermedierként kialakuló) dsRNS-ek igen erős RNáz aktivitást váltanak ki a sejtből. Az így fragmentált rövid duplaszálú RNS-eket nevezzük kis interferáló /small interfering/ RNS-eknek (siRNS). Az RNáz enzim (Dicer) kb. 20-25 bázispár hosszúságú fragmenteket hoz létre. Ezek a siRNS-ek egy komplexbe kapcsolódnak, melyet RISC-Loading-Complexnek (RLC) nevezzük, mely tartalmaz egy egy újabb Dicert (Dicer-2), valamint egy R2D2 fehérjét, melynek szerepe a duplaszálú RNS felismerése. A Dicer-2 szétválasztja a dsRNS-t, melyből az antiszensz szálat a complexhez csatlakozó argonauta enzim (Ago-2) köti meg. Az ily módon megváltozott komplexet RNS-Indukálta-Csendesítő-Complexnek /RNA-Induced-Silenting-Comlex/ (RISC) nevezzük (Tomare és Zamore, 2005). A RISC a beépülő antiszensz szállal a bázis párosítás szabálya szerinti komplementer mRNS-eket találja meg és az argonauta enzim hasítja, amint ez az 1. ábrán is látható. Ezzel a genom érintetlenül hagyása mellett, poszt-transzkripcionálisan csendesíti a gént.
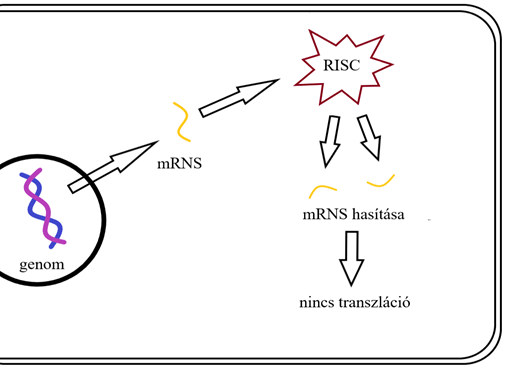
1. ábra: RNSi mechanizmusa sematikus rajza forrás: saját készítésű ábra
Ismeretes ennek a mechanizmusnak az amplifikációja is. Lipardi és munkatársai (2001) nyomán tudjuk, hogy siRNS antiszensz szála viselkedhet primerként és a kiválasztott mRNS-hez komplementer szálat szintetizál az RNS-dependens-RNS-polymeráz (RdRp). Az így létrejövő dsRNS-t hasítja a Dicer, így sok új rövid duplaszálú siRNS jön létre. És az is ismert, hogy önmagában az antiszensz siRNS is képes a RISC-be beépülni (Schwarz, 2002). A szimultán duplaszálú siRNS-sel és szimplaszálú antiszensz siRNS-sel kezelt sejtekben kompetíció alakul ki, ebből ismerhetjük fel, hogy ugyanaz a rendszer használja fel őket (Martinez és mtsai 2020). Ilyen exogén dsRNS nem csak virális eredetű lehet, mesterségesen is bejuttatható és ez jelenti az eljárásban rejlő potenciált.
A siRNS-ek bejuttatása
A kezelés sikerének egyik kulcsfontosságú eleme, hogy a szervezetbe juttatott siRNS-t megfelelő szállító rendszer szállítsa a kívánt szövethez és a sejtek citoplazmájába kerüljön. Ennek egyik legnagyobb hátránya, hogy az állati sejtek sejtmembránja a siRNS-ek számára nem, vagy csak csekély mértékben átjárható, illetve a vese nagyon hamar kiválasztja, így szükség van egy vektorra, ami a sejtbe juttatja. Erre a biofizika törvényei, valamint különböző carrier molekulák, lipidcseppek, illetve vírus vektorok felhasználása szolgáltathat megoldást. A hidrodinamikus injektálás azt használja ki, hogy ha elég nagy koncentrációban vannak jelen a siRNS-ek, akkor azt a sejt különösebb szállító komplexek nélkül is felveszi. Ezt az eljárást in vivo egerekben (Mus musculus) tesztelték, intravénásan a farok vénáiba nagy térfogatban kis időintervallum alatt juttatva (Song és mtsai, 2003) Ezen vizsgálatban szereplő egerek hepatocytáinak 90%-a vette fel a si-RNS-t. Humán terápiás használata aggályos. A siRNS sejtspecifikus ellenanyagokhoz kapcsolása nagyfokú affinitást és specificitást hordoz magában (Liu, 2007). A specifikus antitesttel konjugált liposzómába csomagolt siRNS a sejtmembránnal fuzionálva jut a cytoplazmába. Az eljárás működőképessége akut myeloid leukémiás (SKNO-1 és Kasami-1) sejtvonalakon nyert bizonyítást, mégpedig a siRNS-t tartalmazó liposzómához kapcsolt anti CD33 szimpla szálú változó fragment (scFv) segítségével, mely a myeloid leukémia markereként ismert CD33-at hordozó sejtekhez kötötte a liposzómát (Rothdiener és mtsai, (2010). A vírusok penetrációs stratégiái is kiaknázhatóak. Transzformált vírusvektor felhasználhatóvá válik a sejtbe juttatásra. A hosszantartó hatás elérése érdekében a retrovírusok vagy dependovírusok használata is nyújthat megoldást, ugyanis azok örökítőanyaga a genomba integrálódik. Garraway és munkatársai 2007-ben transzformált dependovírus törzset használva egereken fél éves géncsendesítést tudtak elérni csupán egyetlen kezeléssel. A leggyakoribb vírusvektorként az adenovírusokat használják, mely annak köszönhető, hogy viszonylag nagy genommal rendelkezik, széles körben elterjedt, számos szerotípusát detektálták, viszonylag könnyű transzformálni, illetve kis patogenitású kórókozók tartoznak közéjük (Vorurger és Hunt, 2002).
Géncsendesítő hatás fennállása
A kutatások bizonyították, hogy in vitro és in vivo kísérletekben is általában néhány napig érzékelhető a géncsendesítő hatás. Watanabe és kutatócsoportja által a 2007-ben publikált tanulmány alapján tudjuk, hogy újszülött patkány (Ratus ratus) szívizom sejtekben a géncsendesítés 7 nap után veszítette el a hatását. Különböző rágcsáló (Rodentia) állatmodellekbe juttatás esetén 5 napig volt érzékelhető a kívánt gén csendesítése 50%-os hatékonysággal (Cristoph, 2006). Zimmermann és munkatársai (2006) közönséges makákók (Macaca fascicularis) siRNS kezelését végezték el és kimutatták, hogy akár 11 napos hatás is kiváltható náluk. De mindez függ a célsejtek reprodukciós sebességétől, hisz a gyorsan osztódó sejtekben hamar hígul a siRNS koncentráció.
A siRNS kezelés lehetséges mellékhatásai
Egyes kutatások arra hívják fel a figyelmet, hogy a siRNS-ek használata folytán a kívánt gén csendesítésén kívül előidézhet aspecifikus gén elnémulásokat is. Ilyet figyeltek meg Yang és munkatársai (2000) ecetmuslica (Drosophila melanogaster) modellállaton végzett kutatásaikban. Az aspecifikus hatások elkerülése érdekében számos alapelvet szükséges figyelembe vennünk, melyeket Rácz (2012) összegez munkájában, ezek a következők: a kiválasztott szekvencia a startkodontól 50-100 bp távolságra legyen; a startkodonhoz közeli végen a le nem fordítódó szakaszt érdemes kihagyni, ez zavarhatja a RISC-et; a citozin és guanin tartalmat 30-70% között kell tartani; adeninnek vagy uracilnak kell lennie az antiszensz szál 5’ végén; a szensz szál 5’ végén pedig guanin vagy citozin legyen; 4 nukleotidnál hosszabb adeninben és/vagy uracilben gazdag szakasz az antiszensz szál 5’ végén; valamint hosszú guaninban és/vagy citozinban gazdag szakasz ne legyen a szensz szál 5’ végén.
Összegzés
Napjainkra már több sikeres siRNS által előidézett géncsendesítő eljárást alkalmaztak mind állat- mind pedig humán vonatkozásban. Hatalmas előnye az eljárásnak, hogy a szervezetbe juttatás módszerei igen sokrétűek és viszonylag könnyen kivitelezhetőek. Az aspecifikus gén expresszió gátlás pedig erősen kutatandó és ennek jövőbeni megoldása biztonságos rákterápiás lehetőségeket szül.
A miRNS-ek (microRNS) a tumorterápiában
A miRNS-ek
A humán genom nem fehérje kódoló részében, számos olyan szekvenciát találunk, melyek átíródásával biológiai folyamatokat szabályozó RNS molekulákat kapunk (Slack és Chinnaiyan, 2019). Ezek közé tartoznak a rövid, egy szálú, nem kódoló 22 nukleotidból álló miRNS-ek is. A miRNS-ek hatásukat posztranszkripcionálisan kifejtve szabályozzák a fehérje képződést, így fontos szerepük van a különböző onkogének gátlásában is.
A miRNS-ek érése és szabályozó mechanizmusa
A miRNS-ek transzkripcióját a sejtmagban az RNS polimeráz 2 végzi. A transzkripciót követően a molekula egy jellegzetes hajtű alakot vesz fel, amelyből egy 60 nukleotid hosszúságú pre-miRNS jön létre. A pre-miRNS a citoplazmába jut, ahol a Dicer enzim a molekula két végét levágva egy duplaszálú miRNS-t készít. Ez az Argonauta fehérjéhez kapcsolódik, melynek során a miRNS néma szála leválik, így a vezető szálból, vagyis a már érett miRNS-ből és az Argonauta fehérjéből együttesen a RISC (RNS-induced silencing complex) alakul ki. A RISC a mRNS (messenger RNS) 3’UTR-éhez (3’ untransleted region) kapcsolódva a mRNS elvágásával vagy a transzláció gátlásával fejti ki hatását (Slack és Chinnaiyan, 2019).
A miRNS-ek szerepe az agyalapi mirigy tumorkezelésében
Liang és munkatársai (2015) külömböző miRNS-ek PTTG1 (pituitary tumor transforming gene) ellenes hatását vizsgálták, amelyet egy újonnan felfedezett onkogénként tartanak számon. A PTTG1 fehérje a legtöbb szövetben kis koncentrációban megtalálható, azonban fokozott transzlációja többek között agyalapi mirigy, tüdő, máj és vasatgbél rákhoz vezethet. A kutatás során felfedeztek egy szabályozó rendszert a PTTG1, a p53 gén és bizonyos miRNS-ek kifejeződésében. P53 az egyik legjelentősebb tumorellenes gén, mely a sejtet ért stressz, például hypoxia, onkogén aktiválódás vagy feltekeredési zavar hatására jön működésbe. A miRNS-ek promóter régiójához kötődésével komoly szerepe van azok transzkripciójának serkentésében, és ezáltal a miRNS-ek onkogén szabályozó szerepének kiváltásában. Ugyanakkor a PTTG1 a p53-hoz kötődve képes transzkripciójának gátlására.
A szabályozásban részt vevő miRNS-ek
A kutatás során 10 miRNS PTTG1 ellenes hatását vizsgálták. Ezeket GH3 sejtekbe oltották, majd a PTTG1 fehérje mennyiségét qRT-PCR és Western blott segítségével mérték. 4 miRNS: miR-655, miR-300, miR-381 és miR-329 esetén kimutatható volt a PTTG1 expressziójának csökkenése (Linang és mtsai, 2015). Egy másik kísérletben a 4 miRNS mennyiségét 16 agyalapi mirigy tumor szöveten vizsgálva csökkent koncentrációt tapasztaltak, 4 normál agyalapi mirigy szövetmintával összevetve. MMQ és GH3 sejteket, valamint tumorhordozó kísérleti egereket a 4 miRNS mesterséges hasonmásával kezelve kimutatható volt azok in vitro és in vivo sejtosztódást gátló és a tumorsejtek életképességét csökkentő hatása a kontrollcsoportokhoz képest (Linang és mtsai, 2015). Ezen kívül bebizonyították a miRNS-ek a tumorsejt mozgásképességét csökkentő, valamint sejthalált előidéző funkcióját is (Linang és mtsai, 2015).
A miRNS – p53 – PTTG1 szabályozó rendszer
A kutatás során vizsgálták a PTTG1 miRNS-ekre gyakorolt hatását. GH3 és MMQ sejtekbe 3’UTR-t eltávolított PTTG1-et juttatak a 4 miRNS kíséretében, így elérték a PTTG1 nagymértékű kifejeződését. A sejtek életképességét, osztódását, halálát és migrációját figyelembe véve megállapították, hogy a fokozott PTTG1 érvényesülés visszaszorítja a miRNS-ek tumorellenes hatását (Linang és mtsai, 2015). A p53 – miRNS kapcsolatot vizsgálva, a p53 csökkent trnaszkripcióját elérve, a PTTG1-et célzó 4 miRNS transzkripciója ugyancsak alábbhagyott. Ezzel szemben, ha a GH3 sejtekben stresszt generáltak doxorubicin segítségével, az a p53-on keresztül emelkedett miRNS kifejeződést eredményezett (Linang és mtsai, 2015).
Összegzés
Az elvégzett kísérletekből megállapítható, hogy a p53 fokozza, míg az emelkedett PTTG1 kifejeződés visszaszorítja a vizsgált miRNS-ek onkogén ellenes hatását valamint, hogy csökkent p53 érvényesülés kisebb mértékű miRNS, így nagyobb mértékű PTTG1 transzkripciót eredményez (Linang és mtsai, 2015)
Tumorellenes immunterápia liposzómába oltott RNS-el
A tumorellenes kezelések egyik ígéretes kibontakozó ága a a liposzómába oltott tumor antitestet kódoló RNS alkalmazása, melyet vakcina formájában a szervezetbe juttatva immunterápiás hatást érhetünk el (Sayour és munkatársai, 2018). Ennek hosszútávú alkalmazása megoldást jelenthet daganatos elváltozások megfékezésében.
A vakcina hatásmechanizmusa
A szervezetbe juttatott RNS-t a sejtek patogén felismerő receptorai és intracelluláris szenzorai detektálják, amely így serkenti a sejtben az 1-es típusú interferon termelődést. Az interferon megjelenésével az antigén prezentáló, ezen belül a dendrtitikus sejtek aktiválásával megindul azok B7-1 és B7-2 stimuláló, valamint az MHC I és II-es osztályába tartozó molekulák fokozott termelése. Ezek eljutva a T sejtekhez specifikus immunválaszt váltanak ki a bejuttatott tumorantigénnel szemben (Sayour és munkatársai, 2018).
A liposzóma mint szállító egység
A szállító liposzóma egység védelmi funkcióval bír, így biztosítva a sebezhető RNS megfelelő sejtekhez jutását. Felépítését tekintve amfipatikus lipid molekulákból áll, melyeknek poláros pozitív töltéssel bíró feje a külvilág, valamint a liposzóma középpontja felé, míg apoláros farki részei egymás felé néznek. A külső pozitív felszín képes a negatív töltésű RNS megkötésére. Az így kialakult komplexre az előzőekben vázolt következő réteget burkolva kialakul a már védelmet biztosító multilamelláris hordozó - RNS egység, melyben az RNS molekula, amint 2. ábra mutatja, a két réteg közé szorul. A felszíni töltés változtatásával és a lipid összetétellel szabályozható a liposzóma szervspecifikussága, így bizonyos módosításokkal célszövetei lehetnek bizonyos limfoid szervek (lép, máj), ezzel növelve a kezelés hatékonyságát (Sayour és munkatársai, 2018).
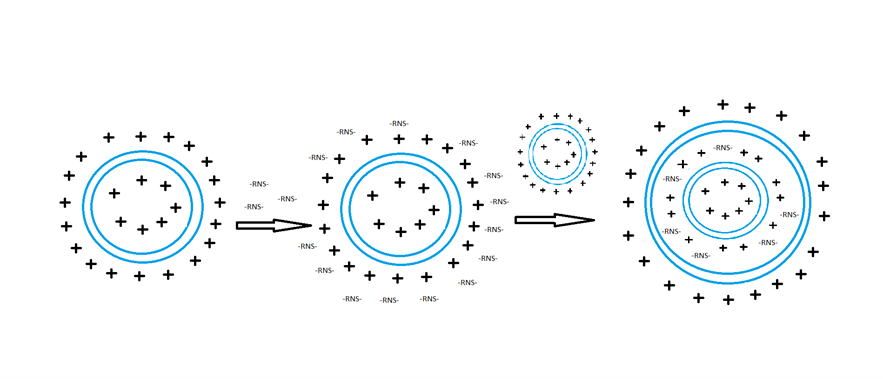
2. ábra (Sayour és munkatársai nyomán): A multilamelláris liposzóma előállítása
Összegzés
Habár a tumorellenes RNS immunterápia csak az immundrendszer hosszú stimulálása után válik hatékonnyá, további fejlesztésükkel potenciális daganat kezelési módszerré válhatnak (Sayour és munkatársai, 2018).
A cirkuláris RNS-ek, mint segítség a megértésben
A nem kódoló RNS-ek egyik nemrég felfedezett fajtája, a cirkuláris RNS-ek, tumorbiológiai szerepe még szinte alig feltérképezett, de folyamatos kutatás alatt áll. Egyes tulajdonságaik miatt viszont van jelentősségük a tumorbiológiában.
A cirkulásris RNS-ek bioszintézise és szerkezete
Nevükből is kiderül, hogy a többi RNS típusú molekulától szerkezetükben jelentősen eltérnek, cirkuláris szerkezetük miatt. Kialakulásukat legfőképp endogén és exogén hatásokkal értelmezhetjük. Az aktív génexpresszió végtermékeinek 5-20%-át teszik ki (Ebbesen és mtsai, 2017), exonokat ugyan tartalmaznak, de a fehérjeszintézisnek nem gyakori résztvevői. Körkörös formájukat egy egyszerű kovalnes kötésnek köszönhetik, mely a 3’ 5’ vég között jön létre (Ashwal-Fluss és mtsai, 2014). Bioszintézisük során ezt a folyamatot cirkularizálódásnak nevezzük, mely a spliceoszómán keresztül megy végbe. A spliceoszómák a pre-mRNS-en épülnek fel, endogén és exogén hatásokra, ezt a folyamatot nevezzük backsplicing-nak. A nem kódoló RNS-ek csoportjába tartozó cirkuláris RNS-ek, passzívan, de szabályozó szerepet töltenek be egyes gének expressziójában. Leginkább poszttranszkripciós módosítások végrehajtásában vesznek részt (Turai és Igaz, 2020).
A cirkuláris RNS-ek, mint microRNS szivacsok
Ahogy már az korábban is szóba került, a microRNS-eknek nem csak a génexpresszió finom szabályozásában van szerpük, hanem az onkogén ellenes hatásukat is felfedezték már. A nem kódoló RNS-ek együttműködése, vagyis szabályozó hálózataik még hatásosabbnak bizonyulhatnak a tumor szupresszióval kapcsolatban. Ugyanis egy nemrég beazonosított cirkuláris RNS-ről, a ciRS-7b nevűről kiderült, hogy a miR-7 inhibitoraként, szivacsaként viselkedhet, így a microRNS onkogén ellenes hatását felszínre hozva könnyebb lehet megérteni a tumor sejtek kialakulásáig vezető utat (Thomas és mtsai, 2013). Ahogy azt Thomas és munkatársai kimutatták, a ciRS-7 körkörös molekulának 90%-át egy 18 nukleotidos hexametrikus kiegészítő motívum teszi ki, mely a miR-7 célszekvenciája. Feltehetően a ciRS-7- nek ez lehet a legfontosabb funkciója, a jelenléte specifikussá teheti a microRNS-ek mRNS célpontjait. Ezzel együtt a ciRS-7 csökkenti a céltalannak tekintett folyamatok számát. Ezen kívül a microRNS-ek kevésbbé lesznek kitéve a hirtelen változásoknak expressziójuk során. Ez a fajta puffer hatása a circRNS-eknek biztonságot ad a microRNS-ek számára. Azt, hogy a két nem kódoló RNS kapcsolódása egyszer megszűnik-e, és mi lesz velük ennek következtében, ma még nem lehet tudni (Thomas és mtsai, 2013).
A cirkuláris RNS-ek biomarker szerepe a daganatdiagnosztikában
A cirkuláris RNS-ek nagy stabilitásuk, hosszú felezési idejük és szövetspecifiukus tulajdonságuk miatt alkalmazhatóak a klinikai diagnosztikában, azon belül is egyes betegségek nyomon követésében. Például a gyomorrák fejlődése esetén már kimutatták a circRNS-ek jelenlétét. Ezzel diagnosztikai markerekké és terápiás célpontokká váltak (Bo és mtsai, 2019). Ezen felül még vizsgálják a circRNS-ek vérben, illetve egyéb testfolyadékokban való jelenlétét. A kinyert folyadék pedig a folyadékbiopszia alkalmazását szolgálná, igy hozzájárulhatna a klinikai diagnosztika fejlődéséhez. Ezen felül a biomarker szerepüket a személyre szabott gyógyításban is alkalmazni lehetne (Turai és Igaz, 2020).
Tüdőrák és a cirkuláris RNS
Az egyik, még kutatás alatt álló kérdés a tüdőrák korai diagnózisa és a cirkuláris RNS kapcsolata. Mivel a világon a legtöbb elhalálozással járó rákos megbetegedés a tüdőrák (Williams és mtsai, 2014), ezért ez létfontosságú lehet a gyógyítás szempontjából. Friss kutatások szerint (Bo és mtsai, 2019) a cirkuláris RNS szerepet játszhat a tüdőrák kifejlődésében. Ezzel kapcsolatban az esetleges kutatások a későbbiekben majd nemcsak a diagnosztikai, hanem akár terápiás segítséghez is vezethetnek a betegség kezelésében. Kiderült, hogy a daganatos szövetekben fokozottabb volt a cirkuláris RNS expresszió, mint a szomszédos egézséges szövetek sejtjeiben. Nem csak a karcinális szövetekben, hanem a páciensek plazmájában is kimutatták a nem kódoló RNS-t. A cirkuláris RNS felthetőleg kapcsolatba hozható a nyirokcsomókra való daganatos áttéttel. Ez a felismerés tüdőrák korai diagnózisában és prognózisában nyújthat segítséget (Bo és mtsai, 2019). A cirkuláris RNS nem csak, mint biomarker, hanem mint microRNS szivacs is kapcsolatban állhat a tüdő daganatos megbetegedéseivel. Az ezért felelős gének aktivitását csökkenti, a miR-134 és hsa_circ_00113958 kapcsolata (Sun és mtsai, 2016). Egy másik ehhez hasonló szivacs kapcsolat, circ-ITCH, miR-7 és miR-214 pedig az onkogén sejtek génexpresszióját gátolják, így indirekt módon csökketntik a sejtproliferizációt (Wan és mtsai, 2016).
Összegzés
Korábban a cirkuláris RNS-eket a splicing mechanizmus hibáinak vélték és egyetlen funkciójukat sem ismerték. Az azóta felfedezett funkcióik is még további magyarázatokat igényelnek hogy biztos állításokat lehessen megfogalmazni. Az mára már világossá vált, hogy a circRNS és microRNS szivacskapcsolatai indirekt módon hatással vannak a microRNS-ek által szabályozott gének expressziójára. Ez nem csak a cirkuláris RNS-ek megértését segítheti a későbbiekben, hanem a microRNS-ek működését is világosabbá teheti. A cirkuláris RNS-ek típusainak ismerete pedig a tumorgenezeissel összfüggésben segíthet majd a rák típusának korai beazonosításában. Az adott elváltozás továbbfejlődésekor a biomarker funkciójuk pedig nemcsak az egyes stádiumok felismerésében játszhatnak szerepet, hanem majd terápiás célpontként is szolgálhat (Bo és mtsai, 2019).
Konklúzió
A különböző ismertetett lehetséges terápiás módszerek mutatják, hogy az RNS alapú kezelések akár in vivo is felhasználhatóak, ezzel szélesítve mind a humán-, mind pedig az állatorvoslás palettáját. A siRNS-ek onkogén némító hatása már jól feltérképezett és a humán pácienseken is bizonyított, ellenben a nem specifikus géncsendesítések miatt még nem mondható ki teljes bizonyossággal az eljárás veszélytelensége, ezért további vizsgálatok szükségesek. A micro RNS-eket használó kezelések leírásánál ismertetett kísérlet egyértelmű bizonyítékot ad, hogy az eljárás hatékony onkogén ellenes terápiás célt szolgálhat a tumorterápiában. Az RNS-t szállító multilammelláris liposzóma mediálta immunterápia specificitása miatt kiváló kezelési lehetőséget jelenthet, de még az eljárás további kutatásokat kíván. A cirkularis RNS-ek génexpressziót szabályozó szerepe a jövőben terápiás lehetőségként mutatkozhat meg valamint a circRNS fontos rák diagnosztikai elemmé válhat. Ezen technológiák széleskörű használata lényegében változtathatja meg a tumoros kórképek lefolyását. Egyértelmű előnye, hogy a kezelt szervezetre nézve sokkal kisebb mellékhatást fejtenek ki, mint a hagyományos cytotoxicus módszerek. Ám fontos hangsúlyozni, hogy az ilyen terápiák ma még erősen kutatandók és felvetnek mind morális, mind etikai kérdéseket egyaránt.
Irodalomjegyzék
Astwal-Fluss; Meyer M; Pamudurti NR (2014): circRNA biogenesis competes with pre-mRNA splicing. Mol Cell 56:55-66
Bo L; Zhiqiang T; Weiping F; Bing N (2019): Circular RNA: a novel biomarker and therapeutic target for human cancer. International Journal of Medical Sciences 16(2): 292-301
Bushra Tabassum, Idrees Ahmad Nasir, Usman Aslam and Tayyab Husnain (2012): How RNA Interference Combat Viruses in Plants, IntechOpen
Cristoph T; Grunweller A; Mika J; Schafer MK; Wade EJ; Weihe E; Erdmann VA; Frank R; Gillen C; Kurreck B (2006): Silencing of vanilloid reseptor TRPV1 by RNAi reduces neuropathic and visceral pain in vivo. Biochem Biophys Res Commun.;350:238- 243.
Ebbsen KK; Hansen TB; Kjems J (2017): Insights into circular RNA biology. RNA Biol. 14:1035-1045
Garraway SM; Xu Q; Inturrisi CE (2007): Design and evaluation of small interfering RNAs that target expression of the N-methyl-D-aspartate receptor NR1 subunit gene in the spinal cord dorsal horn. J Pharmacol Exp Ther.;322:982–988.
Liang HQ; Wang RJ; Diao CF; Li JW; Su JL; Zhang S (2015): The PTTG1-targeting miRNAs miR-329, miR-300, miR-381, and miR-655 inhibit pituitary tumor cell tumorigenesis and are involved in a p53/PTTG1 regulation feedback loop. Oncotarget. 6: (30) 29413-29427
Lipardi C; Wei Q; Paterson B M (2001): RNAi as random degradative PCR. siRNA primers convert mRNA into dsRNAs that are degraded to generate new siRNAsCell, 107, pp. 297-307
Liu B (2007): Exploring cell type-specific internalizing antibodies for targeted delivery of siRNA. Brief Funct Genomic Proteomic.;6:112-119.
Martinez J; Patkaniowska A; Urlaub H; Lühmann R; Tuschl T (2002): Single-stranded antisense siRNA guide target RNA cleavage in RNAi. Cell.;110:563-574.
Rácz Zs. (2012): Vese génterápia (RNSi) és lupus nephritis IVIG kezelésének mellékhatás-vizsgálata egérmodellen. Doktori disszertáció.
Rothdiener M; Muller D; Castro PD; Scholz A; Schwemmlein M; Fey G; Heidenreich Ov Kontermann RE (2010): Targeted delivery of SiRNA to CD33-positive tumor cells with liposomal carrier systems. J Control Release.;144:251-258.
Sayour EJ; Mendez-Gomez HR; Mitchel DA (2018): Cancer Vaccine Immunotherapy with RNA-Loaded Liposomes. Int J Mol Sci. 19: (10) 2890.
Schwarz DS; Hutvágner G; Haley B; Zamore PD (2002): Evidence that siRNA function as guides, not primers, in the Drosophila and human RNAi pathways. Mol Cell.;10:537-548.
Slack FJ; Chinnaiyan AM (2019): The Role of Non-coding RNAs in Oncology. Cell 179: (5) 1033-1055
Song E; Lee SK; Wang J; Ince N; Ouyang N; Min J; Chen J; Shankar P; Lieberman J (2003): RNA interference targeting Fas protects mice from fulminant hepatitis. Nature Medicine.;9:347-351.
Sun CC; Li Sj; Li DJ (2016): Hsa-miR-134 supresses non-small cell lung cancer (NSCLC) development through down-regulation of CCND1. Oncotarget 7:35960-78
Thomas BH; Jorgen K; Christian KD (2013): Circular RNA and miR-7 in Cancer. Cancer Research 73(18):5609-12
Tomari Y; Zamore PD (2005): Perspective: machines for RNAi. Genes Dev.;19:517- 529.
Turai PI; Igaz P (2020): A cirkuláris ribonukleinsav és tumorbiológiai jelentősége. Orv Hetil. 160(11):403-412
Vorburger SA; Hunt KK (2002): Adenoviral gene therapy. The Oncologist.;7:46-59
Wan L; Zhang L; Fan K (2016): Circular RNA-ITCH Supresses Lung Cancer Proliferation via Inhibiting the Wnt /beta-Catein Pathway. Biomed Res Int. 2016:1579490
Watanabe A; Arai M; Yamazaki M; Koiabashi N; Wuytack F; Kurabayashi M (2004): Phospholamban ablation by RNA interference increases Ca2+ uptake into rat cardiac myocyte sarcoplasmic reticulum. J Mol Cell Cardiol.;37:691-698.
Williams CD; Gajra A; Ganti AK (2014): Use and impact of adjuvant chemotherapy in patiens with resected non-small cell lung cancer. Cancer 120:1939-47
Wingard SA (1928): Hosts and symptoms of ring spot, a virus disease of plants. J Agric Res.,37:127-153
Zamore PD; Tuschl T; Sharp P; Bartel DP (2000): RNAiDouble-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell.;101:25- 33.
Zimmermann TS; Lee AC; Akinc A; Bramlage B; Bumcrot D; Fedoruk MN; Harborth J; Heyes JA; Jeffs LB; John M; Judge AD; Lam K; McClintock K; Nechev LV; Palmer LR; Racie T; Rohl I; Seiffert S; Shanmugam S; Sood V; Soutschek J; Toudjarska I; Wheat AJ; Yaworski E; Zedalis W; Koteliansky V; Manoharan M; Vornlocher HP; MacLachan I (2006): RNAi mediated gene silencing in non-human primates. Nature.;441:111-114.
