|
Size: 23123
Comment:
|
Size: 23117
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 32: | Line 32: |
| {{attachment:sm_kul_tun_lef.png|Különböző lefolyási módok|align="left"}} | {{attachment:javitott.png|Különböző lefolyási módok|align="left"}} |
Demielinizációs folyamatok a Sclerosis Multiplex során
Contents
A sclerosis multiplex (SM) a központi idegrendszert, azaz a gerincvelőt és az agyat érintő, krónikus gyulladásos megbetegedés, amely 2,5 millió embert érint világszerte. A legveszélyeztetettebb korosztály a 15 és 40 év közötti nők. A betegséget először 1868-ban Jean-Martin Charcot dokumentálta. Lefolyása során a központi idegrendszer idegrostjait körülvevő mielinhüvely károsodik, ezáltal gyulladásos gócok (plakkok) képződnek. Méretük néhány milimétertől a több centiméteres összefolyt plakkokig terjedhet, melyek mérete diagnosztikai alapul szolgálhat a betegség stádiumának meghatározását illetően. A sérült mielinhüvely hamarosan a teljes idegrost károsodásához, funkciójának elvesztéséhez vezet. Ezenkívül többféle neurológia probléma kialakulásával is jár a betegség. A gyógykezelés a gyulladásos folyamatok csökkentésével, a demielinizációs folyamatok gátlásával, ezzel összefüggésben a remielinizáció megindításával képzelhető el hatékonyan, a betegség előrehaladottságát figyelembe véve több-kevesebb sikerrel. A jövő generációjának a feladatát képezi az őssejtterápia hatékony felhasználása a Sclerosis multiplex és oly sok más betegség gyógyításában is (1).
Betegség oka
A kutatások jelenlegi stádiuma szerint az SM kialakulásának hátterében autoimmun folyamatok állnak, amely során az egyed immunrendszere nem ismeri fel sajátjaként a cerebrális gliasejtek által létrehozott mielinhüvely MHC komlexét, ezáltal a cerebrális mielinprotein az immunreakciót kiváltó antigén szerepét tölti be. Az immunreakció kiindulhat T-sejt függő illetve antitestek által felerősített módon is. Az eredő okot a tudomány jelenleg is kutatja, feltételezvén több opciót, köztük vírusfertőzés lehetőségét is. Ezt a feltevést megerősíti, hogy mind az emberek, mind az állatok esetében kísérletesen indukálhatóak a demielinizációs folyamatok vírusfertőzés hatására. A betegség kialakulásában genetikai hajlam is szerepet játszhat, leggyakrabban a 15-40 év közötti korosztály az érintett. Kutatások bizonyították, hogy ezeknek a betegeknek az elsőfokú rokonainak körében 2-5%-al magasabb a megbetegedés kockázata, míg globálisan ez az előfordulási valószínűség csak 0,1%-ra tehető. Számos külső környezeti hatás véletlenszerű társulása, mint például táplálkozás, lakhely földrajzi elhelyezkedés, sugárzások, vírusos és bakteriális fertőzések gyakori fellépése, stresszhelyzetek, traumák vezethetnek a betegség kialakulásához. A kór lefolyásában számos gén szerepe bizonyított. A széles körű kutatások ellenére csupán a HLA-DR2 valamint a DQ6 haplotípus genetikai régiója mutatott kétségtelen összefüggést az sclerosis multiplexszel(2). Ezek a DNS-beli változások azonban nem érintik a nukleotidok szekvenciáját, csupán a metilációs mintázatban, a hiszton-fehérjék szerkezetében, továbbá az ún. miRNS-régió kikapcsolásában térnek el a normálistól (3).
A demielinizáció és háttere
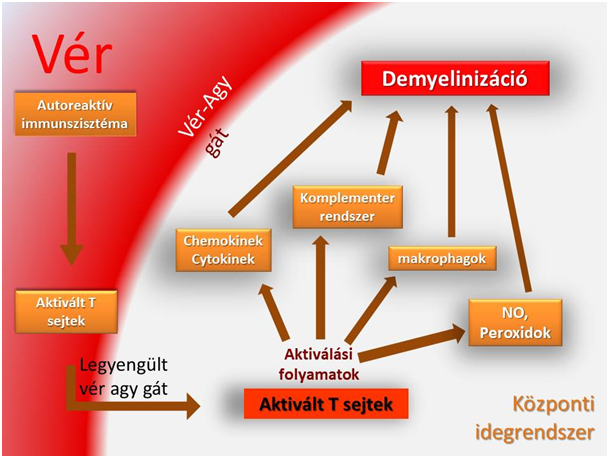
Az eredetileg lymphoid szövetet nem tartalmazó központi idegrendszert a vér-agy gát védi a vérben keringő nagyobb sejtek, molekulák idegszövetbe való jutásától. A gát sclerosis multiplexszel járó fellazulásával azonban mind a B és T lymphocyták bejutnak az idegszövetbe, ahol intra és intermolekuláris változásokat okozva kialakítják az SM-es kórképet. Az egészséges emberi szervezetben a hemato-encephalikus gát átjárhatatlan a vér illetve az immunsejtek számára, azonban SM-es betegek esetében az átteresztőképesség megnő. A vér-agy gátat az astrocyták alkotják főnyúlványaik végén lévő gliatalpaik szoros összekapcsolódásával. Ezen talpak közti nexusok és punktum adherensek felfedezése megdöntötte a korábban feltételezett hézagmentes, folyamatos réteget képző vér-agy gát meglétét. Mai tudásunk szerint a következő rétegek képzik a membrana limitans gliae perivascularist: endothel, membrana basalis, pericyta (nem minden esetben van) idegrendszer felőli membrana basalis. Az endothel sejtek közti zonula occludensek tovább erősítik a barriert. Az egység meglazulásában a kórosan önmaga ellen működő immunrendszer által keltett lokális gyulladási folyamatok játszhatnak szerepet, közreműködve az immunszisztéma valamennyi celluláris és humorális tagjával. Az átjutó lymphociták által az idegrendszerben elindított további degeneráló változások végső soron az idegrostok leépüléséhez, roncsolódásához és demielinizációjához vezetnek (4).
A velőshüvelyeket a központi gliasejt a periférás schwann sejtektől eltérő módon hozza létre, bioszintézise szigorúan szabályozott körülmények között zajlik. Az oligondendrocyták képesek a proteinek és lipidek, különösképp a szfingomielinek mielinhüvelyekhez való szállítására. Hosszabb nyúlványainak megvastagodott végével feltekeredett membránkettőzeteket alkot több idegsejt axonja körül. Így a degeneráció során egy oligodendrocytasejt puszulásával több rost is sérül. Membránkettőzetekről lévén szó, a mielinhüvely főbb komponense a lipidek és fehérjék közé sorolható, melyek fontos szerepet játszanak a mielinhüvely stabilizálásában, oligodendrociták differenciációjában (szignál-receptorok révén) és ezáltal a glia-axon kapcsolat kialakításában. A mielin 70-80%-át adják a lipid komponensek. Ezen állomány 25-30%-át a galaktoszfingolipidek és foszforilált származékai képzik. A legnagyobb számban előforduló fehérjék a PLP-k és MBP-k, melyek százalékos aránya 50-30%. Feladatuk, hogy stabilizálják a membránt a hüvelyben. Az MBP az intracelluláris, a PLP az extracelluláris térben való stabilizálást segíti. A mielinhez asszociált, immuno-globulin szupercsalád tagjaiként számontartott glükoproteinek (MAG) funkcióit még nem derítették fel, de kétségtelenül az axon és az oligodendrocyta között helyezkednek el, magában a mielinben. Ezen kívül az oligodendrocyta membránjában és a mielin nem kompakt részében jelenlévő 2,3 ciklikus nukleotid-3 foszfohidroláz (CNP) jelenléte is bizonyított (4).
A hanyatló folyamatokban az aktivált komplement rendszer, cytokinek, kemokinek, NO, peroxidok játszanak főszerepet (4). A természetes immunitás részeként működő komplementer rendszer faktorai nem csak lokálisan szintetizálódhatnak az idegrendszeri astrociták és mikrogliasejtek által, hanem a már fellazult vér-agy gáton keresztül is átjuthatnak. E rendszer tagjait C1-C9 jelöléssel azonosítják, ezen kívül a rendszer tagjaként említik még B illetve D plazmafehérjéket is. Az aktivációt megelőzően inaktív enzimekként keringenek a szervezetben, majd a megfelelő stimulus hatására a véralvadási kaszkádmechanizmushoz hasonlóan egymást aktiválják, végül a membránfúró megjelenéséhez vezető folyamatban a C9-es tagok összekapcsolódva létrehoznak egy csatornát, mely képes rést alakítani az antigénként kezelt membránon. A cytokinek, mint minden immunválasz lezajlásánál, itt is fontos szabályozó szerepet játszanak. Ezek a jelzőmolekulák megjelenésükkel befolyásolják a megfelelő receptorral rendelkező sejtek működését, szabályozzák a köztük lévő kommunikációt, szerepük van a gyulladásos folyamatok kialakulásában. Cytokinek közé soroljuk az interleukineket és az interferonokat is. Az SM kialakulásának antitestek által felerősített fajtájánál a fent említetteken kívül kimondottan mielin specifikus ellenagyag is kimutatható. A roncsolódott részeket a központi idegrendszer egyes, phagocitózisra képes mikroglia sejtjei, a Hortega sejtek takarítják el. Ezen mesodermális eredetű sejtek MPS rendszer tagjaként embrionális korban vándorolnak be a központi idegrendszerbe. Sejttestükben megtalálhatók a tipikusan az eltakarító apparástusra jellemző képletek: lizoszómák, phagoszómák vesiculák. Egyéb neurodegeneratív betegségeknél is jellemző, hogy számuk megnövekedik, osztódásukat kiváltó ideg- és gliasejtek pusztulásának eredményeként.
Lokális következmények
Az oligodendrocyták által létrehozott mielinhülvely roncsolódása ingerületvezetési problémákhoz vezet az ép rostokra jellemző szaltatórikus ingerületvezetés lehetetlenné tételével. A degenerálódott idegrostok felületét a szervezet kemény, sclerotikus támasztószövettel pótolja, melyek nagysága néhány milimétertől több cm-ig terjedhet viszont hosszabb idejű, előrehaladottabb esetekben óriási nagyságú összeolvadt degenerált területekről beszélhetünk. Maga a demielinizáció mellett a gyulladásos területek szélénél elkezdődhetnek a nagyon lassú remielinizációs folyamatok is. Ennél a stádiumnál a betegség reverzibilisnek mondható, a tünetek megszűnhetnek. A mielinhüvely elvesztése mellett viszont az idegrostok és sejtek másodlagos degenerációt szenvednek, ami már kétségtelenül irreverzibilis következményeket von maga után. Egyes kutatások szerint, ezen másodlagos neurodegeneratív folyamatok, ahol már ténylegesen az idegsejtek sérülnek, már a betegség kezdetén, a gyulladásos folyamatok megjelenése előtt megjelennek, valamint a betegség látszólagos inaktív stádiumában is zajlanak. Az axonvesztés és idegsejtpusztulás eredményeként fellépő gerincvelő atrófia, az agy állományának megkisebbedése, illetve az agykamrák tágulata mind diagnosztikai jellegű kórképeknek minősülnek.
Kutatások, kísérletek
Bár a sclerosis multiplex kizárólag humán megbetegedés, napjainkban a kutatók számos kísérletet folytatnak annak érdekében, hogy reprezentálják az SM során zajló folyamatokat. Egereken végzett kísérletekben, réz-kelát (cuprizone) által indukált demielinizáció lefolyását vizsgálták, mely során világossá vált, hogy a cuprizone jól látható szövettani elváltozásokat okozott a corpus callosumban. A folyamat kezdetén óriási mitokondriumok keletkeztek, melyet az oligodendrocyták apoptosisa, majd a kiterejedt demielinizáció követett. A cuprizone-indukált degeneráció során leginkább a 3-as típusú SM léziókat észlelték. Ez a típusú lézió abban különbözik az 1-es és 2-es típusútól, hogy nem a vénák körül alakul ki, határai kevésbé kiterjedtek. Leginkább a MAG mielin fehérje génexpressziójának a gátlása és nagyfokú oligodendrocyta apaotosisapoptosis jellemzi, csakúgy, mint a 4-es típusú léziót. Az 1-es és 2-es típusút az ellenanyag és makrofág mediált mielinhüvely eltűnés okozza. Mind a 4 típusban közös a T-sejtek és a makrofágok nagyfokú jelenléte a léziós területeken. Számos kísérletet végeztek a cuprizone indukált apostosis gátlására vonatkozóan, és a remielinizációs folyamat elősegítése érdekében is. Megfigyelték, hogy a 6 hetes cuprizone kezelés után minden esetben megindult a remielinizáció, viszont a 12 hetes kezelés után jóval lassabb mértékű volt e folyamat. Ezeken kívül bebizonyosodott a cuprizone serkentő hatása a poly-ADP-ribóz (PARP) nevű enzim corpus callosumban való működésére. A DNS károsodás felismerésében szerepet játszó PARP molekula túlaktiválódása a sejt pusztulásához vezet, továbbá ezen molekula felelős az apoptosis inducing faktor(AIF) mitokondriumból a magba történő átlépéséért is. Ebből következik, hogy a PARP gátlása kivédi a cuprizone demielinizációt serkentő hatásását. Ehhez a 4HQ nevű PARP enzim gátlót használták, ami mindemelett a corpus callosumban létrejövő AIF expresszió emelkedést is gátolja (5)(6).
A női nemi hormonok (17-béta-ösztradiol és progeszteron) jótékony hatása beigazolódni látszik a neurodegeneratív és neurotoxikus folyamatokra. Ezt a felvetést azok az epidemológiai felmérések is alátámasztják, amelyek szerint a többször szült nőkben, illetve a terhesség alatt a legtöbb esetben a tünetek remissziója következik be, valamint az a tény, hogy a több terhességen átesett nők kevésbé érintettek az SM által. A vizsgálatok azt az eredményt hozták, hogy a két női hormon együttes adagolása jelentősen csökkenti a corpus callosumban a demielinizációs folyamatokat, viszont a hormonok külön-külön adagolása esetén csak kis mértékű javulást dokumentáltak . Továbbá a mielint szintetizáló markerek (MBP,PLP) génexpressziójának vizsgálata során világossá vált, hogy a hormonok ebben is csökkentették a cuprizone markerek erre irányuló hatásait.
Az utóbbi évek kísérleteinek témája még a napfény és a sclerosis multiplex kialakulása közti összefüggés kutatása. Erre a témára az az adatokkal alátámasztott érdekes jelenség hívta fel több kutató figyelmét, miszerint a trópusi, melegebb és napfényesebb területeken kevesebb a sclerosis multiplexben szenvedők száma, mint például Észak-Amerikában vagy Európában. Először a napfény hatására termelődő D vitaminnak tulajdonítottak fontos szerepet e jótékony hatás kialakulásában, de ezt bizonyítani nem tudták. Végül egérkísérletek sorozata vezetett arra a következtetésre, miszerint nem az UV sugárzás hatására termelődő D vitamin a pozitív hatás okozója, hanem maga az UV sugárzás váltja ki a degeneráció folyamatok fékezését, illetve maga a betegség kialakulás esélyének csökkenését.
Tünetek és lefolyás
Mivel a sclerotikus gócok a központi idegrendszer egész területén kialakulhatnak, igen sokszámú szimptómát produkáló betegségről beszélhetünk. A tünetek kialakulása, lefolyása, erőssége egyedenként nagy változatosságot mutat. Csupán tünetekből nehéz a diagnózis felállítása, mivel a sclerosis multiplex gyakran más betegségre jellemző megjelenést produkál. Mint sok más kór esetében, itt is számos komorbiditás ismeretes. A myelopathia lokalizációjának és kiterjedésének függvényében károsodnak a gerincvelői idegi reflexívek afferens ágai. Egyéb neurológiai szimptómák is felléphetnek, mint például migrénes fejfájások, valamint a hólyagot beidegző efferens ágak károsodásának következtében fellépő inkontinencia. A leszálló szomatikus vagy vegetatív traktusok által közvetített artériás vasodilatáció hatékonyságának csökkenése kihat az erektilis szövetek funkcionálására is. Ezeken kívül a következő gyakori tünetek jelentkezhetnek: kettőslátás, hőérzékenység , izomgyengeség- és merevség (spaszticitás) zsibbadás, érzékkiesés, járászavar, egyensúlyvesztés, depresszió, fáradékonyság, elkent beszéd, szédülés, székelési zavarok, kognitív nehézségek . Tünetek megjelenésének és a lefolyásának intenzitása szerint négyféle Sclerosis multiplex típust különböztethetünk meg. Ezek a következők:
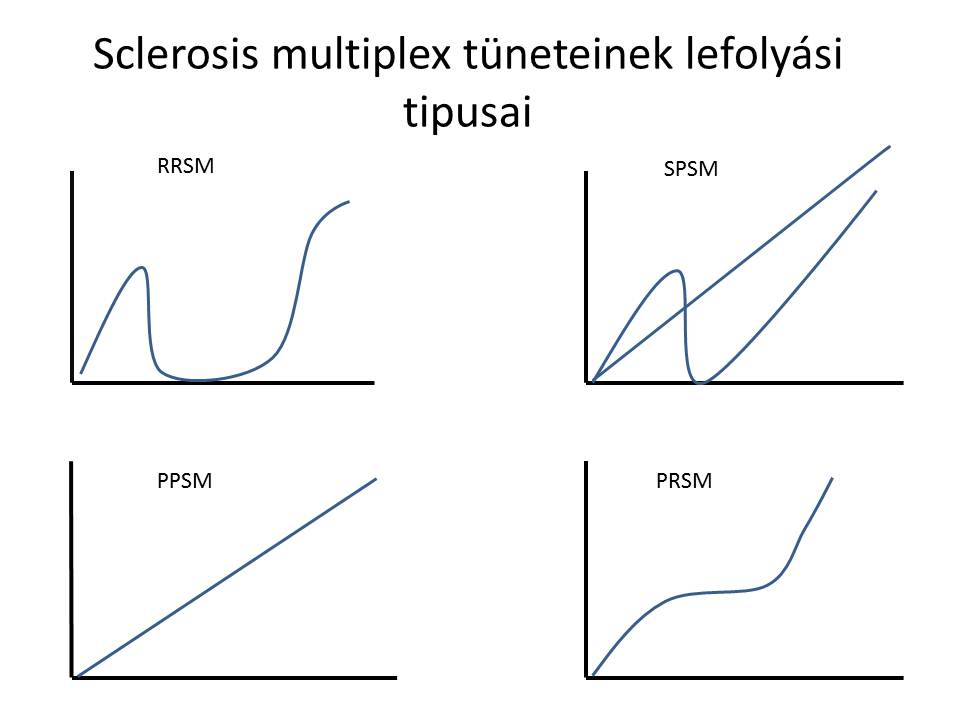
RRSM
Relapszáló-Remittáló Sclerosis Multiplex, mely a betegség kezdeti szakaszának megfelelő stádiumnak mondható. A frissen diagnosztizált betegek több mint a fele tartozik ebbe a csoportba. A tünetek megjelenése után akár több évig tartó tünetmentes időszak jellemző.
PPSM
Primer-Progresszív Sclerosis Multiplex, melyre a megjelenés kezdetétől fogva folyamatosan romló állapot a jellemző. A hanyatlás meredeksége egyénenként változó, a tünetmentesség nem jellemző.
SPSM
Secunder-Progresszív Sclerosis Multiplex esetén a jelentkező tünetek egy csoportjára mondható a remittáló, visszafejlődő stádium, míg a többi tünet folyamatos romlásban, esetleg hosszabb rövidebb stagnáló állapotban marad. E típust mondhatjuk az RRSM tünetmentes periódusa utáni visszaeső, (relapszus, shub) romló stádiumának is.
PRSM
Progresszív-Relapszáló Sclerosis Multiplex, amelybe a betegek csupán 5 % sorolható. A kezdetektől való folyamatos, egyenletes romlási folyamatot nagyon ritkán megszakíthatja kevés visszafejlődő stádium, de az eredeti állapot visszaállása nem jellemző.
x: első tünet megjelenése óta eltelt idő, y: a tünetek súlyossága (4)(7).
Diagnosztika
Az SM gyanús betegek diagnosztikáját neurológiai módszerekkel és pótlólagos vizsgálatokkal állítják fel. A betegség biztos megállapításához figyelembe kell venni a fent kifejtett krónikus, hullámszerű lefolyást, amely a tünetek időleges kiújulását és progresszióját jelentheti (relapsing-remitting mintázat). Mivel az SM kialakulásának okát még nem ismerjük, oki terápiát sem tudnak még alkalmazni az orvosok. Nincs egyetlen megbízható klinikai teszt sem a kór kimutatására, mégis az orvosok a leginfornatívabb vizsgálatnak az agy-gerincvelő mágneses rezonanciás tomográfiáját tartják párhuzamosan az oligoklonális immunglobulinok jelenlétének bizonyításával a betegek cerebrospinális folyadékában, illetve a vérplazmájában. A vizsgálat alapját a lumbálpunkció (gerinccsapolás) adja, mely során a folyadék konzisztenciáját kétféleképpen határozhatjuk meg: agaróz-gélen futtatott elektroforézissel (Coomassie Brilliant Blue festés) és ezüst festéssel. Ezeket az oligoklonális immunglobulinokat a vérplazma sejtjei szekretálják, ám a pontos metódus és eredet nem tisztázott. Egészséges szervezetben efféle immunglobulinok nem jelennek meg a központi idegrendszerben, ám a Sclerosis Multiplexes betegek esetében ez az elváltozás diagnosztikai értékű, mivel a betegségben szenvedők 79-90%-nál folyamatosan jelen vannak. Egy ilyen csoport (ún. monoklonális immunglobulin) jelenléte nem feltétlenül utal krónikus gyulladásra, mivel egy esetleges lymphoproliferáció is okozhatja, azonban több ágens feltűnése már előrevetítheti a központi idegrendszer megbetegedését. A betegség elmúltával ezeknek az immunglobulinoknak a koncentrációja jelentősen csökken.
Gyógymód
Jelenleg nem létezik specifikus gyógymód erre a betegségre, azonban számos kutatás folyik világszerte ennek érdekében. Nagyon ritkán léteznek az úgynevezett benignus, enyhe lefolyású esetek, ahol akár 8-12 év terápia nélküli időszakot követően is csak enyhe panaszokat észlelnek az SM-es betegek. Frissen diagnosztizált betegeknek javasolt a mielőbbi terápia megkezdése, ugyanis hosszú távú gyógykezeléssel a betegség elfajulása féken tartható. Napjainkban leggyakrabban a dexamethasonnal (DX) végzett glükokortikoid kezelés bizonyult a legoptimálisabb megoldásnak, viszont a glükokortikoid kezelésnél ismeretes mellékhatásokkal számolva ez a kezelésmód a betegek életminőségének javításában vesz részt, nem pedig a tényleges megbetegedés specifikus gyógyításában. DX alkalmazása indukálja a T sejtek apoptosisát valamint protektív hatást fejt ki a vér-agy gátra. Az immunválasz részleges, vagy teljes elnyomása, illetve szabályozása viszont nem elegendő, továbbá a központi idegrendszer károsodásának regenerációja sem teljesen kivitelezhető. További immunelnyomásos, illetve immun-modulációs terápiák közül az intravénásan adagolt metil-prednisolone is használatos, ami az előrehaladás késleltetésére alkalmas. Ez a módszer azonban csak a betegség gyulladásos komponensének kezeléséhez elegendő. Az autoimmun betegségek kezelése két lépésben történik: a saját szervezet ellen dolgozó lymphocyták irtása és a tolerancia indukálása, valamint a már károsodott régiók regenerációjára irányuló beavatkozások alkalmazása. Léteznek olyan páciensek is, akiknek szervezete a gyógykezelést megkezdve termelni kezdi a gyógyszerellenes immunglobulinokat, melyek akadályozzák a gyógyszerek hatását. Tehát ezen immunglobulinok vérben való jelenlétének kimutatása esetén gyógyszerváltás szükséges. A sclerosis multiplex esetében a spontán remielinizációs folyamatokat kell facilitálni és ezzel párhuzamosan a demielinizáció okozta neurológiai problémákat orvosolni. Eddigi tapasztalatok szerint mégis a sejtterápia bizonyul a legracionálisabb megoldásnak, így a mesenchymalis vagy a csontvelőből származó őssejtek transzplantációja. Ez utóbbi azonban csupán a relapszáló-remittáló típusú Sclerosis-os betegeknél alkalmazható, és leghatékonyabban a korai fázisban (7). A humán köldökzsinórból származó mesenchymális őssejteknek a szervezetbe juttatása nagymértékben hozzájárul a perivasculáris immun-sejt migrációk elnyomásához, valamint a gerincvelőben bekövetkező demielinizációs és axonroncsoló folyamatok csökkenéséhez. Számos, az idegrendszer megbetegedésével járó kórok esetén alkalmazva érhetünk el bíztató eredményeket e kezeléssel, mivel a keletkezett gyulladásos folyamatot csökkentő, illetve a szervezet idegsejtjeinek védelmét szolgáló molekulák felszabadulása figyelhető meg a terápiát követően. Mindezek ellenére jelenleg nem ismerjük a kezelés minden hatását és mellékhatását, ezért az őssejt terápiával kapcsolatos kutatások jelenleg is zajlanak(1).
Hivatkozások
1. Institute of Cell Therapy, Ukraine
2. Myhr KM., Harbo HF., Haukeland Universitetssykehus, Berge, Norway, 2003
5. Matsushima GK, Morell P., Brain Pathology, 2001 Jan;11(1):107-16.
7. Anlar O., Neurology Department, Ataturk Educational Hospital, Ankara, Turkey, 2009
