|
Size: 24321
Comment:
|
Size: 24325
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 4: | Line 4: |
| <<TableOfContents(7)>> | <<TableOfContents(1)>> |
| Line 11: | Line 11: |
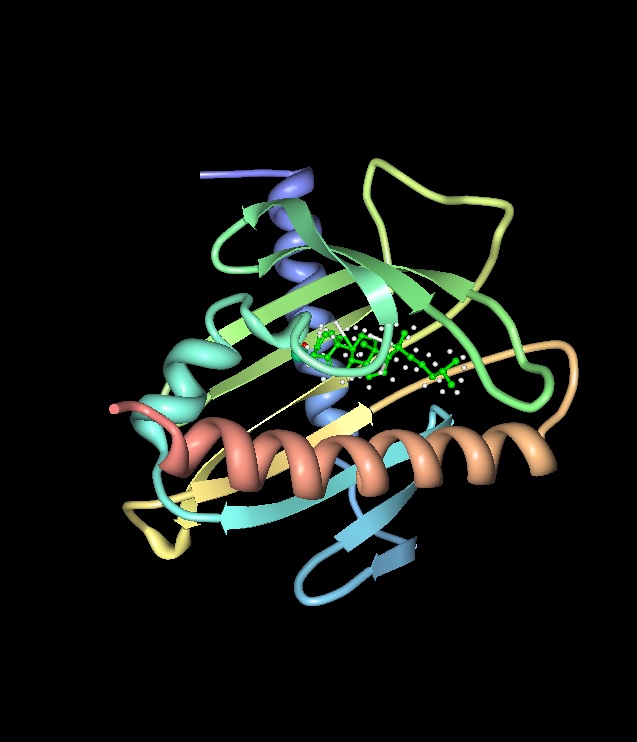
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:A StAR protein.jpg|A StAR protein}} <<BR>>'''1. Ábra'''<<BR>>''A StAR protein szerkezete'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:A StAR protein.jpg|A StAR protein}} <<BR>>'''1. Ábra'''<<BR>>''A StAR protein szerkezete'' || |
| Line 30: | Line 30: |
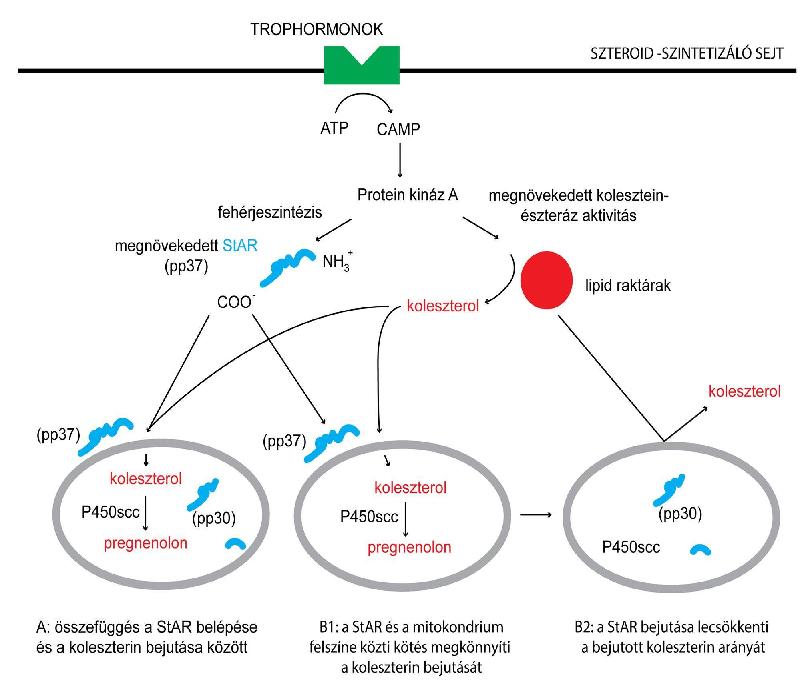
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:A StAR protein működéseUJ.jpg|A StAR protein működése}} <<BR>>'''1. Ábra'''<<BR>>''A StAR protein működése (Készítette: Kovács Andrea)'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:A StAR protein működéseUJ.jpg|A StAR protein működése}} <<BR>>'''1. Ábra'''<<BR>>''A StAR protein működése (Készítette: Kovács Andrea)'' || |
A StAR protein működése
Contents
1. Bevezetés
A szervezetben az endokrin szabályozásért többek között számos szteroid hormon felelős. Ezen szteroid hormonok szintéziséhez koleszterinre van szüksége az egyes sejteknek. A szintézis kezdeti, univerzális lépése (koleszterinből-pregnenolon átalakulás) a sejt mitokondriumán belül zajlik le. Ehhez a koleszterint be kell juttatni a sejt mitokondriumába, valamint azon belül szállítani kell azt a belső mitokondriális membrán mátrix felőli oldalán lokalizálódó 20,22-dezmoláz, más néven oldallánc hasító enzimhez (P450scc). A StAR protein (Steroidogenic acute regulatory protein), azaz a ”Szteroidképző kritikus szabályozó fehérje” lesz a koleszterin szállításának szabályozásában résztvevő fehérje. (Kallen, 1998)
Szerkezete
Emberben egy 285 aminosavból felépülő fehérje (1. ábra). Működése során két lépésben jut be a mitokondriumba. A fehérje 195. aminosavának, a szerinnek a foszforilációja jelentősen megnöveli az aktivitását. Valójában az úgynevezett StART domain család fehérjéi közé tartozik. Úgy is ismerik, mint STARD1 (START domain-containing protein 1). (Arakane, 1997)
|
Azt feltételezik, hogy kis hidrofób zsebbel rendelkezik a fehérje, amiben egy koleszterin molekulát képes megkötni és így szállítani. Ez a kis üreg az említett START doménhez tartozik. A másik fő szerkezeti elem a mitokondriális transzportért felelős N terminális domén (62 aminosav). Habár bizonyított, hogy a StAR a mitokondriumot célzó N terminális domén hiányában is serkentheti a sejtek hormonszintézisét, a fehérje így is elvégzi a koleszterin transzportját (kísérleti körülmények között). A StART-nak két funkcionálisan jelentős eleme a C-terminális alfa hélix, valamint az annak tövében elhelyezkedő, már említett, üregszerű koleszterin kötőhely. Itt többségében lipofil aminosav oldalláncok találhatók, a 168. helyen lévő glutaminsav, valamint a 187-es számú arginin közötti hídszerű ionos kötést, mint poláris elemet leszámítva a molekula ezen a szakaszon apoláros. (Roostaee, 2008)
Funkciója
A mitokondrium egy külső és egy belső membránból épül fel. A koleszterint át kell juttatni először a külső membránon, majd a belső membránon. A belső membránon a citokróm családba tartozó P450scc (CYP11A1) fogja a koleszterin oldalláncát elsőként enzimatikusan hasítani. Ez az első lépése a szteroid hormonok szintézisének. A két membrán közötti rész vizes közeg, tehát a zsíroldékony koleszterin nem tud áthaladni itt, csak ha egy szállító fehérjéhez kötődik. A számos szállító fehérje közül napjainkra világossá vált, hogy a legfontosabb a StAR. (Stocco, 2005)
Szintézise
Mitokondriális eredetű fehérje, aminek a termelődését a sejt stimulálja szteroid hormon szintézis során, bizonyos trophormonok (elsősorban ACTH) hatására. A szintézise cAMP-n, mint másodlagos hírvivőn keresztül történik, ami egy foszforiláción át képes szabályozni a fehérje génjéről történő transzkripciót. (Roostaee, 2008)
Valamennyi szövetben szintetizálódik, ami szteroid hormont képes előállítani. Többek között a mellékvesekéregben, az ivarszervekben, az agyban, a nem emberi placentában. Egyedül eddig a humán placentában nem találták meg. Az alkohol negatívan befolyásolja szintézisét. (Srivastava, 2005)
Működése a klasszikus szteroid hormont termelő sejtekben
A pontos mechanizmusa a szállításnak még a mai napig nem teljesen tisztázott. Számos feltételezés létezik a működésére. Egyes feltételezések szerint a StAR egyszerre több koleszterin szállítását végzi, egyfajta koleszterin csatornát képezve. Más elképzelések szerint a külső-belső membrán között olyan morfológiai változást okoz, ami lehetővé teszi a koleszterin beáramlását. Megint másik elképzelés szerint a perifériás benzodiazepin receptorral (PBR) együttműködve, Cl- kiáramlás mellett teszi lehetővé a koleszterin beáramlását. (Stocco, 2005)
Egyelőre nem tisztázott, hogy a StAR a koleszterint szabad formájában köti meg vagy membránokból, intracelluláris zsírcseppekből, micellákból vonja el. A kutatók kísérletesen egyik verziót sem tudták elvetni. Azt, hogy a fehérje pontosan hogyan segíti a koleszterin transzportot, a külső és a belső mitokondriális membrán között (2. ábra), máig nem tudjuk. (Roostaee, 2008)
|
Ha koleszterin nem kötődik a fehérjéhez, a teljesen feltekeredett szerkezetű alfa hélixszel bíró és a részlegesen feltekeredett alfa hélixszel végződő StAR molekulák egyensúlyban vannak az oldatban, egymásba folytonosan átalakulnak. A koleszterin kötődése stabilizálja, hőre ellenállóvá teszi a START domént, a kapcsolódás indukálja a C-terminális alfa hélix feltekeredését, de a fehérje többi része változatlan marad. Tekinthetjük az alfa hélix stabilizálódást, feltekeredését egy zár mechanizmusnak, ami a koleszterint rögzíti, ha már az a kötőhelyre került. Ezzel szemben a lazább C-terminális lehetővé teszi a szteránváz bejutását a lipofil üregbe. Energetikai jellemzők arra engednek következtetni, hogy bizonyos hidrogénhíd kötések felszakadása, valamint értelemszerűen az apoláros kolesztrein bekötése során új hidrofób kötések kialakulásával stabilizálódik a kolesztrein-StAR komplex. (Roostaee, 2008)
A mellékvese kéreg és az ivarszervek „klasszikus” szteroid termelő szerveknek tekinthetők. Ezen szervek szintézises tevékenységéhez nélkülözhetetlen a StAR fehérje. Ahogy már említettük, egyedül az emberi placentában nem expresszálódik. Az utóbbi évek kutatási eredményei bebizonyították, hogy számos autokrin illetve parakrin szabályozóként működő szteroid hormon termelésében is részt vesz. Egyes feltételezések szerint a StAR nem-szteroidogén funkcióval is rendelkezik. Már számos szteroid termelő szerven kívül mutatták ki jelenlétét a szervezetben, különféle sejtekben és daganatokban. Ezeket a szöveteket ún. „nem klasszikus” szteroid termelő szöveteknek nevezték el. (Anuka, 2013)
A StAR fehérje szteroid szintézis sebességében betöltött szerepe
A szteroidok szintézisének első lépése a koleszterin átalakítása pregnenolonná. Mindez a mitokondriumban zajlik. Ez a koleszterin oldalláncának hasításával kezdődik, amiért a citokróm családba tartozó P450 (CYP11AA1) a felelős, ami viszont minden szteroid hormont előállító sejt mitokondriumának belső membránján tartózkodik. Majd a pregnenolon elhagyja a mitokondriumot és a legtöbb fajban egy 3-béta-hidroxi-szteroid dehidrogenáz (HSD3B) alakítja ezt át progeszteronná, amely a mikroszómális régióban található. A pregnenolon ezt követően átalakul különféle aktív szteroid hormonokká. Valamennyi szövetféleségben átalakulhat glükokortikodiddá (emberben kortizollá, rágcsálókban kortikoszteronná) és mineralokortikoiddá (aldoszteron) a mellékvese kéregben, valamint nemi hormonokká (progeszteron, androgének, ösztrogének). A legtöbb bioszintetikus útvonalnak van egy sebességmeghatározó lépése, amit a CYP11A1 aktivitásának tulajdonítanak. Bizonyossá vált, hogy ez a koleszterin szubsztrát szállításához köthető a külső és belső mitokondriális membrán között. A CYP11A1 itt található. Több évtizedes kutató munka után azonosítottak egy 30 kDA nagyságú foszfoproteint patkány és egér mellékvesekérgi sejtjeiben. Ezután megállapították, hogy ennek van egy 37 kDA nagyságú prekurzor formája. (Anuka, 2013)
A StAR fehérje működése
Kezdetben azt feltételezték, hogy egy trophikus hormon stimulációjának köszönhetően szintetizálódik a sejt citoplazmájában. Ezután kiderült, hogy ez a modell nem teljesen helytálló, amikor az N-terminális részen egy 62 aminosav hosszú rész lehasad, akkor a szteroid szintézise leáll. Egy másik kísérlet a pH csökkenésével járó globuláris szerkezetváltozásra derített fényt. Ha a térszerkezete átmeneti állapotot képez a globuláris szerkezet felé, akkor sokkal kisebb energia szükséges a StAR fehérje működéséhez. A pontos működés a mai napig nem teljesen ismert. A kutatások jelenlegi állása szerint a StAR valószínűleg kölcsönhatásba lép különféle fehérje és lipid faktorral a mitokondriális membránon, amelyek részt vesznek a koleszterin szállításában. Egyes feltételezések szerint akkora komplexet alkot, ami átíveli a külső-belső membránt, egyfajta csatornát biztosítva a koleszterinnek. Ez magában foglal egy transzlokátor fehérjét (TSPO/PBR) és egy feszültség függő 1-es anion csatornát (VDAC1), valamint a CYP11A1-et is. (Anuka, 2013)
Működése a nem klasszikus szteroid hormont termelő sejtekben
Az agyban való működése
A StAR protein, a CYP11A1 és más szteroidogén enzimek cerebralis jelenléte (az agyban) a központi idegrendszer szteroid szintézisben betöltött szerepére utal. Az aktív neuroszteroidok nem korlátozódnak le csupán a klasszikus szteroid hormonokra. Lehetnek köztük a keringésben lévő szteroidok metabolitjai, úgy, mint progeszteron, 11-dezoxikortikoszteron, vagy tesztoszteron; vagy de novo szintetizálódó nem klasszikus hormonok, például a pregnenolon, vagy a DHEA. Utóbbi szintézise folyhat gliasejtekben és neuronokban, embrionálisan, újszülött és felnőtt korban is. A neuroszteroidok funkciói rendkívül szerteágazóak. Szerepet játszanak például a mielinizációban (progeszteron), stresszre adott viselkedés minták kialakításában (allopregnenolon), szorongásban (THDOC vagy androsztendion), illetve depresszív viselkedésben, memóriavesztésben és memória kialakulásban rágcsálókban (pregnenolon, DHEA, DHEAS). Továbbá a pregnenolonnak és a progeszteronnak neuroprotektív hatása is ismert krónikus és akut neurotoxinok ellen. (Anuka, 2013)
A szemben való működése
A StAR protein és a SR-B1(Scavenger Receptor-B1) ko-lokációja kimutatható volt patkány sejtekben a retinában és retinán kívüli szövetekben. Az SR-B1 egy HDL receptor, mely szelektíven képes koleszterint felvenni, s emiatt esszenciális a rágcsálók mellékveséjében, és gonádjaiban. Ezen molekulák közös helyeződése az okuláris sejtekben utalhat azoknak neuroszteroid szintézisére, azonban korábbi, CYP11A1 enzimet érintő kutatások a retinális ganglion sejtekben nem szolgáltak bizonyítékként az okuláris StAR/SR-B1, illetve a CYP11A1 és a 3βHSD helyeződése között. (Anuka, 2013)
A szívben való működése
A szívizom szövetben is található StAR protein. A szívizomsejtekben folyó de novo szteroidhormon szintézise még nem tisztázott. Rágcsálókban szívizom hypertrófia és infarktus esetében megfigyelhető volt a StAR protein transzkripciójának növekedése. Az azonban bizonyos, hogy az aldoszteron szívben található receptoraival való kapcsolódása negatívan befolyásolja az egyes szívbetegségekből való felépülést rágcsálókban. (Anuka, 2013)
A tüdőben való működése
A glükokortikoidoknak a tüdő fejlődésében nélkülözhetetlen szerepe van, ugyanis a kettes típusó pneumocyták surfactant faktor termeléséhez elengedhetetlen. Az embrionális tüdőben lévő StAR protein expresszió de novo glükokortikoid szintézisre utalhat. Az itt lévő CYP11A1, StAR, HSD3B, CYP21B, CYP11B1 és HSD11B1 szintek megegyezőek a fetális mellékvesében mértekkel, azonban a felnőttkorinak csupán 1-4%-a. (Anuka, 2013)
A bőrben való működése
A nemi hormonok bőröregedésre, kopaszodásra gyakorolt hatása közismert tény. Ezen szteroid hormonok lokális szintézisének indikátora lehet a StAR protein jelenléte. A StAR protein génexpressziója bizonyítottan magas az ekcémás, kopaszodó területeken. (Anuka, 2013)
A zsírszövetben való működése
A zsírszövetben is kimutatható de novo szteroid hormon szintézis és ennek megfelelően a StAR protein jelenléte is. A vizsgálatok során kiderült, hogy a zsírsejtek adipocytokinest tartalmaznak, valamint egy renin-angiotenzin rendszer, nemi szteroidot és glükokortikoidot metabolizáló enzimek is előfordulnak benne. A nemi szteroidok szintézise során a keringő androgénből ösztradiol keletkezik. A glükokortikoidok befolyásolják a zsírsejtek differenciálódását és eloszlását. A hyperaldosteronismushoz feltételezhetően hozzájárul a mellékvesében expresszálódó StAR mennyisége. A kérdés az volt, hogy az emberi zsírszövet képes-e kortizolt és aldoszteront koleszterinből szintetizálni. Több nőből vettek zsírbiopsziát, miután azok császármetszésen estek át. Az eredmények alapján kiderült, hogy az mRNS által kódolt StAR protein szükséges a koleszteron átalakításhoz 11-dezoxi-kortikoszteronná. Bár az így helyileg képződő enzimek mennyisége és az ebből következő zsírlerakódás elenyésző a mellékvesében képződő szteroid hormonokhoz képest. (Anuka, 2013)
A hasnyálmirigyben való működése
Először patkány hasnyálmirigyben izolált mitokondriumokban mutattak ki pregnenolon szintézist. A kutatók ezután olyan szintű StAR protein aktivitást mutattak ki, mint ami a májban is megtalálható. (Anuka, 2013)
A vesében való működése
A vesében lévő StAR protein detektálása valószínűleg egy fejlődésbiológiai összefüggéssel magyarázható. Ugyanis az emlős vese és a gonádok, illetve a mellékvese kéreg szteroidogenikus sejtjei azonos fejlődéstani eredettel rendelkeznek, mind a köztes mezodermából alakult ki. Immun-hisztokémiai kutatások kimutattak StAR expressziót a distális kanyarulatos csatornákban, illetve a vese carcinomáiban emberben, s ezt végül patkányokban is észlelték. Fény derült továbbá, hogy a vesében expresszálódik a StAR-on kívül a CYP11A1, a Tspo illetve az Nr5a1 is, csupán kisebb mértékben, mint a mellékvesében vagy a herében. Kezdetben a vesében zajló de novo szteroidogenezisnek a fejlődésben tulajdonítottak szerepet, mivel a CYP11A1 enzim csak a pubertás korig volt megfigyelhető. Később a StAR és a CYP11A1 együttes expresszióját mutatták ki kifejlett vesében a Henle-kacs vastag felszálló ágában, illetve a distális kanyarulatos csatornában. Ez arra utal, hogy a pregnenolon szerepe a vesében nem korlátozódik le csupán a fejlődésre. Fontos, hogy a pregnenolon biotranszformációjához szükséges 3βHSD nem expresszálódik a vesében, így a szerv szteroidogenezisben betöltött szerepe még nem teljesen tisztázott. A pregnenolon KIR-ben betöltött szerepe arra enged következtetni, hogy a vesében is védekező funkciója van. (Anuka, 2013)
Patológiás működése
A StAR élettani jelentőségét igazolják azok a tanulmányok, melyek szerint az LCAH (lipoid congenital adrenal hyperplasia) StAR rendellenességekből adódik. LCAH fennállása esetén a koleszterin nem alakítható át pregnenolonná, így a kortizol szintézis zavart szenved, mely megemelkedett ACTH szinthez vezet a feedback mechanizmus kiesésének következtében. Az ACTH fokozza a koleszterin felhalmozódását a sejtekben koleszterinészter formájában. LCAH esetén a mutáció a fehérje START (STAR-related lipid transfer) doménjét érintik, különösen annak is a C-terminális részét.(Roostaee, 2008)
A StAR protein mutációját elsőként a klasszikus veleszületett lipoid mellékvese hyperpláziával (CLAH) írták le, mely esetben mind a mellékvese, mind a gonádok szteroid hormon szintézise teljesen hiányzik. A betegség kórélettana leírható a koleszterin elégtelen szállításával a szteroid hormonok bioszintézisének helyére (mitokondrium belső membránjához). Ennek következtében a citoplazmatikusan felhalmozódó lipidcseppecskék végzetesen károsíthatják a szteroidogén szövetek sejtjeit. Ezt okozza a StAR protein F267S típusú mutációja is. Nemrégiben a mutáció egy új formáját is leírták, mely a nem-klasszikus típusú lipoid mellékvese hyperplázia (NCLAH), mely korai csecsemőkori vagy később kialakuló mellékvese elégtelenséget okoz. Ez hypokortikolizmus formájában jelenik meg, mely inkonzisztens mineralokortikoid hiány jeleit mutatja. A betegség klinikai profilja nagyon hasonló a familiáris glükokortikoid-hiányéhoz (FGD). Okozója lehet a fehérje V187M, R188C, R192C, A218V, G221D, M225T, F267S, L275P, L260P és az újonnan felfedezett G221S típusú mutációk. (Christa, 2011)
A kutatás felfedett két új mutációt heterozigóta formában, két testvérben. Az előbbi egy frameship mutáció a kettes exonon, melynek során a 44-es pozícióban lévő treonin helyett hisztidin épül be, a 46-os helyzetben lévő szerin helyett pedig STOP kodon kerül. Ennek következtében a fiziológásan 265 aminosav hosszúságú fehérje 45-re redukálódik, így ebben az esetben pregnenolon termelés nem volt mérhető. A G221S mutáció esetében egy pontmutáció figyelhető meg a hatos exonon, így a 221-es glicin helyett szerin épül be a fehérjébe. Ezen elváltozás következtében a sejtek pregnenolon termelése a vad típus 30-50%-a, így NCLAH-t okoz. A testvérpár (egy férfi, egy nő) esetében, ahol a két új mutációt kimutatták öröklődő lipoid mellékvese hyperpláziát diagnosztizáltak, amit glükokortikoidokkal, mineralokortikoidokkal kezeltek. Azonban ahogy az NCLAH-ban szenvedő betegeknél, így náluk is a nemi működés normális volt magzati, pubertáns és felnőtt korban is. A férfinál normál szérum tesztoszteron és gonadotropin szint volt mérhető, a nő esetében a menstruáció normális volt és a gonadotropin szint is határértéken belül volt mérhető. Mindezek dacára mindkettejük esetében számolni kell a kor előrehaladtával infertilitás kialakulásával. (Christa, 2011)
A fehérjének különböző helyeken bekövetkező mutációi eltérő működésbeli zavarokhoz vezetnek. Az F267Q egy mutánsforma, amely az alfa hélix C-terminális kötőhellyel határos részén tartalmaz aminosavbeli módosulásokat. Ebben a StAR variánsban a koleszterinkötődés által indukált termodinamikai stabilitás, valamint a kötéserősség szignifikánsan csökkent. Ezek mellett a szteroidképző aktivitás is elmarad a várhatótól. Feltételezhető tehát, hogy az alfa hélix mind a koleszterinkötésben, mind a szteroid szintézist szabályozó egyéb folyamatokban szerepet kaphat. LCAH-s betegeknél gyakori mutáns az úgynvezett R182L. Ennél a változatnál a fehérje felületéhez közeli részén észlelhető az aminosav szekvenciában változás, a mutáció sem az alfa hélixet, sem a kötőhelyet nem érinti. Az elvártaknak megfelelően a koleszterinkötő képesség nem mutat semmiféle változást, viszont a szteroidképző aktivitás csökken. Ezt a megfigyelést a koleszterinszállításban szerepet kapó egyéb fehérje faktorokhoz való kötődés hiányával magyarázhatjuk. A felületen bekövetkező változás lehetséges, hogy a harmadlagos szerkezetet módosítva vezet az egyéb koleszterin tarnszportban résztvevő fehérje faktorokkal való interakció zavarához. (Roostaee, 2008)
Összegzés
A StAR protein szteroidhormon-szintézisben betöltött szerepe nélkülözhetetlen, azonban pontos működési mechanizmusa máig kutatás tárgyát képzi. Genetikai mutációja az egész endokrin rendszert érintő, súlyos tünetekkel járó betegségekhez vezethet. A klasszikus szteroid termelő szerveken kívül a kutatások azt bizonyítják, hogy szinte a szervezet minden szövetében mérhető különböző mértékű StAR protein aktivitás. A jövő kihívása, hogy ezen mechanizmusokat lépésről lépésre részleteiben megismerje és az így kapott összefüggéseket felhasználhassa olyan aktuális kérdésekben, mint az elhízás folyamata, vagy a különféle daganatos sejtek elleni hatékonyabb küzdelem felvételében.
Irodalomjegyzék
Kallen CB, Billheimer JT, Summers SA, Stayrook SE, Lewis M, Strauss JF 3rd: Steroidogenic acute regulatory protein (StAR) is a sterol transfer protein.1998, 273 (41):26285-8, URL: https://www.ncbi.nlm.nih.gov/pubmed/9756854, Megtekintve: 2016.03.21.
Alireza Roostaee, Élie Barbar, Jean-Guy LeHoux, Pierre Lavigne: Cholesterol binding is a prerequisite for the activity of the steroidogenic acute regulatory protein (StAR), Biochemical Journal 2008, 412 (3) 553-562, DOI: 10.1042/BJ20071264, URL: http://www.biochemj.org/content/412/3/553, Megtekintve: 2016.03.24.
Arakane F, King SR, Du Y, Kallen CB, Walsh LP, Watari H, Stocco DM, Strauss JF 3rd: Phosphorylation of steroidogenic acute regulatory protein (StAR) modulates its steroidogenic activity. 1997, 272 (51):32656-62, URL: https://www.ncbi.nlm.nih.gov/pubmed/9405483, Megtekintve: 2016.04.03.
Stocco DM, Wang X, Jo Y, Manna PR: Multiple signaling pathways regulating steroidogenesis and steroidogenic acute regulatory protein expression: more complicated than we thought. 2005, 19 (11):2647-59. Epub 2005 Apr 14. URL: https://www.ncbi.nlm.nih.gov/pubmed/15831519, Megtekintve: 2016.04.03.
Srivastava VK, Vijayan E, Hiney JK, Dees WL: Effect of ethanol on follicle stimulating hormone-induced steroidogenic acute regulatory protein (StAR) in cultured rat granulosa cells. 2005, 37 (2):105-11. URL: https://www.ncbi.nlm.nih.gov/pubmed/16584974, Megtekintve: 2016.04.03.
Anuka E, Gal M, Stocco DM, Orly J: Expression and roles of steroidogenic acute regulatory (StAR) protein in ‘non-classical’, extra-adrenal and extra-gonadal cells and tissues, 2013, 371 (1-2):47-61. doi: 10.1016/j.mce.2013.02.003. Epub 2013 Feb 13. URL: http://www.ncbi.nlm.nih.gov/pubmed/23415713, Megtekintve: 2016.04.03.
Christa E. Flück, Amit V. Pandey, Bernhard Dick, Núria Camats, Mónica Fernández-Cancio, María Clemente, Miquel Gussinyé, Antonio Carrascosa, Primus E. Mullis, and Laura Audi: Characterization of Novel StAR (Steroidogenic Acute Regulatory Protein) Mutations Causing Non-Classic Lipoid Adrenal Hyperplasia, Published online 2011 May 27. doi: 10.1371/journal.pone.0020178, URL: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3103540/, Megtekintve: 2016.04.03.
Ábrajegyzék
1. ábra A StAR protein (Forrás: https://upload.wikimedia.org/wikipedia/commons/c/c0/StAR_Steroid_acute_regulator_2I93_Modell.png)
2. ábra A StAR protein működése (Készítette: Kovács Andrea)
Köszönetnyilvánítás
Szeretnénk köszönetet mondani professzor Dr. Frenyó V. Lászlónak és professzor Dr. Bartha Tibornak, hogy témánkat befogadták. Szeretnénk megköszönni Kovács Andreának, hogy rajzával hozzájárult a fehérje működésének megértéséhez. Továbbá köszönetet kell mondanunk Kis István Emilnek, aki a szöveg lektorálásában segített. Nem utolsó sorban köszönetet kell mondanunk témavezetőnknek, Jócsák Gergelynek, aki útmutatásaival segítette a munkánkat és támogatott minket szaktudásával.