|
Size: 32337
Comment:
|
← Revision 140 as of 2019-05-03 15:03:04 ⇥
Size: 32145
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 6: | Line 6: |
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0;"style="padding:0.5em;"> {{attachment: image.png||width="600"}} || ||'''Figure 1''' ''Title of figure'' || |
A tromboxán szerepe a simaizomkontrakció szabályozásában
Contents
A tromboxán
A tromboxán egy nagyon jelentős eikozanoid. Két fajtája ismert: TXA2, TXB2 .
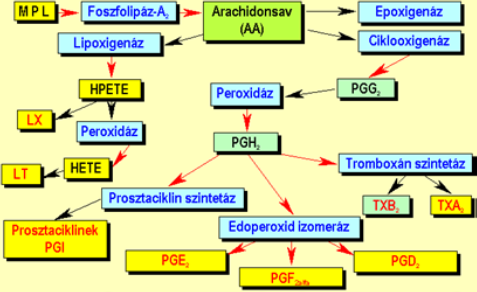
Az eikozanoidok mindenféle sejtben képesek szintetizálódni. Kiinduló vegyületeik a membránalkotó lipidek, melyekből foszolipáz A2 (PLA2) hasítása révén 20 szénatomszámú arachidonsav keletkezik (Δ5, 8, 11, 14 és Ω6). Eme esszenciális zsírsavból több reakcióút indulhat meg: epoxigenáz út, lipoxigenáz út (lipoxinok-LX, leukotriének-LT) és a ciklooxigenáz út. A tromboxán az utóbbi eredményeként jön létre tromboxán szintetázok által. Ugyanezen út végtermékei a prosztaciklinek (PGI) és prosztaglandinok (PGE2, PGF2alfa, PGD2) is (1.Ábra).
Maga a foszfolipáz A2 működése G-fehérjéhez kapcsolt folyamat, mely akkor indul meg, ha megfelelő farmakon (pl. Ca-ion) aktiválja a 7M-receptort, az pedig a hozzá kapcsolódó G-proteint, mely végül beindítja az enzimműködést.
Pár érdekesség a foszfolipáz A2-ről:
- Egyes kígyók, pókok mérgében fellelhető, hemolízist okoz.
- Az enzim a membránalkotó lipidek felépítésében résztvevő glicerin 2. szénatomjáról hasítja le az arachidonsavat, a lipidből pedig lizolecitin/lizokefalin lesz, növelve így a membrán rigiditását.
|
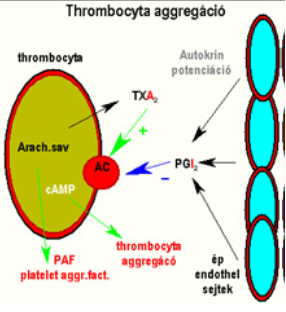
A TXA2 legalapvetőbb szerepe a thrombocyta aggregáció kialakítása.
Az érfal endothel sejtjei normál működéskor PGI2-t (és NO-t) termelnek, melyek az adenilát-cikláz (AC) enzimen keresztül növelik az IC-tér cAMP szintjét, ezzel akadályozzák a PLA2 működését. Sérülés hatására azonban megáll a PGI2 szintézis, illetve megindul a TXA2 termelés, mely csökkenti a cAMP szintet, és thrombocyta aggregációt okoz (2.Ábra). Ez a folyamat a fehér thrombus kialakulásának stimulátora.
|
A TXA2 a bronchus-kontrakcióban talán a legfontosabb eikozanoid. Jelentős constrictora az umbilicalis és agyi ereknek, ugyanakkor a koronáriákat és vesemedencét is képes összehúzni, mikor a szöveteket a lokális vérhiányos állapotukból (ischaemia) kell megszabadítani.
A simaizomkontrakcióról röviden
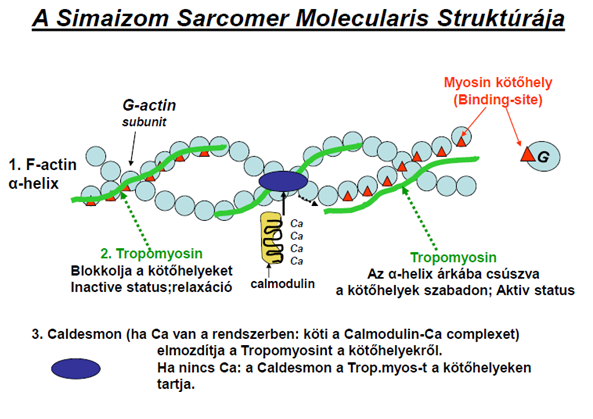
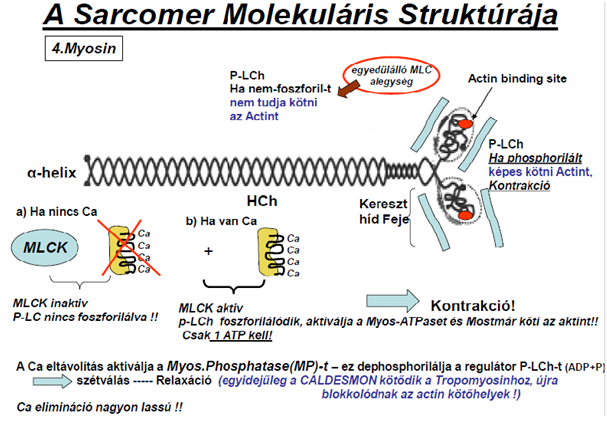
A kontrakció – csakúgy, mint a harántcsíkos izomban – a csúszófilamentum modell alapján jellemezhető. Az aktin és miozin összekapcsolódását a MLCK (myozin-light-chain-kinase) enzim indítja el, ha az IC Ca-ion szint a megfelelő értékre emelkedik. A kontrakció addig tart, míg a MP (myosin-foszfatáz) le nem hasít a komplexről egy foszforil csoportot. Akkor ugyanis újra kettéválik az aktin és miozin molekula, vagyis az izom relaxál.
Ez nem a minden vagy semmi elve alapján működik, hiszen a simaizom folyamatos, enyhe kontrakció alatt áll. Ez határozza meg a két enzim (MLCK és MP) aktivitásának egymáshoz viszonyított arányát. Fontos különbség a harántcsíkolt izomhoz képest, hogy az aktin molekulán a tropomiosint egy Caldesmon nevű molekula rögzíti, ami Ca hatására megköti a Calmodulin-Ca komplexet, a tropomiosin lecsúszik az alfa-hélix árkába, így szabaddá teszi a miozin kötőhelyeket (3. és 4.Ábra).
|
|
|
Simaizom található az erek, bronchusok, belső szervek falában. Alapvető, az élethez nélkülözhetetlen mozgásokat kiviteleznek. Ilyen sajátos mozgás például a nyelőcső simaizomzata által megvalósuló perisztaltikus mozgás, illetve az erekben található simaizmok azok tágasságát szabályozzák.
Májregeneráció
A máj figyelemre méltó megújuló képessége teszi lehetővé a májtömeg működésének helyreállítását toxikus vagy egyéb behatások okozta sérülések miatt (Minamino és mtsai, 2012).
Tromboxán A2 a májban
A tromboxán A2 egy erős stimulátora a thrombocyta aktivációnak, valamint a simaizom összehúzódásnak. Hatását a G-proteinhez kötött receptoron fejti ki, aminek a neve tromboxán prosztanoid receptor. A TXA2 termelése túlszabályozott olyan patológiai állapotok alatt, mint az ischaemia, gyulladás és atherosclerosis. Továbbá, a Kupffer-sejtek által termelt TXA2 hozzájárul az akut májgyulladás kialakításához endotoxemia, májreperfúzió (akadályozott véráramlás a májban) és cholestasis (epeáramlás leállása) során. A TP receptor a máj sinusoid endotheliális sejtjeiben található, valamint a Kupffer-sejtekben. Bizonyított tény, hogy a TXA2 aktiváció felelős a májregenerációért májectomia után (Minamino és mtsai, 2012).
A ginseng poliszacharidok hatása
A májban a keringés elzáródása miatt vérhiányos állapot lép fel (Hepatic Ischaemia Reperfusion Injury, HIRI), ami gyakran előfordul májtranszplantáció, májlebeny eltávolítás és szívinfarktus során; akut májkárosodáshoz vezethet. Számos tanulmány kimutatta, hogy az energia metabolizmus betegségeinél, az oxigén szabadgyökök miatti károsodásnál a nem kiegyensúlyozott, NO/ET (endothelin) és a TXA2/PGI2 termelés a fő problémaokozó.
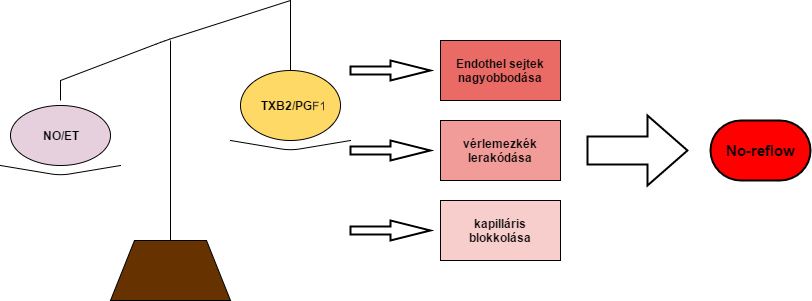
A fiziológiás körülmények között szekretált bizonyos anyagok képesek szabályozni a simaizom összehúzódást, beleértve az arachidonsav metabolitjait, mint például a PGI2 és TXA2, valamint a NO és ET. Ezek az anyagok relatív körülmények között egyensúlyban vannak. Az utóbbi években kimutatták, hogy a NO/ET egyensúlytalansága egy fontos kockázati tényező a máj mikrokeringés károsodásában a reperfúziós ischaemia során. Az egyensúly PGI2 valamint a TXA2 hatása a stabil metabolitjainak arányától függ, azaz a TXB2/PGF1 aránytól. Hypoxia és gyulladás során az endotheliális simaizom sejtválasz károsodik, és a NO/ET , TXB2/PGF1 arány kikerül az egyensúlyi állapotból. A reperfúzió a vasculáris endothelsejtek megnagyobbodását okozza, valamint a vérlemezkék lerakódását és ezáltal a kapillárisok blokkolását. Kialakul egy úgynevezett no-reflow jelenség (5.Ábra). Továbbá a mikrocirkuláció diszfunkciója a májsejtek energia metabolizmusának károsodását okozza és tovább súlyosbíthatja a betegséget.
|
Ez az imbalacia ginzeng poliszacharid injekció hatására helyreáll, mivel ezen anyag a gyulladást kiváltó tromboxán és prosztaglandin arányát csökkenti. A ginseng poliszacharid feltételezhetően a reperfúziós májgyulladásnál elősegíti az energia metabolizmust azáltal, hogy emeli az antioxidációs készséget és szabályozza a NO/ET és a TBX2/PGF1alfa termelését. A ginseng poliszacharid a legaktívabb anyaga a ginsengnek; tanulmányok kimutatták, hogy ezen poliszacharidok ellenállnak a szabadgyökök károsító hatásának, beavatkoznak a sejt apoptózisába (Xiang és mtsai, 2016).
A vérlemezkék adhéziója a májregenerációban
A vérlemezkék feltételezhetően fontos szerepet játszanak a májregenerációban, a gyógyulásban májkimetszés után, valamint akut májgyulladás esetén. Vérlemezke eredetű szerotonin mediált folyamat a májsejtek proliferációja, vagyis burjánzása. A tromboxán prosztanoid receptor által végbemenő jelzések szerepet játszanak a gyulladás és a szövetsérülés kialakulásában a vérlemezkék összetapadása által. Más részről a TP receptor jelzései részt vesznek a szövetregenerációban és a tumor növekedésben is a véredények képződésén keresztül.
A vérlemezkék kis speciális vérsejtek, melyek a csontvelő megakaryocytáiból származtathatóak, mint sejtmag nélküli citoplazmatikus testek. Habár a fő funkciójuk a vérzés megállítása szövet-és érsérülés esetén, a vérlemezkék a gyulladás kialakításában valamint a szövetregenerációban is szerepet játszanak parakrin úton vagy direkt sejt-sejt interakció által.
A TXA2 működése patológiás állapotoknál túlszabályozott, azáltal, hogy a vér sejtjei közötti interakciót stimulálja, különösen a vérlemezkék és a mikrovasculáris endotheliális sejtek közt létrejövő kapcsolatot. Akut gyulladás során a TXA2/TP receptor út működése figyelhető meg, amelynek aktivációja fokozza a proinflammációs mediátorok és a tumor necrosis factor alpha (TNF-alfa) termelését. Ezen anyagok megemelkedett szintje mikrokeringési diszfunkciót vált ki, valamint az endotheliális leukocyták interakcióját.
Ezek a tények a tromboxán gyulladáskeltő szerepét mutatják be, azonban a TP receptorok szignáljai szabályozzák a sinusoidok raktározó képességét is azáltal, hogy helyreállítják a károsodott májszövetet, valamint serkentik a makrofágok működését. A TXA2 angiogenezis stimuláló anyagként szerepelhet, így ezen felül elősegíti a cytokinek termelését is, melyek proangiogenikus faktorként segítik elő a thrombocyta aktivációt (Minamino és mtsai, 2015).
Tromboxán A2 receptor jelzések támogatják a májszövet regenerációját a makrofágok számának fokozásával
A gyógyulás folyamatát a májsejtek proliferációs képessége és a necrotikus sejtek eltávolítása teszi lehetővé. A nem működő sejtek eltakarításáért a makrofágok és a monocyták felelősek, habár az általuk termelt kémiai anyagok az ép sejteket is károsíthatják. Egereken végzett kísérletek igazolják, hogy a TP receptor jelzései szerepet játszanak a májregenerációban, azáltal, hogy elősegítik nemcsak a máj növekedési faktorának traszkripcióját, hanem a makrofágok felületén található monocyte chemoattractant protein-1 (MCP-1/CCL2) receptor megjelenését is. Ezen receptor megjelenése hozzájárul a makrofágok mihamarabbi toborzásához a sérült májba (Minamino és mtsai, 2012).
A tromboxán A2 szerepe biztos a gyulladás kialakításában a májban, azonban számos kísérlet munkálkodik azon, hogy a májregenerációhoz való hozzájárulása is végleg bizonyítást nyerjen, ugyanis még számos aktiválási és egyéb mechanizmusa nem tisztázódott.
TXA2 receptorok a vesében
A vesében a renalis véráramlás, a glomerulációs filtrációs ráta és a a tubuloglomerularis feedback csökkenését okozza. Így bonyolult renalis vér-, vízáramlás és elektrolit anyagcserét tesz lehetővé. A TXA2 szerepet játszik a kórokozók kutatásában, egyes renalis betegségek kórélettanában, mint például a vesegyulladás (nephritis), transzplantáció kilökődése, illetve húgyuti traktusműködés akadályozása.
A tromboxán szintézis aktivitásának csökkentésével, vagy a TXA2 receptor kötődés blokkolásával megelőzhető az általuk okozott renalis károk kifejeződése (Takaaki és mtsai, 1995).
Az autentikus TXA2 és PGH2 receptorok helyeződése a patkány veséjében
Polyclonális antitestet használva a TXA2 és PGH2 receptorfehérjék ellen, a mikroszkopikus immunfluoreszcencia normál módszerével megállapítható azok eloszlása egy fiziológiás patkányvesében. A receptorok mind a glomerulusokban, mind a tubulusokban jelen vannak. Kiemelkedő a számuk a glomerulus kapillárisok lumene mentén. A Bowman-tok epitheliális sejtjei, a podocyták (lábas sejtek, melyek tulajdonképpen a Bowman-tok belső lemezét, vagyis az erek falára boruló réteget alkotják) és mesangiális sejtek is mutatnak érzékenységet az immunfluoreszcenciális reakcióra.
A tubulusok receptoreloszlása: proximális tubulusokban főként a kefeszegély mentén, a distalis kanyarulatos és a vastag felszálló csatornák luminalis felszínén fordulnak elő.
- Ezek a megállapítások rámutattak arra, hogy a TXA2 által a vesében jelentkező károk ezen eikozanoid szintézisének javításával meghatározhatók.
Számos, patkányvesén végzett vizsgálat foglalkozik a veseszövetben lévő TXA2 szintézisével, sejteredetével. Ezek a tanulmányok kimutatták, hogy a TXA2 főleg a glomerulusokban termelődik, ugyanakkor a vesetubulus hámsejtjeiben a képződése minimális vagy észrevehetetlen.
A TXA2 nem a legfontosabb eikozanoid, melyet a glomerulus vagy glomerulus sejtkultúra állít elő. Számuk jelentősen alacsonyabb, mint az egyéb eikozanoidoké, ilyen például a PGF2alfa, vagy PGE2.
- Habár egy glomerulus sérülést nyomon követve, a TXA2 szintézise jelentősen fejlett az izolált területen.
Ezt mutatták ki glomerulus sérülések számos kísérleti formájában:
- antitest-mediált sérülés
- diabetikus glomerulopathia
- veseimplantáció kilökése
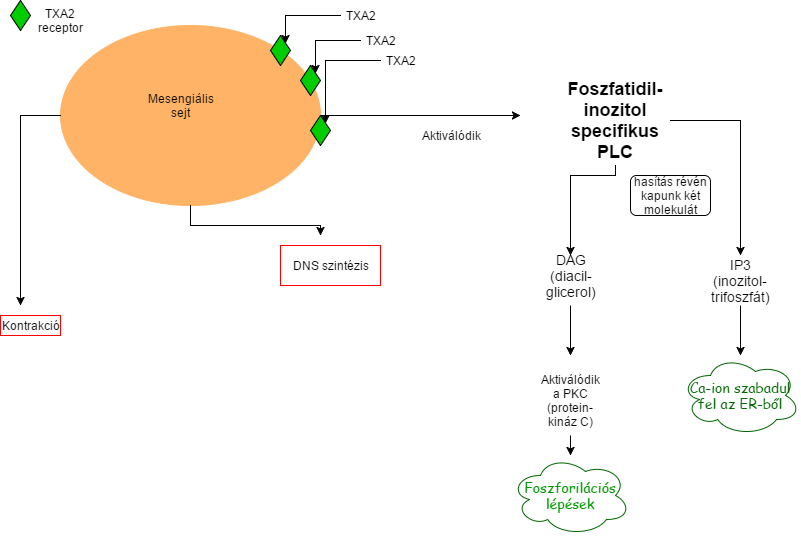
Ilyen esetekben a TXA2 jelzi a gyulladáskeltő sejtek eredetét, melyek főleg aktivált fehérvérsejtek, thrombocyták és beszivárgó glomerulus struktúrák. Ezen sejtek egyszeri kiürülése után a TXA2 parakrin módon képes hatni az endotheliális, mesangiális és epitheliális glomerulus sejtekre, előidézve ezzel rengeteg biológiai folyamatot. Ilyen módon lehet a mesangiális sejteket legjobban jellemezni, ugyanis rajtuk nagy mennyiségű TXA2 receptor fejeződik ki, melyek liganddal való kötődésével különböző biológiai hatások jelentkeznek, mint például aktiválódik a foszfatidil-inozitol specifikus foszfolipáz C (PLC), aktiválódik a PKC (protein-kináz C), így jelentős DNS szintézis, kontrakció, illetve extracellulársi mátrix képződés indul meg (6.Ábra).
|
Az elmondottak alapján sok új információnk van a TXA2 vesében betöltött szerepéről, melynek segítségével hatékonyabban ismerhetjük meg a nephronok működését, mindazonáltal ne feledjük, eme eikozanoid vesei feladatának kutatása még folyamatban van (Bresnahan és mtsai, 1996).
Tromboxán vesében okozott hatásai
A thrombocytákban és vasculáris simaizomsejtekben különböző struktúrájú agonista és antagonista ligandokat vizsgálva feltételezhető, hogy a szövetnek specifikus heterogenitása van. Ez bizonyíték lehet a TXA2 és PGH2 receptorok szövetspecifikus heterogenitásának létezésére. Néhány receptor a foszfolipáz C-n keresztül fejti ki hatását.
A tromboxán és a PGH2 számos olyan reakciót indít el a vesében, melyek hozzájárulnak az ott fellépő betegségek fejlődéséhez. Ezek alatt értendő a glomerulusba belépő és kilépő arteriola összehúzódása, az intraglomerulásris thrombocyta aggregáció, mesangiális sejtek kontrakciója, és azok mátrixának elburjánzása.
Ezeket a hatásokat képesek vagyunk szemléltetni, ha TXA2/PGH2 analógokat és radioaktív ligandokat alkalmazunk. Így feltételezhető egy, a glomerulusban lévő specifikus kötőhelyek receptorcsoportja, mely még nem tisztázott, hogy különböző szubtípusa-e a thrombocytákban illetve erek simaizmaiban lokalizálódó receptoroknak, vagy affinitásuk a TXA2 és PGH2-höz teljesen megegyezik.
Az információ rávilágít eme rendszer funkcionális fontosságára. Ha például a tromboxán szintézist véletlenszerűen gátoljuk, PGH2 felhalmozódást fogunk tapasztalni.
- TXA2-nek tulajdonítanak még ezenkívül ideg-, immunrendszeri sérüléseket, krónikus vesebetegségeket és a veseimplantációk sikertelenségét is. Mindezek állatokban jelentkeznek főleg, de emberben is előfordulhatnak behatárolt kereteken belül.
Így a vesekárosodások kezelésében nagy szerepet fog kapni a farmakológiás TXA2 szintézis vagy esetleg reakcióspecifikus inhibitorok is. Mivel eme eikozanoid veseszövetre kifejtett hatása (in vitro), és gyógyszerekkel gátolható szintézise és működése (in vivo) jelentős előrelépést jelentett, a későbbiekben így új szerek kezelésbe vonása talán még ígéretesebb eredményeket hoz majd (Remuzzi és mtsai, 1992).
Preeclampsia
Preeclampsia a legfőbb okozója a magzati elhalálozásoknak és megbetegedéseknek, perinatális halálnak, koraszülésnek, és intrauterinális növekedés korlátozásnak.
Preeclampsia egy multiszisztematikus, kivételes rendellenessége a humán terhességnek, aminek kialakulása tisztázatlan. A placenta abnormális vasculáris válasza alakul ki, ami együtt jár egy megemelkedett szisztematikus vasculáris rezisztenciával, fokozott thrombocyta aggregációval, a koagulációs rendszer aktivációjával és az endotheliális sejtek diszfunkciójával.
Kialakulása okának tartják a károsodott, ischaemiás vagy reperfúzionált placentát valamint a nem megfelelő vagy túlzott anyai gyulladásos választ, ami a trophoblastok felé irányul; az endothelium megváltozása is egyik oka lehet betegség patofiziológiájának.
A leggyakoribb klinikai megnyilvánulása a betegségnek az endotheliális diszfunkció vagy az endotheliális sejtek nem megfelelő aktivációja, valamint az endothel sejtek megemelkedett permeabilitása és a thrombocyta aggregáció.
Az endotheliális diszfunkció a vasodilatátor prosztaglandinok termelésének csökkenését okozza, leginkább a prosztaciklinét és a nitrogén-oxidét. A megemelkedett vasoconstrictor tromboxán A2 szint tovább csökkentheti az uteroplacentális véráramlást a spirális artériában trombózis és placentális infarktus generálásával. Az endothel sejtek diszfunkcióját és a thrombocyta aggregációt megelőzi a trombin szint megemelkedése és a fibrin formáció kialakulása. A nem megfelelő produkciója az antiaggregációs prosztaciklinnek, nitrogén-oxidnak –vagy mindkettejüknek- biztosít elfogadható magyarázatot a felület mediált vérlemezke aktivációnak a spirális artéria belső felületén. A vérlemezkék összetapadnak, és alfa-granulumot valamint denz-granulumokat termelnek: speciálisan a tromboxán A2-t és szerotonint. Ez hozzájárul a thrombocyta aggegációhoz, emelve a fibrinháló létrejöttét, főleg az uteroplacentális cirkulációban (Sibai és mtsai, 2005).
A kutatások leginkább e betegség prevenciójára irányulnak. Egyik közülük az alacsony dózisú aszpirin adagolása. Az aszpirin csökkenti a tromboxán termelődését azáltal, hogy szelektálja a thrombocyták által termelt eikozanoidokat: főképp a PGI2 termelődését apasztja. A kísérlet kimutatta, hogy a PGI2 csökkent szintje az elsődleges oka a preeclampsia kialakulásának, mintsem a tromboxán nagyobb koncentrációja. Ez másodlagos problémaként szerepel, és ez az oka annak, hogy a tromboxán redukciója nem hatásos preeclampsia kórképének megelőzésében (Mills és mtsai, 1999).
Korreláció a csökkent prosztaciklin-TXA2 arány és központi apnoé között koraszülött csecsemőkben
A prosztaciklineknek vasodilatator, míg a TXA2-nek összehúzó hatása van a tüdő ereire.
Egy tanulmány célja annak a hipotézisnek a vizsgálata volt, hogy vajon a visszatérő központi apnoé koraszülött csecsemőkben korrelált-e a csökkenő prosztaciklin-tromboxán A2 aránnyal.Tizenkét – az apnoé klinikai eseteivel vizsgált – koraszülött csecsemőt vetettek össze tizenkét kontroll csecsemővel.
A vizeletben 2,3-dinor-6-keto-PGF1alfát és 2,3-dinor-TXB2-t determináltak, melyek aránya korrelációt mutatott az éjszakai órákban mért centrális apnoék számával. Két másik kísérleti csoportban is hasonló eredmények születtek, így az eredmény szignifikánsnak tekinthető. Az alábbiakban tárgyalt patomechanizmus képes csökkent pulmonális oxigenizációt okozni.
A patogén mechanizmusok, melyek oxigén deszaturációs szakaszokhoz vezetnek koraszülött, és megfelelő időben világra jött csecsemőknél, még nem teljesen tisztázottak. Kockázati tényezők közé sorolható a korai bronchopulmonalis dysplasia és légzési distressz szindróma. Az utóbbi állapotban hypoxaemia következtében előfordulhat, hogy a pulmonalis kapillárisok részben kikerülik a szellőztető alveolusokat. A tüdőben jelentkező érrendszeri ellenállást és kapillárisban zajló véráramlást befolyásolhatják olyan tényezők, mint például acidaemia, légúti elzáródás és endogén hormonok, beleértve a prosztanoidokat.
Szignifikánsan magas a korreláció a központi apnoék száma és a deszaturáció-prosztanoid arány között. Az alacsony prosztanoid arány bizonyíték erejű a vizsgálati csoportban, míg az apnoék száma szignifikánsan magas.
A csökkenő prosztanoid arányt a vasoconstrictiót okozó TXA2 legfőbb metabolitja, a 2,3-dinor-TXB2 vizelettel kiválasztódó növekvő mennyisége okozza (Hoch és Bernhard, 1999).
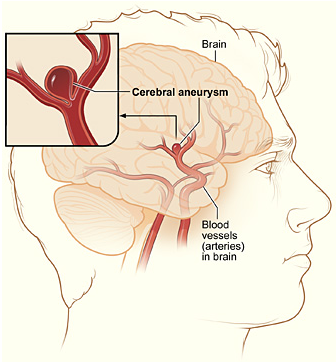
Tromboxán szerepe a subarachnoidalis hemorrhagia esetén
A spontán kialakuló subrachnoidalis hemorrahgia (SAH) egy intracraniális aneurysma (7.Ábra) felrepedésével keletkezik, világszerte korai halálozások és bénulások okozója. Ez a cerebrovascularis betegség okozza a stroke által kiváltott halálesetek felét. Kutatások szerint a betegek 50%-a 30 napon belül meghal, a halálozások 2⁄3-a 48 órán belül jelentkezik.
|
Kísérletek, ezekből levont következtetések
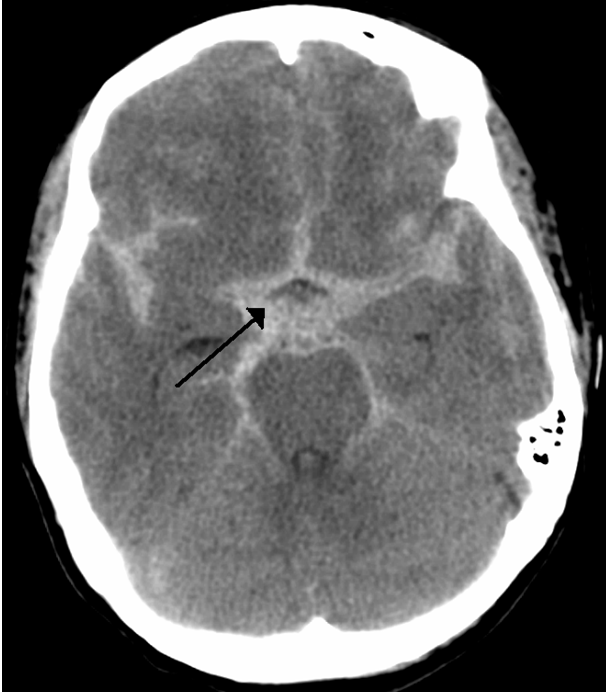
Patkányok agyába (a cisterna prechiasmaticába) 250 µl vért fecskendezve subarachnoidalis vérzést (SAH) váltottak ki (8.Ábra). Cisterna prechiasmatica: cisterna interpeduncularis kiterjedése a chiasma optica elé.
|
Az agyi artériák angiografikus vizsgálata során megállapítottak egy bifázisos érgörcsöt:
- 10. percnél egy maximális akut agyi kontrakció
- egy későbbi, 2 nappal a SAH utáni maximális vasoconstrictio
- Ez alapján a SAH egy bifázisos betegség:
- korai fázis, vagy short-lived phase rögtön a SAH után
- későbbi fázis: meghosszabbodott, krónikus
A SAH után megjelenő késői agyi ischaemia (adott terület vérellátási zavara, ezzel a celluláris metabolizmushoz szükséges oxigén- és táplálékhiányt okoz) multifactorialis:
- szabad hemoglobin
- szabad gyökök fokozott jelenléte
- gyulladásos reakciók
- központi idegrendszer diszfunciója
vasoactiv anyagok fokozott jelenléte
A tromboxán (TXA2) a tromboxán receptorokhoz (TP) kötődve fejti ki hatását. A receptor aktiválódása több folyamatot eredményez:
simaizom kontrakció
- vérlemezke aggregáció
- intravascularis hemostasis
Ezek alapján fontos szerep a cerebralis ischaemia pathogenesisében, myocardialis infarktusban és atherosclerosisban. A SAH globális és helyi agyi véráramlás csökkenést eredményez, ez a cerebralis artériák és kapillárisok simaizomsejtjeinek megnövekedett TP receptor expressziójával hozható összefüggésbe. Ennek következményeként fokozódik a SAH utáni vascularis tónus, mely ischaemiához vezet.
Az arachidonsav metabolizmus során PG2 és PGH2 képződik:
- a tromboxán-szintáz a PGI2 TXA2 átalakulást,
- míg a PGI-szintáz a PGH2 PGI2 átalakulást katalizálja.
Normál patophysiologiás körülmények között egyensúly van a vasoconstrictor TXA2 és a vasodilatator PGI2 között. SAH esetén előfordulhat, hogy felborul az egyensúly, és a TXA2 produkció válik dominánssá. Fontos megemlíteni, hogy a TXA2 közvetlen prekurzora, a PGH2, szintén kötődik a TP receptorokhoz, ezzel vasoconstrictiot idéz elő.
Több tanulmány is alátámasztja, hogy a TP receptorok fontos szerepet játszanak a cerebrális ischaemia kialakulásában, és vasculáris proliferációt, illetve kontractiót idéznek elő, valamint a TP receptor gén összefüggésbe hozható az agyi infarktusra való nagyobb hajlammal.
Emelkedett TXA2 szintet mértek egy subarachnoidalis vérzést (SAH) szenvedett ember cerebrospinalis folyadékában (CSF). Emellett, megnövekedett TXA2 bioszintézist figyeltek meg intracerebrális hemorrhagiában és ischaemiás strokeban szenvedő betegeknél egyaránt. A stroke rossz kimenetelének hátterében többnyire az akut fázisban megemelkedetten szintetizálódó TXA2 állhat (Saema és mtsai, 2010).
Kísérleti próbák a betegség kezelésére
Ezek ellenére a kísérleti tromboxán receptor gátlás nem hozta meg a várt eredményeket. Átmeneti cerebrális ischaemia után egy kutyát TP receptor blokáddal kezelve a cerebralis ischaemia mértéke csökkent.
Egy másik kísérletben kimutatták, hogy a TXA2 szintetáz inhibitor, orzgarel, megelőzi a cerebralis vasospasmust egy hagyományos értelemben vett hemorrhagiás kutyában, azonban egy másik tanulmány szerint az ozgarel nem fordítja vissza az érkontractiót a krónikus fázisban.
Habár a TXA2 cerebralis ischaemiához vezethet, a prosztaglandin és tromboxán szintézist gátló anyagok mégis kevésbé hatékonyak a kísérleti és humán vasospasmus esetén.
Ezek mind arra vezethetők vissza, hogy a cerebralis ischaemia multifactoriális, illetve a tromboxán mellett jelentős mennyiségű vasoaktív anyag is szerepet játszik a kiváltásában. Ezek a rendszerek egymással szoros összefüggésben működnek, egymástól nem választhatók el. Ebből kifolyólag kezelés szempontjából egy, az egész rendszerre ható jelátviteli út gátlása lenne a legoptimálisabb, és legeredményesebb (Saema és mtsai, 2010).
Konklúzió
A fent leírtak alapján azt a következtetést vonhatjuk le, hogy a tromboxánnak leginkább a különböző szervek ereinek tágasságának szabályozásában van szerepe, a simaizom kontrakció révén. Ezáltal nagy jelentősége van a vérellátás szabályozásában. Ugyan egyik területen sem értek el még nagy áttörést ezzel kapcsolatban, a jövőre nézve igen ígéretes lehet.
Források
Bresnahan, B. A.; Le Breton, G. C.; Lianos, E. A. (1996): Localizationof authentic thromboxane A2/prostaglandin H2 receptor in the rat kidney. Kidney International; 49: 1207-1213
Hoch, B.; Bernhard, M. (1999): Reduced prostacyclin to thromboxane A2 ratio is correlated with central apneas in preterm infants. Prostaglandins & other Lipid Mediators; 58: 285–290
Mills, J. L.; Dersimonian, R.; Raymond, E.; Morrow, J. D.; Roberts, J.; Clemens, J. D.; Hauth, J. C.; Catalano, P.; Sibai, B.; Curet, L. B.; Levine, R. J.(1999): Prostacyclin and thromboxane changes predating clinical onset of preeclampsia. JAMA; 281(4): 356-362
Minamino, T.; Ito, Y.; Ohkubo, H.; Hosono, K.; Suzuki, T.; Sato, T.; Ae, T.; Shibuya, A.; Sakagami, H.; Narumiya, S.; Koizumi, W.; Majima, M. (2012): Thromboxane A2 receptor signaling promotes liver tissue repair after toxic injury through the enhancement of macrophage recruitment. Toxicology and Applied Pharmacology; 259: 104-114
Minamino, T.; Ito, Y.; Ohkubo, H.; Shimuzu, Y.; Kojo, K.; Nishizwa, N.; Amano, H.; Narumiya, S.; Koizumi, W.; Majima, M. (2015): Adhesion of platelets through thromboxane A2 receptor signaling facilitates liver repair during acute chemical-induced hepatotoxicity. Life Sciences; 132: 85-92
Remuzzi, G.; Fitzgerald, G. A.; Patrono, C. (1992): Thromboxane synthesis and action within the kidney. Kidney International; 41: 1483-1493
Saema, A.; Carl, L.; Aida, M.; Lars, E. (2010): Subarachnoid hemorrhage induces enhanced expression of thromboxane A2 receptors in rat cerebral arteries. Brain research; 1316: 163-172
Sibai, B.; Dekker, G.; Kupferminc, M. (2005): Pre-eclampsia. Lancet; 365: 785-99
Takaaki, A.; Kazuhisa, T.; Nobuyuki, T.; Eikatsu, T.; Yoshiyuki, T.; and Keishi, A. (1995): Rat kidney thromboxane receptor: Molecular cloning, signal transduction, and intrarenal expression lokalization. The journal of clinical investigation; 96: 657-664
Xiang, B.; Yan, W.; Gao, H.; Luo, Z.; Chen, L.; Wang, W. (2016): The improvement of ginseng polysaccharides against Hepatic Reperfusion Injury on energy metabolism in rabbits and its mechanism. International Journal of Research in Pharmacy and Biosciences; 3(6): 34-48
Ábrajegyzék
1.ábra: Bartha T. : Endokrinológia előadás diasora, 392. dia
2.ábra: Bartha T. : Endokrinológia előadás diasora, 404.dia
3.ábra: Jócsák G. : Izomélettan előadás diasora, 15.dia
4.ábra: Jócsák G. : Izomélettan előadás diasora, 17.dia
5.ábra: Molnár M.
6.ábra: Kórik Cs.
7.ábra:https://en.wikipedia.org/wiki/Intracranial_aneurysm#/media/File:Cerebral_aneurysm_NIH.jpg
8.ábra:https://en.wikipedia.org/wiki/Subarachnoid_hemorrhage#/media/File:SubarachnoidP.png