|
Size: 23889
Comment:
|
Size: 23908
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 15: | Line 15: |
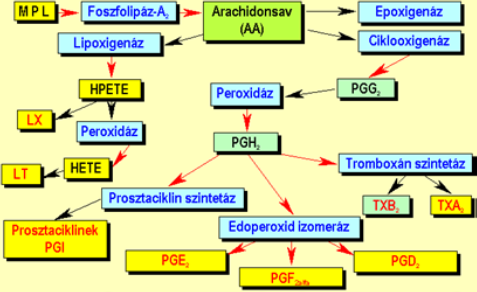
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:1.ábra.png|felugró szöveg}} <<BR>>'''1. Ábra'''<<BR>>''Az eikozanoidok keletkezése'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:1.ábra.png|felugró szöveg}} <<BR>>'''1. Ábra'''<<BR>>''Az eikozanoidok keletkezése'' || |
| Line 23: | Line 23: |
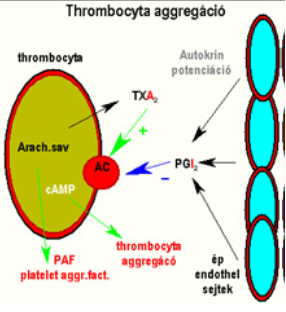
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:2.ábra.png|felugró szöveg}} <<BR>>'''2. Ábra'''<<BR>>''A thrombocyta aggregáció'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:2.ábra.png|felugró szöveg}} <<BR>>'''2. Ábra'''<<BR>>''A thrombocyta aggregáció'' || |
| Line 37: | Line 37: |
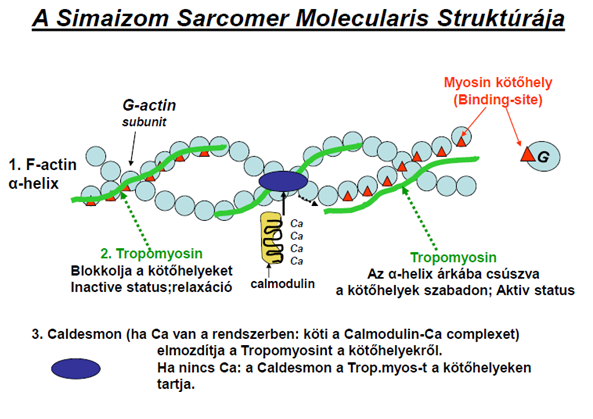
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:3.Ábra.png|felugró szöveg}} <<BR>>'''3. Ábra'''<<BR>>''Aktin felépítése a simaizmokban'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:3.Ábra.png|felugró szöveg}} <<BR>>'''3. Ábra'''<<BR>>''Aktin felépítése a simaizmokban'' || |
| Line 40: | Line 40: |
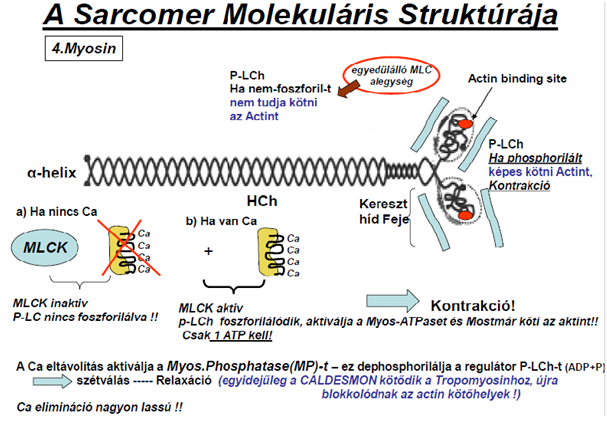
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:4.Ábra.png|felugró szöveg}} <<BR>>'''4. Ábra'''<<BR>>''Miozin felépítése a simaizmokban'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:4.Ábra.png|felugró szöveg}} <<BR>>'''4. Ábra'''<<BR>>''Miozin felépítése a simaizmokban'' || |
| Line 88: | Line 88: |
| . __A tubulusok receptoreloszlása:__ proximális tubulusokban főként a kefeszegély mentén . ♦distalis kanyarulatos és a vastag felszálló csatornák luminalis felszínén fordulnak elő |
. '''A tubulusok receptoreloszlása:''' __proximális tubulusokban__ főként a kefeszegély mentén,a __distalis kanyarulatos__ és a __vastag felszálló__ csatornák luminalis felszínén fordulnak elő |
| Line 111: | Line 110: |
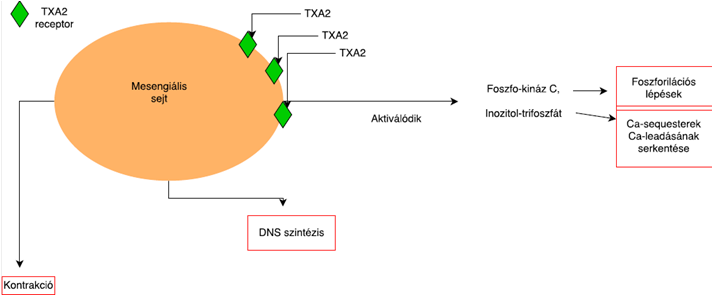
| ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0;"style="padding:0.5em; ;text-align:center"> {{attachment:6.Ábra.png|felugró szöveg}} <<BR>>'''6. Ábra'''<<BR>>''A TXA2 mesengiális sejtek által kifejtett hatása'' || | ||<tablebgcolor="#eeeeee" tablestyle="float:center;font-size:0.85em;margin:0 0 0 0; "style="padding:0.5em; ;text-align:center"> {{attachment:6.Ábra.png|felugró szöveg}} <<BR>>'''6. Ábra'''<<BR>>''A TXA2 mesengiális sejtek által kifejtett hatása'' || |
Itt írjon a(z) TromboxanSimaizom-ról/ről
Contents
A tromboxán
A tromboxán egy nagyon jelentős eikozanoid. Két fajtája ismert: TXA2, TXB2
Az eikozanoidok mindenféle sejtben képesek szintetizálódni. Kiinduló vegyületeik a membránalkotó lipidek, melyekből foszolipáz A2 hasítása révén 20 szénatomszámú arachidonsav keletkezik (Δ5, 8, 11, 14 és Ω6). Eme esszenciális zsírsavból több reakcióút indulhat meg: epoxigenáz út, lipoxigenáz út (lipoxinok-LX, leukotriének-LT) és a ciklooxigenáz út. A tromboxán az utóbbi eredményeként jön létre tromboxán szintetázok által. Ugyanezen út végtermékei a prosztaciklinek(PGI) és prosztaglandinok(PGE2, PGF2alfa, PGD2) is.
Maga a foszfolipáz A2 működése G-fehérjéhez kapcsolt folyamat, mely akkor indul meg, ha megfelelő farmakon (pl. Ca-ion) aktiválja a 7M-receptort, az pedig a hozzá kapcsolódó G-proteint, mely végül beindítja az enzimműködést.
Pár érdekesség a foszfolipáz A2-ről: egyes kígyók, pókok mérgében fellelhető, hemolízist okoz. Az enzim a membránalkotó lipidek felépítésében résztvevő glicerin 2. szénatomjáról hasítja le az arachidonsavat, a lipidből pedig lizolecitin/lizokefalin lesz, növelve így a membrán rigiditását.
|
A TXA2 legalapvetőbb szerepe a thrombocyta aggregáció kialakítása.
Az érfal endothel sejtjei normál működéskor PGI2-t (és NO-t) termelnek, melyek az adenilát-ciklázon keresztül növelik az IC-tér cAMP szintjét, ezzel akadályozzák a PLA2 működését. Sérülés hatására azonban megáll a PGI2 szintézis, illetve megindul a TXA2 termelés, mely csökkenti a cAMP szintet, és thrombocyta aggregációt okoz. Ez a folyamat a fehér thrombus kialakulásának stimulátora.
|
A TXA2 a bronchus-kontrakcióban talán a legfontosabb eikoszanoid. Jelentős konstrictora az umbilicalis ereknek, ugyanakkor a koronáriákat és vesemedencét is képes összehúzni, mikor a szöveteket a lokális vérhiányos (ischemia) állapotukból kell megszabadítani.
A simaizomkontrakcióról röviden
A kontrakció – csakúgy, mint a harántcsíkos izomban – a csúszófilamentum modell alapján jellemezhető. Az aktin és miozin összekapcsolódását a MLCK (myozin-light-chain-kinase) indítja el, ha az IC Ca-ion szint a megfelelő értékre emelkedik. A kontrakció addig tart, míg a MP (myosin-foszfatáz) le nem hasít a komplexről egy foszforil csoportot. Akkor ugyanis újra kettéválik az aktin és miozin molekula, vagyis az izom relaxál.
Ez nem a minden vagy semmi elve alapján működik, hiszen a simaizom folyamatos, enyhe kontrakció alatt áll. Ez határozza meg a két enzim (MLCK és MP) aktivitásának egymáshoz viszonyított arányát. Fontos különbség a harántcsíkolt izomhoz képest, hogy az aktin molekulán a tropomiosint egy Caldesmon nevű molekula rögzíti, ami Ca hatására megköti a Calmodulin-Ca komplexet, a tropomiosin lecsúszik az alfa-hélix árkába, így szabaddá teszi a miozin kötőhelyeket.
|
|
Simaizom található az erek, bronchusok, belső szervek falában. Alapvető, az élethez nélkülözhetetlen mozgásokat kiviteleznek. Ilyen sajátos mozgás például a nyelőcső simaizomzata által keltett perisztaltikus mozgás.
Máj regeneráció
A máj figyelemre méltó megújuló képessége teszi lehetővé a májtömeg működésének helyreállítását toxikus vagy egyéb behatások okozta sérülések miatt.(3.)
Tromboxán A2 a májban
A tromboxán A2 egy erős stimulátora a trombocita aktivációnak, valamint a simaizom összehúzódásnak. A hatását a G-proteinhez kötött receptoron fejezi ki, aminek a neve tromboxán prosztanoid receptor. TXA2 termelése túlszabályozott olyan patológiai állapotok alatt, mint az ishaemia, gyulladás és atherosclerosis. Továbbá, a Kupffer sejtek által termelt TXA2 hozzájárul az akut májgyulladás kialakításához endotoxemia, májreperfúzió és cholestasis során. A TP receptor a máj szinuszoid endotheliális sejtjeiben található, valamint a Kupffer sejtekben. Bizonyított tény, hogy a TXA2 aktiváció felelős a májregenerációért májektómia után. (3.)
A giseng poliszacharidok hatása
A vérlemezkék adhéziója a májregenerációban(2.)A Hepatic Ischemia Reperfusion Injury (HIRI), ami gyakran előfordul máj transzplantáció, májlebeny eltávolítás és szívinfarktus során; akut májkárosodáshoz vezethet. Számos tanulmány kimutatta, hogy az energia metabolizmus betegségeinél, az oxigén szabadgyökök miatti károsodásnál a nem kiegyensúlyozott, NO/ET és a TXA2/PGI2 termelés a fő problémaokozó.
A fiziológiás körülmények között szekretált bizonyos anyagok képesek szabályozni a simaizom összehúzódást, beleértve az arachidonsav metabolitjait, mint például a PGI2 és TXA2, valamint a NO és ET. Ezek az anyagok relatív körülmények között egyensúlyban vannak. Az utóbbi években kimutatták, hogy a NO/ET egyensúlytalansága egy fontos kockázati tényező a máj mikrokeringés károsodásában a reperfúziós ischaemia során. Az egyensúly PGI2 valamint a TXA2 hatása a stabil metabolitjainak arányától függ, azaz a TXB2/ PGF1 aránytól. Hypoxia és gyulladás során az endotheliális simaizom sejtválasz károsodik, és a NO/ET , TXB2/PGI1 arány kikerül az egyensúlyi állapotból. A reperfúzió a vaszkuláris endothelsejtek megnagyobbodását okozza, valamint a vérlemezkék lerakódását és ezáltal a kapillárisok blokkolását. Kialakul egy úgynevezett no-reflow jelenség. Továbbá a mikrocirkuláció diszfunkciója a májsejtek energiametabolizmusának károsodását okozza és tovább súlyosbíthatja a betegséget.

5. Ábra
NO/ET és TXB2/PGI1 arányának eltolódásának következményeiEz az imbalacia ginzeng poliszacharid injekció hatására helyreállt, mivel ezen anyag a gyulladást kiváltó tromboxán és prosztaglandin arányát csökkentette. A ginseng poliszacharid feltételezhetően a reperfúziós májgyulladásnál elősegíti az energia metabolizmust azáltal, hogy emeli az antioxidációs készséget és szabályozza a NO/ET és a TBX2/PGF1alfa termelését. A ginseng poliszaharid a legaktívabb anyaga a ginsengnek; tanulmányok kimutatták, hogy ezen poliszaharidok ellenállnak a szabadgyökök károsító hatásának, beavatkoznak a sejt apoptózisába.
A vérlemezkék adhéziója a májregenerációban
A vérlemezkék feltételezhetően fontos szerepet játszanak a májregenerációban, a gyógyulásban májkimetszés után, valamint akut májgyulladás esetén. Vérlemezke eredetű szerotonin mediált folyamat a májsejtek proliferációja. A tromboxán prosztanoid receptor által végbemenő jelzések szerepet játszanak a gyulladás és a szövetsérülés kialakulásában a vérlemezkék összetapadása által. Más részről a TP receptor jelzései részt vesznek a szövetregenerációban és a tumor növekedésben is a véredények képződésén keresztül.
A vérlemezkék kis speciális vérsejtek, melyek a csontvelő megakaryocitáiból származtathatóak, mint sejtmag nélküli citoplazmatikus testek. Habár a fő funkciójuk a vérzés megállítása szövet-és érsérülés esetén, a vérlemezkék a gyulladás kialakításában valamint a szövetregenerációban is szerepet játszanak parakrin úton vagy direkt sejt-sejt interakció által.
A TXA2 működése patológiás állapotoknál túlszabályozott, azáltal, hogy a vér sejtjei közötti interakciót stimulálja, különösen a vérlemezkék és a mikrovaszkuláris endotheliális sejtek közt létrejövő kapcsolatot. Akut gyulladás során a TXA2/TP receptor út működése figyelhető meg, amelynek aktivációja fokozza a proinflammációs mediátorok és a tumor necrosis factor alpha (TNF-alfa) termelését. Ezen anyagok megemelkedett szintje mikrokeringési diszfunkciót vált ki, valamint az endotheliális leukociták interakcióját.
Ezek a tények a tromboxán gyulladáskeltő szerepét mutatják be, azonban a TP receptorok szignáljai szabályozzák a szinuszoidok raktározó képességét is, hogy helyreállítják a károsodott májszövetet, valamint serkentik a makrofágok működését. A TXA2 angiogenezis stimuláló anyagként szerepelhet, mely még ezen felül elősegíti a cytokinek termelését is, melyek proangiogenikus faktorként segítik elő a trombocita aktivációt. (2.)
Tromboxán A2 receptor jelzések támogatják a májszövet regenerációját a makrofágok számának fokozásával
A gyógyulás folyamatát a májsejtek proliferációs képessége és a nekrotikus sejtek eltávolítása teszi lehetővé. A nem működő sejtek eltakarításáért a makrofágok és a monociták felelősek, habár az általuk termelt kémiai anyagok az ép sejteket is károsíthatják. Egereken végzett kísérletek igazolják, hogy a TP receptor jelzései szerepet játszanak a májregenerációban, azáltal, hogy elősegítik nemcsak a máj növekedési faktorának traszkripcióját, hanem a makrofágok felületén található monocyte chemoattractant protein-1 (MCP-1/CCL2) receptor megjelenését is. Ezen receptor megjelenése hozzájárul a makrofágok mihamarabbi toborzásához a sérült májba.(3.)
A tromboxán A2 szerepe biztos a gyulladás kialakításában a májban, azonban számos kísérlet munkálkodik azon, hogy a májregenerációhoz való hozzájárulása is végleg bizonyítást nyerjen, ugyanis még számos aktiválási és egyéb mechanizmusa nem tisztázódott.
TXA2 receptorok a vesében
A vesében a renalis véráramlás, a glomerulációs filtrációs ráta és a a tubuloglomerularis feedback csökkenését okozza. Így bonyolult renalis vér-, vízáramlás és elektrolit anyagcserét tesz lehetővé. A TXA2 szerepet játszik a kórokozók kutatásában, egyes renalis betegségek kórélettanában, mint például a nephritis, transzplantáció kilökődése, illetve húgyuti traktusműködés akadályozása.
A thromboxán szintézis aktivitásának csökkentésével, vagy a TXA2 receptor kötődés blokkolásával megelőzhető az általuk okozott renalis károk kifejeződése. (4.)
Az autentikus TXA2 és PGH2 receptorok helyeződése a patkány veséjében
Polyclonális antitestet használva a TXA2 és PGH2 receptorfehérjék ellen, a mikroszkopikus immunkfluoreszcencia normál módszerével megállapítható azok eloszlása egy fiziológiás patkányvesében. A receptorok mind a glomerulusokban, mind a tubulusokban jelen vannak. Kiemelkedő a számuk a glomerulus kapillárisok lumene mentén. A Bowman-tok epitheliális sejtjei, a podocyták és mesengiális sejtek is mutatnak érzékenységet az immunfluoreszcenciális reakcióra.
A tubulusok receptoreloszlása: proximális tubulusokban főként a kefeszegély mentén,a distalis kanyarulatos és a vastag felszálló csatornák luminalis felszínén fordulnak elő
- Ezek a megállapítások rámutattak arra, hogy a TXA2 által a vesében jelentkező károk ezen eikoszanoid szintézisének javításával meghatározhatók.
Számos, patkány vesén végzett vizsgálat foglalkozik a veseszövetben lévő TXA2 szintézisével, sejteredetével. Ezek a tanulmányok kimutatták, hogy a TXA2 főleg a glomerulusokban termelődik, ugyanakkor a vesetubulus hámsejtjeiben a képződése minimális vagy észrevehetetlen.
A TXA2 nem a legfontosabb eikoszanoid, melyet a glomerulus vagy glomerulus sejtkultúra állít elő. Számuk jelentősen alacsonyabb, mint az egyéb eikoszanoidoké, ilyen például a PGF2alfa, vagy PGE2.
- Habár egy glomerulus sérülést nyomon követve, a TXA2 szintézise jelentősen fejlett az izolált területen.
Ezt mutatták ki glomerulus sérülések számos kísérleti formájában:
- ♦ antitest közvetítette sérülés
- ♦ diabetikus glomerulopathia
- ♦veseimplantáció kilökése.
- ♦ antitest közvetítette sérülés
Ilyen esetekben a TXA2 jelzi a gyulladáskeltő sejtek eredetét, melyek főleg aktivált fehérvérsejtek, thrombocyták és beszivárgó glomerulus struktúrák. Ezen sejtek egyszeri kiürülése után a TXA2 parakrin módon képes hatni az endotheliális, mesengiális és epitheliális glomerulus sejtekre, előidézve ezzel rengeteg biológiai folyamatot. Ilyen módon lehet a mesengiális sejteket legjobban jellemezni, ugyanis rajtuk nagy mennyiségű TXA2 receptor található, melyek liganddal való kötődésével különböző biológiai hatások jelentkeznek, mint például aktiválódik a PKC (foszfo-kináz C), vagy a PI3 (Inozitol-trifoszfát), jelentős DNS szintézis, kontrakció, illetve extracellulársi mátrix képződés indul meg.
|
Az elmondottak alapján sok új információnk van a TXA2 vesében betöltött szerepéről, melynek segítségével hatékonyabban ismerhetjük meg a nephronok működését, mindazonáltal ne feledjük, eme eikoszanoid vesei feladatának kutatása még folyamatban van. (5.)
Tromboxán vesében okozott hatásai
- A trombocitákban és vaszkuláris simaizomsejtekben különböző struktúrájú agonista és antagonista ligandokat vizsgálva feltételezhető, hogy a szövetnek specifikus heterogenitása van. Ez bizonyíték lehet a TXA2 és PGH2 receptorok szövetspecifikus heterogenitásának létezésére. Néhány receptor a foszfolipáz C-n keresztük fejti ki hatását.
- A tromboxán és a PGH2 számos olyan reakciót indít el a vesében, melyek hozzájárulnak az ott fellépő betegségek fejlődéséhez. Ezek alatt értendő a glomerulusba belépő és kilépő arteriola összehúzódása, az intraglomerulásris trombocyta aggregáció, mesengiális sejtek kontrakciója, és azok mátrixának elburjánzása.
- Ezeket a hatásokat képesek vagyunk szemléltetni, ha TXA2/PGH2 analógokat és radioaktív ligandokat alkalmazunk. Így feltételezhető egy, a glomerulusban lévő specifikus kötőhelyek receptorcsoportja, mely még nem tisztázott, hogy különböző subtípusa-e a trombocytákban illetve erek simaizmaiban lokalizálódó receptoroknak, vagy affinitásuk a TXA2 és PGH2-höz teljesen megegyezik.
- Az információ rávilágít eme rendszer funkcionális fontosságára. Ha például a tromboxán szintézist véletlenszerűen gátoljuk, PGH2 felhalmozódást fogunk tapasztalni.
- TXA2-nek tulajdonítanak még ezenkívül ideg-, immunrendszeri sérüléseket, krónikus vesebetegségeket és a veseimplantációk sikertelenségét. Mindezek állatokban jelentkeznek főleg, de emberben is előfordulhatnak behatárolt kereteken belül.
Így a vesekárosodások kezelésében nagy szerepet fog kapni a pharmakológiás TXA2 szintézis vagy esetleg reakcióspecifikus inhibitorok is. Mivel eme eikoszanoid veseszövetre kifejtett hatása (in vitro), és gyógyszerekkel gátolható szintézise és működése (in vivo) jelentős előrelépést jelentett, a későbbiekben így új szerek kezelésbe vonása talán még ígéretesebb eredményeket hoz majd. (6.)
Preeclampsia
Pre-eclampsia a legfőbb okozója a magzati elhalálozásoknak és megbetegedéseknek,perinatális halálnak,koraszülésnek, és intrauterinális növekedés korlátozásnak.
Pre-eclampsia egy multiszisztematikus, kivételes rendellenessége a humán terhességnek, aminek kialakulása tisztázatlan. A placenta abnormális vaszkuláris válasza alakul ki, ami együtt jár egy megemelkedett szisztematikus vaszkuláris rezisztenciával, fokozott trombocita aggregációval, a koagulációs rendszer aktivációjával és az endotheliális sejtek diszfunkciójával.
Kialakulásának okának tartják a károsodott, isémiás vagy reperfúzionált placentát valamint a nem megfelelő vagy túlzott anyai gyulladásos választ,ami a trophoblastok felé irányul;az endotélium megváltozása is egyik oka lehet betegség patofiziológiájának.
A leggyakoribb klinikai megnyilvánulása a betegségnek az endotheliális diszfunkció vagy az endotheliális sejtek nem megfelelő aktivációja, valamint an endothel sejtek megemelkedett permeabilitása és a trombocita aggregáció.
Az endotheliális diszfunkció a vazodilatátor prosztaglandinok termelésének csökkenését okozza, leginkább a prosztaciklinét és a nitrogén oxidét. A megemelkedett vazokonstriktor tromboxán A2 szint tovább csökkentheti az uteroplacentális véráramlást a spirális artériában trombózis és placentális infarktus generálásával. Az endothel sejtek diszfunkcióját és a trombocita aggregációt megelőzi a trombin szint megemelkedése és a fibrin formáció kialakulása. A nem megfelelő produkciója az antiaggregációs prosztaciklinnek,nitrogén-oxidnak –vagy mindkettejüknek- biztosít elfogadható magyarázatot a felület mediált vérlemezke aktivációnak a spirális artéria belső felületén. A vérlemezkék összetapadnak, és alfa-granulumot valamint denz-granulumokat termelnek: speciálisan a tromboxán A2-t és szerotonint. Ez hozzájárul a trombocita aggegációhoz emelve a fibrinháló létrejöttét, főleg az uteroplacentális cirkulációban. (7.)
A kutatások leginkább e betegség prevenciójára irányulnak. Egyik közülük az alacsony dózisú aszpirin adagolása. Az aszpirin csökkenti a tromboxán termelődését azáltal, hogy szelektálja a trombociták által termelt eikozanoidokat: főképp a PGI2 termelődését apasztja. A kísérlet kimutatta, hogy a PGI2 csökkent szintje az elsődleges oka a preeclampsia kialakulásának, mintsem a tromboxán nagyobb koncentrációja. Ez másodlagos problémaként szerepel, és ez az oka annak, hogy a tromboxán redukciója nem hatásos preeclampsia kórképének megelőzésében. (8.)
Korreláció a csökkent prosztaciklin-TXA2 arány és központi apnoé között koraszülött csecsemőkben
A prosztaciklineknek vasodilatator, míg a TXA2-nek összehúzó hatása van a tüdő ereire.
Egy tanulmány célja annak a hipotézisnek a vizsgálata volt, hogy vajon a visszatérő központi apnoé koraszülött csecsemőkben korrelált-e a csökkenő prosztaciklin-tromboxán A2 aránnyal.Tizenkét – az apnoé klinikai eseteivel vizsgált – koraszülött csecsemőt vetettek össze tizenkét kontroll csecsemővel.
A vizeletben 2,3-dinor-6-keto-PGF1alfát és 2,3-dinor-TxB2-t determináltak, melyek aránya korrelációt mutatott az éjszakai órákban mért centrális apnoék számával.Két másik kísérleti csoportban is hasonló eredmények születtek, így az eredmény szignifikánsnak tekinthető.Az alábbiakban tárgyalt patomechanizmus képes csökkent pulmonális oxigenizációt okozni.
A patogén mechanizmusok, melyek oxigén deszaturációs szakaszokhoz vezetnek koraszülött, és megfelelő időben világra jött csecsemőknél, még nem teljesen tisztázottak. Kockázati tényezők közé sorolható a korai bronchopulmonalis dysplasia és légzési distressz szindróma.Az utóbbi állapotban a hypoxaemia következtében előfordulhat, hogy a pulmonalis kapillárisok részben kikerülik a szellőztető alveolusokat.A tüdőben jelentkező érrendszeri ellenállást és kapillárisban zajló véráramlást befolyásolhatják olyan tényezők, mint például acidaemia, légúti elzáródás és endogén hormonok, beleértve a prosztanoidokat.
Szignifikánsan magas a korreláció a központi apnoék száma és a deszaturáció-prosztanoid arány között. Az alacsony prosztanoid arány bizonyíték erejű a vizsgálati csoportban, míg az apnoék száma szignifikánsan magas.
A csökkenő prosztanoid arányt a vasokonstrikciót okozó TXA2 legfőbb metabolitja, a 2,3-dinor-TXB2 vizelettel kiválasztódó növekvő mennyisége okozta. (9.)
Források
1.Xiang, B.; Yan, W.; Gao, H.; Luo, Z.; Chen, L.; Wang, W. (2016): International Journal of Research in Pharmacy and Biosciences,Volume 3, Issue 6, PP 34-48, ISSN 2394-5885 (Print) & ISSN 2394-5893 (Online)
2.Minamino, T.; Ito, Y.; Ohkubo, H.; Shimuzu, Y.; Kojo, K.; Nishizwa, N.; Amano, H.; Narumiya, S.; Koizumi, W.; Majima, M. (2015): Life Sciences 132 85–92
3.Minamino, T.; Ito, Y.; Ohkubo, H.; Hosono, K.; Suzuki, T.; Sato, T.; Ae, T.; Shibuya, A.; Sakagami, H.; Narumiya, S.; Koizumi, W.; Majima, M. (2012): Toxicology and Applied Pharmacology 259 104–114
4. Takaaki, A.; Kazuhisa, T.; Nobuyuki, T.; Eikatsu, T.; Yoshiyuki, T.; and Keishi, A. (1977-1980):RatKidney ThromboxaneReceptor: MolecularCloning, Signal Transduction, and IntrarenalExpression Localization. The Second Department of Internal Medicine, Tohoku University School of Medicine, Sendai, Japan
5. Bresnahan, B. A.; Le Breton, G. C.; Lianos, E. A. (1996): Localizationof authentic thromboxane A2/prostaglandin H2 receptor in the rat kidney. Kidney International, Vol. 49 , PP. 1207—1213
6. Remuzzi, G.; Fitzgerald, G. A.; Patrono, C. (1992): Thromboxane synthesis and action within the kidney. Kidney International, Vol. 41, pp. 1483—1493
7.Baha Sibai, Gus Dekker, Michael Kupferminc (2005): Lancet 2005; 365: 785–99
8. James L. Mills, Rebecca Dersimonian, Elizabeth Raymond, Jason D. Morrow, L. Jackson Roberts, John D. Clemens, Johns C. Hauth, Patrick Catalano, Baha Sibai, L. B. Curet, Richard J. Levine (1999): JAMA, July 28, 1999-Vol 281, No. 4 9. Hoch, B.; Bernhard, M. (1999): Reduced prostacyclin to thromboxane A2 ratio is correlated with central apneas in preterm infants. Prostaglandins & other Lipid Mediators 58 285–290
9. Hoch, B.; Bernhard, M. (1999): Reduced prostacyclin to thromboxane A2 ratio is correlated with central apneas in preterm infants. Prostaglandins & other Lipid Mediators 58 (1999) 285–290