A vérlemezkék szerepe az immunitásban
Contents
Bevezetés
A vérlemezkék a szélesebb körben elterjedt funkciójuk, azaz a véralvadásban betöltött szerepük mellett részt vesznek az immunitásban és a gyulladásos folyamatokban is. Kapcsolatot létesítenek a dendritikus sejtekkel, B- és T-lymphocytákkal és monocytákkal.
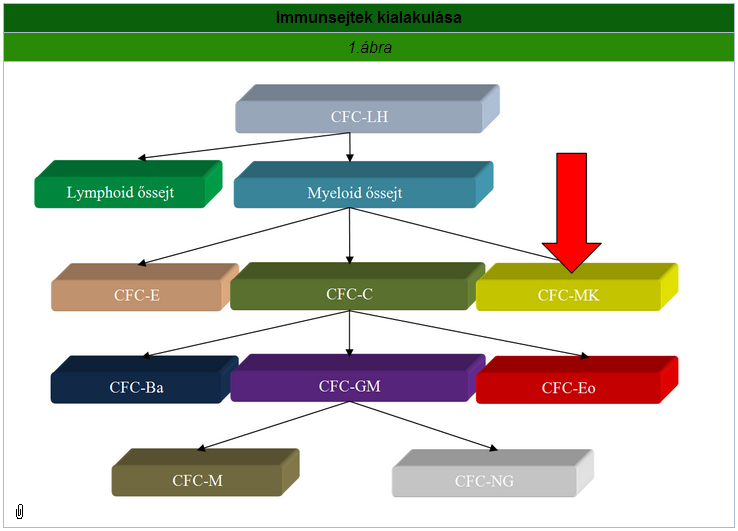
Kialakulásukat tekintve a vörös csontvelőben található omnipotens CFC-LH (colony forming cells) sejtekből jönnek létre, több lépésben. Az először kialakuló lymphoid és myeloid őssejtek közül az utóbbiak továbbosztódása következtében létrejönnek a vörösvérsejteket (CFC-E), a lymphocyták kivételével a fehérvérsejteket (CFC-C) és a thrombocytákat létrehozó (CFC-MK) hematogén őssejtek. A CFC-GM út szétválása eredményezi végül a monocytákat és a neutrophil granulocytákat. Ezen két sejt hasonló tulajdonságai innen eredeztethetőek.
A thrombocytopoesis első lépésében az eukormatinban gazdag magvú megakaryoblast, endomitózissal (csak a mag osztódik, a citoplazma nem) Promegakaryocytává alakul. Ezen sejt szabályos osztódással megakaryocyta lesz, amely endomitózisok sorozatának következtében végül 64 db sejtmagot fog tartalmazni. A sejt aktin filamentumokkal a legközelebbi sinushoz vándorol és annak lumenébe beleengedi citoplazma nyúlványait. Ezek a nyúlványok szétesve több ezer thrombocytát hoznak létre, míg a 64 db sejtmag visszamarad, és a macrophagok bekebelezik őket.
A vérlemezkék (thrombocyták)
A vérlemezkék a vérsejtek közé tartozó, mag nélküli sejtek, melyek mérete 2-5μm, számuk fajtól függően 2-8x1011 egy liter vérre nézve. 5-10 napos élettartamuk során a véráramban passzívan sodródva közlekednek, amennyiben az ép endothel sejtek által termelt prosztaciklin a thrombocyták összetapadását gátló hatása érvényesül. Az általános sejtalkotók mellett speciális granulumok találhatók bennük: sötét, Ca2+ ionokat, szerotonint és ADP-t tartalmazó delta-granulumok, illetve véralvadási faktorokat tartalmazó alfa-granulumok. Ezen szemcsék tartalma a sejthártya betüremkedése által létrejövő csatornarendszeren keresztül jut a külvilágba. A sejtekben aktin szegély és mikrotubulus rendszer található, melyek segítik a granulumokból az anyagok leadását. A szervezet számára létfontosságú thrombocyták több jelentős folyamatban vesznek részt, úgy mint a vérzéscsillapodás összetett mechanizmusának egyes lépéseiben, vagy az immunvédekezés kivitelezésében, így a homeostázis fenntartásának kritikus elemei.
A vérzéscsillapodás
- A vérzéscsillapodás célja az érfalak belső, vagy külső sérülésén keresztül történő vérveszteség megszüntetése. Első lépésként egy érreakció fog bekövetkezni, mely az érfalban lévő simaizom sejtek kontrakciójából és egyes érszűkítő anyagok hatásából(szerotonin, TXA2) áll. Ezek következtében lecsökken a sérülésen keresztül távozó vér mennyisége, illetve a mérsékeltebb véráramlás miatt a vérlemezkék kitapadása könnyebbé válik. Ezt követően a sérülés helyén megjelenő thrombocyták betömik a keletkezett folytonossági hiányt az endothel sejtek alatti kollagén réteghez kapcsolódva sejtfelületi receptoraik (adhéziós glükoproteinek) segítségével. A kisebb átmérőjű erekben nagyobb nyíróerők hatnak, itt a kitapadás az kollagén rostok hatására aktiválódott, érfalban található von Willebrand-faktoron és a vérlemezkéken található Ib glükoproteinen (GPIb) keresztül történik, sőt az endothel sejtek, monocyták és vérlemezkék által termelt trombospondin-1 fehérje is elősegíti ezt a folyamatot. A gyengébb nyíróerők esetén a thrombocyták kapcsolódása az érfal sérülés miatt szabaddá váló kollagén rostjaihoz a glükoprotein-VI (GPVI) Fc-gamma láncán keresztül megy végbe. A thrombocyták kollagénhez való kapcsolódása, azaz a primer aktiváció mellett a másodlagos kitapadás is szükséges a vérzés hatékony csillapításához. A secunder aktiváció során a véralvadási faktorok leadódnak a vérlemezkékből, filopódiumok képzése indul meg, melyek elősegítik a fehér thrombus kialakulását. Az ép endothel sejtek által termelt nitrogén-monoxid és PGI2 szint lecsökken a sejtek sérülése miatt, ennek következményeként a thrombocyták által termelt TXA2 felszabadul a gátlás alól, megindul a fokozott termelése, ez pedig a thrombocyták aktiválódásához, összetapadásához és véralvadási faktorok szekréciójához vezet. A véralvadás során fibrinogénből létrejövő fibrinháló kialakulásához szükséges enzimrendszer a vérplazmában és a thrombocytákban található és aktiválódása során mind a külső, mind a belső érfal sérülés egy közös aktiválódási úthoz vezet. Ezen út központi szerepét a X. véralvadási faktor (Stuart-Prower faktor) tölti be, mely stimulálja a prothrombin - thrombin átalakulást. A keletkező thrombin hatására a fibrinogén laza szerkezetű fibrinné alakul, illetve aktiválja a Lóránd-Laki faktort (XIII), mely stabilizálja a keletkezett fibrin hálózatot. Az így kialakuló vörös thrombus (szemben a thrombocyták aggregációjából kialakuló fehér thrombussal) fibrinhálóval összetartott vörösvérsejtekből áll és a sebgyógyulás során oldódik fel.
Az immunitás
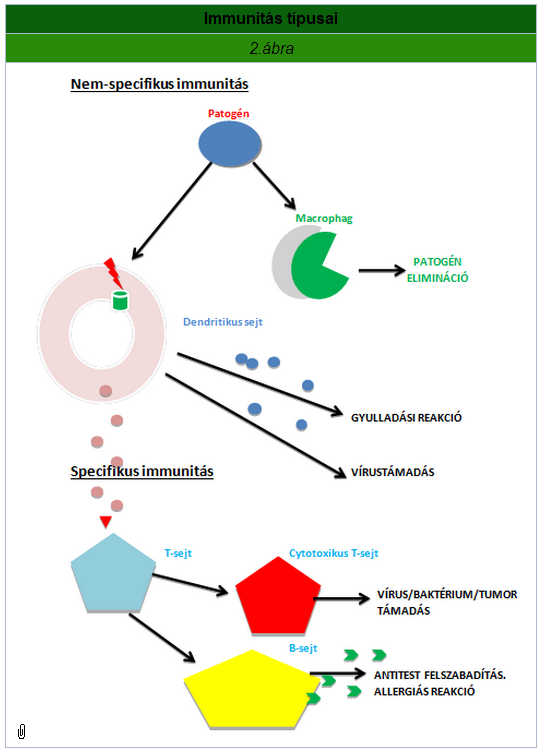
- A szervezet különböző folyamatokon keresztül védekezik az általa károsnak vélt anyagok ellen. Ezeket a folyamatokat összefoglaló néven immunfolyamatoknak hívjuk. Az immunvédekezésnek van egy gyorsan, de nem specifikusan reagáló természetes immunitás része, illetve egy lassabban, de specifikusan, így jóval hatékonyabban fellépő szerzett immunitás része. Immunválaszt kiváltó anyagok, más néven antigének lehetnek mind a szervezet saját anyagai, mind a külvilágból bejutó élő és élettelen anyagok. Az antigének széles spektrumának felismerését az teszi lehetővé, hogy az immunrendszer génátrendeződéssel gyakorlatilag korlátlan mennyiségű különböző ellenanyagot képes előre elkészíteni, mely a szervezet sajátjaként felismert, MHC (Major Histocompatibility Complex) molekulát hordozó anyagokon kívül minden antigénnel szemben fellép.
- A természetes immunitás során mind sejtes, mind humorális elemek közrejátszanak az antigének elleni harcban. A sejtes elemek közé tartoznak a phyagocytáló microphagok (neutrophil és eosinophil granulocyták) és macrophagok, a kémiai anyagokat termelő basophil granulocyták és a vírus- illetve tumorsejteket elölni képes natural killer sejtek. A humorális faktorok közé a gyulladáskeltő cytokinek, a hisztamin, illetve a komplement rendszer molekulái tartoznak. A természetes immunitás aktiválásáért az úgynevezett Toll-like receptorok a felelősek, melyek mikroorganizmusok és anyagaik felismerését végzik és végeredményben a komplementrendszer önmagát felerősítő folyamatai során gyulladás, illetve egy membránfúró jön létre, mely elpusztítja a kórokozókat a membránjuk károsításával. A szerzett immunitásnak is vannak sejtes, illetve humorális elemei egyaránt. Ha a szervezet egy antigénnel találkozva önmaga termeli meg a specifikus ellenanyagokat, akkor aktív immunitásról, míg egy másik egyedbe átvitt ellenanyagok esetén passzív immunitásról beszélünk. A szervezetbe jutó antigén hatására az aktivált immunsejtekből osztódás során létrejövő sejtek (subpopulációk) illetve az általuk termelt immunglobulinok elpusztítják az immunreakciót kiváltó anyagokat, miközben (szemben a természetes immunitással) az adott antigénre specifikus memória sejtek keletkeznek, melyek újrafertőződés esetén gyorsabb és hatékonyabb választ tesznek lehetővé. A T-lymphocyta subpopulációk a sejtes, míg a B-lymphocyta subpopulációk a humorális immunválaszért felelősek. A természetes és a szerzett immunitás között kapcsolatot kialakító sejteket dendritikus sejteknek nevezzük. A szervezetbe jutó antigén kötődik a dendritikus sejteken és egyes macrophagokon található Toll-like receptorokhoz, bekebeleződik, kisebb részekre bontódik, majd az egyes részek az említett MHC molekulákhoz kötődve megjelennek a phagocytáló sejt felületén. Az ezen molekulákat felismerő T- és B-lymphocyták aktiválódnak és beindítják az egyes antigénekre specifikus, sejtek és immunglobulinok által végrehajtott eltávolító folyamatokat.
Vérlemezkék aktiválódása
Ahhoz, hogy a vérlemezkék az immunitással kapcsolatos funkciójukat képesek legyenek ellátni, először aktiválódniuk kell. Ezen aktiválási folyamat számos módon mehet végbe (K. Jurk és B. E. Kehrel, 2008).
- Neutrophil granulocyták defenzimje által, amit a fehérvérsejtek a kórokozók elleni harcban bocsátanak ki.
- Baktériumok általi aktiváció: egy többlépéses folyamat, ami a Gram-pozitív baktériumok thrombocytákhoz való kötődésével kezdődik, a thrombospondin-1 által pedig a Gram-pozitívok kitapadásával, az endothel és az epithelium inváziójával folytatódik.
- T-sejtekhez kötött oldható CD40L, pozitív visszacsatolással képes újabb vérlemezkéket aktiválni, ami a specifikus immunvédekezés egyik fontos lépése.
- SDF-1 által, ami plazmafehérjék jelenlétében képes aktiválni a thrombocytákat, ez a gyulladásos folyamatok során jelentős.
- JAM általi aktiváció, amiket a vérlemezkék a felületükön képesek prezentálni. Kollagén és trombin általi aktiváció, amik a véralvadási folyamatok jelentős faktorai.
Vérlemezkék aktiválódása utáni folyamatok
Antimikrobiális anyagok elválasztása
Antimikrobiális anyagok közé tartoznak a kationos antimikrobiális peptidek/fehérjék és a mikrobiális fehérjék (PF-4), CCL5 (kemotaktikus citokin, béta-4-timozin (ezek származékai a trombocinidek). Ezek az anyagok a mikroorganizmusok sejthártyáját támadják meg, lyukat ütnek rajta és depolarizálják azt (K. Jurk és B. E. Kehrel, 2008). E folyamat fontos elemei a Toll-like receptorok. Ezen membránfehérjék a vérlemezkék felületén helyezkednek el. A receptorok a kórokozók felismerését teszik lehetővé és a visszatérő molekuláris jellegzetességeihez (pathogen-associated molecular patterns) kapcsolódnak pl.: egyes liposzacharidokhoz. Ha a Toll-like receptor nem működik (pl.: mutáció), akkor nem tud aktiválódni a természetes immunrendszer, tehát nem lesz megfelelő védekezés.
A P-szelektin az alfa-granulumok membránjáról a sejtmembránba kerül
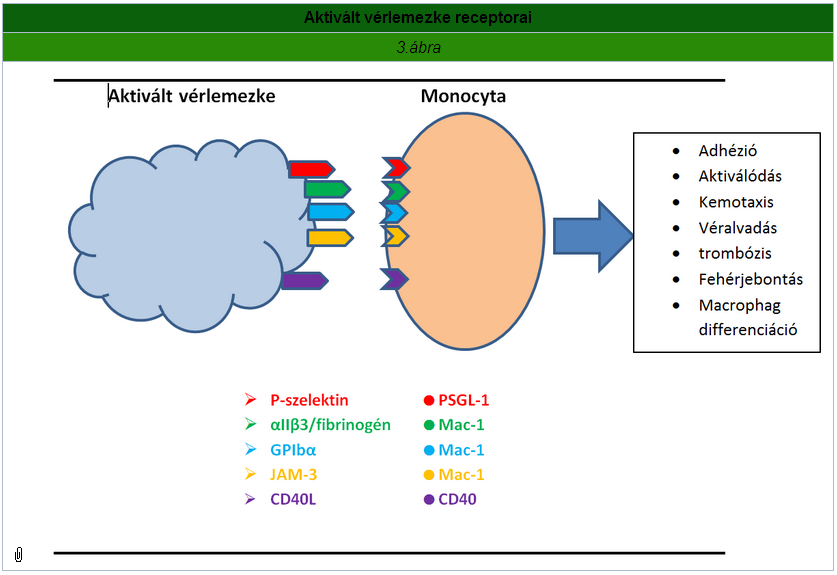
A szelektinek a gyulladásos folyamat első fázisában a kezdeti, laza kapcsolat kialakításával meghatározó szerepet játszanak. Az E-szelektin kizárólag aktivált endothel sejten, a P-szelektin az endothel sejteken és thrombocytákon, az L-szelektin pedig a fehérvérsejteken expresszálódik. A P-szelektin (CD62) egy olyan adhéziós membránfehérje, mely csak az aktivált thrombocyták és endothel sejtek felszínén jelenik meg. A thrombocytákban a P-szelektint az alfa-granulumok tartalmazzák, melyek degranulációjának eredményeként expresszálódik a felszínen. Az aktivált thrombocyták a P-szelektin révén kötődhetnek a leukocytákhoz és feltételezik szerepüket a thrombocyták egymáshoz történő aggregációjában is. Kora szülöttek alacsony P-szelektin expressziója hozzájárulhat a neutrofil granulociták csökkent mértékű kivándorlásához és a fertőzésekkel szembeni fokozott fogékonysághoz. A P-szelektin PSGL-1 révén kapcsolatot teremt az immunsejtekkel. A vérlemezkék elősegítik a lymphocyták lerakódását és elsődleges kitapadását a nyirokszervek posztkapilláris venuláiban, megteremtve a béta2-integrinek által közvetített stabil kapcsolat feltételeit. A béta-2 integrin, a leukocyták endothellel való adhézióját mediáló fehérje család, ami a CAM-1 (intracell. adhesion molecule-1) hatására lehetővé teszi a leukocyták transendotheliális migrációját a gyulladás helyére. Másik fontos lépés a monocytákhoz való kötődés. Ekkor a P-szelektin PSGL-1 hídon kis affinitású kötést alakít ki az érfal endotheljével. Béta1- és béta2- integrineken keresztül megvalósul a szoros kitapadás, ami a gyulladásos szövetben történő migráció nélkülözhetetlen feltétele. A monocyták a rájuk tapadó thrombocytákat elszállítják a gyulladt szövetbe és ott fehérvérsejtek működését befolyásolják. A thrombocyták - a fibrinogén és a vW-faktor közvetítette -, monocytákhoz és érfalhoz tapadása során az integrinek (GPIIa/IIIa és az avb-3) hídképzőként szerepelnek (Andrew S. Weyrich és Guy A. Zimmerman, 2004) (A. Trzeciak-Ryczek, B. Tokarz-Deptuła és W. Deptuła, 2013).
Felületükön endotheliális JAM-A és JAM-C fehérjéket prezentálnak
JAM-A és JAM-C fehérjék által kapcsolódhat az LFA-1-hez és a MAC-1-hez. MAC-1 kapcsolódhat a thrombocyta GPIb-jéhez is. JAM(Junctional adhesion molecula): Az immunglobulin szuperfamiliába(IgSF) tartozó proteinek kifejezett sejt csomópontok az epitheliális és endothel sejteken, valamint a leukocyták, vérlemezkék és vörösvértestek felületén. Jelentős szerepük van a különféle celluláris folyamatokban, a tight-junction kapcsolatokban, a leukocyta transzmigrációban, a vérlemezke aktivációban, az angiogenezisben és a víruskötésben. LFA-1 integrin: A T-sejtek és az antigénprezentáló sejtek közötti adhézió mediátora. Bizonyos esetekben a T-sejt aktiválódást és differenciálódást is elősegíti. MAC: Komplement receptor-3 (CR3) (CD11b/CD18) egy humán sejtfelszíni receptor, amely megtalálható a polimorfonukleáris leukocytákon (főleg neutrofilek), NK-sejteken és a mononukleáris phagocytákon (makrofágokon). CR3 egy alakfelismerő receptor, amely képes felismerni és megkötni a behatoló molekulák felületén található molekulákat. A molekulához való kötődés indukálja a phagocytosist és az idegen sejt megsemmisítését. CR3 egy olyan sejtfelszíni receptor, ami az integrinekhez tartozik (K. Jurk és B. E. Kehrel, 2008).
Felületükön megjelennek specifikus immunvédekezési fehérjék (CD40 ligand)
A CD40 ligand szerkezetében rokon a TNFa-val. A CD40 a CD40L segítségével hálózatot képez a dendritikus sejtek felületén, ami az antigénbemutató sejtek éréséhez vezet. A T -lymphocyták a CD40L-CD40 híd révén aktiválódnak. A vérplazmában oldott CD40L fő forrását a thrombocyták képzik. A T-sejtekhez kötött oldható CD40L újabb vérlemezkéket aktivál, ezek RANTES kemokint bocsájtanak ki, ami újabb T-sej aktivációt indukál. A B-lymphocyták esetében ez a folyamat a termelt immunglobulin típusának változását idézi elő: IgM helyett a továbbiakban IgG termelôdik. TNF-a: Gyulladáskor a véráramba kerülő citokin. Elsődleges szerepe az immunsejtek szabályozásában van. A TNF egy endogén pirogén, ami képes indukálni a lázat, az apoptotikus a sejthalált, a cachexiat és a gyulladást. Gátolja a tumorgenezist, a vírus replikációt és válaszol szepszisen keresztül az IL1 és IL6 termelő sejteknek (Bennett D. Elzey, Daniel L. Sprague és Timothy L. RatliV, 2005) (K. Jurk és B. E. Kehrel, 2008).
Gyulladás alatti aktiváció esetében
Gyulladás alatti aktiváció során a vérlemezkékben található proinflammatorikus kemokin, a citokin és növekedési faktorok felszabadulnak, a környezetbe kerülnek. A vérlemezkék felületén kemokinreceptorok is találhatók. Az SDF-1 receptora a nagy CXCR4 kemokinreceptor. Az SDF-1 plazmafehérjék jelenlétében képes aktiválni a thrombocytákat. Az SDF-1 azonban endothelialis progenitor sejteket is toborozhat a vérlemezkék által elzárt, sérült ér területén, elősegítve a gyógyulási folyamat megindulását (K. Jurk és B. E. Kehrel, 2008).
Betegségekben való szerepük
Heveny tüdősérülés
A tüdőben nincsenek neutrophyl granulocyták. Felhalmozódásukhoz az aktivált thrombocyták révén, a P-szelektinen keresztül megvalósuló hídképződés alapvető fontosságú.
HIV-1
A vérlemezkék közvetlenül bekebelezik (a C-típusú lektinszerű receptor-2 és egy „nonintegrin” molekula segítségével) a vírust. A vérlemezkékben a vírus védve van, így hozzájárul a fertőzés kifejlődéséhez. A thrombospondin-1 reakcióba lép a HIV Env fehérjéjével és gátolja a HIV kitapadását a CD4+ lymphocytákra.
Atherosclerosis
Az érelmeszesedés kezdő pontja az endothel kóros működése. Bizonyos helyeken nagyobb valószínűséggel tapadnak ki thrombocyták és fehérvérsejtek az endothel aktiválódása közben. Ezek vazoaktív anyagokat (pl.: citokineket és növekedési faktorokat) bocsátanak ki. A vérlemezkék - proinflammatorikus mediátorok expressziója révén - elősegítik a gyulladásos jellegzetességek kialakulását és a monocyták toborzását az adott területen. Az általuk termelt SDF-1 révén a vérlemezkék elősegítik a CD34+ progenitor sejtek toborzását, érését és ezzel oki szerepet játszanak a plakkok képződésében. A vérlemezkék megerősítik a monocyták kapcsolódását a plakkot szegélyező endotheliális területen, és elősegítik a bevándorlásukat a plakk belsejébe. A monocyták fehérjebontó enzimek által instabilizálják a plakk szerkezetét.
Trombózis
Koszorúér elzáródás esetén a vérlemezkék hozzájárulhatnak a nem megfelelő reperfúzióhoz és az ischemiás időszak megnyúlásához. A gyulladásos folyamatok előmozdításával a thrombocyták nagyban hozzájárulnak az ischaemiás-reperfúziós károsodások kialakításához (K. Jurk és B. E. Kehrel, 2008).
Cystás fibrosis
A cisztás fibrózis (CF) a leggyakoribb halálos genetikai betegség a fehér emberek körében. Hozzávetőlegesen minden 2500 újszülöttből legalább egy ezzel a rendellenességgel jön világra. 1989-ben azonosították azt a genetikai mutációt, ami a betegségért felelős, ez a CFTR(cystic fibrosis transmembrane conductance regulator). A CFTR, tagja az adenozin-trifoszfát (ATP)-kötő családnak elsősorban transzporterként működik, mint klorid csatorna. Többi funkciói közt említhetjük a szabályozást, az alternatív klorid csatornát és epitheliális nátrium csatornát valamint az ATP transzportban is közrejátszik.
A betegségben szenvedő emberekben megnövekedett mennyiségű aktivált vérlemezke kering az egészségesekkel szemben. Ennek okai a nagy menniységű monocyta-vérlemezke és neutrophyl-vérlemezke aggregátumok. Ezek a heterotípusos aggregátumok nagyon érzékeny markerei a vérlemezke aktivációnak. Az egészséges emberben végbemenő folyamatokhoz képest a CF betegek vérlemezkéi sokkal érzékenyebben reagálnak az ADP-re és TRAP-re (thrombin receptor activating peptide). A végzett kisérlezek azt mutatják, hogy a CF plazma képes megnövelni az ADPre és a TRAPre való érzékenységet, mind az egészséges, mind a beteg páciensek vérlemezkéiben. A CF plazma a normális és a beteg emberek vérlemezkéit is aktiválja. A thrombocyták felületi P-szelektin expressziója is növekszik. A PGE1(prostaglandin E1 ) nem képes teljes mértékbenmeggátolni a cf vérlemezke hiperaktiv viselkedését.
Továbi mérésekkel kimutaták, hogy a CF vérlemezkékben megnövekedett a terminál-n-6 zsirsav tartalom. A betegekben a Mead-féle sav szám is megnövexik a plazmában és a vérlemezkékben as. A Mead-sav metabolizmusának - thrombocyta-derived lipoxygenase által- végén egy PGE2 szerű aktivitást mutató végtermék jön létre, ami felerősiti a vérlemezke aggregációt. A Mead-sav önmagában nem képes a leukocyta-vérlemezke aggregáció növekedésének előidézésére, de meghatározó szerepet játszik benne. Összefoglalva kisérletekkel kimutatásra került, hogy a CF vérlemezkékben intrinsic zsírsav rendellenesség van jelen, ami minden bizonnyal a fő okozója a megnövekedett vérlemezke aktivációnak (Brian P. O'Sullivan és Matthew D. Linden, 2005).
Humán Thrombocyta: gyulladáskeltő, antimikrobiális és immunmoduláló faktorok |
||||
Faktor |
Tárolt vagy szintetizált |
Thrombocytán belüli lokalizáció |
Célsejtek |
Funkció |
Hisztamin |
Tárolt |
alfa-Granulum |
Enterokromaffin sejtek, Monocyták, Granulocyták (PMNs), Natural Killer sejtek, T és B lymphocyták |
Leukocyta, Lymphocyta és Endothel sejtek által termelt modulátor |
5-HT, Szerotonin |
Tárolt |
alfa-Granulum |
Monocyták, Macrophagok |
Monocyta és Macrophag moduláló |
TXA2 |
Szintetizált |
Plazma membrán |
Thrombocyták, T-lymphocyta és Macrophag subpopulatiok |
Pro-Koaguláns, T sejt és Leukocyta subpopulatio moduláló |
PAF |
Szintetizált |
Plazma membrán |
Thrombocyták, PMNs, Monocyták, Lymphocyta és Macrophag subpopulatiok |
Pro-Koaguláns, Lymphocyta és Leukocyta subpopulatio moduláló |
PDGF |
Tárolt |
alfa-Granulum |
Monocyták, Macrophagok, T- Lymphocyták |
Angiogenesis, számos sejttípus osztódását, migrációját és növekedését szabályozza |
TGF-ß |
Tárolt |
alfa-Granulum |
Monocyták, Macrophagok, T és B lymphocyták |
Immunmodulátor, Leukocyták kemotaktikus vonzása, Leukocyta és Lymphocyta aktivitás szabályozása |
NAP2 (CXCL7) és közeli ß-TG variánsok |
Proteolitikus hasítás tárolt prekurzorokból |
Nem ismert |
PMNs |
PMN rekrutáció |
PF4 (CXCL4) |
Tárolt |
alfa-Granulum |
PMNs |
PMN rekrutáció |
GRO-alfa (CXCL1) |
Tárolt |
alfa-Granulum |
PMNs |
PMN rekrutáció |
ENA-78 (CXCL5) |
Tárolt |
alfa-Granulum |
PMNs |
PMN rekrutáció |
RANTES (CCL5) |
Tárolt |
alfa-Granulum |
Monocyták, Eosinophil és Basophil Granulocyták, NK sejtek, T-Lymphocyták, Dendritikus sejtek |
Leukocyta és Lymphocyta subpopulatiok aktivitásának modulálása, rekrutációja |
MIP-1 alfa (CCL3) |
Tárolt |
alfa-Granulum |
Monocyták, Eosinophil és Basophil Granulocyták, NK sejtek, Lymphocyták, Dendritikus sejtek |
Leukocyta és NK sejt rekrutáció |
MCP-3 (CCL7) |
Tárolt |
alfa-Granulum |
Monocyták, Basophil Granulocyták, NK sejtek, Lymphocyták, Dendritikus sejtek |
Leukocyta és NK sejt rekrutáció |
Thrombocidin |
Proteolitikus hasítás tárolt prekurzorokból |
alfa-Granulum |
Nincs humán célsejt. Baktérium és Gomba |
Antimikrobiális |
IL-1 ß |
Szintetizált |
Nem ismert |
Enterokromaffin sejtek, Monocyták, Macrophag és Dendritikus sejt subpopulatiok |
Leukocyta subpopulatiok és Endothel sejtek aktivitásának szabályozása |
HMGB1 |
Tárolt |
alfa-Granulum |
Macrophagok, PMNs, Enterokromaffin sejtek |
Leukocyta subpopulatiok és Endothel sejtek aktivitásának szabályozása |
Felhasznált irodalom
- K. Jurk és B. E. Kehrel (2008): DIE ROLLE VON THROMBOZITEN BEI HÄMOSTASE, THROMBOSE, IMMUNABWEHR UND ENTZÜNDUNG • VOL 133 / NO 21 / 2008 / DEUTSCHE MEDIZINISCHE WOCHENSCHRIFT
- Andrew S. Weyrich és Guy A. Zimmerman (2004): Program in Human Molecular Biology and Genetics, Eccles Institute of Human Genetics, 15 North 2030 East, Room 4220, Salt Lake City, Utah 84112, USA
- A. Trzeciak-Ryczek1,2, B. Tokarz-Deptuła1, W. Deptuła2 (2013): Platelets – an important element of the immune system 1 Department of Immunology 2 Department of Microbiology, Faculty of Biology University of Szczecin, Felczaka 3c, 71-412 Szczecin, Poland
- Bennett D. Elzey a, Daniel L. Sprague b,c, Timothy L. RatliV a,c,d, (2005): The emerging role of platelets in adaptive immunity a Department of Urology, University of Iowa, USA b Carver College of Medicine, Medical Scientist Training Program, University of Iowa, USA c Department of Microbiology, University of Iowa, USA d Interdisciplinary Immunology Program, University of Iowa, USA Received 17 October 2005; accepted 13 December 2005
- Brian P. O'Sullivan, Matthew D. Linden, Andrew L. Frelinger III, Marc R. Barnard, Michele Spencer-Manzon, James E. Morris, Raneem O. Salem, Michael Laposata, Alan D. Michelson (2005): Platelet activation in cystic fibrosis
- Ryunosuke Ohkawaa, Yuji Hirowatarib, Kazuhiro Nakamuraa, Shigeo Ohkuboa, Hitoshi Ikedaa, Mitsumasa Okadac, Minoru Tozukaa, Kazuhiko Nakaharad, Yutaka Yatomid, (2005): Platelet release of h-thromboglobulin and platelet factor 4 and serotonin in plasma samples aDepartment of Clinical Laboratory, The University of Tokyo Hospital, Tokyo, Japan bScientific Instruments Division, Tosoh Corporation, Kanagawa, Japan cDepartment of Biomolecular Science, Toho University, Chiba, Japan dDepartment of Laboratory Medicine, Graduate School of Medicine, The University of Tokyo, 7-3-1 Hongo, Bunkyo-ku, Tokyo 113-8655, Japan Received 8 February 2005; received in revised form 29 June 2005; accepted 4 July 2005
Bennett D. Elzey, Jun Tian, Robert J. Jensen, Axel K. Swanson, Jason R. Lees, Steven R. Lentz, Colleen S. Stein, Bernhard Nieswandt, Yiqiang Wang, Beverly L. Davidson, and Timothy L. Ratliff (2003): Platelet-Mediated Modulation of Adaptive Immunity: A Communication Link between Innate and Adaptive Immune Compartments
