|
Size: 13735
Comment:
|
← Revision 265 as of 2014-12-05 17:26:10 ⇥
Size: 24804
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 4: | Line 4: |
| Das [[http://de.wikipedia.org/wiki/Blutbild|Blutbild]] von Nutzgeflügel und exotischen Vögeln ist in der Veterinärmedizin eine wichtige Untersuchungsmethode um mit Hilfe der zellulären Bestandteile des Blutes Aufschluss über den Gesundheits- oder Krankheitsstatus des Tieres zu gewinnen. Genau genommen kann man ihren Anteil, ihre Morphologie und ihre Qualität bestimmen. Man unterscheidet zwischen großen und kleinem Blutbild, wobei das kleine die Gesamtleukozytenzahl beschreibt und das große zusätzlich das [[http://de.wikipedia.org/wiki/Differentialblutbild|Differentialblutbild]]. <<TableOfContents(3)>> |
---- Das [[http://de.wikipedia.org/wiki/Blutbild|Blutbild]] von Nutzgeflügel und exotischen Vögeln ist in der Veterinärmedizin eine wichtige Untersuchungsmethode um mit Hilfe der zellulären Bestandteile des Blutes Aufschluss über den Gesundheits- oder Krankheitsstatus des Tieres zu gewinnen. Genau genommen kann man ihren Anteil, ihre Morphologie und ihre Qualität bestimmen. Man unterscheidet zwischen großem und kleinem Blutbild, wobei das kleine Blutbild die Gesamtleukozytenzahl beschreibt und das große Blutbild zusätzlich das [[http://de.wikipedia.org/wiki/Differentialblutbild|Differentialblutbild]] ''(Pendl, 2008)''. <<TableOfContents(4)>> |
| Line 9: | Line 8: |
| Das Blut im Allgemein besteht aus zwei Teilen, dem Blutplasma und den Blutzellen. Zu den Blutzellen zählen bei Vögeln genau wie bei Säugetieren die Erythrozyten, Thrombozyten und Leukozyten. (Salomon) | ---- Das Blut im Allgemeinen besteht aus zwei Teilen, dem [[http://de.wikipedia.org/wiki/Blutplasma|Blutplasma]] und den Blutzellen. Zu den Blutzellen zählen bei Vögeln genau wie bei Säugetieren die Erythrozyten, Thrombozyten und Leukozyten. |
| Line 12: | Line 12: |
| Die Blutentnahme findet bei Vögeln durch die V.cutaneus ulnaris statt. (Laboklin) | Die Blutentnahme findet bei Vögeln durch die Vena cutaneus ulnaris statt ''(Laboklin, 2001)''. |
| Line 14: | Line 14: |
| Bei der Blutabnahme sollte man vorzugsweise eine grosslumige Kanüle und eine kleinlumige Spritze verwenden. Besonders zu beachten ist, dass das EDTA-Röhrchen (Antikoagulans Ethylendiamintetraazetat) bei den Vogelarten Raben- (Corvidae), Eis- (Alcedinidae), Kranich- (Gruidae) und Straussenvoegel (Struthionidae) zum Hämatolye führt. Bei anderen Arten kann das Blut ohne auffällige Veränderungen über kurze Zeit in EDTA oder Heparinröhrchen gelagert werden. Bei längerer Aufbewahrung jedoch kommt es zu vermehrtem Bakterienwachstum, da das Vogelblut nicht steril ist, welches in der Blutausstrich Untersuchung einer pathologischen Veränderung sehr ähneln.(xx) | Bei der Blutabnahme sollte man vorzugsweise eine großlumige Kanüle und eine kleinlumige Spritze verwenden. Besonders zu beachten ist, dass das EDTA-Röhrchen (Antikoagulans Ethylendiamintetraazetat) bei den Vogelarten Raben- (Corvidae), Eis- (Alcedinidae), Kranich- (Gruidae) und Straußenvögel (Struthionidae) zur [[http://de.wikipedia.org/wiki/Hämolyse|Hämolyse]] führt ''(Pendl, 2008)''. Bei anderen Arten kann das Blut ohne auffällige Veränderungen über kurze Zeit in EDTA oder Heparinröhrchen gelagert werden. Bei längerer Aufbewahrung jedoch kommt es zu vermehrtem Bakterienwachstum, da das Vogelblut nicht steril ist, welches in der Blutausstrich Untersuchung einer pathologischen Veränderung sehr ähneln ''(Pendl, 2008)''. |
| Line 16: | Line 16: |
| === Blutausstrich === Mit dem frisch entnommenem Blut, kann desweiteren noch ein Blutausstrich gemacht werden. Auf einen Objektträger pipettiert man einen Tropfen Blut, dieser wird dann mithilfe eines zweiten Objektträgers (ca. im 45° Winkel ansetzen) verstrichen. Anders als sonst beim mikroskopieren wird er nach dem Lufttrocken nicht mit einem Deckglas versehen, sondern direkt so mikroskopiert. (vet med labor) Zur Färbung des Blutausstriches eignet sich die Wright-Giemsa-Färbung. (Pendel 1) |
Mit dem entnommenen Blut kann dann ein [[http://de.wikipedia.org/wiki/Blutausstrich|Blutausstrich]] gefertigt werden. |
| Line 20: | Line 19: |
| ---- | |
| Line 21: | Line 21: |
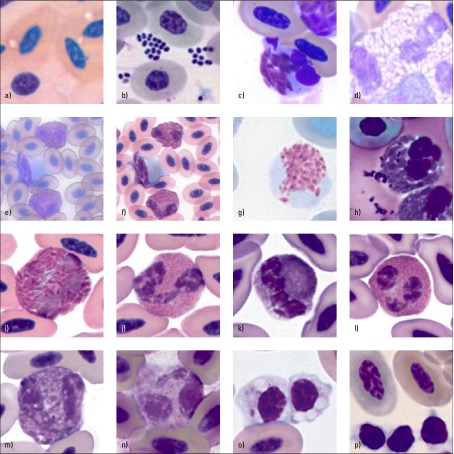
| Der Hämatokrit gibt den Anteil der Erythrozyten des Blutes an. Der Anteil des [[http://de.wikipedia.org/wiki/Buffy-Coat|Buffy-Coat]] wird hier nicht mit angegeben. (festst. BW bei V.) | ||<tablebgcolor="#eeeeee" tablestyle="float:right;font-size:0.85em;margin:0000; "style="padding:0.5em; ;text-align:center"> {{attachment:zellen1.jpg|zellen|width="400"}} <<BR>>'''Abb. 1''' a)Kronenkranich, Hämolyse durch EDTA b)Haushuhn, <<BR>> Bakterien c)Reisetaube, Zelllysis d)Kolkrabe, heterophile mit <<BR>> ungefärbten Granula e-f)Gelbscheitelamazone, <<BR>> Originalvergrößerung x40 e)ohne Eindeckelung <<BR>> f)mit Eindeckelung g)Haushuhn, Unterfärbung des Kerns h)Reisetaube, <<BR>> Überfärbung und Staubpartikel i-l)Kronenkranich i)heterophiler j)eosinophiler <<BR>> k)heterophiler l)eosinophiler in Diff-Quik-Färbung <<BR>> m-n)Schwarzohrpapagei m)ohne Alkoholfixation n)mit Alkoholfixation <<BR>> o)Doppelhornvogel, Thrombozyten mit Vakuolen und undulierter <<BR>> Zellmembran p)Edelpapagei, Thrombozyten aggregiert; <<BR>> Aufnahmen in Originalvergrößerung x1000 <<BR>> und Wright-Giemsa-Färbung nach Samour || |
| Line 23: | Line 23: |
| Die Hämatokritbestimmung bei den Vögeln ist identisch mit der, der Säugetiere (Trennung durch Zentrifugieren), jedoch liegt eine geringere Blutmenge vor. Bei einem Vogel werden lediglich 0,5 ml entnommen (fest.BW Vogel), weshalb es sich besser eignet die Untersuchung mit einer Mikrohämatokritzentrifuge durchzufuehren. Der Richtwert beschreibt die Zentrifugationszeit für 5 Minuten bei 12000g in einem heparisiertem Mikrohämatokritroehrchen. | |
| Line 25: | Line 24: |
| Die physiologischen Werten für das Vogelblut liegen zwischen 35 und 55%. (XX). Die spezifischen Hämatokritwerte liegen bei Ente bei 40-45%, bei der Taube bei 58%, beim Huhn bei 46% und der Wert der Gans gleicht dem der Ente. (Salomon) | Die [[http://de.wikipedia.org/wiki/Hämatokrit|Hämatokrit]]bestimmung bei den Vögeln ist identisch mit der der Säugetiere (Trennung durch Zentrifugieren), jedoch liegt eine geringere Blutmenge vor. Bei einem Vogel werden lediglich 0,5 ml entnommen, weshalb es sich besser eignet die Untersuchung mit einer Mikrohämatokritzentrifuge durchzuführen. Der Richtwert beschreibt die Zentrifugationszeit für 5 Minuten bei 12000 g in einem heparinisiertem Mikrohämatokritröhrchen ''(Pendl, 2008; Veil, 1978). '' |
| Line 27: | Line 26: |
| Der Hämatokritwert nimmt in der ersten Lebenswochen bei vielen Vöglen ab, um dann mit einigen Schwankungen bis zum Erreichen der Geschlechtsreife kontinuierlich zu zunehmen.(Gylstoff und Grimm). | Die physiologischen Werte für das Vogelblut liegen zwischen 35 und 55%. Die spezifischen Hämatokritwerte liegen bei der Ente und Gans bei 40-45%, bei der Taube bei 58%, beim Huhn bei 46% ''(Salomon, 1993). '' |
| Line 29: | Line 28: |
| Werte, die sich unter dem pysiologischem Richtwert befinden, koennen ein Hinweis sein auf Anämie durch Darmparasieten oder Blutverlust. Ausserdem kann es in extremen Stresssituationen zu einem Abfall des Hämatokritwerts kommen, aufgrund eines Serumnatriumantiegs und steigendem Plasmavolumen. === Leukozyten === Die Leukozytenzahl wird mithilfe der Thoma-Neu-Zählkammer bestimmt. (festst. BW bei V.) Die genauere Differenzierung innerhalb der Leukozyten wird bei dem großen Blutbild bestimmt. Erst in dem Differentialblutbild werden dann die Unterschiede zwischen Vögeln und Säugetieren deutlich. (Laboklin) Die im Normalbereich liegende Gesamtleukozytenzahl ist bei Vögeln mit granulozytärem und lymphozytärem Blutbild unterschiedlich. Bei den der ersten Gruppe angehörenden Geflügel und Vögeln liegt sie zwischen 5000-25000 und bei denen der zweiten Gruppe angehörenden Vögeln zwischen 25000 und 45000. (Pendel Blut1) |
Bei Jungvögeln ist dieser Wert etwas niedriger und Schwankungen aufgrund der Tageszeit, dem Geschlecht oder dem Einfluss von bestimmten Hormonen, wie [[http://de.wikipedia.org/wiki/Thyroxin|Thyroxin]] oder [[http://de.wikipedia.org/wiki/Prolaktin|Prolaktin]] sind möglich. Durch Messung des Gesamtproteingehalts kann eine entweder absolute oder relative quantitative Abweichung des Hämatokrits festgestellt werden. Bei einer [[http://de.wikipedia.org/wiki/Anämie|Anämie]] ist der physiologische Wert vermindert und bei einer [[http://de.wikipedia.org/wiki/Polycythaemia_vera|Polyzythämie]] erhöht. Eine Thrombo- oder Leukozytose kann in einem Vogel diagnostiziert werden, wenn dessen [[http://de.wikipedia.org/wiki/Buffy-Coat|"buffy coat"]] den gesunden Wert von 1% mit >1,5% überschreitet. Ab Werten mit >10% rechnet man mit einer leukämischen Neoplasie. Festgestellt wird die Hämatokritabweichung mit dem Farbwechsel zwischen roter und weißer Phase und somit der Verschiebung der Erythrozytenzahl. Bei einer Vermischung der einzelnen Komponente kann das „buffy coat“ eine rosane Farbe aufweisen. Dann ist keine Untersuchung bezüglich des Hämatokrits möglich ''(Pendl, 2008)''. |
| Line 41: | Line 31: |
| Die Thrombozytenzahl wird mithilfe des Blutausstriches bestimmt. Unter dem Mikroskop schaut man sich den Ausstrich an und kann somit die Quantität und die Qualität der Zellen bestimmen. Die Differenzierung zwischen Thrombozyten, Lymphozyten und polychromatischen Erythrozyten gestaltet sich beim Vogel, aufgrund der veränderten Morphologie, wesentlich schwerer als beim Säuger. | Der Thrombozyt bei Vögeln besitzt ein farblos bis leicht graues Zytoplasma mit feiner Netzstruktur, Vakuolen und ondulierter Membran, was als Aktivierungszeichen gilt. Der Kern hat keine vorgeschriebene Position in der Zelle und ist oval bis rund und polymorph bei Aggregation. Seine Struktur ist dicht pyknotisch und er erscheint dunkel in der Zelle. Die Granula befinden sich als rot violette Polkörperchen in Kernnähe. Insgesamt ist die Zelle klein bis moderat, bei Aggregation sind oft nur die Zellkerne zu erkennen. Die Differenzierung zwischen Thrombozyten, Lymphozyten und polychromatischen Erythrozyten gestaltet sich beim Vogel, aufgrund der veränderten Morphologie, wesentlich schwerer als beim Säuger. Alle drei Zellarten enthalten Zellkerne, somit fällt dieses Erkennungsmerkmal bereits weg. Die Thrombozyten erkennt man dann lediglich noch an ihrem pyknotischen Kern und dem häufigen Auftreten von kernnahnen Polkörperchen. Des Weiteren zeigen Thrombozyten oft eine Tendenz zu Aggregation ''(Pendl, 2008)''. Die gesamte Thrombozytenzahl liegt bei den meisten Species der Vögel bei 20000-40000 ''(Pendl, 2012)''. |
| Line 43: | Line 33: |
| Alle drei Zellarten enthalten Zellkerne, somit fällt dieses Erkennungsmerkmal bereits weg. Die Thrombozyten erkennt man dann lediglich noch an ihrem pyknotischen Kern und dem häufigen Auftreten von kernnahnen Polkörperchen. Desweiteren zeigen Thrombozyten oft eine Tendenz zu Aggregation. Bei Ziervögeln weist ein über 50%-iger Anteil von reaktiven Thrombozyten auf Veränderungen im Organismus hin (beispielsweise erhöhte Gerinnungsaktivität). (ZV Pendel) Die gesamte Thrombozytenzahl liegt bei den meisten Species der Vögel bei 20000-40000. (Pendel Blut 1) |
Bei Ziervögeln weist ein über 50%-iger Anteil von reaktiven Thrombozyten auf Veränderungen im Organismus hin (beispielsweise erhöhte Gerinnungsaktivität). |
| Line 50: | Line 36: |
| Die Anzahl der Erythrozyten kann entweder gezählt werden (Blutausstrich oder Thoma-Neu-Zählkammer) oder prozentual mittels der Hämatokritwertbestimmung ermittelt werden. | Erythrozyten sind beim Geflügel große, ovale und abgeplattete Zellen. Diese besitzen einen ovalen Zellkern. Im Normalfall liegt die Erythrozytenzahl/mm^3^ bei 2,4-4 Millionen ''(Salomon, 1993)''. Diese Zahl ist vergleichsweise gering (Katze: 7,2-10 Millionen) ''(Liebich, 2010)''. |
| Line 52: | Line 38: |
| Erythrozyten sind bei Geflügel große, ovale und abgeplatte Zellen. Diese besitzen einen ovalen Zellkern. (Salomon) Dies ist ein wichtiger Unterschied zwischem dem Vogelblut und dem Blut der Säugetiere. (Liebich) | Als [[http://de.wikipedia.org/wiki/Poikilozytose|Anisozytose]] wird eine hohe Variabilität in der Größe der Zellen bezeichnet. Festgestellt wird dies mit dem polychromatischen Index (PI) ''(Pendl, 2008)''. |
| Line 54: | Line 40: |
| Im Normalfall liegt die Erythrozytenzahl/mm^3^ bei 2,4-4 Millionen.(Salomon) Diese Zahl ist vergleichsweise gering (Katze: 7,2-10 Millionen). (Liebich) | [[http://de.wikipedia.org/wiki/Polychromasie_(Zytologie)|Polychromasie]] bezieht sich auf eine erhöhte Varianz in der Färbung der Erythrozyten. Bei Küken ist der Anteil an juvenilen Zellen größer als bei erwachsenen Tieren, allerdings gleicht sich dieser Wert bis zur 6. Lebenswoche an. Als [[http://de.wikipedia.org/wiki/Poikilozytose|Poikilozytose]] bezeichnet man eine pathologische Veränderung des Zellkerns und der Plasmaform. Hervorgerufen durch Sauerstoffmangel können bei einigen Arten des Genus Amazona verdickte, abgerundete Zellen auftreten, wodurch eine Verbreiterung des Zytoplasmas resultiert. Beim Ziervogel tritt nur selten eine Form einer Polycythameia vera auf ''(Pendl, 2008)''. |
| Line 57: | Line 43: |
| Der Blutfarbstoff Häm mit zweiwertigem Eisen und Globin, eine aus zwei identischen Polypeptidketten aufgebaute Struktur, sind die Bestandteile von Hämoglobin (Kraft et al 1999a). Als günstig für die Hämoglobinmessung beim Vogel zählt die Cyanhämoglobinmethode. Hämoglobinopathien wurden bisher beim Vogel noch nicht beschrieben. Hämoglobin ist trotzdem ein guter Parameter, um durch inneren/aeusseren Blutverlust, Hämolyse oder Hemmung der Erytro- und Hämatopoese verursachte Anämie festzustellen. Dafür sind vielerlei Ursachen bekannt, Magen-Darm Parasiten, Knochenfrakturen, blutsaugende Ektoparasiten, Blutparasiten, Nährstoffmangel. | Als günstig für die [[http://de.wikipedia.org/wiki/Hämoglobin|Hämoglobin]]messung beim Vogel zählt die Cyanhämoglobinmethode. [[http://de.wikipedia.org/wiki/Hämoglobinopathie|Hämoglobinopathie]] wurden bisher beim Vogel noch nicht beschrieben. Hämoglobin ist trotzdem ein guter Parameter, um durch inneren/äußeren Blutverlust, [[http://de.wikipedia.org/wiki/Hämolyse|Hämolyse]] oder Hemmung der Erytro- und [[http://de.wikipedia.org/wiki/Hämatopoese|Hämatopoese]] verursachte Anämie festzustellen. Dafür sind vielerlei Ursachen bekannt zum Beispiel: Magen-Darm Parasiten, Knochenfrakturen, blutsaugende Ektoparasiten, Blutparasiten, Nährstoffmangel ''(Pendel, 2008)''. |
| Line 60: | Line 46: |
| Genau wie Säugetiere besitzen auch Vögel verschiedene Abwehrmechanismen über humurale und zellvermittelnde Immunitaet. Aufgrund der evolutionären Unterschiede in der Entwicklung, können wir aber einige Unterschiede finden. Der Bursa cloacalis, den nur die Vögel besitzen, produziert B-Zellen, bei den Säugetieren werden diese jedoch hauptsächlich im Knochenmark synthetisiert. Die Aufgabe der B-Zellen ist Immunoglobine freizusetzen und somit die humoral vermittelnde Immunität zu steuern. Folgende Immunglobine finden wir bei den Vöglen: IgM, IgA, IgG ( kann auch als IgY bezeichnet werden), IgD und IgE haben aber nur die Säugetiere. Der Ort der T-Zellen Entwicklung ist derselbe wie bei den Säugetieren: der Thymus. Diese stellen die spezifisch zellvermittelnde Immunkompetenz dar. Jedoch wurden sie bei den Vögeln bisher noch nicht ausreichend erforscht (Rautenschlein und Kaleta, 2005). Zur Kontrolle eines Impferfolges ist es unerlässlich Stichprobenuntersuchungen der Herde durchzuführen, die Aufschluss üben den Immunstatus geben. Kann über die Bestimmung der Antikörper im Serum oder im Eidotter bewerkstelligt werden (Jungbaeck, Kaleta und Siegmann 2005). Ein positiver Antikörpertest zeigt, dass eine Feldinfektion oder eine Impfung vorangegangen sein muss (Rautenschlein 2005). Eine sehr gute Methode dafuer ist ELISA (Enzyme-Linked-Immuno-Sorbent-Assay) (Siegmann1992). Durch diese kann man den IgY-Nachweis in Eidotter, Koerperflüssigkeiten und Serum durchführen. Phosphor können wir im Vogelblut in Form von anorganischen Phosphat, Phospholipid oder als organischen Ester finden. Das anorganische Phosphat im Serum hat diagnostische Bedeutung. Durch Einwirkung von Parathormon und Calcitonin erniedrigt sich der Phosphorniveau im Blut. Unter den physiologischen Richtwert senkt sich der Phosphorspiegel durch Vitamin D Mangel oder Hitzestress (Glystroff und Grimm 1987). Durch eine Mineralienunterversorgung der Körpers, treten Beeinträchtigungen der Gesundheit, Leistungsfähigkeit und Wohlbefindens ein. Weitere Folgen des Phosphormangels bei Vogel sind „Beinschwäche“ und eine herabgesetzte Knochenstabilität (Damme und Hildebrand 2002). Je nach Alter und Nutzungsrichtung ist einen unterschiedliche Mineralversorgung nötig (Siegmann 2005). |
Die [[http://de.wikipedia.org/w/index.php?title=Bursa_Fabricii&redirect=no|Bursa cloacalis]], die nur die Vögel besitzen, produziert [[http://de.wikipedia.org/wiki/B-Lymphozyt|B-Zellen]], bei den Säugetieren werden diese jedoch hauptsächlich im Knochenmark synthetisiert. Die Aufgabe der B-Zellen ist Immunoglobine freizusetzen und somit die humoral vermittelnde Immunität zu steuern. Folgende Immunglobine finden wir bei den Vögeln: IgM, IgA, IgG (kann auch als IgY bezeichnet werden), IgD und IgE haben aber nur die Säugetiere. Die Entwicklung findet im [[http://de.wikipedia.org/wiki/Thymus|Thymus]], statt. Diese stellen die spezifisch zellvermittelnde Immunkompetenz dar. Jedoch wurden sie bei den Vögeln bisher noch nicht ausreichend erforscht ''(Rautenschlein und Kaleta, 2005)''. |
| Line 65: | Line 49: |
| Die Kalziumhomoeostase wird duch Parathormon und Vitamin D sichergestellt. Der Gesamtkalziumgehalt wird im Vogelblut gemessen und beträgt für ionisiertes Kalzium im Serum 55%, 40% sind an Proteine und 5% an organische Säuren gebunden (Kraft et al 1999b). Durch Mobilisation aus dem Knochen wird der Kalziumgehalt durch das Parathormon und Vitamin D gesteigert. Zusätzlich regt Vitamin D ein kalziumbindendes Protein für die erhöhte Kalziumresorption aus dem Darm an. Eine sinken des Kalziumwertes kann Hypoalbumänie, sehr grosse Fettgewebsnekrosen und Nierenerkrankung im Endstadium hinweisen (Gylstroff und Grimm 1987). | Phosphor können wir im Vogelblut in Form von anorganischen Phosphat, Phospholipid oder als organischen Ester finden. Das anorganische Phosphat im Serum hat diagnostische Bedeutung. Durch Einwirkung von [[http://de.wikipedia.org/wiki/Parathormon|Parathormonen]] und [[http://de.wikipedia.org/wiki/Calcitonin|Calcitonin]] erniedrigt sich der Phosphorniveau im Blut. Unter den physiologischen Richtwert senkt sich der Phosphorspiegel durch Vitamin D Mangel oder Hitzestress ''(Gylstorff und Grimm, 1987)''. Durch eine Mineralienunterversorgung der Körpers, treten Beeinträchtigungen der Gesundheit, Leistungsfähigkeit und Wohlbefindens ein. Weitere Folgen des Phosphormangels bei Vogel sind „Beinschwäche“ und eine herabgesetzte Knochenstabilität ''(Damme und Hildebrand, 2002)''. Je nach Alter und Nutzungsrichtung ist einen unterschiedliche Mineralversorgung nötig ''(Siegmann, 2005)''. |
| Line 67: | Line 51: |
| === Blutparameter: === Durch dir pylogenetische Entwicklung weist das Blut der Vögel viel mehr Differenzierungen bezogen auf die Blutzellen auf. (Siegmann 1992) Im Vergleich mit den Säugetieren weist das Blutbild der Vögel einige Unterscheide auf. Sowohl Erytrozyten als auch Thrombozyten beinhalten einen Kern. Der neutrophile Granulozyt wird durch den granulahaltigen heterophilen Granolozyten ersetzt. Das Plasma enthält weniger Albumin und Natrium, jedoch mehr Kalium. Zusätzlich sind einige Faktoren des Blutgerinnungssystems nicht oder nur gering vorhanden.(Glystroff und Grimm 1987). Das Vorteil von der Blutuntersuchung bei Vögeln ist, dass sie immer auf mehrere Tiere in der Herde zurückgegriffen werden kann, welche sich in verscheidenen pathogenetischen Stadien befinden (Rautenschlein 2005) und ist daher vor allem bei Herdendiagnostik besonders wichtig (Siegmann 1992). |
Die Kalziumhomöostase wird durch Parathormon und Vitamin D sichergestellt. Der Gesamtkalziumgehalt wird im Vogelblut gemessen und beträgt für ionisiertes Kalzium im Serum 55%, 40% sind an Proteine und 5% an organische Säuren gebunden ''(Kraft et al., 1999)''. Durch Mobilisation aus dem Knochen wird der Kalziumgehalt durch das Parathormon und Vitamin D gesteigert. Zusätzlich regt Vitamin D ein kalziumbindendes Protein für die erhöhte Kalziumresorption aus dem Darm an. Ein Sinken des Kalziumwertes kann [[http://de.wikipedia.org/wiki/Hypalbuminämie|Hypolbuminämie]], sehr große Fettgewebsnekrosen und Nierenerkrankung im Endstadium hinweisen ''(Gylstorff und Grimm, 1987)''. |
| Line 70: | Line 53: |
| === Differentialblutbild === | == Differentialblutbild == ---- === Leukozyten === Erst in dem [[http://de.wikipedia.org/wiki/Differentialblutbild|Differentialblutbild]] werden die Unterschiede zwischen Vögeln und Säugetieren deutlich. Die im Normalbereich liegende Gesamtleukozytenzahl ist bei Vögeln mit granulozytärem und lymphozytärem Blutbild unterschiedlich. Bei dem der ersten Gruppe angehörenden Geflügel und Vögeln liegt sie zwischen 5000 und 25000 und bei denen der zweiten Gruppe angehörenden Vögeln zwischen 25000 und 45000'' (Pendl, 2008)''. === Granulozyten === ||<tablewidth="800px">'''Kriterium''' ||'''Heterophiler''' ||'''Eosinophiler''' ||'''Basophiler''' || ||Plasma ||farblos, eosinophiler Farbstich bei Granulaauflösung ||farblos bis basophil ||farblos, basophil oder eosinophil || ||Granulierung ||elliptisch, eosinophil, eventuell rötlich, brauner Stich, Auflösungserscheinungen oder nur Zentralkörperchen angefärbt (runde Granula) ||rund, farblos, eosinophil bis basophil, klar erkennbar, ohne Zentralkörperchen, größer und variabler als bei Basophilen ||basophil bis rötlich, weiß durch Auflösungstendenz, selten dicht gepackt mit kleinen dunkelvioletten Granula || ||Kern ||gelappt, weniger gut strukturiert ||gelappt, intensive Färbung, gut strukturiert ||ungelappt, rundlich, schlecht strukturiert || ||Allgemeines Bild ||Speziesübergreifende Morphologie, kontrastarm, artefaktanfällig ||speziesspezifische Variabilität, kontrastreich, wenig artefaktanfällig ||technisch bedingte Variabilität, Auflösungstendenz, stark artefaktanfällig || Tabelle modifiziert nach ''(Pendl, 2008)'' === Monozyten === Der Monozyt der Vögel ist moderat bis groß und von runder Gestalt. Sein Zellkern ist irregulär mit Unebenheiten an den Seitenrändern, feinschollig und erscheint hell in der Zelle. Er liegt in dem blaugrauen, schaumigen Plasma exzentrisch, das in der Kernnähe eine orange rosa Verfärbung aufweist. Außerdem enthält es Vakuolen und Protoplasmabläschen, die ein Hinweis auf die Aktivierung der Zelle sind. Die feinen, azurophilen Granula befinden sich ausschließlich in Kernnähe. Insgesamt ist es eine fein strukturierte Zelle, bei der man die einzelnen Teile gut erkennen kann ''(Pendl, 2008)''. === Lymphozyt === Der Lymphozyt des Vogels ist weniger gut strukturiert, die Details sind jedoch immer noch sehr gut zu erkennen. Der Zellkern hat kugelige Gestalt, liegt zentral in der Zelle und ist grobschollig vor einem netzartigem Hintergrund. Vor allem bei kleineren Lymphozyten ist er sehr dicht. Azurophile Granula und Magentakörperchen sind zu finden, welche wieder ein Zeichen der Aktivierung sind. Diese befinden sich in homogenem, basophilem Plasma mit Vakuolen und Protoplasmbläschen. Er hat runde Form mit irregulären Formen durch Anlagerungen an benachbarte Zellen. Seine Größe kann sehr unterschiedlich sein und reicht von klein mit sehr wenig Plasma bis groß mit viel Plasma ''(Pendl, 2008)''. ''"In chickens the heterophil/lymphocyte ratio (H/L) has proved to be a valuable tool in stress related research. In general, H/L is determined with the microscopic differential count on a blood film." (Post et al., 2003) '' |
| Line 72: | Line 79: |
| Die Identifikation vieler Krankheiten beruht auf der Untersuchung des Blutes. Dies bedeutet die Feststellung eines veränderten Blutbildes, beruhend auf Abweichungen der physiologischen Form oder Wertebereiche der zellulären Bestandteile des Blutes. Folglich besteht ein Ungleichgewicht innerhalb der Synthese und dem Verbrauch, sowie eine Störung des allgemeinen Bedarfs des jeweiligen Organismus. Besonders ausschlaggebend sind beim Vogel die quantitativen Parameter, da generell eine hohe Stoffwechselaktivität vorhanden ist. Zu beachten sind die Thrombozyten- und Gesamtleukzytenzahl. Aufgrund akuter Veränderungen dieser Werte sind mehrere aufeinander folgende Untersuchungen im Abstand von mehreren Tagen zu empfehlen. | ---- === Plasmasäule === ||<tablebgcolor="#eeeeee" tablestyle="float:right;font-size:0.85em;margin:0000; "style="padding:0.5em; ;text-align:center"> {{attachment:Kubaflamingo.jpg|Kubaflamingo|width="300"}} <<BR>>'''Abb. 2''' Kubaflamingo || |
| Line 74: | Line 83: |
| === Hämatokrit === Der physiologische Hämatokrit liegt bei Nutzgeflügel und exotischen Vögeln zwischen 35 und 55% in ausgewachsenen Tieren. Bei Küken ist dieser Wert etwas niedriger und Schwankungen aufgrund der Tageszeit, dem Geschlecht oder dem Einfluss von bestimmten Hormonen, wie [[http://de.wikipedia.org/wiki/Thyroxin|Thyroxin]] oder [[http://de.wikipedia.org/wiki/Prolaktin|Prolaktin]] sind möglich. Durch Messung des Gesamtproteingehalts kann eine entweder absolute oder relative quantitative Abweichung des Hämatokrits festgestellt werden. Bei einer [[http://de.wikipedia.org/wiki/Anämie|Anämie]] ist der physiologische Wert vermindert und bei einer [[http://de.wikipedia.org/wiki/Polycythaemia_vera|Polyzythämie]] erhöht. Eine Thrombo- oder Leukozytose kann in einem Vogel diagnostiziert werden, dessen „buffy coat“ den gesunden Wert von 1% mit >1,5% überschreitet. Ab Werten mit >10% rechnet man mit einer leukämischen Neoplasie. Festgestellt wird die Hämatokritabweichung mit dem Farbwechsel zwischen roter und weißer Phase und somit der Verschiebung der Erythrozytenzahl. Bei einer Vermischung der einzelnen Komponente kann das „buffy coat“ eine rosane Farbe aufweisen. Dann ist keine Untersuchung bezüglich des Hämatokrits möglich. |
|
| Line 77: | Line 84: |
| === Plasmasäule === Die Plasmasäule (entstehendes Plasma) hat bei Vögeln mit einer hellroten Federfarbe, wie dem Kuba-flamingo (Phoenicopterus ruber rüber) oder dem Roten Ibis (Eudocimus ruber) einen rosanen Farbstich. Dies liegt an den mit der Nahrung aufgenommenen [[http://de.wikipedia.org/wiki/Carotinoide|Karotinoide]]. Ebenfalls durch die in den Samen aufgenommenen [[http://de.wikipedia.org/wiki/Lipochrome|Lipochrome]] hat die Plasmasäule bei granivoren (LINK) Vögeln eine gelbliche Farbe. Ein grünlicher äußerst seltener Farbstich kann bei Tukanen und Fächerpapageien (Deroptyus accipitrinus)PENDEL! auftreten. Je höher die Menge der aufgenommenen Keratinoide desto höher ist die Farbintensität. Eine Störung des Lipidstoffwechsels kann Ursache einer Lipämie und somit einer milchigen Trübung des Plasmas sein. Eine deutlich rote Verfärbung spricht für Hämolyse und ist meist krankheitsbedingt. Zu beachten bei der Untersuchung des Farbstiches ist die Differenzierung zwischen den physiologischen Verfärbungen aufgrund der Nahrung und Farbstiche, die tatsächlich durch eine Krankheit verursacht wurden. |
Die Plasmasäule (entstehendes Plasma) hat bei Vögeln mit einer hellroten Federfarbe, wie dem Kubaflamingo (Phoenicopterus ruber) oder dem Roten Ibis (Eudocimus ruber) einen rosanen Farbstich. Dies liegt an den mit der Nahrung aufgenommenen [[http://de.wikipedia.org/wiki/Carotinoide|Karotinoide]]. Ebenfalls durch die in den Samen aufgenommenen [[http://de.wikipedia.org/wiki/Lipochrome|Lipochrome]] hat die Plasmasäule bei [[http://de.wikipedia.org/wiki/Samenfresser|granivoren]] Vögeln eine gelbliche Farbe. Ein grünlicher äußerst seltener Farbstich kann bei Tukanen und Fächerpapageien (Deroptyus accipitrinus) auftreten. Eine Störung des Lipidstoffwechsels kann Ursache einer [[http://de.wikipedia.org/wiki/Lipämie|Lipämie]] und somit einer milchigen Trübung des Plasmas sein. Eine deutlich rote Verfärbung spricht für Hämolyse und ist meist krankheitsbedingt ''(Pendl, 2008)''. === Leuko- & Thrombozyten === Physiologischer Hintergrund ist hier das [[http://de.wikipedia.org/wiki/Immunsystem|Immunsystem]] der Vögel, welches dem der Säuger entspricht. ''"[...]'' ''the'' ''blood'' ''cells'' ''collecting'' ''circulating'' ''antigen'' ''might'' ''contribute'' ''to the'' ''establishment'' ''of'' ''immunotolerance''.''"'' ''(Wu et al., 2009)'' ||<tablewidth="1000px">'''Befund''' ||'''Interpretation (Beispiele)''' || ||Eosinophilie > 600 Zellen/μl ||Dermopathien, wie zum Beispiel Flugunfällen oder Bissverletzungen, physiologisch hohen Zahlen bei auch bei manchen Greifvogelarten || ||Basophilie > 600 Zellen/μl ||Nymphensittich (''Nymphicus hollandicus) ''respiratorischen Erkrankungen oder Dermopathien mit schwerem Gewebetrauma || ||Thrombozytopenie > 60.000 Zellen ||posthämorrhagische Situationen, gesteigerte unspezifische Phagozytose, starke Reaktion nach Thrombopenie || ||Thrombozytopenie < 15.000 Zellen ||Artefakt (Aggregate in Blutprobe), übersteigerter Bedarf (Koagulopathien), reduzierte Poese (Knochenmarksdepression) || ||moderate Leukozytose mit Heterophilie, Monozytose (>1000 Zellen), Lymphopenie ||Reaktion überwiegend des angeborenen Immunsytems mit Verdacht auf Supression der Lmphozyten (klinisch gehäuft bei Aspergilloseinfektionen, siehe auch Lymphopenie) || ||Lymphopenie (<1000 Zellen) ||Supression der Lymphozyten (stressbedingt, chronische virale Infektion, z.B.Paramyxo-, Herpes-, Poxvirus, Gliotoxine bestimmter Aspergillusstämme, Infektionen mit Mycobacterium sp., Kortikosteroidtherapie) || ||Heterophilie mit toxischer Linksverschiebung > 15.000 Zellen ||massive Reaktion des angeborenen Immunsystems, Anzeichen einer septikämisch-toxämischen Situation oder Schädigung/Erschöpfung der Granulopoese, Prognose vorsichtig bis ungünstig || ||hochgradie Leukozyten > 100.000 Zellen mit Heterophilie auffälliger Monozytose reaktiver Morphologie der Mono- / Lymphozyten ||leukömoide Reaktion des angeborenen und erworbenen Immunsystems, Antigenreiz (gehäuft bei Infektionen mit Chlamydophila sp., Mycobacterium sp. - letztere oft aufgrund der mikrobiellen Eisenakkumulation mit einer hypochromen Anämie vergesellschaftet) || ||Heteropenie < 1.500 Zellen ||Artefakt (Entmischung der Blutprobe vor dem Ausstreichen), Infektionen (Circovirusinfektion bei juvenilen Graupapageien, Intoxikation (Fenbendazolvergiftung), finale Exazerbation einer Heterophilie mit toxischer Linksverschiebung || Tabelle modifiziert nach ''(Pendl, 2008)'' === Blutmilben === Die blutsaugenden roten Vogelmilben, oder auch Blutmilben genannt, sind die gefährlichsten Exoparasiten der Geflügelarten. Vor allem betroffen davon sind Hühner, Puten und Tauben, aber auch bei anderen Nutz-, Wild- und Ziervögeln sind sie zu finden. Außerdem können auch andere Tiere befallen und in seltenen Fällen beim Menschen erscheinen. Sie erreichen etwa eine Größe von 0,75cm und haben normalerweise eine gelbgraue Färbung und ovale Form, färben sich jedoch nach dem Blutsaugen schwarzrot und erhalten eine runde Gestalt. Auch ohne Blutsaugen oder bei kalten Temperaturen können Milben viele Wochen überleben. Bei starken Milbenbefall kann ein Tier von mehreren 100 Milben überfallen werden und sogar blutleer gesaugt werden, wobei das bei vielen Jungtieren zum Tod führt. Bei adulten Tieren sind Hinweise auf Blutmilben starke Blässe der Kopfanhänge, Legeleistung sinkt, Tauben werden durch die Schwäche sogar flugunfähig und die Sterblichkeit nimmt zu. Bei verendeten Tieren ist die Muskultur sehr blass. Nachweisbar sind Milben selbst am Tier oder Käfig, nach dem Befall am pulverfeinem Milbenkot in der Stallung und am Vogel im Schleim von Schnabelhöhle, Schlund und Gehörgang ''(Dorn, 1971)''. Es gibt sehr viele verschiedene Formen der Bekämpfung von Vogelmilben. Eine effektive Möglichkeit der Bekämpfung ist Carbamate. Es zeichnet sich durch eine gute Verträglichkeit aus und lässt keine Rückstände im Tier oder Ei. Bei der Behandlung werden die Vögel mit 1%igem Puder bestäubt ''(Dorn, 1971)''. |
| Line 81: | Line 110: |
| ---- === Fachartikel === [1] Post, J., Rebel, J.M., ter Huurne, A.A. (2003): Automated blood cell count: a sensitive and reliable method to study corticosterone-related stress in broilers. Poultry Science: 82 (4) 591-595 [2] Wu, G. J., Yuan, F., Du, M. H., Han, H. T., Lu, L. Q., Yan, L., Zhang, W. X., Wang, X. P., Sun, P., Li, Z. D. (2009): Early embryonic blood cells collect antigens and induce immunotolerance in the hatched chicken. Poultry Science: 89 (3) 457-463 [3] Tieleman, B. I. (2008): Carotenoid-based masks in the European Goldfinch Carduelis carduelis reflect different information in males and females. Bio One: (96) 233-242 [4] Pendl, H. (2006): Morphological change in red blood cells of birds and reptiles and their interpretation. Israel Journal of veterinary Mediziner. Tierärztliche Praxis: (27) 280-287 [5] Natt, M. P., Herrick, C. A. (1955): Blood Cells of the Domestic Fowl 1. A Comparison of the Changes in the Erythrocyte Count Resulting from Hemorrhage in Infected and Mechanically Bled Birds. The use of the Hematocrit Value as an Index of the Severity of the Hemorrhage Resulting from the Infection. Poultry Science: 34 (5) 1100-1106 [6] Olanrewaju, H. A., Purswell, J. L., Collier, S. D., Branton, S. L. (2014): Effects of genetic strain and light intensity on blood physiological variables of broilers grown to heavy weights. Poultry Science: 93 (4) 970-978 [7] Wang, X., Peebles, E. D., Zhai, W. (2014): Effects of protein source and nutrient density in the diets of male broilers from 8 to 21 days of age on their subsequent growth, blood constituents, and carcass compositions. Poultry Science: 93 (6): 1463-1474 [8] Słupczyńska, M., Jamroz, D., Orda, J., Wiliczkiewicz, A. (2014): Effect of various sources and levels of iodine, as well as the kind of diet, on the performance of young laying hens, iodine accumulation in eggs, egg characteristics, and morphotic and biochemical indices in blood. Poultry Science: 93 (10): 2536-2547 [9] Veil, K. (1978): Feststellung von Blutwerten bei verschiedenen Vögeln. LMU München (Doktorarbeit): 12-26 [10] Schweizer, C. (2009): Gesundheit, Leistung und Fleischqualität von gemischt gehaltenen B.U.T. BIG 6 und Kelly Bronze Puten in der Auslaufhaltung LMU München (Doktorarbeit): 9-13 [11] Pendl, H. (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 1: Methodische Einführung und Befunde beim klinisch gesunden Vogel. Tierärztliche Praxis Kleintiere. Schattauer Verlag: 290-298 [12] Pendl, H. (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 2: Ontogenetisch-physiologische und pathologische Befunde und deren Interpretation. Tierärztliche Praxis Kleintiere. Schattauer Verlag: 368-380 === Fachbücher === [13] Salomon, F.-V. (1993): Lehrbuch der Geflügelanatomie. Gustav Fischer Verlag: 300-302 [14] Liebich, H.-G. (2010): Funktionelle Histologie der Haussäugetiere und Vogel. Schattauer Verlag: 145-156 [15] Damme, K., Hildebrand, R.-A. (2002): Geflügelhaltung. Verlag Eugen Ulmer: 100-200 [16] Gylstorff, I., Grimm, F. (1987): Vogelkrankheiten. Verlag Eugen Ulmer GmbH & Co.: 122-140 [17] Kraft, W., Dürr, U. M., Fürll, M., Bostedt, H., Heinritzi, K. (1999): Hämatologie. Klinische Labordiagnostik in der Tiermedizin. Schattauer Verlagsgesellschaft: 43-77 [18] Kraft, W., Fürll, M., Bostedt, H., Heinritzi, K. (1999): Skelettmuskulatur, Knochen, Kalzium-, Phosphor-, Magnesiumstoffwechsel. Klinische Labordiagnostik in der Tiermedizin. Schattauer Verlagsgesellschaft: 251-258 [19] Jungbäck, C., Kaleta, E. F., Siegmann, O. (2005): Prophylaxe, Diagnose und Therapie: Allgemeine Seuchenvorbeuge. Kompendium der Geflügelkrankheiten. Schlütersche Verlagsgesellschaft mbH & Co. KG: 71-80 [20] Rautenschlein, S., Kaleta, E. F. (2005): Prophylaxe, Diagnose und Therapie: Prophylaxe. Kompendium der Geflügelkrankheiten. Schlütersche Verlagsgesellschaft mbH & Co. KG: 68-69 [21] Siegmann, O. (1992): Propädeutik. Krankheiten des Wirtschaftsgeflügels. Gustav Fischer Verlag Jena: 15-44 [22] Dorn, P. (1971): Handbuch der Geflügelkrankheiten. Verlag Eugen Ulmer: 190-192 [23] Reinhardt, R. (1950): Lehrbuch der Geflügelkrankheiten. Verlag M.&H. Schaper: 257-260 [24] Kronberger, H. (1974): Haltung von Vögeln - Krankheiten der Vogel. Gustav Fischer Verlag: 120-123 [25] Gylstorff, I. (1983): Blut, Blutbildung und Blutkreislauf. Handbuch der Geflügel Physiologie. Fischer Verlag: 280–395 === Lehrmaterial === [26] Pendl, H. (2012): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend [27] Pendl, H. (2012): Praktische Hämatologie beim Vogel, Kurzanleitung; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend === Internetquellen === [28] http://www.idexx.de/pdf/de_de/smallanimal/reference-laboratories/vet-med-labor-directory.pdf (15.11.2014) [29] http://flexikon.doccheck.com/de/Blutbild (02.11.2014) [30] http://www.laboklin.com/pdf/de/news/laboklin_aktuell/lab_akt_0106.pdf (01.12.2014) === Abbildungsverzeichnis === 1. Helene Pendl (2008): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend 2. http://de.wikipedia.org/wiki/Kubaflamingo (24.11.2014) |
Generelle und grundsätzliche Charakteristika des Blutbildes bei Nutzgeflügel und exotischen Vögeln
Einleitung
Das Blutbild von Nutzgeflügel und exotischen Vögeln ist in der Veterinärmedizin eine wichtige Untersuchungsmethode um mit Hilfe der zellulären Bestandteile des Blutes Aufschluss über den Gesundheits- oder Krankheitsstatus des Tieres zu gewinnen. Genau genommen kann man ihren Anteil, ihre Morphologie und ihre Qualität bestimmen. Man unterscheidet zwischen großem und kleinem Blutbild, wobei das kleine Blutbild die Gesamtleukozytenzahl beschreibt und das große Blutbild zusätzlich das Differentialblutbild (Pendl, 2008).
Contents
Allgemeines
Das Blut im Allgemeinen besteht aus zwei Teilen, dem Blutplasma und den Blutzellen. Zu den Blutzellen zählen bei Vögeln genau wie bei Säugetieren die Erythrozyten, Thrombozyten und Leukozyten.
Blutentnahme
Die Blutentnahme findet bei Vögeln durch die Vena cutaneus ulnaris statt (Laboklin, 2001).
Bei der Blutabnahme sollte man vorzugsweise eine großlumige Kanüle und eine kleinlumige Spritze verwenden. Besonders zu beachten ist, dass das EDTA-Röhrchen (Antikoagulans Ethylendiamintetraazetat) bei den Vogelarten Raben- (Corvidae), Eis- (Alcedinidae), Kranich- (Gruidae) und Straußenvögel (Struthionidae) zur Hämolyse führt (Pendl, 2008). Bei anderen Arten kann das Blut ohne auffällige Veränderungen über kurze Zeit in EDTA oder Heparinröhrchen gelagert werden. Bei längerer Aufbewahrung jedoch kommt es zu vermehrtem Bakterienwachstum, da das Vogelblut nicht steril ist, welches in der Blutausstrich Untersuchung einer pathologischen Veränderung sehr ähneln (Pendl, 2008).
Mit dem entnommenen Blut kann dann ein Blutausstrich gefertigt werden.
Blutbild
Hämatokrit
|
Die Hämatokritbestimmung bei den Vögeln ist identisch mit der der Säugetiere (Trennung durch Zentrifugieren), jedoch liegt eine geringere Blutmenge vor. Bei einem Vogel werden lediglich 0,5 ml entnommen, weshalb es sich besser eignet die Untersuchung mit einer Mikrohämatokritzentrifuge durchzuführen. Der Richtwert beschreibt die Zentrifugationszeit für 5 Minuten bei 12000 g in einem heparinisiertem Mikrohämatokritröhrchen (Pendl, 2008; Veil, 1978).
Die physiologischen Werte für das Vogelblut liegen zwischen 35 und 55%. Die spezifischen Hämatokritwerte liegen bei der Ente und Gans bei 40-45%, bei der Taube bei 58%, beim Huhn bei 46% (Salomon, 1993).
Bei Jungvögeln ist dieser Wert etwas niedriger und Schwankungen aufgrund der Tageszeit, dem Geschlecht oder dem Einfluss von bestimmten Hormonen, wie Thyroxin oder Prolaktin sind möglich. Durch Messung des Gesamtproteingehalts kann eine entweder absolute oder relative quantitative Abweichung des Hämatokrits festgestellt werden. Bei einer Anämie ist der physiologische Wert vermindert und bei einer Polyzythämie erhöht. Eine Thrombo- oder Leukozytose kann in einem Vogel diagnostiziert werden, wenn dessen "buffy coat" den gesunden Wert von 1% mit >1,5% überschreitet. Ab Werten mit >10% rechnet man mit einer leukämischen Neoplasie. Festgestellt wird die Hämatokritabweichung mit dem Farbwechsel zwischen roter und weißer Phase und somit der Verschiebung der Erythrozytenzahl. Bei einer Vermischung der einzelnen Komponente kann das „buffy coat“ eine rosane Farbe aufweisen. Dann ist keine Untersuchung bezüglich des Hämatokrits möglich (Pendl, 2008).
Thrombozyten
Der Thrombozyt bei Vögeln besitzt ein farblos bis leicht graues Zytoplasma mit feiner Netzstruktur, Vakuolen und ondulierter Membran, was als Aktivierungszeichen gilt. Der Kern hat keine vorgeschriebene Position in der Zelle und ist oval bis rund und polymorph bei Aggregation. Seine Struktur ist dicht pyknotisch und er erscheint dunkel in der Zelle. Die Granula befinden sich als rot violette Polkörperchen in Kernnähe. Insgesamt ist die Zelle klein bis moderat, bei Aggregation sind oft nur die Zellkerne zu erkennen. Die Differenzierung zwischen Thrombozyten, Lymphozyten und polychromatischen Erythrozyten gestaltet sich beim Vogel, aufgrund der veränderten Morphologie, wesentlich schwerer als beim Säuger. Alle drei Zellarten enthalten Zellkerne, somit fällt dieses Erkennungsmerkmal bereits weg. Die Thrombozyten erkennt man dann lediglich noch an ihrem pyknotischen Kern und dem häufigen Auftreten von kernnahnen Polkörperchen. Des Weiteren zeigen Thrombozyten oft eine Tendenz zu Aggregation (Pendl, 2008). Die gesamte Thrombozytenzahl liegt bei den meisten Species der Vögel bei 20000-40000 (Pendl, 2012).
Bei Ziervögeln weist ein über 50%-iger Anteil von reaktiven Thrombozyten auf Veränderungen im Organismus hin (beispielsweise erhöhte Gerinnungsaktivität).
Erythrozyten
Erythrozyten sind beim Geflügel große, ovale und abgeplattete Zellen. Diese besitzen einen ovalen Zellkern. Im Normalfall liegt die Erythrozytenzahl/mm3 bei 2,4-4 Millionen (Salomon, 1993). Diese Zahl ist vergleichsweise gering (Katze: 7,2-10 Millionen) (Liebich, 2010).
Als Anisozytose wird eine hohe Variabilität in der Größe der Zellen bezeichnet. Festgestellt wird dies mit dem polychromatischen Index (PI) (Pendl, 2008).
Polychromasie bezieht sich auf eine erhöhte Varianz in der Färbung der Erythrozyten. Bei Küken ist der Anteil an juvenilen Zellen größer als bei erwachsenen Tieren, allerdings gleicht sich dieser Wert bis zur 6. Lebenswoche an. Als Poikilozytose bezeichnet man eine pathologische Veränderung des Zellkerns und der Plasmaform. Hervorgerufen durch Sauerstoffmangel können bei einigen Arten des Genus Amazona verdickte, abgerundete Zellen auftreten, wodurch eine Verbreiterung des Zytoplasmas resultiert. Beim Ziervogel tritt nur selten eine Form einer Polycythameia vera auf (Pendl, 2008).
Hämoglobin
Als günstig für die Hämoglobinmessung beim Vogel zählt die Cyanhämoglobinmethode. Hämoglobinopathie wurden bisher beim Vogel noch nicht beschrieben. Hämoglobin ist trotzdem ein guter Parameter, um durch inneren/äußeren Blutverlust, Hämolyse oder Hemmung der Erytro- und Hämatopoese verursachte Anämie festzustellen. Dafür sind vielerlei Ursachen bekannt zum Beispiel: Magen-Darm Parasiten, Knochenfrakturen, blutsaugende Ektoparasiten, Blutparasiten, Nährstoffmangel (Pendel, 2008).
Immunglobine
Die Bursa cloacalis, die nur die Vögel besitzen, produziert B-Zellen, bei den Säugetieren werden diese jedoch hauptsächlich im Knochenmark synthetisiert. Die Aufgabe der B-Zellen ist Immunoglobine freizusetzen und somit die humoral vermittelnde Immunität zu steuern. Folgende Immunglobine finden wir bei den Vögeln: IgM, IgA, IgG (kann auch als IgY bezeichnet werden), IgD und IgE haben aber nur die Säugetiere. Die Entwicklung findet im Thymus, statt. Diese stellen die spezifisch zellvermittelnde Immunkompetenz dar. Jedoch wurden sie bei den Vögeln bisher noch nicht ausreichend erforscht (Rautenschlein und Kaleta, 2005).
Kalzium und Phosphor
Phosphor können wir im Vogelblut in Form von anorganischen Phosphat, Phospholipid oder als organischen Ester finden. Das anorganische Phosphat im Serum hat diagnostische Bedeutung. Durch Einwirkung von Parathormonen und Calcitonin erniedrigt sich der Phosphorniveau im Blut. Unter den physiologischen Richtwert senkt sich der Phosphorspiegel durch Vitamin D Mangel oder Hitzestress (Gylstorff und Grimm, 1987). Durch eine Mineralienunterversorgung der Körpers, treten Beeinträchtigungen der Gesundheit, Leistungsfähigkeit und Wohlbefindens ein. Weitere Folgen des Phosphormangels bei Vogel sind „Beinschwäche“ und eine herabgesetzte Knochenstabilität (Damme und Hildebrand, 2002). Je nach Alter und Nutzungsrichtung ist einen unterschiedliche Mineralversorgung nötig (Siegmann, 2005).
Die Kalziumhomöostase wird durch Parathormon und Vitamin D sichergestellt. Der Gesamtkalziumgehalt wird im Vogelblut gemessen und beträgt für ionisiertes Kalzium im Serum 55%, 40% sind an Proteine und 5% an organische Säuren gebunden (Kraft et al., 1999). Durch Mobilisation aus dem Knochen wird der Kalziumgehalt durch das Parathormon und Vitamin D gesteigert. Zusätzlich regt Vitamin D ein kalziumbindendes Protein für die erhöhte Kalziumresorption aus dem Darm an. Ein Sinken des Kalziumwertes kann Hypolbuminämie, sehr große Fettgewebsnekrosen und Nierenerkrankung im Endstadium hinweisen (Gylstorff und Grimm, 1987).
Differentialblutbild
Leukozyten
Erst in dem Differentialblutbild werden die Unterschiede zwischen Vögeln und Säugetieren deutlich.
Die im Normalbereich liegende Gesamtleukozytenzahl ist bei Vögeln mit granulozytärem und lymphozytärem Blutbild unterschiedlich. Bei dem der ersten Gruppe angehörenden Geflügel und Vögeln liegt sie zwischen 5000 und 25000 und bei denen der zweiten Gruppe angehörenden Vögeln zwischen 25000 und 45000 (Pendl, 2008).
Granulozyten
Kriterium |
Heterophiler |
Eosinophiler |
Basophiler |
Plasma |
farblos, eosinophiler Farbstich bei Granulaauflösung |
farblos bis basophil |
farblos, basophil oder eosinophil |
Granulierung |
elliptisch, eosinophil, eventuell rötlich, brauner Stich, Auflösungserscheinungen oder nur Zentralkörperchen angefärbt (runde Granula) |
rund, farblos, eosinophil bis basophil, klar erkennbar, ohne Zentralkörperchen, größer und variabler als bei Basophilen |
basophil bis rötlich, weiß durch Auflösungstendenz, selten dicht gepackt mit kleinen dunkelvioletten Granula |
Kern |
gelappt, weniger gut strukturiert |
gelappt, intensive Färbung, gut strukturiert |
ungelappt, rundlich, schlecht strukturiert |
Allgemeines Bild |
Speziesübergreifende Morphologie, kontrastarm, artefaktanfällig |
speziesspezifische Variabilität, kontrastreich, wenig artefaktanfällig |
technisch bedingte Variabilität, Auflösungstendenz, stark artefaktanfällig |
Tabelle modifiziert nach (Pendl, 2008)
Monozyten
Der Monozyt der Vögel ist moderat bis groß und von runder Gestalt. Sein Zellkern ist irregulär mit Unebenheiten an den Seitenrändern, feinschollig und erscheint hell in der Zelle. Er liegt in dem blaugrauen, schaumigen Plasma exzentrisch, das in der Kernnähe eine orange rosa Verfärbung aufweist. Außerdem enthält es Vakuolen und Protoplasmabläschen, die ein Hinweis auf die Aktivierung der Zelle sind. Die feinen, azurophilen Granula befinden sich ausschließlich in Kernnähe. Insgesamt ist es eine fein strukturierte Zelle, bei der man die einzelnen Teile gut erkennen kann (Pendl, 2008).
Lymphozyt
Der Lymphozyt des Vogels ist weniger gut strukturiert, die Details sind jedoch immer noch sehr gut zu erkennen. Der Zellkern hat kugelige Gestalt, liegt zentral in der Zelle und ist grobschollig vor einem netzartigem Hintergrund. Vor allem bei kleineren Lymphozyten ist er sehr dicht. Azurophile Granula und Magentakörperchen sind zu finden, welche wieder ein Zeichen der Aktivierung sind. Diese befinden sich in homogenem, basophilem Plasma mit Vakuolen und Protoplasmbläschen. Er hat runde Form mit irregulären Formen durch Anlagerungen an benachbarte Zellen. Seine Größe kann sehr unterschiedlich sein und reicht von klein mit sehr wenig Plasma bis groß mit viel Plasma (Pendl, 2008).
"In chickens the heterophil/lymphocyte ratio (H/L) has proved to be a valuable tool in stress related research. In general, H/L is determined with the microscopic differential count on a blood film." (Post et al., 2003)
Physiologische und pathologische Veränderungen
Plasmasäule
|
Die Plasmasäule (entstehendes Plasma) hat bei Vögeln mit einer hellroten Federfarbe, wie dem Kubaflamingo (Phoenicopterus ruber) oder dem Roten Ibis (Eudocimus ruber) einen rosanen Farbstich. Dies liegt an den mit der Nahrung aufgenommenen Karotinoide. Ebenfalls durch die in den Samen aufgenommenen Lipochrome hat die Plasmasäule bei granivoren Vögeln eine gelbliche Farbe. Ein grünlicher äußerst seltener Farbstich kann bei Tukanen und Fächerpapageien (Deroptyus accipitrinus) auftreten. Eine Störung des Lipidstoffwechsels kann Ursache einer Lipämie und somit einer milchigen Trübung des Plasmas sein. Eine deutlich rote Verfärbung spricht für Hämolyse und ist meist krankheitsbedingt (Pendl, 2008).
Leuko- & Thrombozyten
Physiologischer Hintergrund ist hier das Immunsystem der Vögel, welches dem der Säuger entspricht. "[...] the blood cells collecting circulating antigen might contribute to the establishment of immunotolerance." (Wu et al., 2009)
Befund |
Interpretation (Beispiele) |
Eosinophilie > 600 Zellen/μl |
Dermopathien, wie zum Beispiel Flugunfällen oder Bissverletzungen, physiologisch hohen Zahlen bei auch bei manchen Greifvogelarten |
Basophilie > 600 Zellen/μl |
Nymphensittich (Nymphicus hollandicus) respiratorischen Erkrankungen oder Dermopathien mit schwerem Gewebetrauma |
Thrombozytopenie > 60.000 Zellen |
posthämorrhagische Situationen, gesteigerte unspezifische Phagozytose, starke Reaktion nach Thrombopenie |
Thrombozytopenie < 15.000 Zellen |
Artefakt (Aggregate in Blutprobe), übersteigerter Bedarf (Koagulopathien), reduzierte Poese (Knochenmarksdepression) |
moderate Leukozytose mit Heterophilie, Monozytose (>1000 Zellen), Lymphopenie |
Reaktion überwiegend des angeborenen Immunsytems mit Verdacht auf Supression der Lmphozyten (klinisch gehäuft bei Aspergilloseinfektionen, siehe auch Lymphopenie) |
Lymphopenie (<1000 Zellen) |
Supression der Lymphozyten (stressbedingt, chronische virale Infektion, z.B.Paramyxo-, Herpes-, Poxvirus, Gliotoxine bestimmter Aspergillusstämme, Infektionen mit Mycobacterium sp., Kortikosteroidtherapie) |
Heterophilie mit toxischer Linksverschiebung > 15.000 Zellen |
massive Reaktion des angeborenen Immunsystems, Anzeichen einer septikämisch-toxämischen Situation oder Schädigung/Erschöpfung der Granulopoese, Prognose vorsichtig bis ungünstig |
hochgradie Leukozyten > 100.000 Zellen mit Heterophilie auffälliger Monozytose reaktiver Morphologie der Mono- / Lymphozyten |
leukömoide Reaktion des angeborenen und erworbenen Immunsystems, Antigenreiz (gehäuft bei Infektionen mit Chlamydophila sp., Mycobacterium sp. - letztere oft aufgrund der mikrobiellen Eisenakkumulation mit einer hypochromen Anämie vergesellschaftet) |
Heteropenie < 1.500 Zellen |
Artefakt (Entmischung der Blutprobe vor dem Ausstreichen), Infektionen (Circovirusinfektion bei juvenilen Graupapageien, Intoxikation (Fenbendazolvergiftung), finale Exazerbation einer Heterophilie mit toxischer Linksverschiebung |
Tabelle modifiziert nach (Pendl, 2008)
Blutmilben
Die blutsaugenden roten Vogelmilben, oder auch Blutmilben genannt, sind die gefährlichsten Exoparasiten der Geflügelarten. Vor allem betroffen davon sind Hühner, Puten und Tauben, aber auch bei anderen Nutz-, Wild- und Ziervögeln sind sie zu finden. Außerdem können auch andere Tiere befallen und in seltenen Fällen beim Menschen erscheinen. Sie erreichen etwa eine Größe von 0,75cm und haben normalerweise eine gelbgraue Färbung und ovale Form, färben sich jedoch nach dem Blutsaugen schwarzrot und erhalten eine runde Gestalt. Auch ohne Blutsaugen oder bei kalten Temperaturen können Milben viele Wochen überleben. Bei starken Milbenbefall kann ein Tier von mehreren 100 Milben überfallen werden und sogar blutleer gesaugt werden, wobei das bei vielen Jungtieren zum Tod führt. Bei adulten Tieren sind Hinweise auf Blutmilben starke Blässe der Kopfanhänge, Legeleistung sinkt, Tauben werden durch die Schwäche sogar flugunfähig und die Sterblichkeit nimmt zu. Bei verendeten Tieren ist die Muskultur sehr blass. Nachweisbar sind Milben selbst am Tier oder Käfig, nach dem Befall am pulverfeinem Milbenkot in der Stallung und am Vogel im Schleim von Schnabelhöhle, Schlund und Gehörgang (Dorn, 1971).
Es gibt sehr viele verschiedene Formen der Bekämpfung von Vogelmilben. Eine effektive Möglichkeit der Bekämpfung ist Carbamate. Es zeichnet sich durch eine gute Verträglichkeit aus und lässt keine Rückstände im Tier oder Ei. Bei der Behandlung werden die Vögel mit 1%igem Puder bestäubt (Dorn, 1971).
Quellenverzeichnis
Fachartikel
[1] Post, J., Rebel, J.M., ter Huurne, A.A. (2003): Automated blood cell count: a sensitive and reliable method to study corticosterone-related stress in broilers. Poultry Science: 82 (4) 591-595
[2] Wu, G. J., Yuan, F., Du, M. H., Han, H. T., Lu, L. Q., Yan, L., Zhang, W. X., Wang, X. P., Sun, P., Li, Z. D. (2009): Early embryonic blood cells collect antigens and induce immunotolerance in the hatched chicken. Poultry Science: 89 (3) 457-463
[3] Tieleman, B. I. (2008): Carotenoid-based masks in the European Goldfinch Carduelis carduelis reflect different information in males and females. Bio One: (96) 233-242
[4] Pendl, H. (2006): Morphological change in red blood cells of birds and reptiles and their interpretation. Israel Journal of veterinary Mediziner. Tierärztliche Praxis: (27) 280-287
[5] Natt, M. P., Herrick, C. A. (1955): Blood Cells of the Domestic Fowl 1. A Comparison of the Changes in the Erythrocyte Count Resulting from Hemorrhage in Infected and Mechanically Bled Birds. The use of the Hematocrit Value as an Index of the Severity of the Hemorrhage Resulting from the Infection. Poultry Science: 34 (5) 1100-1106
[6] Olanrewaju, H. A., Purswell, J. L., Collier, S. D., Branton, S. L. (2014): Effects of genetic strain and light intensity on blood physiological variables of broilers grown to heavy weights. Poultry Science: 93 (4) 970-978
[7] Wang, X., Peebles, E. D., Zhai, W. (2014): Effects of protein source and nutrient density in the diets of male broilers from 8 to 21 days of age on their subsequent growth, blood constituents, and carcass compositions. Poultry Science: 93 (6): 1463-1474
[8] Słupczyńska, M., Jamroz, D., Orda, J., Wiliczkiewicz, A. (2014): Effect of various sources and levels of iodine, as well as the kind of diet, on the performance of young laying hens, iodine accumulation in eggs, egg characteristics, and morphotic and biochemical indices in blood. Poultry Science: 93 (10): 2536-2547
[9] Veil, K. (1978): Feststellung von Blutwerten bei verschiedenen Vögeln. LMU München (Doktorarbeit): 12-26
[10] Schweizer, C. (2009): Gesundheit, Leistung und Fleischqualität von gemischt gehaltenen B.U.T. BIG 6 und Kelly Bronze Puten in der Auslaufhaltung LMU München (Doktorarbeit): 9-13
[11] Pendl, H. (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 1: Methodische Einführung und Befunde beim klinisch gesunden Vogel. Tierärztliche Praxis Kleintiere. Schattauer Verlag: 290-298
[12] Pendl, H. (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 2: Ontogenetisch-physiologische und pathologische Befunde und deren Interpretation. Tierärztliche Praxis Kleintiere. Schattauer Verlag: 368-380
Fachbücher
[13] Salomon, F.-V. (1993): Lehrbuch der Geflügelanatomie. Gustav Fischer Verlag: 300-302
[14] Liebich, H.-G. (2010): Funktionelle Histologie der Haussäugetiere und Vogel. Schattauer Verlag: 145-156
[15] Damme, K., Hildebrand, R.-A. (2002): Geflügelhaltung. Verlag Eugen Ulmer: 100-200
[16] Gylstorff, I., Grimm, F. (1987): Vogelkrankheiten. Verlag Eugen Ulmer GmbH & Co.: 122-140
[17] Kraft, W., Dürr, U. M., Fürll, M., Bostedt, H., Heinritzi, K. (1999): Hämatologie. Klinische Labordiagnostik in der Tiermedizin. Schattauer Verlagsgesellschaft: 43-77
[18] Kraft, W., Fürll, M., Bostedt, H., Heinritzi, K. (1999): Skelettmuskulatur, Knochen, Kalzium-, Phosphor-, Magnesiumstoffwechsel. Klinische Labordiagnostik in der Tiermedizin. Schattauer Verlagsgesellschaft: 251-258
[19] Jungbäck, C., Kaleta, E. F., Siegmann, O. (2005): Prophylaxe, Diagnose und Therapie: Allgemeine Seuchenvorbeuge. Kompendium der Geflügelkrankheiten. Schlütersche Verlagsgesellschaft mbH & Co. KG: 71-80
[20] Rautenschlein, S., Kaleta, E. F. (2005): Prophylaxe, Diagnose und Therapie: Prophylaxe. Kompendium der Geflügelkrankheiten. Schlütersche Verlagsgesellschaft mbH & Co. KG: 68-69
[21] Siegmann, O. (1992): Propädeutik. Krankheiten des Wirtschaftsgeflügels. Gustav Fischer Verlag Jena: 15-44
[22] Dorn, P. (1971): Handbuch der Geflügelkrankheiten. Verlag Eugen Ulmer: 190-192
[23] Reinhardt, R. (1950): Lehrbuch der Geflügelkrankheiten. Verlag M.&H. Schaper: 257-260
[24] Kronberger, H. (1974): Haltung von Vögeln - Krankheiten der Vogel. Gustav Fischer Verlag: 120-123
[25] Gylstorff, I. (1983): Blut, Blutbildung und Blutkreislauf. Handbuch der Geflügel Physiologie. Fischer Verlag: 280–395
Lehrmaterial
[26] Pendl, H. (2012): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
[27] Pendl, H. (2012): Praktische Hämatologie beim Vogel, Kurzanleitung; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
Internetquellen
[28] http://www.idexx.de/pdf/de_de/smallanimal/reference-laboratories/vet-med-labor-directory.pdf (15.11.2014)
[29] http://flexikon.doccheck.com/de/Blutbild (02.11.2014)
[30] http://www.laboklin.com/pdf/de/news/laboklin_aktuell/lab_akt_0106.pdf (01.12.2014)
Abbildungsverzeichnis
1. Helene Pendl (2008): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
2. http://de.wikipedia.org/wiki/Kubaflamingo (24.11.2014)