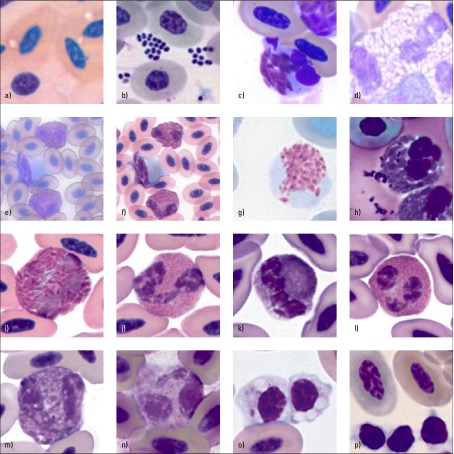
Generelle und grundsätzliche Charakteristika des Blutbildes bei Nutzgeflügel und exotischen Vögeln
Einleitung
Das Blutbild von Nutzgeflügel und exotischen Vögeln ist in der Veterinärmedizin eine wichtige Untersuchungsmethode um mit Hilfe der zellulären Bestandteile des Blutes Aufschluss über den Gesundheits- oder Krankheitsstatus des Tieres zu gewinnen. Genau genommen kann man ihren Anteil, ihre Morphologie und ihre Qualität bestimmen. Man unterscheidet zwischen großen und kleinem Blutbild, wobei das kleine Blutbild die Gesamtleukozytenzahl beschreibt und das große Blutbild zusätzlich das Differentialblutbild.
Contents
Allgemeines
Das Blut im Allgemein besteht aus zwei Teilen, dem Blutplasma und den Blutzellen. Zu den Blutzellen zählen bei Vögeln genau wie bei Säugetieren die Erythrozyten, Thrombozyten und Leukozyten.
Blutentnahme
Die Blutentnahme findet bei Vögeln durch die Vena cutaneus ulnaris statt (Laboklin, 2001).
Bei der Blutabnahme sollte man vorzugsweise eine großlumige Kanüle und eine kleinlumige Spritze verwenden. Besonders zu beachten ist, dass das EDTA-Röhrchen (Antikoagulans Ethylendiamintetraazetat) bei den Vogelarten Raben- (Corvidae), Eis- (Alcedinidae), Kranich- (Gruidae) und Straussenvögel (Struthionidae) zur Hämolyse führt (Pendel, 2008 (1)). Bei anderen Arten kann das Blut ohne auffällige Veränderungen über kurze Zeit in EDTA oder Heparinröhrchen gelagert werden. Bei längerer Aufbewahrung jedoch kommt es zu vermehrtem Bakterienwachstum, da das Vogelblut nicht steril ist, welches in der Blutausstrich Untersuchung einer pathologischen Veränderung sehr ähneln (Pendel, 2012 (1)).
Mit dem entnommenen Blut kann dann ein Blutausstrich gefertigt werden (idexx.de).
Blutbild
Hämatokrit
|
Die Hämatokritbestimmung bei den Vögeln ist identisch mit der der Säugetiere (Trennung durch Zentrifugieren), jedoch liegt eine geringere Blutmenge vor. Bei einem Vogel werden lediglich 0,5 ml entnommen, weshalb es sich besser eignet die Untersuchung mit einer Mikrohämatokritzentrifuge durchzuführen. Der Richtwert beschreibt die Zentrifugationszeit für 5 Minuten bei 12000 g in einem heparisiertem Mikrohämatokritröhrchen (Pendel, 2012 (1); Veil, 1978).
Die physiologischen Werte für das Vogelblut liegen zwischen 35 und 55%. Die spezifischen Hämatokritwerte liegen bei der Ente und Gans bei 40-45%, bei der Taube bei 58%, beim Huhn bei 46% (Salomon, 1993).
Bei Jungvögeln ist dieser Wert etwas niedriger und Schwankungen aufgrund der Tageszeit, dem Geschlecht oder dem Einfluss von bestimmten Hormonen, wie Thyroxin oder Prolaktin sind möglich. Durch Messung des Gesamtproteingehalts kann eine entweder absolute oder relative quantitative Abweichung des Hämatokrits festgestellt werden. Bei einer Anämie ist der physiologische Wert vermindert und bei einer Polyzythämie erhöht. Eine Thrombo- oder Leukozytose kann in einem Vogel diagnostiziert werden, dessen "buffy coat" den gesunden Wert von 1% mit >1,5% überschreitet. Ab Werten mit >10% rechnet man mit einer leukämischen Neoplasie. Festgestellt wird die Hämatokritabweichung mit dem Farbwechsel zwischen roter und weißer Phase und somit der Verschiebung der Erythrozytenzahl. Bei einer Vermischung der einzelnen Komponente kann das „buffy coat“ eine rosane Farbe aufweisen. Dann ist keine Untersuchung bezüglich des Hämatokrits möglich (Pendel 2012 (2).
Thrombozyten
Der Thrombozyt bei Vögeln besitzt ein farblos bis leicht graues Zytoplasma mit feiner Netzstruktur, Vakuolen und ondulierter Membran, was als Aktivierungszeichen gilt. Der Kern hat keine vorgeschriebene Position in der Zelle und ist oval bis rund und polymorph bei Aggregation. Seine Struktur ist dicht pyknotisch und er erscheint dunkel in der Zelle. Die Granula befinden sich als rot violette Polkörperchen in Kernnähe. Insgesamt ist die Zelle klein bis moderat, bei Aggregation sind oft nur die Zellkerne zu erkennen. Die Differenzierung zwischen Thrombozyten, Lymphozyten und polychromatischen Erythrozyten gestaltet sich beim Vogel, aufgrund der veränderten Morphologie, wesentlich schwerer als beim Säuger. Alle drei Zellarten enthalten Zellkerne, somit fällt dieses Erkennungsmerkmal bereits weg. Die Thrombozyten erkennt man dann lediglich noch an ihrem pyknotischen Kern und dem häufigen Auftreten von kernnahnen Polkörperchen. Desweiteren zeigen Thrombozyten oft eine Tendenz zu Aggregation (Pendel 2008 (1)). Die gesamte Thrombozytenzahl liegt bei den meisten Species der Vögel bei 20000-40000 (Pendel 2012 (1)).
Bei Ziervögeln weist ein über 50%-iger Anteil von reaktiven Thrombozyten auf Veränderungen im Organismus hin (beispielsweise erhöhte Gerinnungsaktivität).
Erythrozyten
Erythrozyten sind beim Geflügel große, ovale und abgeplatte Zellen. Diese besitzen einen ovalen Zellkern. Im Normalfall liegt die Erythrozytenzahl/mm3 bei 2,4-4 Millionen (Salomon, 1993). Diese Zahl ist vergleichsweise gering (Katze: 7,2-10 Millionen) (Liebich, 2010).
Als Anisozytose Anisozytose wird eine hohe Variabilität in der Größe der Zellen bezeichnet. Festgestellt wird dies mit dem polychromatischen Index (PI) (Pendel, 2012 (2)).
Polychromasie bezieht sich auf eine erhöhte Varianz in der Färbung der Erythrozyten. Bei Küken ist der Anteil an juvenilen Zellen größer als bei erwachsenen Tieren, allerdings gleicht sich dieser Wert bis zur 6. Lebenswoche an. Als Poikilozytose bezeichnet man eine pathologische Veränderung des Zellkerns und der Plasmaform. Hervorgerufen durch Sauerstoffmangel können bei einigen Arten des Genus Amazona verdickte, abgerundete Zellen auftreten, wodurch eine Verbreiterung des Zytoplasmas resultiert. Beim Ziervogel tritt nur selten eine Form einer Polycythameia vera auf (Pendel, 2012 (2)).
Hämoglobin
Als günstig für die Hämoglobinmessung beim Vogel zählt die Cyanhämoglobinmethode. Hämoglobinopathie wurden bisher beim Vogel noch nicht beschrieben. Hämoglobin ist trotzdem ein guter Parameter, um durch inneren/äußeren Blutverlust, Hämolyse oder Hemmung der Erytro- und Hämatopoese verursachte Anämie festzustellen. Dafür sind vielerlei Ursachen bekannt zum Beispiel: Magen-Darm Parasiten, Knochenfrakturen, blutsaugende Ektoparasiten, Blutparasiten, Nährstoffmangel (Pendel 2012 (1)).
Immunglobine
Die Bursa cloacalis, die nur die Vögel besitzen, produziert B-Zellen, bei den Säugetieren werden diese jedoch hauptsächlich im Knochenmark synthetisiert. Die Aufgabe der B-Zellen ist Immunoglobine freizusetzen und somit die humoral vermittelnde Immunität zu steuern. Folgende Immunglobine finden wir bei den Vöglen: IgM, IgA, IgG (kann auch als IgY bezeichnet werden), IgD und IgE haben aber nur die Säugetiere. Die Entwicklung findet im http://de.wikipedia.org/wiki/Thymus statt. Diese stellen die spezifisch zellvermittelnde Immunkompetenz dar. Jedoch wurden sie bei den Vögeln bisher noch nicht ausreichend erforscht (Rautenschlein und Kaleta, 2005).
Kalzium und Phosphor
Phosphor können wir im Vogelblut in Form von anorganischen Phosphat, Phospholipid oder als organischen Ester finden. Das anorganische Phosphat im Serum hat diagnostische Bedeutung. Durch Einwirkung von Parathormonen und Calcitonin erniedrigt sich der Phosphorniveau im Blut. Unter den physiologischen Richtwert senkt sich der Phosphorspiegel durch Vitamin D Mangel oder Hitzestress (Glystroff und Grimm, 1987). Durch eine Mineralienunterversorgung der Körpers, treten Beeinträchtigungen der Gesundheit, Leistungsfähigkeit und Wohlbefindens ein. Weitere Folgen des Phosphormangels bei Vogel sind „Beinschwäche“ und eine herabgesetzte Knochenstabilität (Damme und Hildebrand, 2002). Je nach Alter und Nutzungsrichtung ist einen unterschiedliche Mineralversorgung nötig (Siegmann, 2005).
Die Kalziumhomöostase wird duch Parathormon und Vitamin D sichergestellt. Der Gesamtkalziumgehalt wird im Vogelblut gemessen und beträgt für ionisiertes Kalzium im Serum 55%, 40% sind an Proteine und 5% an organische Säuren gebunden (Kraft et al., 1999b). Durch Mobilisation aus dem Knochen wird der Kalziumgehalt durch das Parathormon und Vitamin D gesteigert. Zusätzlich regt Vitamin D ein kalziumbindendes Protein für die erhöhte Kalziumresorption aus dem Darm an. Eine sinken des Kalziumwertes kann Hypolbuminämie, sehr grosse Fettgewebsnekrosen und Nierenerkrankung im Endstadium hinweisen (Gylstroff und Grimm, 1987).
Differentialblutbild
Leukozyten
Erst in dem Differentialblutbild werden die Unterschiede zwischen Vögeln und Säugetieren deutlich.
Die im Normalbereich liegende Gesamtleukozytenzahl ist bei Vögeln mit granulozytärem und lymphozytärem Blutbild unterschiedlich. Bei dem der ersten Gruppe angehörenden Geflügel und Vögeln liegt sie zwischen 5000 und 25000 und bei denen der zweiten Gruppe angehörenden Vögeln zwischen 25000 und 45000 (Pendel, 2012 (1)).
Granulozyten
Kriterium |
Heterophiler |
Eosinophiler |
Basophiler |
Plasma |
farblos, eosinophiler Farbstich bei Granulaauflösung |
farblos bis basophil |
farblos, basophil oder eosinophil |
Granulierung |
elliptisch, eosinophil, eventuell rötlich, brauner Stich, Auflösungserscheinungen oder nur Zentralkörperchen angefärbt (runde Granula) |
rund, farblos, eosinophil bis basophil, klar erkennbar, ohne Zentralkörperchen, größer und variabler als bei Basophilen |
basophil bis rötlich, weiß durch Auflösungstendenz, selten dicht gepackt mit kleinen dunkelvioletten Granula |
Kern |
gelappt, weniger gut strukturiert |
gelappt, intesive Färbung, gut strukturiert |
ungelappt, rundlich, schlecht strukturiert |
Allgemeines Bild |
Speziesübergreifende Morphologie, kontrastarm, artefaktanfällig |
speziesspezifische Variabilität, kontrastreich, wenig artefaktanfällig |
technisch bedingte Variabilität, Auflösungstendenz, stark artefaktanfällig |
Monozyten
Der Monozyt der Vögel ist mordernat bis groß und von runder Gestalt. Sein Zellkern ist irregulär mit Unebenheiten an den Seitenrändern, feinschollig und erscheint hell in der Zelle. Er liegt in dem blaugrauen, schaumigen Plasma exzentrisch, das in der Kernnähe eine orange rosa Verfärbung aufweist. Außerdem enthält es Vakuolen und Protoplasmabläschen, die ein Hinweis auf die Aktivierung der Zelle sind. Die feinen, azurophilen Granula befinden sich ausschliesslich in Kernnähe. Insgesamt ist es eine fein strukturierte Zelle, bei der man die einzelnen Teile gut erkennen kann (Pendel, 2012 (1)).
Lymphozyt
Der Lymphozyt ist weniger gut strukturiert, die Details sind jedoch immer noch sehr gut zu erkennen. Der Zellkern hat kugelige Gestalt, liegt zentral in der Zelle und ist grobschollig vor einem netzartigem Hintergrund. Vor allem bei kleineren Lymphozyten ist er sehr dicht. Wir finden azurophile Granula und Magentakörperchen, die wieder ein Zeichen der Aktivierung sind. Diese befinden sich in homogenem, basophilem Plasma mit Vakuolen und Protoplasmbläschen. Er hat runde Form mit irregulären Formen durch Anlagerungen an benachbarte Zellen. Seine Größe kann sehr unterschiedlich sein und reicht von klein mit sehr wenig Plasma bis groß mit viel Plasma (Pendel, 2012 (1)).
Physiologische und pathologische Veränderungen
Plasmasäule
|
Die Plasmasäule (entstehendes Plasma) hat bei Vögeln mit einer hellroten Federfarbe,wie dem Kuba-flamingo (Phoenicopterus ruber) oder dem Roten Ibis (Eudocimus ruber) einen rosanen Farbstich. Dies liegt an den mit der Nahrung aufgenommenen Karotinoide. Ebenfalls durch die in den Samen aufgenommenen Lipochrome hat die Plasmasäule bei granivoren Vögeln eine gelbliche Farbe. Ein grünlicher äußerst seltener Farbstich kann bei Tukanen und Fächerpapageien (Deroptyus accipitrinus) auftreten. Eine Störung des Lipidstoffwechsels kann Ursache einer Lipämie und somit einer milchigen Trübung des Plasmas sein. Eine deutlich rote Verfärbung spricht für Hämolyse und ist meist krankheitsbedingt (Pendel, 2012 (2)).
Leuko- & Thrombozyten
Physiologischer Hintergrund ist hier das Immunsystem der Vögel, welches dem der Säuger entspricht.
Befund |
Interpretation (Beispiele) |
Eosinophilie > 600 Zellen/μl |
Dermopathien, wie zum Beispiel Flugunfällen oder Bissverletzungen, physiologisch hohen Zahlen bei auch bei manchen Greifvogelarten |
Basophilie > 600 Zellen/μl |
Nymphensittich (Nymphicus hollandicus) respiratorischen Erkrankungen oder Dermopathien mit schwerem Gewebetrauma |
Thrombozytopenie > 60.000 Zellen |
posthämorrhagische Situtationen, gesteigerte unspezifische Phagozytose, starke Reaktion nach Thrombopenie |
Thrombozytopenie < 15.000 Zellen |
Artefakt (Aggregate in Blutprobe), übersteigerter Bedarf (Koagulopathien), reduzierte Poese (Knochenmarksdepression) |
moderate Leukozytose mit Heterophilie, Monozytose (>1000 Zellen), Lymphopenie |
Reaktion überwiegend des angeborenen Immunsytems mit Verdacht auf Supression der Lmphozyten (klinisch gehäuft bei Aspergilloseinfektionen, siehe auch Lymphopenie) |
Lymphopenie (<1000 Zellen) |
Supression der Lymphozyten (stressbedingt, chronische virale Infektion, z.B.Paramyxo-, Herpes-, Poxvirus, Gliotoxine bestimmter Aspergillusstämme, Infektionen mit Mycobacterium sp., Kortikosteroidtherapie) |
Heterophilie mit toxischer Linksverschiebung > 15.000 Zellen |
massive Reaktion des angeborenen Immunsystems, Anzeichen einer septikämisch-toxämischen Situation oder Schädigung/Erschöpfung der Granulopoese, Prognose vorsichtig bis ungünstig |
hochgradie Leukozyten > 100.000 Zellen mit Heterophilie auffälliger Monozytose reaktiver Morphologie der Mono- / Lymphozyten |
leukömoide Reaktion des angeborenen und erworbenen Immunsystems, Antigenreiz (gehäuft bei Infektionen mit Chlamydophila sp., Mycobacterium sp. - letztere oft aufgrund der mikrobiellen Eisenakkumulation mit einer hypochromen Anämie vergesellschaftet) |
Heteropenie < 1.500 Zellen |
Artefakt (Entmischung der Blutprobe vor dem Ausstreichen), Infektionen (Circovirusinfektion bei juvenilen Graupapageien, Intoxikation (Fenbendazolvergiftung), finale Exazerbation einer Heterophilie mit toxischer Linksverschiebung |
Funktionen
modifiziert nach Campbell , Fudge, Gylstorff ,Hawkey & Dennet): Eine heterophile Blutzelle hat die angeborene Funktion der Immunreaktion, der Primärantwort und der unspezifischen Phagozytose von Mikroorganismen.
Die Funktion des Lymphozyten ist sowohl die Sekundärantwort, als auch die spezifisch humorale- und zellassoziierte Immunantwort. Unter der spezifisch humoralen Antwort versteht man die Bildung von Immunglobulinen und Zytokinen. Ausgenommen davon wind die „natural killer cells“ (NK-Zellen), welche ungefähr 5% der Lymphozytenpopulation entsprechen und zum angeborenen Immunsytem eines gesunden Vogels gehören.
Monozyten vermitteln zwischen angeborener und erworbener Immunreaktion. Des Weiteren beteiligen sie sich an der antigenspezifischen Immunglobulininteraktionen, vor allem zwischen IgM und IgY. Außerdem haben sie eine wichtige Funktion bei der Antigenpräsentation für Lymphozyten.Funktionen der Thrombozyten sind Wundheilung, Thrombusbildung, sowie die unspezifisch
|
Funktionen
modifiziert nach Campbell , Fudge, Gylstorff ,Hawkey & Dennet): Eine heterophile Blutzelle hat die angeborene Funktion der Immunreaktion, der Primärantwort und der unspezifischen Phagozytose von Mikroorganismen.
Die Funktion des Lymphozyten ist sowohl die Sekundärantwort, als auch die spezifisch humorale- und zellassoziierte Immunantwort. Unter der spezifisch humoralen Antwort versteht man die Bildung von Immunglobulinen und Zytokinen. Ausgenommen davon wind die „natural killer cells“ (NK-Zellen), welche ungefähr 5% der Lymphozytenpopulation entsprechen und zum angeborenen Immunsytem eines gesunden Vogels gehören.
Monozyten vermitteln zwischen angeborener und erworbener Immunreaktion. Des Weiteren beteiligen sie sich an der antigenspezifischen Immunglobulininteraktionen, vor allem zwischen IgM und IgY. Außerdem haben sie eine wichtige Funktion bei der Antigenpräsentation für Lymphozyten.Funktionen der Thrombozyten sind Wundheilung, Thrombusbildung, sowie die unspezifische Phagozytose von Mikroorganismen.
Der folgende Abschnitt handelt über bestimmte Blutbefunde und deren Interpretation und Bedeutung.
Blutmilben
Die blutsaugenden roten Vogelmilben, oder auch Blutmilben genannnt, sind die gefährlichsten Exoparasiten der Geflügelarten. Vor allem betroffen davon sind Hühner, Puten und Tauben, aber auch bei anderen Nutz-, Wild- und Ziervögeln sind sie zu finden. Ausserdem können auch andere Tiere befallen und in seltenen Fällen beim Menschen erscheinen. Sie erreichen etwa eine Größe von 0,75cm und haben normalerweise eine gelbgraue Färbung und ovale Form, färben sich jedoch nach dem Blutsaugen schwarzrot und erhalten eine runde Gestalt. Auch ohne Blutsaugen oder bei kalten Temperaturen können Milben viele Wochen überleben. Bei starken Milbenbefall kann ein Tier von mehreren 100 Milben überfallen werden und sogar blutleer gesaugt werden, wobei das bei vielen Jungtieren zum Tod führt. Bei adulten Tieren sind Hinweise auf Blutmilben starke Blässe der Kopfanhänge, Legeleistung sinkt, Tauben werden durch die Schwäche sogar flugunfähig und die Sterblichkeit nimmt zu. Bei verendeten Tieren ist die Muskultur sehr blass. Nachweisbar sind Milben selbst am Tier oder Käfig, nach dem Befall am pulverfeinem Milbenkot in der Stallung und am Vogel im Schleim von Schnabelhöhle, Schlund und Gehörgang (Dorn, 1971).
Es gibt sehr viele verschiedene Formen der Bekämpfung von Vogelmilben. Eine effektive Möglichkeit der Bekämpfung ist Carbamate. Es zeichnet sich durch eine gute Verträglichkeit aus und lässt keine Rückstände im Tier oder Ei. Bei der Behandlung werden die Vögel mit 1%igem Puder bestäubt (Dorn, 1971).
Quellenverzeichnis
Fachartikel
- Katja Veil (1978): Feststellung von Blutwerten bei verschiedenen Vögeln (S.12-26); LMU München: Doktorarbeit
- Claudia Schweizer (2009): Gesundheit, Leistung und Fleischqualität von gemischt gehaltenen B.U.T. BIG 6 und Kelly Bronze Puten in der Auslaufhaltung (S.9-13);LMU München: Doktorarbeit
- Laboklin (2001): Laboklin aktuell (S.1-5); Info 6/2001
- Helene Pendel (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 1: Methodische Einführung und Befunde beim klinisch gesunden Vogel (S.290-298); erschienen in: Tierärztliche Praxis Kleintiere; Schattauer Verlag
- Helene Pendel (2008): Für Studium und Praxis: Möglichkeiten und Grenzen einer praxisnahen Hämatologie beim Vogel - Teil 2: Ontogenetisch-physiologische und pathologische Befunde und deren Interpretation (S.368-380); erschienen in: Tierärztliche Praxis Kleintiere; Schattauer Verlag
- Dein FJ.Avian hematology: erythrocytes and anemia. Proc Ann Meet Ass Avian Veto 1983; 10–23
- (Anodorhynchus hyazinthinus). JZoo An Med 1987;2–3:98–99
- Wiskott M. Vergleichverschiedener Methoden zur Leukozytenzählung bei Vögeln. Dissmed vet,Wien2002
- Hauska H, Scope A, Vasicek L, Reauz B. Vergleichende Untersuchungen zur Färbung aviärer Blutzellen. Tierärztl Prax 1999; 27 (K): 280–287.
- RosskopfWJ jr,Woerpel RW,Rosskopf G,Van deWater D.Normal hematologic and blood chemistryvalues for pet avian species. Proc Ann Meet Ass Avian Vet 1982; 162–168.
Fachbücher
- Franz-Viktor Salomon (1993): Lehrbuch der Geflügelanatomie (S.300-302); Gustav Fischer Verlag; 1.Auflage
- Hans-Georg Liebich (2010): Funktionelle Histologie der Haussäugetiere und Vögel (S.145-156); Schattauer Verlag, 5.Auflage
- Peter Dorn (1971): Handbuch der Geflügelkrankheiten (S.190-192); Verlag Eugen Ulmer Stuttgart; 1.Auflage
- Richard Reinhardt (1950): Lehrbuch der Geflügelkrankheiten (S.257-260); Verlag M.&H. Schaper; 4.Auflage
- Harry Kronberger (1974): Haltung von Vögeln - Krankheiten der Vögel; Gustav Fischer Verlag; 1. Auflage
- Gylstorff.Blut,Blutbildungund Blutkreislauf. In: Handbuch der Geflügel Physiologie. Mehner A, Hartfiel W, Hrsg. Jena: Fischer 1983; 280–395
- Hawkey CM, Dennett TB.AColour Atlasof Comparative VeterinaryHematology.London: Wolfe1989
- Ritchie, B.W., Harrison, G.J.,Harrison, L.R.,eds.Avi- an Medicine: Principles andApplication. Lake WorthFlorida:WingersPublishing Inc 1994; 1330ff.
- Peirce MA. International Reference Centre for Avian Hematozoa,Wokingham,Berkshire,UK
- Grecchi, R., Saliba, A.M., Mariano, M.,Pathol, J. (1999): Surface receptors and phagocytic potential of fowl mononuclear phagocytes and thrombocytes in vivo and in vitro. (9) 23–31
Lehrmaterial
- Helene Pendel (2012): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
- Helene Pendel (2012): Praktische Hämatologie beim Vogel, Kurzanleitung; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
Internetquellen
- http://www.idexx.de/pdf/de_de/smallanimal/reference-laboratories/vet-med-labor-directory.pdf (15.11.2014)
Abbildungsverzeichnis
1. Helene Pendel (2012): Vögel als Patienten in der Tierarztpraxis/Grundkurs; ATF.Vetion.de (eLearning) - als PDF-Datei vorliegend
2. http://de.wikipedia.org/wiki/Kubaflamingo (24.11.2014)
3. http://de.wikipedia.org/wiki/Nymphensittich (13.11.2014)