|
Size: 10790
Comment:
|
Size: 17026
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 1: | Line 1: |
| = '''A cAMP szerepe harántcsíkos izom adaptációjában''' = | = A cAMP szerepe harántcsíkos izom adaptációjában = |
| Line 7: | Line 7: |
| A Ciklikus Adenozin Monofoszfát (cAMP) a második hírvivő molekulák közé sorolható, azaz olyan hormonok hatásmechanizmusában vesz részt, melyek nem képesek a sejthártyán át a sejtbe bejutni. A második hírvivő molekulákat olyan sejtfelszíni receptor molekulák aktiválják, melyek sejten kívüli részéhez hormon tud kötni, sejten belüli része pedig hormon kötése esetén aktiválja a második hírvivő rendszert. ábra1 | A Ciklikus Adenozin-Monofoszfát (cAMP) a második hírvivő molekulák közé sorolható, azaz olyan hormonok hatásmechanizmusában vesz részt,(legtöbb esetben) melyek nem képesek a sejthártyán át a sejtbe bejutni. A második hírvivő molekulákat olyan sejtfelszíni receptor molekulák aktiválják, melyek sejten kívüli részéhez hormon tud kötni, sejten belüli része pedig hormon kötése esetén aktiválja a második hírvivő rendszert. |
| Line 9: | Line 9: |
| A cAMP a sejtplazmában keletkezik az adenozin trifoszfát nevű molekulából, adenilát cikláz enzim hatására. Az adenilát cikláz enzim aktiválását az adenilát cikláz stimuláló G fehérje kapcsolt receptorok végzik, ugyanakkor megtalálhatóak adenilát cikláz inhibitorikus G fehérjék is, melyek az adenilát cikláz enzim aktiválását gátolják, és ezen keresztül csökkentik a sejtben lévő cAMP mennyiséget. A májsejtekben található adenilát cikláz erősebben válaszol a glukagon hormon hatására, míg az izomban az adrenalin hatása kifejezettebb. A cAMP lebontását a foszfodiészteráz enzim végzi adenozin monofoszfáttá. ábra2 ( *milyen ábra 2?? ) | . {{attachment:cAMP általánosan.jpg|1. Ábra, cAMP általános|align="middle",height="394",width="555"}} . . '''1.ábra''''' A cAMP általános hatásmechanizmusa'' |
| Line 11: | Line 12: |
| A cAMP a sejtplazmában keletkezik az adenozin-trifoszfát nevű molekulából, adenilát-cikláz enzim hatására(1. ábra). Az adenilát-cikláz enzim aktiválását az adenilát-cikláz stimuláló G-fehérje kapcsolt receptorok végzik, ugyanakkor megtalálhatóak adenilát-cikláz inhibitorikus G-fehérjék is, melyek az adenilát-cikláz enzim aktiválását gátolják, és ezen keresztül csökkentik a sejtben lévő cAMP mennyiséget. A májsejtekben található adenilát-cikláz erősebben válaszol a glukagon hormon hatására, míg az izomban az adrenalin hatása kifejezettebb. A cAMP lebontását adenozin-monofoszfáttá a foszfodiészteráz enzim végzi. | |
| Line 12: | Line 14: |
| ||<tablestyle="float:center; font-size: 0.85em; background: #eeeeee; margin: 0 0 0 0;" style="padding: 0.5em;":> {{attachment:image.png |felugró szöveg}} <<BR>>'''1. Ábra'''<<BR>>''Glikogénbontás'' || | === Szerepe a harántcsíkos izom glikogén-anyagcseréjében === |
| Line 14: | Line 16: |
| Egyes enzimek foszforilálódásának illetve defoszforilálódásának szabályozó funkciója van a lebontó és felépítő folyamatok egyensúlyának kialakításában. Ilyen a protein-kináz enzimcsoport, amely többféle fehérje foszforilálását katalizálja. Ezek az enzimek két ATP molekula és Mg2+-ion jelenlétében foszforilált protein-kinázzá alakulnak, majd ezt követően cAMP kötődik ezekhez a foszforilált enzimekhez, mint hormonhatást indító szignál. A kináz aktívvá válik a cAMP által és elvégzi egy másik enzim foszforilálását. Ilyen foszforilált enzim a foszforiláz-kináz amely ATP jelenlétében a glikogén-foszforiláz-b-t foszforiláz-a-vá alakítja. A glikogén-foszforiláz-a enzim felelős a harántcsíkolt izomban lévő glikogén glükóz-1-foszfáttá bontásáért (2.ábra). . {{attachment:glikogén bontás.jpg|2. Ábra, glikogén bontása|align="middle",height="394",width="555"}} . . '''2.ábra''''' A glikokén lebontása'' Az előbbi glikogénmobilizáló folyamat a glikogén foszforiláz-a foszfatáz enzimmel történő defoszforilálásával, és a cAMP mennyiségének foszfodiészteráz általi hidrolítikus bontásával állítható le. A glikogén anyagcserében másik jelentős enzim a glikogén-szintáz, ami a glikogén felépítését végzi. Ezt az enzimet is a cAMP mediálta protein-kináz foszforilálja, de ebben az esetben a foszforilált molekula az inaktív forma, vagyis cAMP jel esetén nem történik glikogénszintézis. Ezen reakcióút gátlódott a glikogén-szintáz cAMP általi foszforilálásával. A cAMP szerepe ezekben a folyamatokban igen fontos, mint intracellularis szignál, mert lehetővé teszi a glikogénraktárak gyors mobilizálását. A harántcsíkos izomban jelentős tényező a tartalékolt glikogén szintje, mivel ennek mozgósításával nagy mennyiségű energiához juthat az izomzat, elősegítve ezzel a terheléshez vagy stresszhez történő gyors adaptációt. |
|
| Line 18: | Line 28: |
| A harántcsíkos izom struktúrálisan igen szervezett,nagyon jelentős a szubcelluláris felépítése. A mozgató idegsejtek ingerlő hatása nyomán az izmok az előbbieknek köszönhetően képesek a mozgás kialakítására. E jól struktúráltság és nagyfokú szervezettség ellenére a harántcsíkos izomban igen bonyolult belső jelző mechanizmusok vannak, melyek lehetővé teszik az izom adaptációját a hosszútávú változásokhoz, illetve jó regenerációt biztosítanak izomsérülések esetén. Az egyik regenerációt biztosító tényező az izom számára a ciklikus adenozin-monofoszfát. A cAMP a gyors adaptációhoz is,és a hosszútávú adaptációhoz is hozzájárul az izomban. A rövidtávú alkalmazkodás a megnövekedett erőkifejtést igénylő izommunka során történik, ennek során elsősorban a vérellátása javul az izomnak, és a kontrakció erőssége növekszik. Hosszútávon pedig hozzájárul az izom növekedéséhez, és a metabolikus aktivitás fokozódásához. Megfigyelték, hogy hosszú időn keresztül fennálló magas cAMP szint az izomrostokban az izom tömegét növelte, azaz hypertróphiát okozott. (Berdeaux R. és Stewart R., 2012) E tulajdonsága miatt állati modellekben jól felhasználható volt a cAMP izom dystrophia és atrophia, rákos senyvedés és sepsis kezelésében illetve denervációs sérülések gyógyításában. A megnövekedett cAMP szint eme jótékony hatásai miatt azon vegyületek kifejlesztése ígéretessé válhat gyógyszertani szempontból, melyek stimulálják a cAMP jeladást az izomban, és ezáltal elősegítik az izom regenerációját illetve adaptációját. |
|
| Line 22: | Line 35: |
| === Hipotézis és igazolás === A cAMP koncentrációjának emelése növeli a vázizom erejét. Ezen folyamat igazolásának céljából Reading SA, Murrant CL és Barclay JK végeztek el egy kísérletet, melynek menetét röviden ismertetjük: Egérből származó m. soleus-át és m. extensor digitorum longus-át preparálták ki, és ezeket a vizsgálathoz isoproterenol, illetve dcAMP jelenlétében készítették elő. Előbbi a katekolaminok közé tartozó ß-adrenerg agonista hormonhatású anyag, utóbbi egy membránpermeábilis cAMP-analóg vegyület. Ezeket a hatóanyagokat mind Krebs-Henseleit bikarbonát pufferben oldva, 27 °C-on alkalmazták. Az izmokat a kísérlet során egymás után 50-szer stimulálták, és minden stimuláció közt fél perc telt el. Ennek eredményeként izometriás tetániás összehúzódás jött létre. A kontrakciók hatására 25 perc után jelentős erőnövekedés volt tapasztalható az izompreparátumoknál. Amelynél isoproterenolt használtak, annál jelentős erőnövekedés következett be: m.soleus: megközelítőleg 2.5%-kal, m.ext.dig.longus: kb. 13.8%-kal, és a dcAMP-kezelt minta is hasonló eredményt mutatott: soleus: 2.3%, m.ext.dig. longus: 10.9%. Mindezekhez természetesen mintaként készíteniük kellett egy pusztán Krebs-Henseleit bikarbonát puffert tartalmazó kontrollt, melynek a kísérleti eredményei: m.soleus: 0.0% (maximum 0,2%-kal több), m.ext.dig. longus: -2.5%. Hogy a hipotézist alátámaszthassák vagy cáfolhassák, le kellett rántaniuk a leplet a Ca2+ izomban betöltött szerepének hatásáról. Erősítették, illetve gyengítették a sarcolemma L-típusú Ca2+-függő csatornáit Bay K-val, illetve diltiazem hidroklorid-dal (dilt). Ezt követően koffeinnel növelték, dantrolennel csökkentették a sarcoplasmaticus retukulumból a Ca2+-felszabadulást. |
=== Hipotézis és igazolása === A cAMP koncentrációjának emelése növeli a vázizom erejét. Ezen folyamat igazolásának céljából Reading SA, Murrant CL és Barclay JK (2003) végeztek el egy kísérletet, melynek menetét röviden ismertetjük: Egérből származó m. soleus-t és m. extensor digitorum longus-t preparáltak ki, és ezeket a vizsgálathoz isoproterenol, illetve dcAMP jelenlétében készítették elő. Előbbi a katekolaminok közé tartozó ß-adrenerg agonista hormonhatású anyag, utóbbi egy membránpermeábilis cAMP-analóg vegyület. Ezeket a hatóanyagokat mind Krebs-Henseleit bikarbonát pufferben oldva, 27 °C-on alkalmazták. Az izmokat a kísérlet során egymás után 50-szer stimulálták, és minden stimuláció közt fél perc telt el. Ennek eredményeként izometriás tetániás összehúzódás jött létre. A kontrakciók hatására 25 perc után jelentős erőnövekedés volt tapasztalható az izompreparátumoknál. Amelynél isoproterenolt használtak, annál jelentős erőnövekedés következett be: m.soleus: megközelítőleg 2.5%-kal, m.ext.dig.longus: kb. 13.8%-kal, és a dcAMP-kezelt minta is hasonló eredményt mutatott: soleus: 2.3%, m.ext.dig. longus: 10.9%. Mindezekhez természetesen mintaként készíteniük kellett egy pusztán Krebs-Henseleit bikarbonát puffert tartalmazó kontrollt, melynek a kísérleti eredményei: m.soleus: 0.0% (maximum 0,2%-kal több), m.ext.dig. longus: -2.5%. Hogy a hipotézist alátámaszthassák vagy cáfolhassák, le kellett rántaniuk a leplet a Ca2+ izomban betöltött szerepének hatásáról. Erősítették, illetve gyengítették a sarcolemma L-típusú Ca2+-függő csatornáit Bay K-val, illetve diltiazem hidroklorid-dal (dilt). Ezt követően koffeinnel növelték, dantrolennel csökkentették a sarcoplasmaticus reticulumból a Ca2+-felszabadulást. |
| Line 31: | Line 38: |
| A dcAMP m.soleusba való adagolásának köszönhetően bekövetkező Ca2+-mozgósítás jelentős erőnövekedést eredményezett az izomban a kontrollal szemben (továbbra is csak a megközelítő adatok vannak feltüntetve) (kontroll: 2.3%; Bay K: 4.0%; dilt: 52.3%; caffeine: 2.3%; dant: 6.0%; dilt + dant: 55.0%). Szintén erőnövekedés volt tapasztalható a kontrollhoz képest, amikor ugyanezt a lépést a m.ext.dig.longus-szal is elvégezték (kontroll: 13.7%; Bay K: 17.0%; dilt: 170.0% caffeine: 23.0%; dant: 72.0%; dilt + dant: 54.0%). Ennélfogva igazolható (Reading SA, Murrant CL, Barclay JK), hogy a cAMP pozitív inotróp hatása fennáll az emlősök vázizmainak mind gyors, mind lassú összehúzódása esetén a Ca2+ SR-be áramlásának normál, és a megváltoztatott működése mellett is. |
A dcAMP m.soleusba való adagolásának köszönhetően bekövetkező Ca2+-mozgósítás jelentős erőnövekedést eredményezett az izomban a kontrollal szemben (továbbra is csak a megközelítő adatok vannak feltüntetve) (kontroll: 2.3%; Bay K: 4.0%; dilt: 52.3%; caffeine: 2.3%; dant: 6.0%; dilt + dant: 55.0%). Szintén erőnövekedés volt tapasztalható a kontrollhoz képest, amikor ugyanezt a lépést a m.ext.dig.longus-szal is elvégezték (kontroll: 13.7%; Bay K: 17.0%; dilt: 170.0% caffeine: 23.0%; dant: 72.0%; dilt + dant: 54.0%). Ennélfogva igazolható (Reading SA, Murrant CL, Barclay JK, 2003), hogy a cAMP pozitív inotróp hatása fennáll az emlősök vázizmainak mind gyors, mind lassú összehúzódása esetén a Ca2+ SR-be áramlásának normál, és a megváltoztatott működése mellett is. |
| Line 35: | Line 40: |
| === Ionok szerepe az adaptációban === | |
| Line 36: | Line 42: |
| . {{attachment:Ca csatorna.jpg|3. Ábra,|align="middle",height="394",width="455"}} . . '''3.ábra''''' cAMP hatása az ioncsatornára'' |
|
| Line 37: | Line 45: |
| Feltételezhetően a cAMP-mediált protein-kináz befolyásolja bizonyos membrán transzporterek foszforilálását, aktiválását. Így a ciklikus adenozin-monofoszfátnak többek közt a Ca2+ SR membránon át történő transzportjában is közvetett szerepe van (3.ábra). A cAMP az erő visszanyerésében is szerepet játszik a membrántranszporterek stimulálásával. A salbutamol, mely ß(2)-receptor agonista, beindítja az anoxiás izmokban a Na+/K+ pumpa működését (Fredsted A, Gissel H, Ortenblad N, Clausen T, 2012). Így a cAMP indukálni képes az izom ingerelhetőségének visszanyerését. Az izomrostok újra ingerelhetővé válnak. A cAMP segítségével a ß(2)- agonisták csökkenthetik az oxigénhiány okozta izomgyengeséget. Itt a cAMP közvetítő szerepe a hormon és az ionpumpa között fontos tényező. Oxigénhiány mellett (anoxia) ezzel a mechanizmussal újra kontrakcióba hozható az izom, növelve így az izomterhelhetőséget. A folyamat adaptálja, edzi az izmot a kialakult szélsőséges körülményhez, az oxigénhiányhoz. |
|
| Line 42: | Line 51: |
| A CREB (cAMP response element binding protein) ahogy a neve is mutatja, egy cAMP által mediált fehérje. A cAMP a protein kináz rendszeren keresztül aktiválja a CREB-et, mely a DNS CRE nevű szakaszához képes kötődni, és így bizonyos gének expresszióját tudja aktiválni. Kísérletek mutattak rá arra, hogy e cAMP mediálta fehérjének igen nagy szerepe van az embrionális izom őssejtek differenciálódásában, és a felnőtt harántcsíkos izomrostok adaptációjában, túlélésében. (Berdeaux R. és munkatársai) Az elvégzett kutatások azt az eredményt hozták,hogy akut izomsérülés után, illetve regeneráció közben kiváltódik a CREB foszforilációja (aktiválódása) és a CREB által befolyásolt gének expressziója. Az aktivált CREB hatása megfigyelhető volt mind a miogén prekurzor sejtekben, mind a regenerálódó izomrostokban. Berdeaux R. és munkatársai egy aktivált CREB mutánssal végeztek még kísérleteket, melynek hatására primer myocita tenyészetben myoblast sejtszaporulat indult meg, illetve korai miogén transzkripciós faktorokat tudtak izolálni a tenyészetből. E CREB mutáns hatásait vizsgálták még dystrophiás egereken, ahol azt tapasztalták, hogy hatására megindult az izmok regenerálódása. E kísérletek megmutatják a CREB fontosságát a harántcsíkos izom regenerációjában, melyben a CREB mediálásával a cAMP is fontos szerepet tölt be. |
A CREB (cAMP response element-binding protein) ahogy a neve is mutatja, egy cAMP által mediált fehérje. A cAMP a protein-kináz rendszeren keresztül aktiválja a CREB-et, mely a DNS CRE elnevezésű szakaszához képes kötődni, és így bizonyos gének expresszióját tudja aktiválni (4.ábra). Kísérletek mutattak rá arra, hogy e cAMP mediált fehérjének igen nagy szerepe van az embrionális izom őssejtek differenciálódásában, és a felnőtt harántcsíkos izomrostok adaptációjában, túlélésében. (Berdeaux R. és mtsai,2011) Az elvégzett kutatások azt az eredményt hozták,hogy akut izomsérülés után, illetve regeneráció közben kiváltódik a CREB foszforilációja (aktiválódása) és a CREB által befolyásolt gének expressziója. Az aktivált CREB hatása megfigyelhető volt mind a miogén prekurzor sejtekben, mind a regenerálódó izomrostokban. Berdeaux R. és munkatársai (2011) egy aktivált CREB mutánssal végeztek még kísérleteket, melynek hatására primer myocita tenyészetben myoblast sejtszaporulat indult meg, illetve korai miogén transzkripciós faktorokat tudtak izolálni a tenyészetből. E CREB mutáns hatásait vizsgálták még dystrophiás egereken, ahol azt tapasztalták, hogy hatására megindult az izmok regenerálódása. E kísérletek megmutatják a CREB fontosságát a harántcsíkos izom regenerációjában, melyben a CREB mediálásával a cAMP is fontos szerepet tölt be. |
| Line 47: | Line 53: |
| . {{attachment:CREB.jpg|4. Ábra,|align="middle",height="394",width="480"}} . . '''4.ábra''''' CREB'' |
|
| Line 52: | Line 58: |
| A cAMP mint intercelluláris jel egyszerre több folyamatot is irányíthat a harántcsíkos izomrostban. Ezek közül az egyik során a cAMP aktívan kipumpálható az extracelluláris térbe az izomsejtekből. (Chiavegatti és munkatársai, 2008) Kísérletesen megfigyelték, hogy az extracellulárisan felhalmozódó cAMP mennyiség csökkenése összefüggésben van az extracelluláris adenozin koncentráció növekedésével. A cAMP effluxot és lebomlását megvizsgálták exogén cAMP-vel illetve forskolinnal (adenilát cikláz serkentő) és isoprenalinnal (B receptor agonista) patkány harántcsíkos izmában. A használt anyagok mindegyike végső soron növelte az extracelluláris térben a cAMP koncentrációját, hiszen az exogén úton bejuttatott cAMP közvetlenül növeli a meglévő cAMP szintet a sejtben (hozzáadódik az addig meglévő cAMP mennyiséghez), míg a forskolin és az isoprenalin közvetetten. A forskolin az adenilát cikláz aktiválásával, míg az isoprenalin a B-receptoron keresztüli adenilát cikláz stimulációval növelte meg a cAMP szintet a sejten belül, mely ezután a cAMP efflux során az interstitium cAMP koncentrációját is megnövelte. Ezután a cAMP-t és metabolitjait az extracelluláris térben HPLC-vel meghatározták. Az eredmények azt mutatták, hogyaz instertitiumban az 5’AMP és adenozin szint jelentősen megemelkedett mind az exogén cAMP adagolás hatására, mind a forskolinnal illetve az isoprenalinnal elvégzett reakció esetén. A metabolitok keletkezését szelektíven lehet gátolni az ecto-foszfodiészteráz és ecto-nukleotidáz inhibitoraival (DPSPX és AMPCP-vel). A foszfodiészteráz és nukleotidáz bontják ugyanis a cAMP-t adenozin monofoszfáttá,majd adenozinná, így érthető hogy ezen enzimek gátlása esetén miért nem keletkeznek a metabolitok. Ezután a kutatók még egy kísérletet végeztek el, ezúttal is patkányon, de ex vivo körülmények között. A patkány extensor izmán végzett kísérlet során is az adenilát cikláz enzimet serkentették, és ezúttal is megfigyelhető volt a cAMP-adenozin út. E folyamatot probeneciddel lehetett gyengíteni,ugyanis ez az anyag az adenozin létrejöttét gátolja. Chiavegatti és társai ezzel bebizonyították egy extracelluláris kaszkád létét, mely a cAMP-t alakítja át adenozinná. Ez a cAMP-adenozin út. Szerepe azért van a harántcsíkos izom adaptációjában, mert egy viszonylag erős vasodilatátor anyag (Marshall, 2007), tehát a vázizom vérellátását javítja munkavégzés esetén. Adott egy a példa: egy egyén nehéz fizikai munkát kezd végezni, ennek hatására a vérében megnövekszik az adrenalin mennyisége, ez az izomrostokban megnöveli az adenilát cikláz enzim aktivitását, minek hatására az intercelluláris cAMP szint növekszik. A cAMP-adenozin úton keresztül ez növeli az interstícium adenozin koncentrációját, az pedig vasodilatátor hatásánál fogva tágítja az izomi ereket, és ezáltal megnöveli az izom oxigénellátottságát, ami adaptációként fogható fel. (Más,az adenozin-cAMP úttól független intercelluláris utakon keresztül a cAMP növeli a kontrakció erejét is.) Az izom típusától, az állatfajtól, a munkavégzés mértékétől függően az adenozin hozzájárulása a maximális áramláshoz válaszként a megnövekedett terhelésre körülbelül 20-40%! (Marshall, 2007) |
A cAMP mint intercelluláris jel egyszerre több folyamatot is irányíthat a harántcsíkos izomrostban. Ezek közül az egyik során a cAMP aktívan kipumpálható az extracelluláris térbe az izomsejtekből. (Chiavegatti és mtsai, 2008) Kísérletesen megfigyelték, hogy az extracellulárisan felhalmozódó cAMP mennyiség csökkenése összefüggésben van az extracelluláris adenozin koncentráció növekedésével. A cAMP effluxot és lebomlását megvizsgálták exogén cAMP-vel illetve forskolinnal (adenilát-cikláz serkentő) és isoprenalinnal (Béta receptor agonista) patkány harántcsíkos izmában. A használt anyagok mindegyike végső soron növelte az extracelluláris térben a cAMP koncentrációját, hiszen az exogén úton bejuttatott cAMP közvetlenül növeli a meglévő cAMP szintet a sejtben (hozzáadódik az addig meglévő cAMP mennyiséghez), míg a forskolin és az isoprenalin közvetetten. A forskolin az adenilát-cikláz aktiválásával, míg az isoprenalin a Béta-receptoron keresztüli adenilát-cikláz stimulációval növelte meg a cAMP szintet a sejten belül, mely ezután a cAMP efflux során az interstitium cAMP koncentrációját is megnövelte. Ezután az extracelluláris térben felhalmozódó cAMP-t és metabolitjait HPLC-vel meghatározták. Az eredmények azt mutatták, hogy az instertitiumban az 5’AMP és adenozin szint jelentősen megemelkedett mind az exogén cAMP adagolás hatására, mind a forskolinnal illetve az isoprenalinnal elvégzett reakció esetén. A metabolitok keletkezését szelektíven lehetett gátolni az ecto-foszfodiészteráz és ecto-nukleotidáz inhibitoraival (DPSPX és AMPCP-vel). A foszfodiészteráz és nukleotidáz bontják ugyanis a cAMP-t adenozin monofoszfáttá,majd adenozinná, így érthető hogy ezen enzimek gátlása esetén miért nem keletkeznek a metabolitok.(Illetve bizonyítja, hogy az adenozin cAMP-ből keletkezett a EC-ben,ugyanis ha más molekulából keletkezett volna,akkor nem lehetett volna ezen enzimek inhibitoraival gátolni a létrejöttét) Ezután a kutatók még egy kísérletet elvégeztek, ezúttal is patkányon, de ex vivo körülmények között. A patkány extensor izmán végzett kísérlet során is az adenilát-cikláz enzimet serkentették, és ezúttal is megfigyelhető volt a cAMP-adenozin út. E folyamatot probeneciddel lehetett gyengíteni,ugyanis ez az anyag az adenozin létrejöttét gátolja. Chiavegatti és társai (2008) ezzel bebizonyították egy extracelluláris kaszkád létét, mely a cAMP-t alakítja át adenozinná. Ez a cAMP-adenozin út. Szerepe azért van a harántcsíkos izom adaptációjában, mert egy viszonylag erős vasodilatátor anyag (Marshall, 2007), tehát a vázizom vérellátását javítja munkavégzés esetén (5.ábra). . {{attachment:Adenozin út.jpg|5. Ábra,|align="middle",height="394",width="500"}} . . '''5.ábra''''' cAMP-adenozin út'' |
| Line 59: | Line 64: |
| Adott egy a példa: egy egyén nehéz fizikai munkát kezd végezni, ennek hatására a vérében megnövekszik az adrenalin mennyisége, ez az izomrostokban megnöveli az adenilát cikláz enzim aktivitását, minek hatására az intercelluláris cAMP szint növekszik. A cAMP-adenozin úton keresztül ez növeli az interstícium adenozin koncentrációját, az pedig vasodilatátor hatásánál fogva tágítja az izomi ereket, és ezáltal megnöveli az izom oxigénellátottságát, ami adaptációként fogható fel. (Más,az adenozin-cAMP úttól független intercelluláris utakon keresztül a cAMP növeli a kontrakció erejét is.) Az izom típusától, az állatfajtól, a munkavégzés mértékétől függően az adenozin hozzájárulása a maximális áramláshoz válaszként a megnövekedett terhelésre körülbelül 20-40%! (Marshall, 2007) | |
| Line 60: | Line 66: |
| == Áttekintés == ---- A szervezetet az élet során nagyszámú külső és belső hatás éri, a testet befolyásoló tényezők igen gyakran megváltoznak, és a szervezet igyekszik ezekhez a megváltozott tényezőkhöz alkalmazkodni, a lehetőségekhez mérten az optimális módon működni, amit az adott változáshoz való alkalmazkodással ér el. A cAMP fontos szerepet játszik az izom adaptációjában, mint a környezeti változásokra válaszokat indító faktor. Munkánk során a cAMP ezen hatásainak a harántcsíkos izomrostokra vonatkozó paragrafusaival foglalkoztunk. Ezen különleges nukleotidnak a sokrétű enzimaktiváló szerepe hat a sejt különböző folyamataira. Mindezt mediátor mivoltának segítségével éri el: ioncsatornák működésének befolyásolásán, fehérjék szerkezetének módosításán, a glükóz anyagcserében betöltött szerepén és bizonyos gének expressziójában való közreműködésén keresztül. Ezeken felül sejten kívüli tevékenysége is említést érdemel, melynek során módosult molekulája befolyásolni képes az izomszövet vérellátását. |
|
| Line 64: | Line 75: |
| ''Reading SA, Murrant CL, Barclay JK: Increased cAMP as a positive inotropic factor for mammalian skeletal muscle in vitro. Department of Human Biology and Nutritional Sciences, University of Guelph, ON, Canada.'' | ''S A Reading, C L Murrant, J K Barclay: Increased cAMP as a positive inotropic factor for mammalian skeletal muscle in vitro, Canadian Journal of Physiology and Pharmacology, 2003, 81(10): 986-996'' |
| Line 66: | Line 77: |
| ''Berdeaux R, Stewart R.: cAMP signaling in skeletal muscle adaptation: hypertrophy, metabolism, and regeneration. Department of Integrative Biology and Pharmacology, University of Texas Health Science Center at Houston, Houston, TX, USA. Rebecca.berdeaux @ uth.tmc.edu'' | ''Berdeaux R. and Stewart R.: cAMP signaling in skeletal muscle adaptation: hypertrophy, metabolism, and regeneration, Am J Physiol Endocrinol Metab., 2012, 303(1):E1-17.'' |
| Line 68: | Line 79: |
| ''Fredsted A, Gissel H, Ortenblad N, Clausen T.: Effects of β₂-agonists on force during and following anoxia in rat extensor digitorum longus muscle. Department of Biomedicine, Aarhus University, Denmark. af @ fi.au.d'' | ''Fredsted A, Gissel H, Ortenblad N, Clausen T.: Effects of β₂-agonists on force during and following anoxia in rat extensor digitorum longus muscle, J Appl Physiol., 2012, 112(12):2057-67'' |
| Line 70: | Line 81: |
| ''A Gödecke, Marshall (2007), Chiavegatti et al. (2008: cAMP: fuel for extracellular adenosine formation? Br J Pharmacol. 2008 March; 153(6): 1087–1089. Published online 2008 February 11. doi: 10.1038/bjp.2008.7'' | ''A Gödecke, Marshall: cAMP: fuel for extracellular adenosine formation?, Br J Pharmacol. 2008, 153(6): 1087–1089.'' |
| Line 72: | Line 83: |
| ''Chiavegatti T, Costa VL Jr, Araújo MS, Godinho RO: Skeletal muscle expresses the extracellular cyclic AMP-adenosine pathway. Department of Pharmacology, Universidade Federal de São Paulo-Escola Paulista de Medicina, Rua Três de Maio, São Paulo, SP, Brazil.'' | ''T Chiavegatti, V L Costa Jr, M S Araújo, R O Godinho: Skeletal muscle expresses the extracellular cyclic AMP–adenosine pathway, 2008, British Journal of Pharmacology Volume 153, Issue 6, pages 1331–1340'' |
| Line 74: | Line 86: |
| ''Stewart R, Flechner L, Montminy M, Berdeaux R.: CREB is activated by muscle injury and promotes muscle regeneration. Department of Integrative Biology and Pharmacology, University of Texas Health Science Center at Houston, Houston, Texas, United States of America.'' | ''Randi Stewart, Lawrence Flechner, Marc Montminy, Rebecca Berdeaux (2011): CREB Is Activated by Muscle Injury and Promotes Muscle Regeneration, PLoS ONE 6(9): e24714 doi:10.1371/journal.pone.0024714'' |
A cAMP szerepe harántcsíkos izom adaptációjában
Contents
cAMP általánosan
A Ciklikus Adenozin-Monofoszfát (cAMP) a második hírvivő molekulák közé sorolható, azaz olyan hormonok hatásmechanizmusában vesz részt,(legtöbb esetben) melyek nem képesek a sejthártyán át a sejtbe bejutni. A második hírvivő molekulákat olyan sejtfelszíni receptor molekulák aktiválják, melyek sejten kívüli részéhez hormon tud kötni, sejten belüli része pedig hormon kötése esetén aktiválja a második hírvivő rendszert.
. 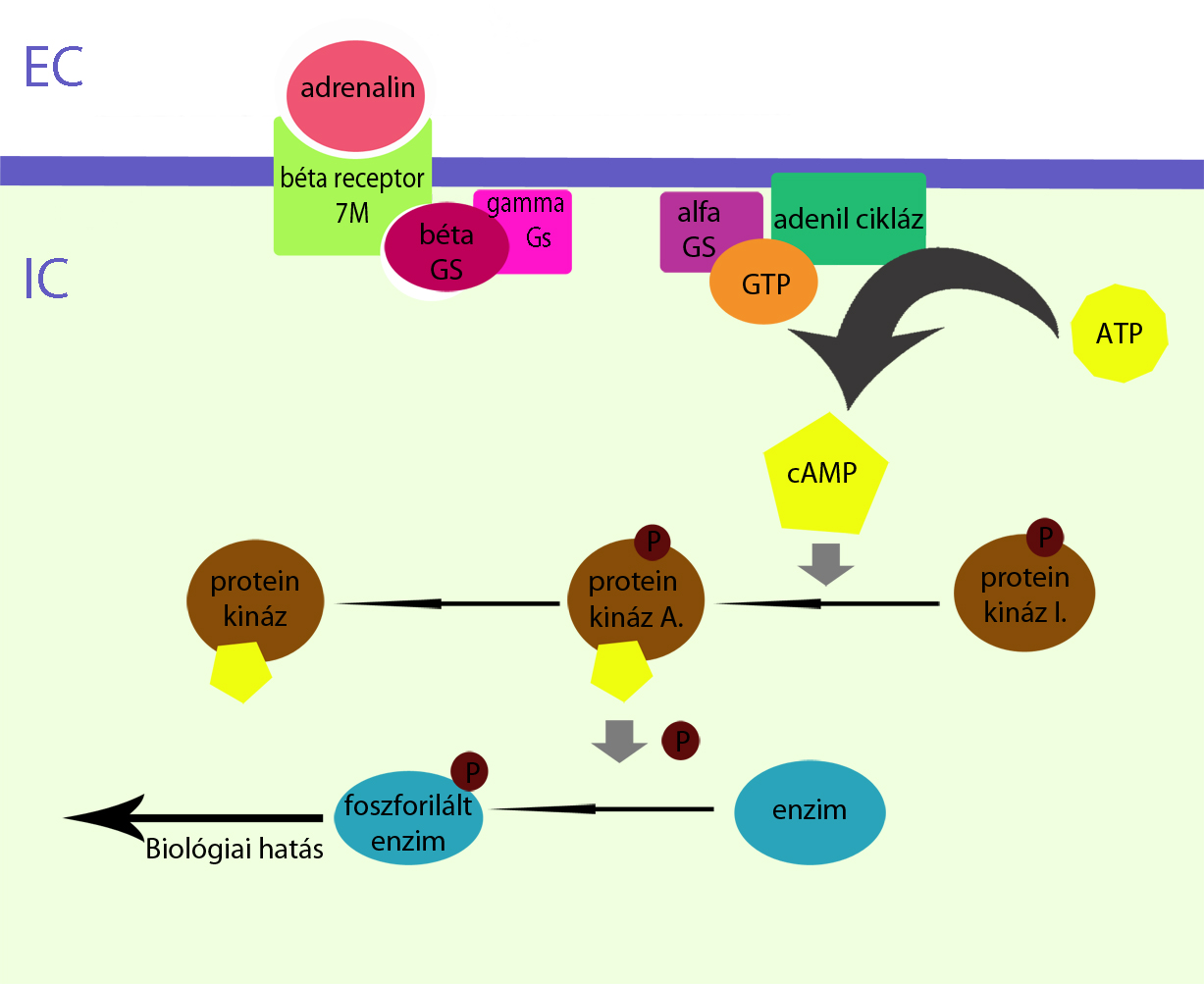
. 1.ábra A cAMP általános hatásmechanizmusa
A cAMP a sejtplazmában keletkezik az adenozin-trifoszfát nevű molekulából, adenilát-cikláz enzim hatására(1. ábra). Az adenilát-cikláz enzim aktiválását az adenilát-cikláz stimuláló G-fehérje kapcsolt receptorok végzik, ugyanakkor megtalálhatóak adenilát-cikláz inhibitorikus G-fehérjék is, melyek az adenilát-cikláz enzim aktiválását gátolják, és ezen keresztül csökkentik a sejtben lévő cAMP mennyiséget. A májsejtekben található adenilát-cikláz erősebben válaszol a glukagon hormon hatására, míg az izomban az adrenalin hatása kifejezettebb. A cAMP lebontását adenozin-monofoszfáttá a foszfodiészteráz enzim végzi.
Szerepe a harántcsíkos izom glikogén-anyagcseréjében
Egyes enzimek foszforilálódásának illetve defoszforilálódásának szabályozó funkciója van a lebontó és felépítő folyamatok egyensúlyának kialakításában. Ilyen a protein-kináz enzimcsoport, amely többféle fehérje foszforilálását katalizálja. Ezek az enzimek két ATP molekula és Mg2+-ion jelenlétében foszforilált protein-kinázzá alakulnak, majd ezt követően cAMP kötődik ezekhez a foszforilált enzimekhez, mint hormonhatást indító szignál. A kináz aktívvá válik a cAMP által és elvégzi egy másik enzim foszforilálását. Ilyen foszforilált enzim a foszforiláz-kináz amely ATP jelenlétében a glikogén-foszforiláz-b-t foszforiláz-a-vá alakítja. A glikogén-foszforiláz-a enzim felelős a harántcsíkolt izomban lévő glikogén glükóz-1-foszfáttá bontásáért (2.ábra).
. 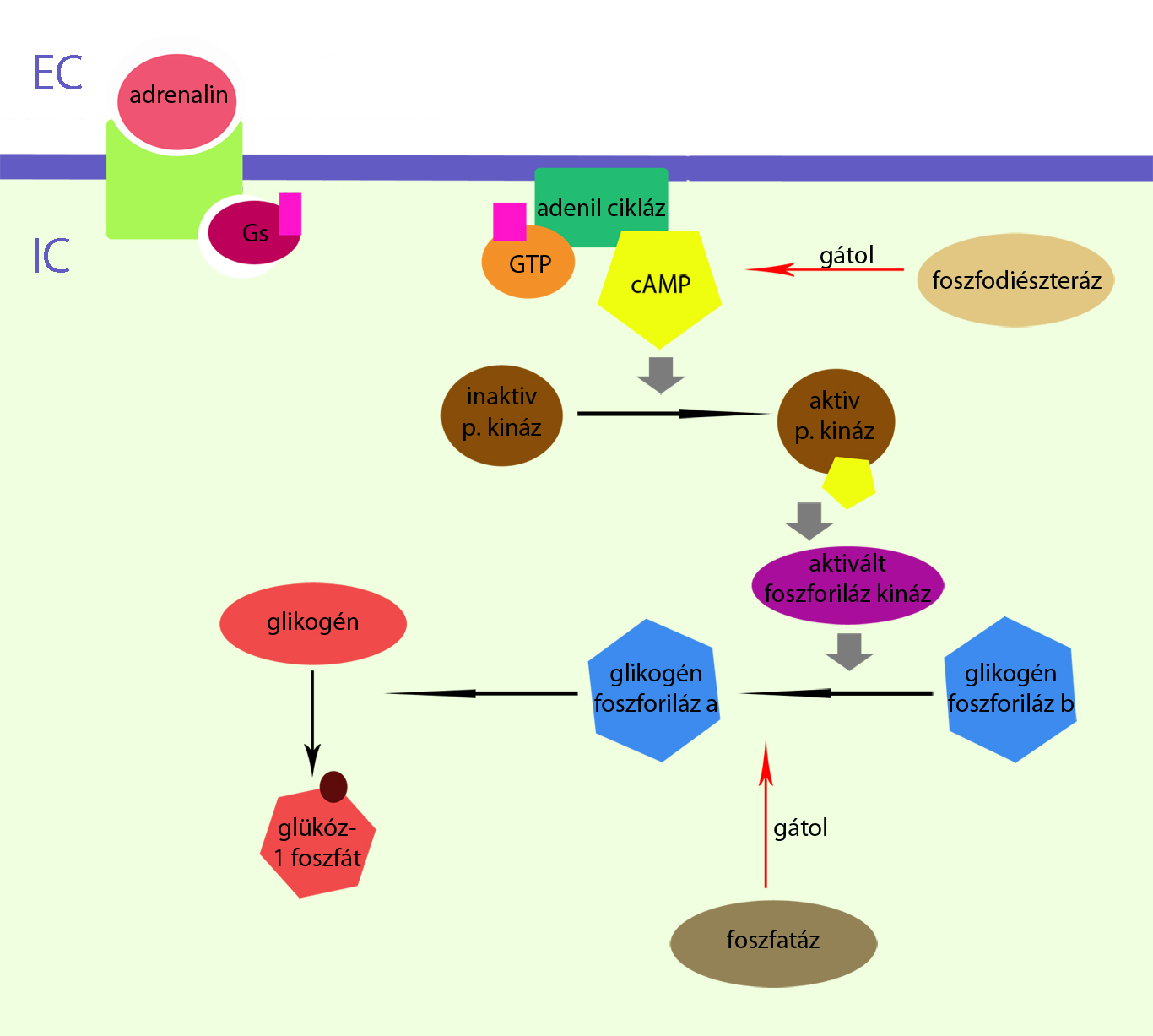
. 2.ábra A glikokén lebontása
Az előbbi glikogénmobilizáló folyamat a glikogén foszforiláz-a foszfatáz enzimmel történő defoszforilálásával, és a cAMP mennyiségének foszfodiészteráz általi hidrolítikus bontásával állítható le. A glikogén anyagcserében másik jelentős enzim a glikogén-szintáz, ami a glikogén felépítését végzi. Ezt az enzimet is a cAMP mediálta protein-kináz foszforilálja, de ebben az esetben a foszforilált molekula az inaktív forma, vagyis cAMP jel esetén nem történik glikogénszintézis. Ezen reakcióút gátlódott a glikogén-szintáz cAMP általi foszforilálásával. A cAMP szerepe ezekben a folyamatokban igen fontos, mint intracellularis szignál, mert lehetővé teszi a glikogénraktárak gyors mobilizálását. A harántcsíkos izomban jelentős tényező a tartalékolt glikogén szintje, mivel ennek mozgósításával nagy mennyiségű energiához juthat az izomzat, elősegítve ezzel a terheléshez vagy stresszhez történő gyors adaptációt.
Izomadaptáció
A harántcsíkos izom struktúrálisan igen szervezett,nagyon jelentős a szubcelluláris felépítése. A mozgató idegsejtek ingerlő hatása nyomán az izmok az előbbieknek köszönhetően képesek a mozgás kialakítására. E jól struktúráltság és nagyfokú szervezettség ellenére a harántcsíkos izomban igen bonyolult belső jelző mechanizmusok vannak, melyek lehetővé teszik az izom adaptációját a hosszútávú változásokhoz, illetve jó regenerációt biztosítanak izomsérülések esetén. Az egyik regenerációt biztosító tényező az izom számára a ciklikus adenozin-monofoszfát. A cAMP a gyors adaptációhoz is,és a hosszútávú adaptációhoz is hozzájárul az izomban. A rövidtávú alkalmazkodás a megnövekedett erőkifejtést igénylő izommunka során történik, ennek során elsősorban a vérellátása javul az izomnak, és a kontrakció erőssége növekszik. Hosszútávon pedig hozzájárul az izom növekedéséhez, és a metabolikus aktivitás fokozódásához. Megfigyelték, hogy hosszú időn keresztül fennálló magas cAMP szint az izomrostokban az izom tömegét növelte, azaz hypertróphiát okozott. (Berdeaux R. és Stewart R., 2012) E tulajdonsága miatt állati modellekben jól felhasználható volt a cAMP izom dystrophia és atrophia, rákos senyvedés és sepsis kezelésében illetve denervációs sérülések gyógyításában. A megnövekedett cAMP szint eme jótékony hatásai miatt azon vegyületek kifejlesztése ígéretessé válhat gyógyszertani szempontból, melyek stimulálják a cAMP jeladást az izomban, és ezáltal elősegítik az izom regenerációját illetve adaptációját.
A cAMP ioncsatornákra gyakorolt hatása
Hipotézis és igazolása
A cAMP koncentrációjának emelése növeli a vázizom erejét. Ezen folyamat igazolásának céljából Reading SA, Murrant CL és Barclay JK (2003) végeztek el egy kísérletet, melynek menetét röviden ismertetjük: Egérből származó m. soleus-t és m. extensor digitorum longus-t preparáltak ki, és ezeket a vizsgálathoz isoproterenol, illetve dcAMP jelenlétében készítették elő. Előbbi a katekolaminok közé tartozó ß-adrenerg agonista hormonhatású anyag, utóbbi egy membránpermeábilis cAMP-analóg vegyület. Ezeket a hatóanyagokat mind Krebs-Henseleit bikarbonát pufferben oldva, 27 °C-on alkalmazták. Az izmokat a kísérlet során egymás után 50-szer stimulálták, és minden stimuláció közt fél perc telt el. Ennek eredményeként izometriás tetániás összehúzódás jött létre. A kontrakciók hatására 25 perc után jelentős erőnövekedés volt tapasztalható az izompreparátumoknál. Amelynél isoproterenolt használtak, annál jelentős erőnövekedés következett be: m.soleus: megközelítőleg 2.5%-kal, m.ext.dig.longus: kb. 13.8%-kal, és a dcAMP-kezelt minta is hasonló eredményt mutatott: soleus: 2.3%, m.ext.dig. longus: 10.9%. Mindezekhez természetesen mintaként készíteniük kellett egy pusztán Krebs-Henseleit bikarbonát puffert tartalmazó kontrollt, melynek a kísérleti eredményei: m.soleus: 0.0% (maximum 0,2%-kal több), m.ext.dig. longus: -2.5%. Hogy a hipotézist alátámaszthassák vagy cáfolhassák, le kellett rántaniuk a leplet a Ca2+ izomban betöltött szerepének hatásáról. Erősítették, illetve gyengítették a sarcolemma L-típusú Ca2+-függő csatornáit Bay K-val, illetve diltiazem hidroklorid-dal (dilt). Ezt követően koffeinnel növelték, dantrolennel csökkentették a sarcoplasmaticus reticulumból a Ca2+-felszabadulást.
A dcAMP m.soleusba való adagolásának köszönhetően bekövetkező Ca2+-mozgósítás jelentős erőnövekedést eredményezett az izomban a kontrollal szemben (továbbra is csak a megközelítő adatok vannak feltüntetve) (kontroll: 2.3%; Bay K: 4.0%; dilt: 52.3%; caffeine: 2.3%; dant: 6.0%; dilt + dant: 55.0%). Szintén erőnövekedés volt tapasztalható a kontrollhoz képest, amikor ugyanezt a lépést a m.ext.dig.longus-szal is elvégezték (kontroll: 13.7%; Bay K: 17.0%; dilt: 170.0% caffeine: 23.0%; dant: 72.0%; dilt + dant: 54.0%). Ennélfogva igazolható (Reading SA, Murrant CL, Barclay JK, 2003), hogy a cAMP pozitív inotróp hatása fennáll az emlősök vázizmainak mind gyors, mind lassú összehúzódása esetén a Ca2+ SR-be áramlásának normál, és a megváltoztatott működése mellett is.
Ionok szerepe az adaptációban
. 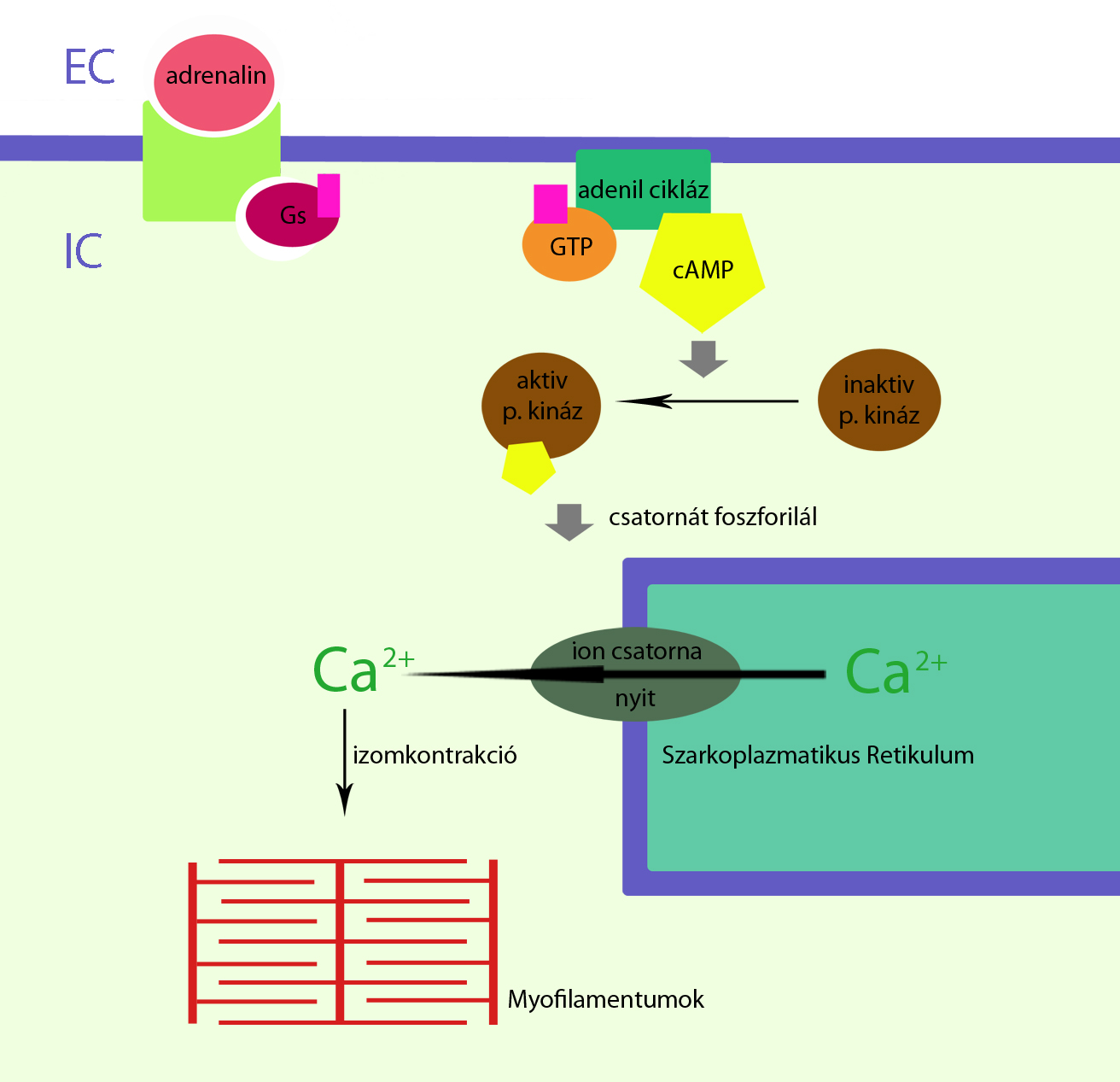
. 3.ábra cAMP hatása az ioncsatornára
Feltételezhetően a cAMP-mediált protein-kináz befolyásolja bizonyos membrán transzporterek foszforilálását, aktiválását. Így a ciklikus adenozin-monofoszfátnak többek közt a Ca2+ SR membránon át történő transzportjában is közvetett szerepe van (3.ábra). A cAMP az erő visszanyerésében is szerepet játszik a membrántranszporterek stimulálásával. A salbutamol, mely ß(2)-receptor agonista, beindítja az anoxiás izmokban a Na+/K+ pumpa működését (Fredsted A, Gissel H, Ortenblad N, Clausen T, 2012). Így a cAMP indukálni képes az izom ingerelhetőségének visszanyerését. Az izomrostok újra ingerelhetővé válnak. A cAMP segítségével a ß(2)- agonisták csökkenthetik az oxigénhiány okozta izomgyengeséget. Itt a cAMP közvetítő szerepe a hormon és az ionpumpa között fontos tényező. Oxigénhiány mellett (anoxia) ezzel a mechanizmussal újra kontrakcióba hozható az izom, növelve így az izomterhelhetőséget. A folyamat adaptálja, edzi az izmot a kialakult szélsőséges körülményhez, az oxigénhiányhoz.
CREB
A CREB (cAMP response element-binding protein) ahogy a neve is mutatja, egy cAMP által mediált fehérje. A cAMP a protein-kináz rendszeren keresztül aktiválja a CREB-et, mely a DNS CRE elnevezésű szakaszához képes kötődni, és így bizonyos gének expresszióját tudja aktiválni (4.ábra). Kísérletek mutattak rá arra, hogy e cAMP mediált fehérjének igen nagy szerepe van az embrionális izom őssejtek differenciálódásában, és a felnőtt harántcsíkos izomrostok adaptációjában, túlélésében. (Berdeaux R. és mtsai,2011) Az elvégzett kutatások azt az eredményt hozták,hogy akut izomsérülés után, illetve regeneráció közben kiváltódik a CREB foszforilációja (aktiválódása) és a CREB által befolyásolt gének expressziója. Az aktivált CREB hatása megfigyelhető volt mind a miogén prekurzor sejtekben, mind a regenerálódó izomrostokban. Berdeaux R. és munkatársai (2011) egy aktivált CREB mutánssal végeztek még kísérleteket, melynek hatására primer myocita tenyészetben myoblast sejtszaporulat indult meg, illetve korai miogén transzkripciós faktorokat tudtak izolálni a tenyészetből. E CREB mutáns hatásait vizsgálták még dystrophiás egereken, ahol azt tapasztalták, hogy hatására megindult az izmok regenerálódása. E kísérletek megmutatják a CREB fontosságát a harántcsíkos izom regenerációjában, melyben a CREB mediálásával a cAMP is fontos szerepet tölt be.
. 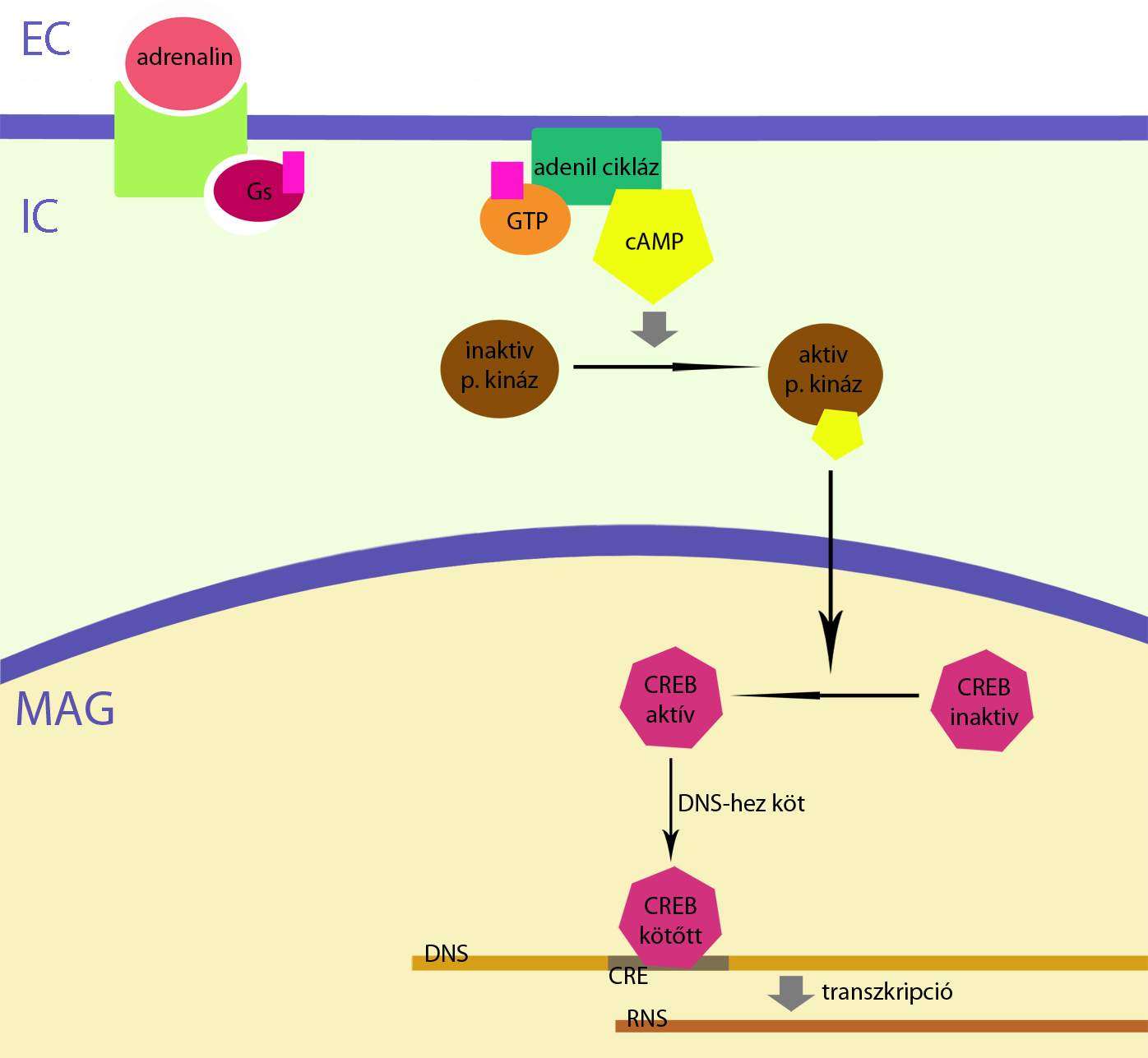
. 4.ábra CREB
A cAMP - adenosin út
A cAMP mint intercelluláris jel egyszerre több folyamatot is irányíthat a harántcsíkos izomrostban. Ezek közül az egyik során a cAMP aktívan kipumpálható az extracelluláris térbe az izomsejtekből. (Chiavegatti és mtsai, 2008) Kísérletesen megfigyelték, hogy az extracellulárisan felhalmozódó cAMP mennyiség csökkenése összefüggésben van az extracelluláris adenozin koncentráció növekedésével. A cAMP effluxot és lebomlását megvizsgálták exogén cAMP-vel illetve forskolinnal (adenilát-cikláz serkentő) és isoprenalinnal (Béta receptor agonista) patkány harántcsíkos izmában. A használt anyagok mindegyike végső soron növelte az extracelluláris térben a cAMP koncentrációját, hiszen az exogén úton bejuttatott cAMP közvetlenül növeli a meglévő cAMP szintet a sejtben (hozzáadódik az addig meglévő cAMP mennyiséghez), míg a forskolin és az isoprenalin közvetetten. A forskolin az adenilát-cikláz aktiválásával, míg az isoprenalin a Béta-receptoron keresztüli adenilát-cikláz stimulációval növelte meg a cAMP szintet a sejten belül, mely ezután a cAMP efflux során az interstitium cAMP koncentrációját is megnövelte. Ezután az extracelluláris térben felhalmozódó cAMP-t és metabolitjait HPLC-vel meghatározták. Az eredmények azt mutatták, hogy az instertitiumban az 5’AMP és adenozin szint jelentősen megemelkedett mind az exogén cAMP adagolás hatására, mind a forskolinnal illetve az isoprenalinnal elvégzett reakció esetén. A metabolitok keletkezését szelektíven lehetett gátolni az ecto-foszfodiészteráz és ecto-nukleotidáz inhibitoraival (DPSPX és AMPCP-vel). A foszfodiészteráz és nukleotidáz bontják ugyanis a cAMP-t adenozin monofoszfáttá,majd adenozinná, így érthető hogy ezen enzimek gátlása esetén miért nem keletkeznek a metabolitok.(Illetve bizonyítja, hogy az adenozin cAMP-ből keletkezett a EC-ben,ugyanis ha más molekulából keletkezett volna,akkor nem lehetett volna ezen enzimek inhibitoraival gátolni a létrejöttét) Ezután a kutatók még egy kísérletet elvégeztek, ezúttal is patkányon, de ex vivo körülmények között. A patkány extensor izmán végzett kísérlet során is az adenilát-cikláz enzimet serkentették, és ezúttal is megfigyelhető volt a cAMP-adenozin út. E folyamatot probeneciddel lehetett gyengíteni,ugyanis ez az anyag az adenozin létrejöttét gátolja. Chiavegatti és társai (2008) ezzel bebizonyították egy extracelluláris kaszkád létét, mely a cAMP-t alakítja át adenozinná. Ez a cAMP-adenozin út. Szerepe azért van a harántcsíkos izom adaptációjában, mert egy viszonylag erős vasodilatátor anyag (Marshall, 2007), tehát a vázizom vérellátását javítja munkavégzés esetén (5.ábra).
. 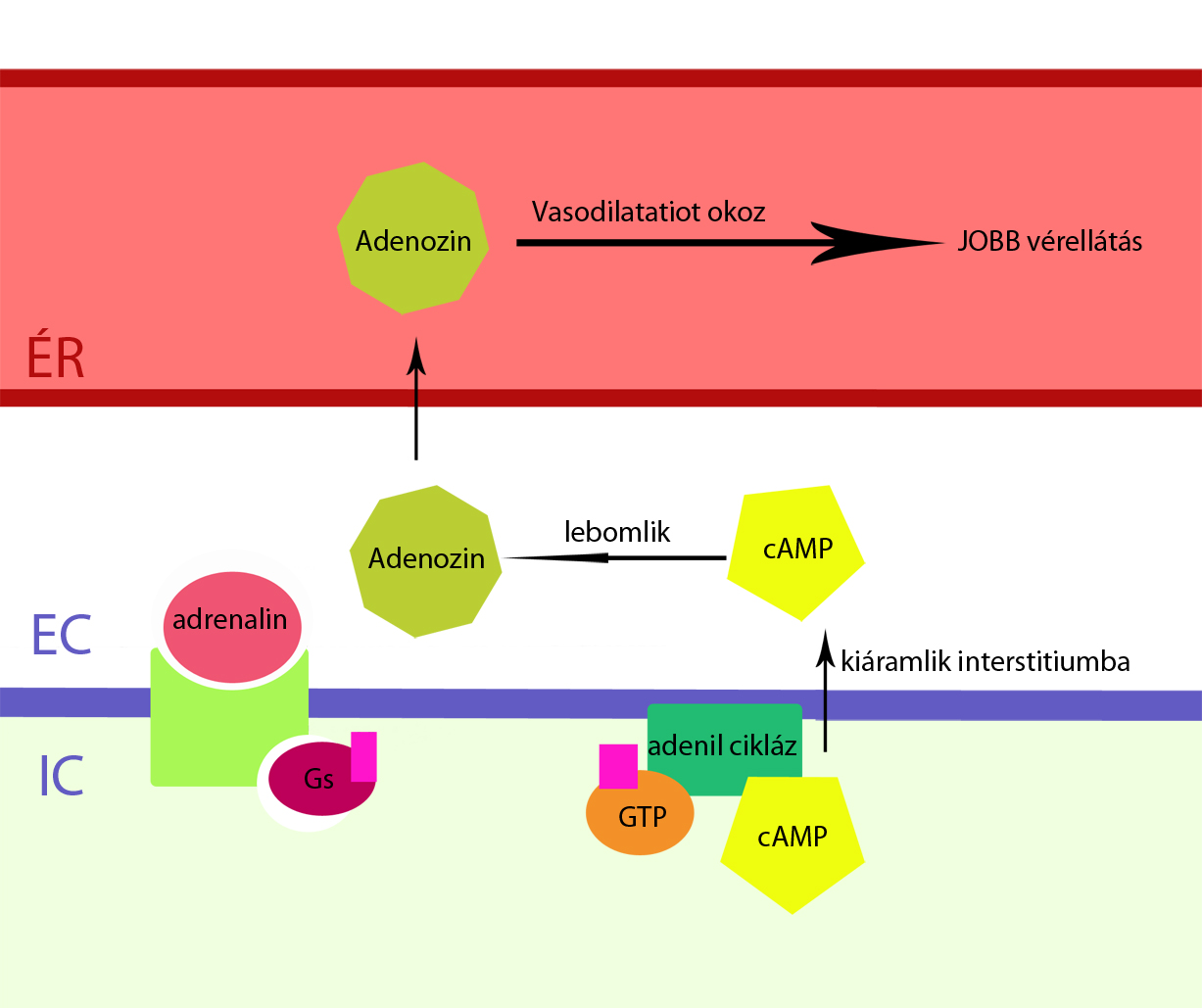
. 5.ábra cAMP-adenozin út
Adott egy a példa: egy egyén nehéz fizikai munkát kezd végezni, ennek hatására a vérében megnövekszik az adrenalin mennyisége, ez az izomrostokban megnöveli az adenilát cikláz enzim aktivitását, minek hatására az intercelluláris cAMP szint növekszik. A cAMP-adenozin úton keresztül ez növeli az interstícium adenozin koncentrációját, az pedig vasodilatátor hatásánál fogva tágítja az izomi ereket, és ezáltal megnöveli az izom oxigénellátottságát, ami adaptációként fogható fel. (Más,az adenozin-cAMP úttól független intercelluláris utakon keresztül a cAMP növeli a kontrakció erejét is.) Az izom típusától, az állatfajtól, a munkavégzés mértékétől függően az adenozin hozzájárulása a maximális áramláshoz válaszként a megnövekedett terhelésre körülbelül 20-40%! (Marshall, 2007)
Áttekintés
A szervezetet az élet során nagyszámú külső és belső hatás éri, a testet befolyásoló tényezők igen gyakran megváltoznak, és a szervezet igyekszik ezekhez a megváltozott tényezőkhöz alkalmazkodni, a lehetőségekhez mérten az optimális módon működni, amit az adott változáshoz való alkalmazkodással ér el. A cAMP fontos szerepet játszik az izom adaptációjában, mint a környezeti változásokra válaszokat indító faktor. Munkánk során a cAMP ezen hatásainak a harántcsíkos izomrostokra vonatkozó paragrafusaival foglalkoztunk. Ezen különleges nukleotidnak a sokrétű enzimaktiváló szerepe hat a sejt különböző folyamataira. Mindezt mediátor mivoltának segítségével éri el: ioncsatornák működésének befolyásolásán, fehérjék szerkezetének módosításán, a glükóz anyagcserében betöltött szerepén és bizonyos gének expressziójában való közreműködésén keresztül. Ezeken felül sejten kívüli tevékenysége is említést érdemel, melynek során módosult molekulája befolyásolni képes az izomszövet vérellátását.
Felhasznált irodalom
S A Reading, C L Murrant, J K Barclay: Increased cAMP as a positive inotropic factor for mammalian skeletal muscle in vitro, Canadian Journal of Physiology and Pharmacology, 2003, 81(10): 986-996
Berdeaux R. and Stewart R.: cAMP signaling in skeletal muscle adaptation: hypertrophy, metabolism, and regeneration, Am J Physiol Endocrinol Metab., 2012, 303(1):E1-17.
Fredsted A, Gissel H, Ortenblad N, Clausen T.: Effects of β₂-agonists on force during and following anoxia in rat extensor digitorum longus muscle, J Appl Physiol., 2012, 112(12):2057-67
A Gödecke, Marshall: cAMP: fuel for extracellular adenosine formation?, Br J Pharmacol. 2008, 153(6): 1087–1089.
T Chiavegatti, V L Costa Jr, M S Araújo, R O Godinho: Skeletal muscle expresses the extracellular cyclic AMP–adenosine pathway, 2008, British Journal of Pharmacology Volume 153, Issue 6, pages 1331–1340
Randi Stewart, Lawrence Flechner, Marc Montminy, Rebecca Berdeaux (2011): CREB Is Activated by Muscle Injury and Promotes Muscle Regeneration, PLoS ONE 6(9): e24714 doi:10.1371/journal.pone.0024714
