A cAMP szerepe harántcsíkos izom adaptációjában
Contents
cAMP általánosan
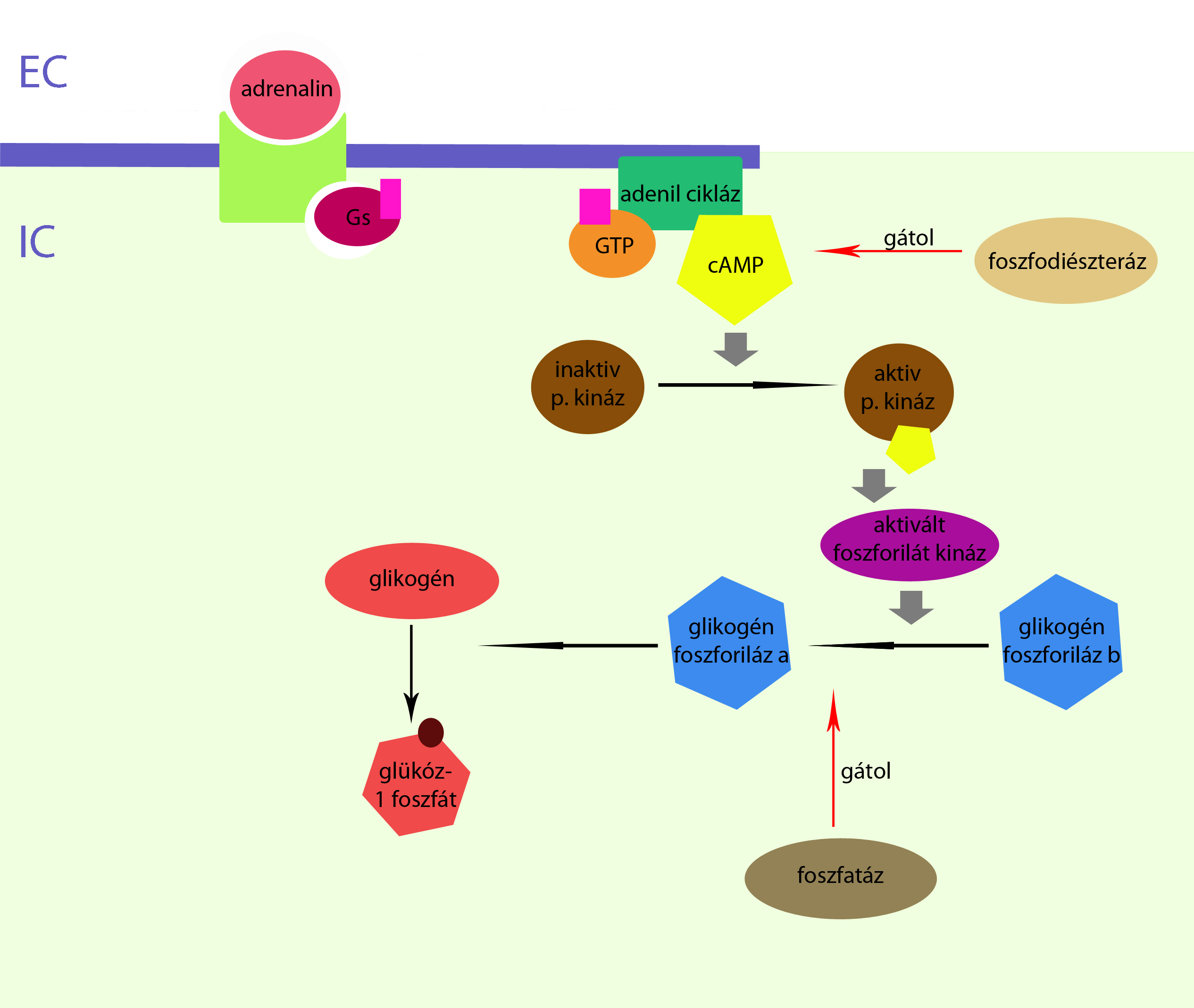
A Ciklikus Adenozin Monofoszfát (cAMP) a második hírvivő molekulák közé sorolható, azaz olyan hormonok hatásmechanizmusában vesz részt, melyek nem képesek a sejthártyán át a sejtbe bejutni. A második hírvivő molekulákat olyan sejtfelszíni receptor molekulák aktiválják, melyek sejten kívüli részéhez hormon tud kötni, sejten belüli része pedig hormon kötése esetén aktiválja a második hírvivő rendszert. ábra1
A cAMP a sejtplazmában keletkezik az adenozin trifoszfát nevű molekulából, adenilát cikláz enzim hatására. Az adenilát cikláz enzim aktiválását az adenilát cikláz stimuláló G fehérje kapcsolt receptorok végzik, ugyanakkor megtalálhatóak adenilát cikláz inhibitorikus G fehérjék is, melyek az adenilát cikláz enzim aktiválását gátolják, és ezen keresztül csökkentik a sejtben lévő cAMP mennyiséget. A májsejtekben található adenilát cikláz erősebben válaszol a glukagon hormon hatására, míg az izomban az adrenalin hatása kifejezettebb. A cAMP lebontását a foszfodiészteráz enzim végzi adenozin monofoszfáttá. ábra2 ( *milyen ábra 2?? )
|
|
Izomadaptáció
A cAMP ioncsatornákra gyakorolt hatása
Hipotézis és igazolás
A cAMP koncentrációjának emelése növeli a vázizom erejét. Ezen folyamat igazolásának céljából Reading SA, Murrant CL és Barclay JK végeztek el egy kísérletet, melynek menetét röviden ismertetjük: Egérből származó m. soleus-át és m. extensor digitorum longus-át preparálták ki, és ezeket a vizsgálathoz isoproterenol, illetve dcAMP jelenlétében készítették elő. Előbbi a katekolaminok közé tartozó ß-adrenerg agonista hormonhatású anyag, utóbbi egy membránpermeábilis cAMP-analóg vegyület. Ezeket a hatóanyagokat mind Krebs-Henseleit bikarbonát pufferben oldva, 27 °C-on alkalmazták. Az izmokat a kísérlet során egymás után 50-szer stimulálták, és minden stimuláció közt fél perc telt el. Ennek eredményeként izometriás tetániás összehúzódás jött létre. A kontrakciók hatására 25 perc után jelentős erőnövekedés volt tapasztalható az izompreparátumoknál. Amelynél isoproterenolt használtak, annál jelentős erőnövekedés következett be: m.soleus: megközelítőleg 2.5%-kal, m.ext.dig.longus: kb. 13.8%-kal, és a dcAMP-kezelt minta is hasonló eredményt mutatott: soleus: 2.3%, m.ext.dig. longus: 10.9%. Mindezekhez természetesen mintaként készíteniük kellett egy pusztán Krebs-Henseleit bikarbonát puffert tartalmazó kontrollt, melynek a kísérleti eredményei: m.soleus: 0.0% (maximum 0,2%-kal több), m.ext.dig. longus: -2.5%. Hogy a hipotézist alátámaszthassák vagy cáfolhassák, le kellett rántaniuk a leplet a Ca2+ izomban betöltött szerepének hatásáról. Erősítették, illetve gyengítették a sarcolemma L-típusú Ca2+-függő csatornáit Bay K-val, illetve diltiazem hidroklorid-dal (dilt). Ezt követően koffeinnel növelték, dantrolennel csökkentették a sarcoplasmaticus retukulumból a Ca2+-felszabadulást.
A dcAMP m.soleusba való adagolásának köszönhetően bekövetkező Ca2+-mozgósítás jelentős erőnövekedést eredményezett az izomban a kontrollal szemben (továbbra is csak a megközelítő adatok vannak feltüntetve) (kontroll: 2.3%; Bay K: 4.0%; dilt: 52.3%; caffeine: 2.3%; dant: 6.0%; dilt + dant: 55.0%). Szintén erőnövekedés volt tapasztalható a kontrollhoz képest, amikor ugyanezt a lépést a m.ext.dig.longus-szal is elvégezték (kontroll: 13.7%; Bay K: 17.0%; dilt: 170.0% caffeine: 23.0%; dant: 72.0%; dilt + dant: 54.0%). Ennélfogva igazolható (Reading SA, Murrant CL, Barclay JK), hogy a cAMP pozitív inotróp hatása fennáll az emlősök vázizmainak mind gyors, mind lassú összehúzódása esetén a Ca2+ SR-be áramlásának normál, és a megváltoztatott működése mellett is.
CREB
A CREB (cAMP response element binding protein) ahogy a neve is mutatja, egy cAMP által mediált fehérje. A cAMP a protein kináz rendszeren keresztül aktiválja a CREB-et, mely a DNS CRE nevű szakaszához képes kötődni, és így bizonyos gének expresszióját tudja aktiválni. Kísérletek mutattak rá arra, hogy e cAMP mediálta fehérjének igen nagy szerepe van az embrionális izom őssejtek differenciálódásában, és a felnőtt harántcsíkos izomrostok adaptációjában, túlélésében. (Berdeaux R. és munkatársai) Az elvégzett kutatások azt az eredményt hozták,hogy akut izomsérülés után, illetve regeneráció közben kiváltódik a CREB foszforilációja (aktiválódása) és a CREB által befolyásolt gének expressziója. Az aktivált CREB hatása megfigyelhető volt mind a miogén prekurzor sejtekben, mind a regenerálódó izomrostokban. Berdeaux R. és munkatársai egy aktivált CREB mutánssal végeztek még kísérleteket, melynek hatására primer myocita tenyészetben myoblast sejtszaporulat indult meg, illetve korai miogén transzkripciós faktorokat tudtak izolálni a tenyészetből. E CREB mutáns hatásait vizsgálták még dystrophiás egereken, ahol azt tapasztalták, hogy hatására megindult az izmok regenerálódása. E kísérletek megmutatják a CREB fontosságát a harántcsíkos izom regenerációjában, melyben a CREB mediálásával a cAMP is fontos szerepet tölt be.
A cAMP - adenosin út
A cAMP mint intercelluláris jel egyszerre több folyamatot is irányíthat a harántcsíkos izomrostban. Ezek közül az egyik során a cAMP aktívan kipumpálható az extracelluláris térbe az izomsejtekből. (Chiavegatti és munkatársai, 2008) Kísérletesen megfigyelték, hogy az extracellulárisan felhalmozódó cAMP mennyiség csökkenése összefüggésben van az extracelluláris adenozin koncentráció növekedésével. A cAMP effluxot és lebomlását megvizsgálták exogén cAMP-vel illetve forskolinnal (adenilát cikláz serkentő) és isoprenalinnal (B receptor agonista) patkány harántcsíkos izmában. A használt anyagok mindegyike végső soron növelte az extracelluláris térben a cAMP koncentrációját, hiszen az exogén úton bejuttatott cAMP közvetlenül növeli a meglévő cAMP szintet a sejtben (hozzáadódik az addig meglévő cAMP mennyiséghez), míg a forskolin és az isoprenalin közvetetten. A forskolin az adenilát cikláz aktiválásával, míg az isoprenalin a B-receptoron keresztüli adenilát cikláz stimulációval növelte meg a cAMP szintet a sejten belül, mely ezután a cAMP efflux során az interstitium cAMP koncentrációját is megnövelte. Ezután a cAMP-t és metabolitjait az extracelluláris térben HPLC-vel meghatározták. Az eredmények azt mutatták, hogyaz instertitiumban az 5’AMP és adenozin szint jelentősen megemelkedett mind az exogén cAMP adagolás hatására, mind a forskolinnal illetve az isoprenalinnal elvégzett reakció esetén. A metabolitok keletkezését szelektíven lehet gátolni az ecto-foszfodiészteráz és ecto-nukleotidáz inhibitoraival (DPSPX és AMPCP-vel). A foszfodiészteráz és nukleotidáz bontják ugyanis a cAMP-t adenozin monofoszfáttá,majd adenozinná, így érthető hogy ezen enzimek gátlása esetén miért nem keletkeznek a metabolitok. Ezután a kutatók még egy kísérletet végeztek el, ezúttal is patkányon, de ex vivo körülmények között. A patkány extensor izmán végzett kísérlet során is az adenilát cikláz enzimet serkentették, és ezúttal is megfigyelhető volt a cAMP-adenozin út. E folyamatot probeneciddel lehetett gyengíteni,ugyanis ez az anyag az adenozin létrejöttét gátolja. Chiavegatti és társai ezzel bebizonyították egy extracelluláris kaszkád létét, mely a cAMP-t alakítja át adenozinná. Ez a cAMP-adenozin út. Szerepe azért van a harántcsíkos izom adaptációjában, mert egy viszonylag erős vasodilatátor anyag (Marshall, 2007), tehát a vázizom vérellátását javítja munkavégzés esetén. Adott egy a példa: egy egyén nehéz fizikai munkát kezd végezni, ennek hatására a vérében megnövekszik az adrenalin mennyisége, ez az izomrostokban megnöveli az adenilát cikláz enzim aktivitását, minek hatására az intercelluláris cAMP szint növekszik. A cAMP-adenozin úton keresztül ez növeli az interstícium adenozin koncentrációját, az pedig vasodilatátor hatásánál fogva tágítja az izomi ereket, és ezáltal megnöveli az izom oxigénellátottságát, ami adaptációként fogható fel. (Más,az adenozin-cAMP úttól független intercelluláris utakon keresztül a cAMP növeli a kontrakció erejét is.) Az izom típusától, az állatfajtól, a munkavégzés mértékétől függően az adenozin hozzájárulása a maximális áramláshoz válaszként a megnövekedett terhelésre körülbelül 20-40%! (Marshall, 2007)
Felhasznált irodalom
Reading SA, Murrant CL, Barclay JK: Increased cAMP as a positive inotropic factor for mammalian skeletal muscle in vitro. Department of Human Biology and Nutritional Sciences, University of Guelph, ON, Canada.
Berdeaux R, Stewart R.: cAMP signaling in skeletal muscle adaptation: hypertrophy, metabolism, and regeneration. Department of Integrative Biology and Pharmacology, University of Texas Health Science Center at Houston, Houston, TX, USA. Rebecca.berdeaux @ uth.tmc.edu
Fredsted A, Gissel H, Ortenblad N, Clausen T.: Effects of β₂-agonists on force during and following anoxia in rat extensor digitorum longus muscle. Department of Biomedicine, Aarhus University, Denmark. af @ fi.au.d
A Gödecke, Marshall (2007), Chiavegatti et al. (2008: cAMP: fuel for extracellular adenosine formation? Br J Pharmacol. 2008 March; 153(6): 1087–1089. Published online 2008 February 11. doi: 10.1038/bjp.2008.7
Chiavegatti T, Costa VL Jr, Araújo MS, Godinho RO: Skeletal muscle expresses the extracellular cyclic AMP-adenosine pathway. Department of Pharmacology, Universidade Federal de São Paulo-Escola Paulista de Medicina, Rua Três de Maio, São Paulo, SP, Brazil.
Stewart R, Flechner L, Montminy M, Berdeaux R.: CREB is activated by muscle injury and promotes muscle regeneration. Department of Integrative Biology and Pharmacology, University of Texas Health Science Center at Houston, Houston, Texas, United States of America.