|
Size: 27382
Comment:
|
← Revision 137 as of 2019-05-14 17:42:00 ⇥
Size: 32086
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 2: | Line 2: |
| = A negatív immunreguláción alapuló tumorterápia = ---- |
|
| Line 4: | Line 6: |
| = A negatív immunreguláción alapuló tumorterápia = == 1.Bevezetés == A 2018-as orvosi-élettani Nobel-díjat az amerikai James P. Allison és a japán Hondzso Taszuku megosztva kapták a rákkutatásban tett nagy felfedezésükért, “a negatív immunreguláció gátlására alapuló tumorterápia felfedezéséért”. Olyan immunológiai kutatási eredményeket kaptak, amelyek alkalmasak voltak új daganatterápiás módszerek kifejlesztésére azáltal, hogy erőteljesebb immunválaszra késztetik a szervezetet a tumorsejtekkel szemben. Ezzel a terápiával a már előrehaladott és kezelt betegek is gyógyíthatóak. Mivel a tumorsejtek észrevétlenek maradhatnak az immunrendszerrel szemben, zavartalanul tudnak szaporodni. Azonban a kifejlesztett gyógymóddal az immunrendszer “lefékezése” felszabadítható, így a szervezet fel tudja venni a harcot a rákkal. |
= Bevezetés = A 2018-as orvosi-élettani [[https://hu.wikipedia.org/wiki/Nobel-díj|Nobel-díjat]] az amerikai James P. Allison és a japán Hondzso Taszuku megosztva kapták a rákkutatásban tett nagy felfedezésükért, “a negatív immunreguláció gátlására alapuló tumorterápia felfedezéséért”. Olyan [[https://hu.wikipedia.org/wiki/Immunonkológia|immunonkológiai]] kutatási eredményeket kaptak, amelyek alkalmasak voltak új [[https://hu.wikipedia.org/wiki/Célzott_molekuláris_daganatterápia|daganatterápiás]] módszerek kifejlesztésére azáltal, hogy erőteljesebb immunválaszra késztetik a szervezetet a tumorsejtekkel szemben. Ezzel a terápiával a már előrehaladott és kezelt betegek is gyógyíthatóak. Mivel a tumorsejtek észrevétlenek maradhatnak az immunrendszerrel szemben, zavartalanul tudnak szaporodni. Azonban a kifejlesztett gyógymóddal az immunrendszer “lefékezése” felszabadítható, így a szervezet fel tudja venni a harcot a rákkal. |
| Line 8: | Line 9: |
| == 2. Tumorsejtek és immunrendszer találkozása == Az immunrendszer a szervezet védekező mechanizmusa. Szervezetünkben számos sejttípus található, ezek összehangolt működése képes különbséget tenni a saját és nem saját anyagok között, és így a felismert struktúrákra toleranciával vagy immunválasszal reagálni. Így fennáll a folyamatos védekezés a különböző kórokozókkal, patogénekkel szemben. A kórosan működő saját sejtek elpusztítása is az immunrendszer feladatai közé tartozik, védve a szervezetet a tumor kialakulásától. |
= Tumorsejtek és immunrendszer találkozása = Az [[https://hu.wikipedia.org/wiki/Immunrendszer|immunrendszer]] a szervezet védekező mechanizmusa. Szervezetünkben számos sejttípus található, ezek összehangolt működése képes különbséget tenni a saját és nem saját anyagok között, és így a felismert struktúrákra toleranciával vagy immunválasszal reagálni. Így fennáll a folyamatos védekezés a különböző kórokozókkal, patogénekkel szemben. A kórosan működő saját sejtek elpusztítása is az immunrendszer feladatai közé tartozik, védve a szervezetet a tumor kialakulásától. |
| Line 13: | Line 14: |
| Immunfelügyelet: rákos sejtek sikeres elpusztítása, elimináció | . '''Immunfelügyelet''': rákos sejtek sikeres elpusztítása, elimináció . '''Perzisztáló tumor''': egyensúlyi állapot kialakulása, a tumort nem sikerült teljesen elpusztítani, de növekedése szabályozva van . '''Tumorprogresszió''': immunrendszer elől rejtve maradó tumorsejt . (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 15: | Line 19: |
| Perzisztáló tumor: egyensúlyi állapot kialakulása, a tumort nem sikerült teljesen elpusztítani, de növekedése szabályozva van | == Sikeres T-sejt válasz == A tumorspecifikus [[https://hu.wikipedia.org/wiki/T-limfocita|T-sejt]]-válasz sikeres, ha olyan antigéneket tud kifejezni, amik tumorossá fajult és egészséges sejteken egyaránt előfordulhatnak és tumorasszociáltak, vagy amik csak a tumorra jellemző mutáns génekről íródtak át, ezért tumorspecifikusak. (Pl.: melanómánál specifikus CD4+ és CD8+ antigének, T-sejt-válasz és ellenagyag-termelés indult be.) |
| Line 17: | Line 22: |
| Tumorprogresszió: immunrendszer elől rejtve maradó tumorsejt | A T-lymphocyták aktivációjának feltétele két szignál aktiválódása ('''1.ábra''' mutatja a folyamatot): __antigénspecifikus jel__ a T-sejt receptor (T-cell receptor = TCR) antigénhez történő kötést követően alakul ki, és a __kostimulációs molekulák kapcsolódásával születő jel__ (naiv T-lymphocyták aktiválásához elengedhetetlen). |
| Line 19: | Line 24: |
| === 2.1. Sikeres T-sejt válasz === A tumorspecifikus T-sejt-válasz sikeres, ha olyan antigéneket tud kifejezni, amik tumorossá fajult és egészséges sejteken egyaránt előfordulhatnak és tumorasszociáltak, vagy amik csak a tumorra jellemző mutáns génekről íródtak át, ezért tumorspecifikusak. (Pl.: melanómánál specifikus CD4 és CD8 antigének, T-sejt-válasz és ellenagyag-termelés indult be.) |
A kölcsönhatások együttesen felelősek az antigénspecifikus immunválasz aktiválódásáért (Türk-Mázló és Rajnavölgyi, 2017). ||<tablebgcolor="#eeeeee" tablewidth="513px" tableheight="514px" tablestyle="font-size: 0.85em; margin: 0px;"style="padding:0.5em;"> {{attachment:elso.png||width="500",height="405"}} || ||'''1. ábra:''' ''A T-sejt receptor (TCR) felismerése és kötése egy antigénprezentáló sejt (APC) felületén lévő fő hisztokompatibilitási komplexben (MHC) megjelenő antigénhez. Ezzel egyidejűleg megtörténik a kostimulációs molekulák, CD28-B7 kapcsolódása, és megindul IL-2 citokin termelése.'' || |
| Line 22: | Line 28: |
| A T-lymphocyták aktivációjának feltétele két szignál aktiválódása (1.ábra mutatja a folyamatot): | |
| Line 24: | Line 29: |
| antigénspecifikus jel: T-sejt receptor (T-cell receptor = TCR) antigénhez történő kötést követően alakul ki | |
| Line 26: | Line 30: |
| kostimulációs molekulák kapcsolódásával születő jel (naiv T-lymphocyták aktiválásához elengedhetetlen) | |
| Line 28: | Line 31: |
| A kölcsönhatások együttesen felelősek az antigénspecifikus immunválasz aktiválódásáért. {{https://lh3.googleusercontent.com/X7lou7HWAcguGTTnT2wO-X3aNpiqzGPXPl-EXmNxwIdEI6ameLA9ofz6YkA-rXnQ2zEw05a6r_YDqDs-TjtSsZIFgJwx8TNi9uahGa-ZYhgF1HysdtKWlhL4WL4K61_Dh54FGWfn}} 1.ábra: a T-sejt receptor (TCR) felismerése és kötése egy antigénprezentáló sejt (APC) felületén lévő fő hisztokompatibilitási komplexben (MHC) megjelenő antigénhez. Ezzel egyidejűleg megtörténik a kostimulációs molekulák, CD28-B7 kapcsolódása, és megindul IL-2 citokin termelése. === 2.2. Sikertelen T-sejt válasz === |
== Sikertelen T-sejt válasz == |
| Line 39: | Line 38: |
| · Tumor körüli mikrokörnyezet immunszupresszívvé válik | · __Tumor körüli mikrokörnyezet immunszupresszívvé válik__ |
| Line 41: | Line 40: |
| Kimutatták, hogy primer karcinomáknál az immundeficiens állatokban kialakuló tumor immunogén, ekkor a jól működő immunrendszer a rákos sejteket eliminálja. Viszont az egészséges egyénből immundefficiens betegbe ültetett kevésbé immunogén primer carcinoma el tudja kerülni az immunrendszer felismerését, és így ellenállóbbá válik a sejtöléssel szemben. Megtörtént az immunátszerkesztés. Pl.: HIV fertőzöttek, transzplantációt követően és az immunszupresszív kezeltek esetében nő az esélye a rosszindulatú tumoros megbetegedésnek. | Kimutatták, hogy primer carcinomáknál az immundeficiens állatokban kialakuló tumor immunogén, ekkor a jól működő immunrendszer a rákos sejteket eliminálja. Viszont az egészséges egyénből immundefficiens betegbe ültetett kevésbé immunogén primer carcinoma el tudja kerülni az immunrendszer felismerését, és így ellenállóbbá válik a sejtöléssel szemben. Megtörtént az immunátszerkesztés. Pl.: HIV fertőzöttek, transzplantációt követően és az immunszupresszív kezeltek esetében nő az esélye a rosszindulatú tumoros megbetegedésnek (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 43: | Line 42: |
| == 3. Koinhibitor fehérjék az immunrendszer negatív regulátorai (checkpoint mechanizmus) == A koinhibitor fehérjék fontos szerepet játszanak az immunrendszer megfelelő működésében. Ellenőrző pontként -„checkpoint”- az immunrendszer negatív regulátorai. A checkpoint kifejezés alatt az immunrendszer azon negatív regulátor elemeit értjük, amelyek a T-sejtek végrehajtó funkcióit legátolják. Bizonyos molekulák és sejttípusok az immunválasz ellenőrző pontjaiként csökkentik az effektor T-lymhocyták sejt-, és szövetkárosító hatását komplex jelátviteli hálózatot képezve. Fiziológiásan az autoimmun folyamatokat gátolják. Ugyanakkor a tumorok mikrokörnyezetében az effektorsejtek tumorellenes hatását csökkentik. Ez lehetővé teszi a tumorok számára a túlélést és a proliferációt. |
= Koinhibitor fehérjék az immunrendszer negatív regulátorai (checkpoint mechanizmus) = A ''' koinhibitor fehérjék''' fontos szerepet játszanak az immunrendszer megfelelő működésében. __''Ellenőrző pontként -„checkpoint”- az immunrendszer negatív regulátorai''__. A '''checkpoint''' kifejezés alatt az immunrendszer azon negatív regulátor elemeit értjük, amelyek a T-sejtek végrehajtó funkcióit legátolják. Bizonyos molekulák és sejttípusok az immunválasz ellenőrző pontjaiként csökkentik az effektor T-lymhocyták sejt-, és szövetkárosító hatását komplex jelátviteli hálózatot képezve. Fiziológiásan az autoimmun folyamatokat gátolják. Ugyanakkor a tumorok mikrokörnyezetében az effektorsejtek tumorellenes hatását csökkentik. Ez lehetővé teszi a tumorok számára a túlélést és a proliferációt. |
| Line 46: | Line 45: |
| Mikor a T-sejt CD28 kostimulációs molekulája kapcsolódik az antigénprezentáló sejt expresszált B7 molekula családhoz, beindul IL-2 citokinek termelése. Ez eredményezi a naiv T-lymphocyták klonális osztódását és effektor T-sejtekké történő differenciálódását. A B7 receptor nemcsak kostimuláló molekulához kapcsolódhat, hanem gátló/koinhibitor CTLA-4 molekulához is. Ha ez a fehérje (CTLA-4 intracellulácisan tárolt) kijut a sejtfelszínre, akkor kompetitív módon gátolja a CD28-függő kostimulációt, ezzel pedig az effektor T-sejt-válasz gátlását eredményezi. (2.ábra) | Mikor a T-sejt CD28 kostimulációs molekulája kapcsolódik az [[https://hu.wikipedia.org/wiki/Antigénprezentáló_sejt|antigénprezentáló sej]]t expresszált B7 molekula családhoz, beindul IL-2 citokinek termelése. Ez eredményezi a naiv T-lymphocyták klonális osztódását és effektor T-sejtekké történő differenciálódását. A B7 receptor nemcsak kostimuláló molekulához kapcsolódhat, hanem gátló/koinhibitor CTLA-4 molekulához is. Ha ez a fehérje (CTLA-4 intracellulácisan tárolt) kijut a sejtfelszínre, akkor kompetitív módon gátolja a CD28-függő kostimulációt, ezzel pedig az effektor T-sejt-válasz gátlását eredményezi ('''2.ábra'''). ||<tablebgcolor="#eeeeee" tablewidth="357px" tableheight="528px" tablestyle="font-size: 0.85em; margin: 0px;"style="padding:0.5em;"> {{attachment:masodik.png||width="345",height="400"}} || ||'''2. ábra:''' ''Az anitgénprezentáló sejt (APC) B7 receptorának kapcsolódása a T-sejt CD28 kostimulációs és gátló CTLA-4 molekulájához. Ezzel megszületik a kostimuláció kompetitív gátlása.'' || |
| Line 48: | Line 49: |
| {{https://lh4.googleusercontent.com/h-a8yBuLrIizoMjQelAnnbCk9kdsPui9cP9OCzTTQ5Ro3wUh0RO6zX3hkIigxsps1VoTE5o4rOYvnwutzUMBvYbbxSg18PX-zV5-2taZ02zvSMSySQiBD2vVc2tkW_7CjXchhPxy}} | |
| Line 50: | Line 50: |
| 2.ábra: Az anitgénprezentáló sejt (APC) B7 receptorának kapcsolódása a T-sejt CD28 kostimulációs és gátló CTLA-4 molekulájához. Ezzel megszületik a kostimuláció kompetitív gátlása. | |
| Line 56: | Line 56: |
| A legintenzívebben kutatott negatív checkpoint regulátorok: | __'''''A legintenzívebben kutatott negatív checkpoint regulátorok: '''''__ |
| Line 58: | Line 58: |
| CTLA-4 / CD152 (cytotoxic T lymphocyte (CTL-) associated antigen-4) | . '''CTLA-4''' / CD152 (cytotoxic T lymphocyte (CTL-) associated antigen-4) . '''PD-1 '''/ CD279 (programmed cell death protein-1) . '''PD-L1''' / CD274 / B7-H1 (programmed cell death protein-1 ligand) (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 60: | Line 62: |
| PD-1 / CD279 (programmed cell death protein-1) PD-L1 / CD274 / B7-H1 (programmed cell death protein-1 ligand) === 3.1. CTLA-4 === ==== 3.1..1. A CTLA-4 helyeződése, mechanizmusa, szerepe ==== |
== CTLA-4 == === CTLA-4 helyeződése, mechanizmusa, szerepe === |
| Line 70: | Line 68: |
| A CTLA-4 különböző szuppresszív funkciókkal gátolja a T-sejtek aktiválódását, beleértve a CD28-val való versenyt, a T-regulátor sejtek gátló funkciójának szabályozását, mint például a transzendocitózist, az adhézió és a motilitás szabályozását. A CTLA-4 által közvetített T-regulátor sejtek szuppressziója fontos szerepet játszik a perifériás tolerancia és az autoimmun betegségek megelőzésében. | A CTLA-4 különböző szuppresszív funkciókkal gátolja a T-sejtek aktiválódását, beleértve a CD28-val való versenyt, a T-regulátor sejtek gátló funkciójának szabályozását, mint például a transzendocitózist, az adhézió és a motilitás szabályozását. A CTLA-4 által közvetített T-regulátor sejtek szuppressziója fontos szerepet játszik a perifériás tolerancia és az autoimmun betegségek megelőzésében (Mitsuiki és mtsai, 2018). |
| Line 74: | Line 72: |
| A gátló mechanizmus során megtörténhet a TCR-immunszinapszis közvetlen gátlása, a CD28 vagy e receptorfehérje jelátviteli útjának gátlása, illetve az APC-T-sejt kapcsolódásának akadályozása a megnövekedett T-sejt motilitás miatt. | A gátló mechanizmus során megtörténhet a TCR-immunszinapszis közvetlen gátlása, a CD28 vagy e receptorfehérje jelátviteli útjának gátlása, illetve az APC-T-sejt kapcsolódásának akadályozása a megnövekedett T-sejt motilitás miatt (Buchbinder és Desai, 2016). |
| Line 76: | Line 74: |
| Az alábbi 3., 4. ábra mutatja be a CTLA-4 fentebb leírt mechanizmusait. | Az alábbi '''3., 4. ábra''' mutatja be a CTLA-4 fentebb leírt mechanizmusait. ||<tablebgcolor="#eeeeee" tablewidth="566px" tableheight="347px" tablestyle="font-size:0.85em;margin:0px; "style="padding:0.5em;"> {{attachment:harmadik.png||width="540",height="293"}} || ||'''3. ábra:''' '''''A, része: '''T-sejtek CTLA-4 által közvetített gátlása. A T-sejtek akkor aktiválódnak, ha a TCR-MHC kapcsolódás és CD28-B7 kapcsolódás egyidejűleg történik. A gyenge TCR inger esetén a CD28- B7 kötődés dominál, ami pozitív aktiváló jelet eredményez és ez IL-2 termeléshez, a T-sejtek proliferációjához vezet, és nő a túlélési esély.'' || |
| Line 78: | Line 78: |
| {{https://lh3.googleusercontent.com/vQnNwkHsMB5XDSJ9hZW2aixH_dpZoVt7-gvAdXuKwvZVTKkZrsMWmJJWhOGDuS2EHWK2BYJ8BDynq58cG0xWMR8CWs6sfWYW8yZxe1ozx2y7jtNhuvJNXaudrBMYejh82VSXHUrt}} | |
| Line 80: | Line 79: |
| {{https://lh6.googleusercontent.com/FEtGIjAiQvf21UCVcADy4ENk7IhZoDd0Cuk6DNU7ymPj6UrBGrWgUuR77WyIdeSLZCmjhrCPsJ2R3Gzw-NdfdKvyqxXpSCMu2u_GVD5m_MQJlkdQYIxcRvYAeqv6ajUBRcaWBehg}} | ||<tablebgcolor="#eeeeee" tablewidth="564px" tableheight="377px" tablestyle="font-size:0.85em;margin:0px; "style="padding:0.5em;"> {{attachment:negyedik.png||width="540",height="293"}} || ||'''3. ábra:''' '''''B, része:''' Erős TCR inger esetén a CTLA-4 expressziója kifejezettebbé válik a sejtfelszínen a celluláris endoszómákból. A CTLA-4 verseng a CD28-cal a B7 molekulákkal való kötődésért. A megnövekedett CTLA-4- B7 kapcsolódás negatív jelet eredményez, amely visszaszorítja az IL-2 termelést és a proliferációt, és korlátozza a T-sejt túlélését.'' || |
| Line 82: | Line 82: |
| 3.ábra: | |
| Line 84: | Line 83: |
| A, része: T-sejtek CTLA-4 által közvetített gátlása. A T-sejtek akkor aktiválódnak, ha a TCR-MHC kapcsolódás és CD28-B7 kapcsolódás egyidejűleg történik. A gyenge TCR inger esetén a CD28- B7 kötődés dominál, ami pozitív aktiváló jelet eredményez és ez IL-2 termeléshez, a T-sejtek proliferációjához vezet, és nő a túlélési esély. | ||<tablebgcolor="#eeeeee" tablewidth="562px" tableheight="462px" tablestyle="font-size:0.85em;margin:0px; "style="padding:0.5em;"> {{attachment:otodik.png||width="539",height="406"}} || ||'''4. ábra:''' ''A CTLA-4 mediált T-regulátor sejt gátlási mechanizmusa. A T-regulátor sejten expresszálódott CTLA-4 kapcsolódik az APC B7 molekulájához, ez B7 internalizálódást okoz az antigénprezentáló sejten. Emiatt a T-sejtek CD28-B7 kötődés mediálta kostimuláció hiánya csökkent T-sejt proliferációhoz és leredukált effektor funkcióhoz vezet.'' || |
| Line 86: | Line 86: |
| B, része: Erős TCR inger esetén a CTLA-4 expressziója kifejezettebbé válik a sejtfelszínen a celluláris endoszómákból. A CTLA-4 verseng a CD28-cal a B7 molekulákkal való kötődésért. A megnövekedett CTLA-4- B7 kapcsolódás negatív jelet eredményez, amely visszaszorítja az IL-2 termelést és a proliferációt, és korlátozza a T-sejt túlélését. | |
| Line 88: | Line 87: |
| {{https://lh4.googleusercontent.com/2HVPj-_MejGVp7pD-BLSwp72tdb-FjQZ_Lz1rLML2DOjwnB3NJrNz8QH3atb3Ggs-Cn66FRkZiqcaa2sBasmg_QZacfpib7u6DdYBbSzvCKNbKZGa0joNCaiUtAwyxfEsimgEUcN}} | |
| Line 90: | Line 88: |
| 4.ábra: CTLA-4 mediált T-regulátor sejt gátlási mechanizmusa. A T-regulátor sejten expresszálódott CTLA-4 kapcsolódik az APC B7 molekulájához, ez B7 internalizálódást okoz az antigénprezentáló sejten. Emiatt a T-sejtek CD28-B7 kötődés mediálta kostimuláció hiánya csökkent T-sejt proliferációhoz és leredukált effektor funkcióhoz vezet. | |
| Line 92: | Line 89: |
| ==== 3.1.2. A CTLA-4 gátlása tumoros megbetegedések kezelésében ==== A CTLA-4 általi szabályozás hozzájárul az immunszupresszív állapot fenntartásához és lehetőség nyílik tumor kialakulására. A molekula működésének gátlásával jelentősen befolyásolni lehet az immunválasz kimenetelét. |
=== CTLA-4 gátlása tumoros megbetegedések kezelésében === A CTLA-4 általi szabályozás hozzájárul az immunszupresszív állapot fenntartásához és lehetőség nyílik tumor kialakulására. A molekula működésének gátlásával jelentősen befolyásolni lehet az immunválasz kimenetelét (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 95: | Line 92: |
| Erre fejlesztették ki az anti-CTLA-4 impilimumab (Yervoy gyógyszer hatóanyaga) és a tremelimumab alkalmazásán alapuló immunterápiát. Mindkét hatóanyag áttétképző melanomás megbetegedéseknél tartós klinikai választ mutatott. Sajnos a tremelimumab nem tartotta statisztikailag szignifikánsan az általános túlélést. | Erre fejlesztették ki az anti-CTLA-4 [[https://en.wikipedia.org/wiki/Ipilimumab|ipilimumab]](Yervoy gyógyszer hatóanyaga) és a [[https://en.wikipedia.org/wiki/Tremelimumab|tremelimumab]] __ __alkalmazásán alapuló immunterápiát. Mindkét hatóanyag áttétképző melanomás megbetegedéseknél tartós klinikai választ mutatott. Sajnos a tremelimumab nem tartotta statisztikailag szignifikánsan az általános túlélést (Postow és mtsai, 2015). |
| Line 97: | Line 94: |
| Az impilimumab alkalmazását 2011-ben a Food and Drug Administration dacarbazinnal kezelt betegek számára jóváhagyta. | Az ipilimumab alkalmazását 2011-ben a [[https://en.wikipedia.org/wiki/Food_and_Drug_Administration|Food and Drug Administration]] (FDA) [[https://hu.wikipedia.org/wiki/Dakarbazin|dacarbazinnal]] kezelt betegek számára jóváhagyta. |
| Line 99: | Line 96: |
| Az impilimumab alkalmazásának hatékonyságát alapvetően két tanulmány támasztotta alá. Az egyik olyan áttétes melanomában szenvedő betegcsoportokat vizsgált, amelyeknél az első vonalban alkalmazott kemoterápia nem csökkentette a tumor progresszióját. Azon betegek átlagos túlélési ideje 6,4 hónapról 10,4 hónapra emelkedett, akik a szokásos kemoterápiás vakcina mellé, vagy anélkül impilimumab kezelést kaptak. A másik jelentős vizsgálat azt az eredményt hozta, hogy azok a betegek, akik dacarbazin kezelés mellett impilimumabot kaptak, átlagosan 2,1 hónappal tovább éltek, mint azok, akik ebben nem részesültek. | Az ipilimumab alkalmazásának hatékonyságát alapvetően két tanulmány támasztotta alá. Az egyik olyan áttétes melanomában szenvedő betegcsoportokat vizsgált, amelyeknél az első vonalban alkalmazott kemoterápia nem csökkentette a tumor progresszióját. Azon betegek átlagos túlélési ideje 6,4 hónapról 10,4 hónapra emelkedett, akik a szokásos kemoterápiás vakcina mellé, vagy anélkül ipilimumab kezelést kaptak. A másik jelentős vizsgálat azt az eredményt hozta, hogy azok a betegek, akik dacarbazin kezelés mellett ipilimumabot kaptak, átlagosan 2,1 hónappal tovább éltek, mint azok, akik ebben nem részesültek (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 101: | Line 98: |
| Más rosszindulatú daganatok esetén - nem kissejtes tüdőrákos betegeknél, számos hasnyálmirigyrákban és prosztatarákban szenvedő betegnél-, a CTLA-4 antitestterápia bizonyos előnyöket mutatott. | Más rosszindulatú daganatok esetén - nem kissejtes tüdőrákos betegeknél, számos hasnyálmirigyrákban és prosztatarákban szenvedő betegnél-, a CTLA-4 antitestterápia bizonyos előnyöket mutatott (Buchbinder és Desai, 2016). |
| Line 103: | Line 100: |
| Sajnos a sugárkezelés után az ipilimumab nem javította a teljes túlélést a placebóval összehasonlítva. Bár ez a vizsgálat negatívnak bizonyult, az ipilimumab előnyös lehetett a kedvező prognosztikai jellemzőkkel rendelkező betegek számára, de ez további tanulmányokat igényel. | Sajnos a [[https://hu.wikipedia.org/wiki/Sugárkezelés|sugárkezelés]] után az ipilimumab nem javította a teljes túlélést a placebóval összehasonlítva. Bár ez a vizsgálat negatívnak bizonyult, az ipilimumab előnyös lehetett a kedvező prognosztikai jellemzőkkel rendelkező betegek számára, de ez további tanulmányokat igényel. |
| Line 105: | Line 102: |
| A tremelimumab, másik CTLA-4 blokkoló antitest, válaszokat mutatott a rosszindulatú mellhártyadaganatokban (mesothelioma) szenvedő betegeknél, azonban ezek a vizsgálatok még nem zárultak le. | A tremelimumab, másik CTLA-4 blokkoló antitest, válaszokat mutatott a rosszindulatú mellhártyadaganatokban (mesothelioma) szenvedő betegeknél, azonban ezek a vizsgálatok még nem zárultak le (Postow és mtsai, 2015). |
| Line 107: | Line 104: |
| Összességében az elmúlt 10 év statisztikai adatai igazolták, hogy a CTLA-4 molekula blokkolásával a betegek 20%-ánál tartós remissziót sikerült elérni. | Összességében az elmúlt 10 év statisztikai adatai igazolták, hogy a CTLA-4 molekula blokkolásával a betegek 20%-ánál tartós remissziót sikerült elérni (Türk-Mázló és Rajnavölgyi, 2017). |
| Line 109: | Line 106: |
| === 3.2. PD-1 === ==== 3.2.1. A PD-1 helyeződése, mechanizmusa, szerepe ==== |
== PD-1 == === PD-1 helyeződése, mechanizmusa, szerepe === |
| Line 115: | Line 112: |
| A PD-1 mulekula két ismert liganduma a PD-L1 és a PD-L2. A PD-1 ligandumainak eloszlása szintén eltér a CTLA-4 ligandumaiétól, szélesebb körben expresszálódnak. A PD-L1-et leukociták, nem haemopoetikus sejtek nem morfoid szövetekben expresszálják, továbbá parenchimális sejteken indukálhatók gyulladásos citokinek vagy tumorigén jelátviteli útvonalak segítségével. A PD-L1 expressziója számos különböző tumor típuson is megtalálható. A PD-L2 elsősorban dendritikus sejteken és monocitákon expresszálódik, de számos más immunsejt és nem-immun sejtben is indukálható. Előbbi elsősorban a nem lymphoid, utóbbi a primer immunszervekben hat. | A PD-1 mulekula két ismert liganduma a PD-L1 és a PD-L2. A PD-1 ligandumainak eloszlása szintén eltér a CTLA-4 ligandumaiétól, szélesebb körben expresszálódnak. A PD-L1-et leukociták, nem haemopoetikus sejtek nem morfoid szövetekben expresszálják, továbbá parenchimális sejteken indukálhatók gyulladásos citokinek vagy tumorigén jelátviteli útvonalak segítségével. A PD-L1 expressziója számos különböző tumor típuson is megtalálható. A PD-L2 elsősorban dendritikus sejteken és monocitákon expresszálódik, de számos más immunsejtben és nem immunsejtben is indukálható. Előbbi elsősorban a nem lymphoid, utóbbi a primer immunszervekben hat (Keir és mtsai, 2008; Parry és mtsai, 2005). |
| Line 119: | Line 116: |
| A PD-1/PD-L1 útvonal a gyulladásos folyamatok mérséklése céljából, ezáltal a túlzott szövetkárosodás elkerülése miatt alakult ki. Elsősorban olyan szövetekben fejti ki gátló hatást ahol éppen immunválasz zajlik, tehát az effektor fázis alatt, főként a perifériás szövetekben. | A PD-1/PD-L1 útvonal a gyulladásos folyamatok mérséklése céljából, ezáltal a túlzott szövetkárosodás elkerülése miatt alakult ki. Elsősorban olyan szövetekben fejti ki gátló hatást, ahol éppen immunválasz zajlik, tehát az effektor fázis alatt, főként a perifériás szövetekben. |
| Line 121: | Line 118: |
| Amikor egy T-sejt felismeri az MHC-komplex által, a célsejten expresszált antigént, gyulladásos citokineket termel, amelyek megindítják a gyulladásos folyamatot. Ezek a citokinek PD-L1 expressziót eredményeznek a szövetben, aktiválva kapcsolódásukkal a T-sejten lévő PD-1 fehérjét, ami immuntoleranciát eredményez, ezáltal az immunrendszer elveszíti a kontrollt, hogy gyulladásos reakciót hozzon létre, még akkor is, ha hatásos antigének vannak jelen. (5.ábra mutatja be a folyamatot) | Amikor egy T-sejt felismeri az MHC-komplex által a célsejten expresszált antigént, gyulladásos citokineket termel, amelyek megindítják a gyulladásos folyamatot. Ezek a citokinek PD-L1 expressziót eredményeznek a szövetben, aktiválva kapcsolódásukkal a T-sejten lévő PD-1 fehérjét, ami immuntoleranciát eredményez, ezáltal az immunrendszer elveszíti a kontrollt, hogy gyulladásos reakciót hozzon létre, még akkor is, ha hatásos antigének vannak jelen ('''5.ábra''' mutatja be a folyamatot). ||<tablebgcolor="#eeeeee" tablewidth="570px" tableheight="448px" tablestyle="font-size:0.85em;margin:0px; "style="padding:0.5em;"> {{attachment:hatodik.png||width="551",height="378"}} || ||'''5. ábra:''' ''A T-sejtek PD-1 mediálta gátlása A tumorantigéneket felismerni képes T-sejt aktiválható, és ennek következtében proliferációra, gyulladásos citokin termelésére és a sejthalál elkerülésre bírható. A hosszabb ideig fennálló TCR jel egy éppen zajló immunválasz során megnövekedett PD-1 expressziót okozhat. A tumorsejtek PD-L1-et expresszálhatnak az emelkedett citokin koncentráció és/vagy egyéb onkogenikus jelátviteli útvonalak által. A PD-1/PD-L1 kötődés gátolja a TCR által kiváltott pozitív jel kialakulását, csökkent proliferációhoz, citokin termeléshez és túlélési esélyekhez vezetve.'' || |
| Line 123: | Line 122: |
| {{https://lh3.googleusercontent.com/ITofUgfi2_gE-IByrr1jar_UcU_iJKQTXtybr0j4GvrG6Sbgxp5kqjK7zEN6by9sME1-pxTyfZtMMO0G3TkGbY13TyvGkGj5j5YMGH95eSG3ll2vzA5aElTG2mgKCrjRzfRjkob8}} | |
| Line 125: | Line 123: |
| 5.ábra: A T-sejtek PD-1 mediálta gátlása | |
| Line 127: | Line 124: |
| A tumorantigéneket felismerni képes T-sejt aktiválható, és ennek következtében proliferációra, gyulladásos citokin termelésére és a sejthalál elkerülésre bírható. A hosszabb ideig fennálló TCR jel egy éppen zajló immunválasz során megnövekedett PD-1 expressziót okozhat. A tumorsejtek PD-L1-et expresszálhatnak az emelkedett citokin koncentráció és/vagy egyéb onkogenikus jelátviteli útvonalak által. A PD-1/PD-L1 kötődés gátolja a TCR által kiváltott pozitív jel kialakulását, csökkent proliferációhoz, citokin termeléshez és túlélési esélyekhez vezetve. | |
| Line 131: | Line 127: |
| Bizonyos tumorokban, leginkább a melanómákban, ez a védekező funkció kiesik a PD-L1 túlzott expressziója miatt, és ennek eredményeként a tumor megkerüli az immunrendszer támadását. A PD-L1 tumor expressziója ugyanakkor egy olyan daganatra utalhat, amely az immunválaszt kikerüli, és ennek eredményeként potenciális biomarkerként szolgálhat a klinikai vizsgálatok számára, azonban nem minden PD-L1 expresszáló daganat reagál a PD-1-re / PD-L1 inhibitorokra. Ezzel szemben megjegyezhetjük, hogy a PD-L1-negatív tumorok is reagálhatnak ezekre az ágensekre. A kérdéssel kapcsolatos további kutatások jelenleg is zajlanak. | Bizonyos tumorokban, leginkább a melanómákban, ez a védekező funkció kiesik a PD-L1 túlzott expressziója miatt, és ennek eredményeként a tumor megkerüli az immunrendszer támadását. A PD-L1 tumor expressziója ugyanakkor egy olyan daganatra utalhat, amely az immunválaszt kikerüli, és ennek eredményeként potenciális biomarkerként szolgálhat a klinikai vizsgálatok számára, azonban nem minden PD-L1 expresszáló daganat reagál a PD-1-re / PD-L1 inhibitorokra. Ezzel szemben megjegyezhetjük, hogy a PD-L1-negatív tumorok is reagálhatnak ezekre az ágensekre. A kérdéssel kapcsolatos további kutatások jelenleg is zajlanak (Alsaab és mtsai, 2017). |
| Line 133: | Line 129: |
| ==== 3.2.2. A PD-1 gátlása tumoros megbetegedések kezelésében ==== | === PD-1 gátlása tumoros megbetegedések kezelésében === |
| Line 136: | Line 132: |
| A monoklonális antitestek (mAb-ok) a checkpoint-gátló gyógyszerek egy csoportját alkotják. Az anti-PD-1 és PD-L1 mAb-k közül több kimagasló eredményeket mutat a klinikai vizsgálatokban. Jelentősen csökkenthetik a toxicitást a tolerálható határokon belül és közben képesek a szilárd tumorok zsugorítására illetve a fejlett tumorok és metasztázisok elnyomásra, összességében javítva a betegek túlélési esélyeit. | A monoklonális antitestek (mAb-ok) a checkpoint-gátló gyógyszerek egy csoportját alkotják. Az anti-PD-1 és PD-L1 mAb-k közül több kimagasló eredményeket mutat a klinikai vizsgálatokban. Jelentősen csökkenthetik a toxicitást a tolerálható határokon belül és közben képesek a szilárd tumorok zsugorítására, illetve a fejlett tumorok és metasztázisok elnyomásra, összességében javítva a betegek túlélési esélyeit. |
| Line 140: | Line 136: |
| Az FDA 2014-ben hagyta jóvá az erre a célra kifejlesztett, anti-PD-1 ellenanyagot tartalmazó nivolumab (Opdivo gyógyszer hatóanyaga) alkalmazását. Ezen szerek nagyon ígéretes eredményeket mutattak nem kissejtes tüdőrákkal, előrehaladott melanomával, vese-sejtes karcinomával és más szilárd jellegű tumorokkal szemben, minimális mellékhatások jelentkezésével. A nivolumab alkalmazása legfőképp megelőzően ipilimumabot kapott melanomás betegek kezelésében bizonyult sikeresnek. A melanoma az egyik legnehezebben gyógyítható daganat típus, a legtöbb hagyományos citotoxikus gyógyszerrel való kezelés nem hoz kielégítő eredményt. Az egyéves túlélést alapul véve 30,8%-al nőtt a nivolumabot kapott betegek túlélési aránya a csak dacarbazinnal kezeltekhez képest. A kezelés továbbá fej- és nyaki laphámsejtes karcinóma, nem kissejtes tüdőrák, vesét érintő tumorok valamit Hodgkin –lymphoma esetén is sikeresnek bizonyult. | Az FDA 2014-ben hagyta jóvá az erre a célra kifejlesztett, anti-PD-1 ellenanyagot tartalmazó [[https://en.wikipedia.org/wiki/Nivolumab|nivolumab]] (Opdivo gyógyszer hatóanyaga) alkalmazását. Ezen szerek nagyon ígéretes eredményeket mutattak nem kissejtes tüdőrákkal, előrehaladott melanomával, vesesejtes carcinomával és más szilárd jellegű tumorokkal szemben, minimális mellékhatások jelentkezésével. A nivolumab alkalmazása legfőképp megelőzően ipilimumabot kapott melanomás betegek kezelésében bizonyult sikeresnek. A melanoma az egyik legnehezebben gyógyítható daganat típus, a legtöbb hagyományos citotoxikus gyógyszerrel való kezelés nem hoz kielégítő eredményt. Az egyéves túlélést alapul véve 30,8%-al nőtt a nivolumabot kapott betegek túlélési aránya a csak dacarbazinnal kezeltekhez képest. A kezelés továbbá fej- és nyaki laphámsejtes carcinoma, nem kissejtes tüdőrák, vesét érintő tumorok, valamit Hodgkin –lymphoma esetén is sikeresnek bizonyult. |
| Line 142: | Line 138: |
| A pembrolizumabot (Keytruda gyógyszer hatóanyaga) az FDA 2016-ban hagyta jóvá visszatérő vagy áttétes fej- és nyaki laphámsejtes megbetegedések kezelésére. A Keytruda- kezelésre a vizsgált betegek 23%-a reagált pozitívan 6 hónapig, vagy annál hosszabb ideig. | A [[https://en.wikipedia.org/wiki/Pembrolizumab|pembrolizumabot]] (Keytruda gyógyszer hatóanyaga) az FDA 2016-ban hagyta jóvá visszatérő vagy áttétes fej- és nyaki laphámsejtes megbetegedések kezelésére. A Keytruda- kezelésre a vizsgált betegek 23%-a reagált pozitívan 6 hónapig, vagy annál hosszabb ideig. |
| Line 144: | Line 140: |
| A PD-1 inhibitorokat sikerrel alkalmazzák kombinált terápiában is. Kombinálható más checkpoint-inhibitorokkal, például a CTLA-4 gátló impilimumabbal, kináz-inhibitorokkal, mint a mitogén-aktivált protein-kináz, amely a BRAF mutáció hatékony szabályozója, amely felelős a bőr melanoma metasztázis kialakulásáért, továbbá alkalmazzák kemoterápiás szerekkel egyetemben is. | A PD-1 inhibitorokat sikerrel alkalmazzák kombinált terápiában is. Kombinálható más checkpoint-inhibitorokkal, például a CTLA-4 gátló ipilimumabbal, kináz-inhibitorokkal, mint a mitogén-aktivált protein-kináz, amely a [[https://en.wikipedia.org/wiki/BRAF_(gene)|BRAF]] mutáció hatékony szabályozója, amely felelős a bőr melanoma metasztázis kialakulásáért, továbbá alkalmazzák kemoterápiás szerekkel egyetemben is (Alsaab és mtsai, 2017). |
| Line 146: | Line 142: |
| == 4. Tumorterápiák mellékhatásai és kombinált terápiák == === 4.1. Mellékhatások === A checkpoint blokád jelentős tumorellenes előnyöket okozhat, mivel nemcsak a tumorspecifikus immunválaszokat fokozza, hanem egyedi nemkívánatos hatások is előfordulhatnak nem specifikus immunológiai aktiválással. A checkpoint-mechanizmus gátlása potenciálisan immunológiai eredetű, úgynevezett immun-mediálta mellékhatások megjelenésével járhat. A leggyakrabban jelentett ilyen tünetek a kiütés vagy pruritus megjelenése, gasztrointesztinális rendellenességek jelentkezése, vagy endokrin elváltozások. |
= Tumorterápiák mellékhatásai és kombinált terápiák = == Mellékhatások == A checkpoint blokád jelentős tumorellenes előnyöket okozhat, ellenben nemcsak a tumorspecifikus immunválaszokat fokozza, hanem egyedi autoimmun reakció megjelenésével társulhat (irAE = immune-related adverse events) (Postow és mtsai, 2015). A checkpoint-mechanizmus gátlása potenciálisan immunológiai eredetű, úgynevezett immunmediálta mellékhatások megjelenésével járhat. A leggyakrabban jelentett ilyen tünetek a kiütés vagy pruritus megjelenése, gasztrointesztinális rendellenességek jelentkezése, vagy endokrin elváltozások (Buchbinder és Desai, 2016). |
| Line 150: | Line 146: |
| Ezek bár eltérnek a hagyományos kemoterápia vagy a célzott terápia által okozott mellékhatásoktól, a 3. vagy 4. fokozatú toxicitás aránya az immun-ellenőrző pont blokáddal (kb. 10-20%) nem nagyobb, mint sok standard kemoterápia vagy célzott terápia esetén. | Ezek bár eltérnek a hagyományos kemoterápia vagy a célzott terápia által okozott mellékhatásoktól, a 3. vagy 4. fokozatú toxicitás aránya az immunellenőrző pont blokáddal (kb. 10-20%) nem nagyobb, mint sok standard kemoterápia vagy célzott terápia esetén (Postow és mtsai, 2015). |
| Line 152: | Line 148: |
| Ezen mellékhatások gyakorisága impilimumab alkalmazása mellett magasabb volt (20%) mint pembrolizumab kezelés mellett (10-13%). Ezt okozhatja a nagyobb mértékű T-sejt proliferáció, a csökkent T-regulátor mediálta immunszupresszió CTLA-4 blokkolás által, vagy az, hogy csökkent PD-1 gátlás által több T-set klón aktiválódik. | Ezen mellékhatások gyakorisága ipilimumab alkalmazása mellett magasabb volt (20%), mint pembrolizumab kezelés mellett (10-13%). Ezt okozhatja a nagyobb mértékű T-sejt proliferáció, a csökkent T-regulátor mediálta immunszupresszió CTLA-4 blokkolás által, vagy az, hogy csökkent PD-1 gátlás által több T-set klón aktiválódik. |
| Line 154: | Line 150: |
| Hypophisitist jelentettek az impilimumabbal kezelt betegek 2-4%-ánál, míg a PD-1 gátló szerekben részesült betegeknél ez az arány kevesebb, mint 1%. Azonban ez a jelenség lehetséges, hogy az eltérő immunmechanizmusok helyett a CTLA-4 tobozmirigysejtek felszínén való megjelenéséhez, és ezáltal az impilimumab endokrin sejtekhez való kapcsolódásához köthető. | Hypophisitist jelentettek az ipilimumabbal kezelt betegek 2-4%-ánál, míg a PD-1 gátló szerekben részesült betegeknél ez az arány kevesebb, mint 1%. Azonban ez a jelenség lehetséges, hogy az eltérő immunmechanizmusok helyett a CTLA-4 tobozmirigysejtek felszínén való megjelenéséhez, és ezáltal az ipilimumab endokrin sejtekhez való kapcsolódásához köthető. |
| Line 156: | Line 152: |
| PD-1 helyett a PD-L1 gátlása kissé különböző eredményeket hozhat, azonban klinikai adatok jelenleg limitáltan állnak rendelkezésre. A kezeléshez köthető mellékhatások PD-L1 inhibitorok esetén valamivel kisebb mértékben jelentkeztek a tesztek során, azonban az immun-mediált mellékhatások egyenlően jelentkeztek a két csoport között. | PD-1 helyett a PD-L1 gátlása kissé különböző eredményeket hozhat, azonban klinikai adatok jelenleg limitáltan állnak rendelkezésre. A kezeléshez köthető mellékhatások PD-L1 inhibitorok esetén valamivel kisebb mértékben jelentkeztek a tesztek során, azonban az immunmediált mellékhatások egyenlően jelen voltak a két csoport között (Buchbinder és Desai, 2016). |
| Line 158: | Line 154: |
| A dermatológiai, máj, endokrin és egyéb, kevésbé gyakori gyulladásos események valószínűleg az általános immunválasz fokozódásából erednek. Kortikoszteroidokkal, tumor nekrózis faktor α antagonistákkal, mikofenolát-mofetillel vagy más szerekkel való ideiglenes immunszuppresszió gyakran szükséges. A korai felismerés és kezelés fontos a súlyosság csökkentésében. | A dermatológiai, máj, endokrin és egyéb, kevésbé gyakori gyulladásos események valószínűleg az általános immunválasz fokozódásából erednek. Kortikoszteroidokkal, tumor nekrózis faktor α antagonistákkal, mikofenolát-mofetillel vagy más szerekkel való ideiglenes immunszuppresszió gyakran szükséges. A korai felismerés és kezelés fontos a súlyosság csökkentésében (Postow és mtsai, 2015). |
| Line 160: | Line 156: |
| === 4.2. Kombinált terápiák === | == Kombinált terápiák == |
| Line 163: | Line 159: |
| A kezelésre adott pozitív válasz és a progressziómentes túlélés aránya növekedett az impilimumab-nivolumab kombinációval kezelt áttétes melanomás betegeknél szemben az egyedül impilimumabbal kezeltekkel szemben. Az objektív válasz aránya 58- illetve 19%, a progressziómentes túlélés időtartama 11,5 illetve 2,9 hónap volt. A CDLA-4 és PD-1 gátló szerek kombinált alkalmazását más tumortípusok esetében is vizsgálják, úgy mint előrehaladott nem kissejtes tüdőrák (NSCLC) és vesesejt rák (RCC) esetében. Metasztázisos RCC-nél az adatok szintén a kombinált terápia nagyobb sikerességét (38-44%) vetítik elő a kizárólagos PD-1 gátlással szemben (20-22%). Korai adatok tüdőrák-vizsgálatokból azt mutatják, hogy NSCLC esetén a kombinált terápia nem jár a tumorellenes aktivitás növekedésével, azonban kissejtes tüdőrák esetén igen. | A kezelésre adott pozitív válasz és a progressziómentes túlélés aránya növekedett az ipilimumab-nivolumab kombinációval kezelt áttétes melanomás betegeknél szemben az egyedül ipilimumabbal kezeltekkel szemben. Az objektív válasz aránya 58- illetve 19%, a progressziómentes túlélés időtartama 11,5 illetve 2,9 hónap volt. A CDLA-4 és PD-1 gátló szerek kombinált alkalmazását más tumortípusok esetében is vizsgálják, úgy mint előrehaladott nem kissejtes tüdőrák (NSCLC) és vesesejtes rák (RCC) esetében. Metasztázisos RCC-nél az adatok szintén a kombinált terápia nagyobb sikerességét (38-44%) vetítik elő a kizárólagos PD-1 gátlással szemben (20-22%). Korai adatok tüdőrák-vizsgálatokból azt mutatják, hogy NSCLC esetén a kombinált terápia nem jár a tumorellenes aktivitás növekedésével, azonban kissejtes tüdőrák esetén igen. |
| Line 165: | Line 161: |
| A kombinált terápia alkalmazása eredményesnek bizonyulhat, azonban nagyobb toxicitást is mutathat. Előzőleg kezeletlen melanoma és kissejtes tüdőrák esetében a gyógyszerhasználat okozta mellékhatások előfordulásának aránya a kombinált terápia esetén 54-55%, kizárólagos impilimumab kezelés esetén 24-27%, egyedül nivolumab alkalmazása esetén pedig 15-16% volt. A megelőző CTLA-4 gátlás nem okozza a későbbiekben PD-1 gátlókkal kezelt betegekben immun-mediált mellékhatások megjelenésének növekedését, ezért a kétféle terápia egymást követő alkalmazása is felmerül mint lehetőség a párhuzamosan történő használat mellett. | A kombinált terápia alkalmazása eredményesnek bizonyulhat, azonban nagyobb toxicitást is mutathat. Előzőleg kezeletlen melanoma és kissejtes tüdőrák esetében a gyógyszerhasználat okozta mellékhatások előfordulásának aránya a kombinált terápia esetén 54-55%, kizárólagos ipilimumab kezelés esetén 24-27%, egyedül nivolumab alkalmazása esetén pedig 15-16% volt. A megelőző CTLA-4 gátlás nem okozza a későbbiekben PD-1 gátlókkal kezelt betegekben immunmediált mellékhatások megjelenésének növekedését, ezért a kétféle terápia egymást követő alkalmazása is felmerül mint lehetőség a párhuzamosan történő használat mellett (Buchbinder és Desai, 2016). |
| Line 167: | Line 163: |
| == 5. Összegzés == Az immunrendszer fontos szerepet játszik a rák szabályozásában és felszámolásában. Azonban a rosszindulatú daganat kialakulásában számos immunrendszeri mechanizmus vesz részt, amely megakadályozza a hatékony tumorellenes immunitást. A CTLA-4-re és PD-1 / PD-L1-re irányuló checkpoint-blokkoló antitestekkel végzett immunterápia javította a különböző rosszindulatú daganatokkal rendelkező betegek kilátásait. |
= Összegzés = Az immunrendszer fontos szerepet játszik a rák szabályozásában és felszámolásában. Azonban a rosszindulatú daganat kialakulásában számos immunrendszeri mechanizmus vesz részt, amely megakadályozza a hatékony tumorellenes immunitást. A CTLA-4-re és PD-1 / PD-L1-re irányuló checkpoint-blokkoló antitestekkel végzett immunterápia javította a különböző rosszindulatú daganatokkal rendelkező betegek kilátásait (Postow és mtsai, 2015). |
| Line 170: | Line 166: |
| A tumorterápiás vizsgálatok során sok kérdés maradt fenn, mint például az immunrendszerrel kapcsolatos nemkívánatos események (irAE) pl.: immunközvetített toxicitás optimális kezelése pl.:kortikoszteroidokkal, és a kombinált megközelítések legmegfelelőbb értékelése annak megállapítására, hogy a CTLA-4 vagy PD-1 / PD-L1 blokád hatékonyságát növelik-e. Az előzetes adatok arra utalnak, hogy a CTLA-4 és PD-1 útvonalak egyidejű blokkolása a CTLA-4 vagy PD-1 gátláshoz képest önmagában vagy szekvenciában fokozott hatékonyságot eredményez, és további bizonyítékot szolgáltat ezeknek az ellenőrzési pontoknak a tumorellenes immunválaszok szabályozásában betöltött különálló szerepéről. | A tumorterápiás vizsgálatok során sok kérdés maradt fenn, mint például az autoimmun reakció megjelenése, az immunközvetített toxicitás optimális kezelése például kortikoszteroidokkal, és a kombinált megközelítések legmegfelelőbb értékelése annak megállapítására, hogy a CTLA-4 vagy PD-1 / PD-L1 blokád hatékonyságát növelik-e. Az előzetes adatok arra utalnak, hogy a CTLA-4 és PD-1 útvonalak egyidejű blokkolása a CTLA-4 vagy PD-1 gátláshoz képest önmagában vagy szekvenciában fokozott hatékonyságot eredményez, és további bizonyítékot szolgáltat ezeknek az ellenőrzési pontoknak a tumorellenes immunválaszok szabályozásában betöltött különálló szerepéről (Buchbinder és Desai, 2016; Postow és mtsai, 2015). |
| Line 174: | Line 170: |
| A CTLA-4, PD-1 és PD-L1 inhibitorok vizsgálatai aktív klinikai fejlesztésekben részesülnek és potenciálisan forradalmasíthatják a előrehaladott rákos betegek jövőbeni kezelési lehetőségeit. | A CTLA-4, PD-1 és PD-L1 inhibitorok vizsgálatai aktív klinikai fejlesztésekben részesülnek és potenciálisan forradalmasíthatják a előrehaladott rákos betegek jövőbeni kezelési lehetőségeit (Buchbinder és Desai, 2016). |
| Line 176: | Line 172: |
| == 6. Források == === 6.1 Irodalom jegyzék === === 6.2. Egyéb felhasznált irodalom === === 6.3. Ábrajegyzék === |
= Források = == Irodalomjegyzék == 1. Alsaab, H.O.; Sau, S.; Alzhrani, R.; Tatiparti, K.; Bhise, K.; Kashaw, S.K.; Iyer, A.K. (2017): PD-1 and PD-L1 Checkpoint Signaling Inhibition for Cancer; Immunotherapy: Mechanism, Combinations, and Clinical Outcome. Frontiers in Pharmacology 8: 561. doi: 10.3389/fphar.2017.00561 1. Buchbinder, E.I.; Desai, A. (2016): CTLA-4 and PD-1 Pathways. American Journal of Clinical Oncology 39: (1) 98-106. doi: 10.1097/coc.0000000000000239 1. Ishida, Y.; Agata, Y.; Shibahara, K.; Honjo, T. (1992): Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. The EMBO Journal 11: (11) 3887-3895 1. Keir, M.E.; Butte, M.J.; Freeman, G.J.; Sharpe, A.H. (2008): PD-1 and its ligands in tolerance and immunity. Annual Review Immunology 26: 677–704. doi: 10.1146/annurev.immunol.26.021607.090331 1. Knudson, K.M.; Hicks, K.C.; Alter, S.; Schlom, J.; Gameiro, S.R. (2019): Mechanisms involved in IL-15 superagonist enhancement of anti-PD-L1 therapy. Journal for Immunotherapy of Cancer 7: (1) 82. doi: 10.1186/s40425-019-0551-y. 1. Krummel, M.F.; Allison J.P. (1996): CTLA-4 engagement inhibits IL-2 accumulation and cell cycle progression upon activation of resting T cells. Journal of Experimental Medicine 183: (6) 2533–2540 1. Mitsuiki, N.; Schwab, C.; Grimbacher, B. (2018): What did we learn from CTLA‐4 insufficiency on the human immune system? Immunological Reviews 287: (1) 33-49. doi: 10.1111/imr.12721 1. Parry, R.V.; Chemnitz, J.M.; Frauwirth, K.A.; Lanfranc, A.R.; Braunstein, I.; Kobayashi, S.V.;Linsley, P.S.; Thompson, C.B.; Riley, J.L. (2005): CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Molecular and Cellular Biology 25: (21) 9543–9553 1. Poschke, I.; Mougiakakos, D.; Kiessling, R. (2011) Camouflage and sabotage: tumor escape from the immune system. Cancer Immunology Immunotherapy 60: (8) 1161–1711. doi: 10.1007/s00262-011-1012-8 1. Postow, M.A.; Callahan, M.K.; Wolchok, J.D. (2015): Immune Checkpoint Blockade in Cancer Therapy. Journal of Clinical Oncology 33: (17) 1974-1982. doi: 10.1200/jco.2014.59.4358 1. Türk-Mázló, A.; Rajnavölgyi, É. (2017): A CTLA-4 rendszer immunológiai és immunonkológiai szerepe: kétélű fegyver? Immunológiai Szemle/Immunology Quarterly 9: (1) 18-22 == Ábrajegyzék == 1.ábra: saját készítésű, forrás:https://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_Immunologia/ch13.html (13.4.ábra) 2.ábra: saját készítésű, forrás: Türk-Mázló, A.; Rajnavölgyi, É. (2017): A CTLA-4 rendszer immunológiai és immunonkológiai szerepe: kétélű fegyver? Immunológiai Szemle/Immunology Quarterly 9: (1) 18-22 https://immunology.unideb.hu/sites/default/files/upload_documents/isz_2017_1_18_turk_mazlo.pdf (1.ábra) 3., 4., 5. ábra: saját készítésű, forrás: Buchbinder, E.I.; Desai, A. (2016): CTLA-4 and PD-1 Pathways. American Journal of Clinical Oncology 39: (1) 98-106. doi: 10.1097/coc.0000000000000239 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4892769/''''' ''''' |
A negatív immunreguláción alapuló tumorterápia
Contents
Bevezetés
A 2018-as orvosi-élettani Nobel-díjat az amerikai James P. Allison és a japán Hondzso Taszuku megosztva kapták a rákkutatásban tett nagy felfedezésükért, “a negatív immunreguláció gátlására alapuló tumorterápia felfedezéséért”. Olyan immunonkológiai kutatási eredményeket kaptak, amelyek alkalmasak voltak új daganatterápiás módszerek kifejlesztésére azáltal, hogy erőteljesebb immunválaszra késztetik a szervezetet a tumorsejtekkel szemben. Ezzel a terápiával a már előrehaladott és kezelt betegek is gyógyíthatóak. Mivel a tumorsejtek észrevétlenek maradhatnak az immunrendszerrel szemben, zavartalanul tudnak szaporodni. Azonban a kifejlesztett gyógymóddal az immunrendszer “lefékezése” felszabadítható, így a szervezet fel tudja venni a harcot a rákkal.
Tumorsejtek és immunrendszer találkozása
Az immunrendszer a szervezet védekező mechanizmusa. Szervezetünkben számos sejttípus található, ezek összehangolt működése képes különbséget tenni a saját és nem saját anyagok között, és így a felismert struktúrákra toleranciával vagy immunválasszal reagálni. Így fennáll a folyamatos védekezés a különböző kórokozókkal, patogénekkel szemben. A kórosan működő saját sejtek elpusztítása is az immunrendszer feladatai közé tartozik, védve a szervezetet a tumor kialakulásától.
Szervezetünk védekező rendszere folyamatosan azonosít és eliminál veszélyes mutációkon átesett rákos sejteket. Azonban jól működő immunrendszer mellett is kialakulhat rosszindulatú daganat. Ezek a mutálódott sejtek (malignus transzformált) közvetlen vagy közvetve hatással vannak a védekező rendszerre, és képesek rejtve maradni az immunsejtek elől. Az immunsejtek 3 lehetséges módon reagálhatnak a tumorsejtekre:
Immunfelügyelet: rákos sejtek sikeres elpusztítása, elimináció
Perzisztáló tumor: egyensúlyi állapot kialakulása, a tumort nem sikerült teljesen elpusztítani, de növekedése szabályozva van
Tumorprogresszió: immunrendszer elől rejtve maradó tumorsejt
- (Türk-Mázló és Rajnavölgyi, 2017).
Sikeres T-sejt válasz
A tumorspecifikus T-sejt-válasz sikeres, ha olyan antigéneket tud kifejezni, amik tumorossá fajult és egészséges sejteken egyaránt előfordulhatnak és tumorasszociáltak, vagy amik csak a tumorra jellemző mutáns génekről íródtak át, ezért tumorspecifikusak. (Pl.: melanómánál specifikus CD4+ és CD8+ antigének, T-sejt-válasz és ellenagyag-termelés indult be.)
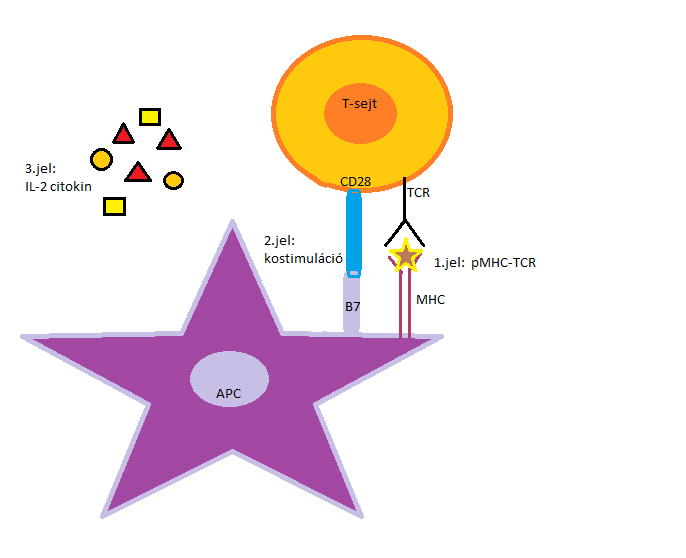
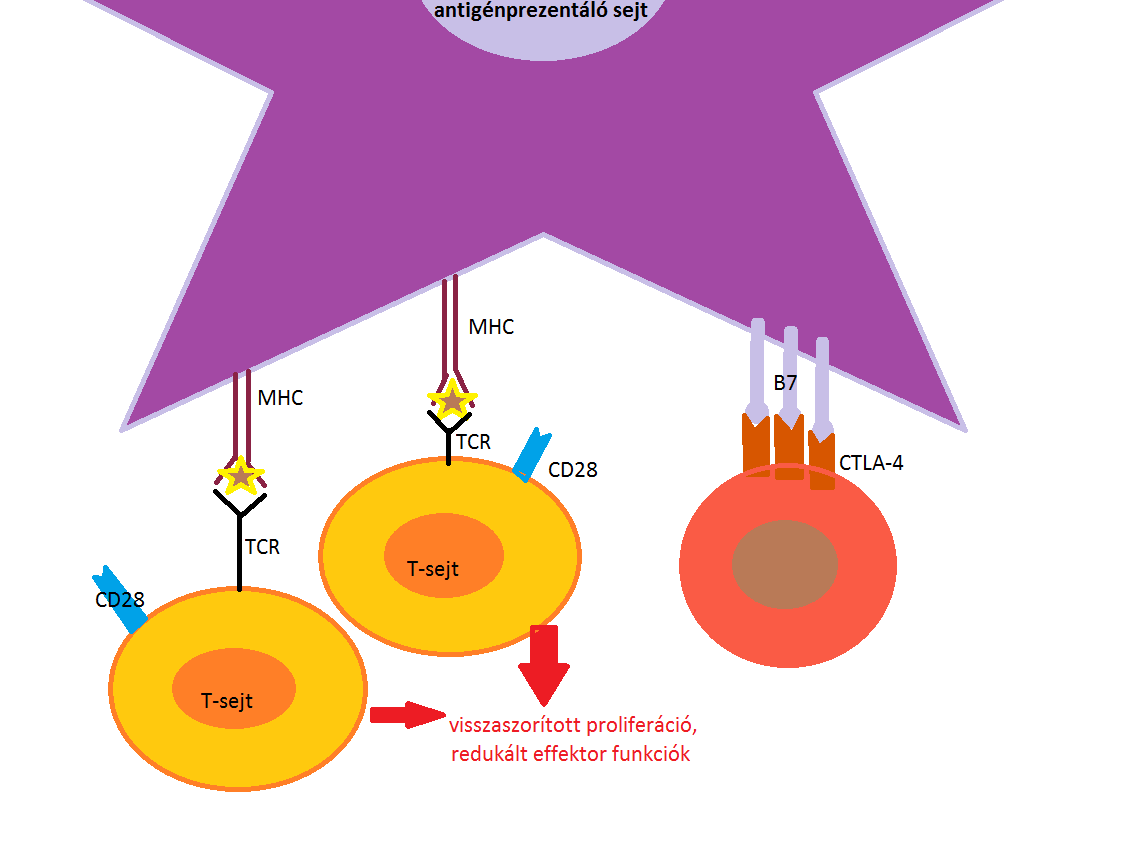
A T-lymphocyták aktivációjának feltétele két szignál aktiválódása (1.ábra mutatja a folyamatot): antigénspecifikus jel a T-sejt receptor (T-cell receptor = TCR) antigénhez történő kötést követően alakul ki, és a kostimulációs molekulák kapcsolódásával születő jel (naiv T-lymphocyták aktiválásához elengedhetetlen).
A kölcsönhatások együttesen felelősek az antigénspecifikus immunválasz aktiválódásáért (Türk-Mázló és Rajnavölgyi, 2017).
|
1. ábra: A T-sejt receptor (TCR) felismerése és kötése egy antigénprezentáló sejt (APC) felületén lévő fő hisztokompatibilitási komplexben (MHC) megjelenő antigénhez. Ezzel egyidejűleg megtörténik a kostimulációs molekulák, CD28-B7 kapcsolódása, és megindul IL-2 citokin termelése. |
Sikertelen T-sejt válasz
A tumorprogresszió lehetséges okai :
· Felismerő mechanizmusok kisebb hatékonysága, tumorsejtek alacsony immunogenitása
· Rákos sejtek rezisztenssé válnak az immunrendszer effektor működésével szemben
· Tumor körüli mikrokörnyezet immunszupresszívvé válik
Kimutatták, hogy primer carcinomáknál az immundeficiens állatokban kialakuló tumor immunogén, ekkor a jól működő immunrendszer a rákos sejteket eliminálja. Viszont az egészséges egyénből immundefficiens betegbe ültetett kevésbé immunogén primer carcinoma el tudja kerülni az immunrendszer felismerését, és így ellenállóbbá válik a sejtöléssel szemben. Megtörtént az immunátszerkesztés. Pl.: HIV fertőzöttek, transzplantációt követően és az immunszupresszív kezeltek esetében nő az esélye a rosszindulatú tumoros megbetegedésnek (Türk-Mázló és Rajnavölgyi, 2017).
Koinhibitor fehérjék az immunrendszer negatív regulátorai (checkpoint mechanizmus)
A koinhibitor fehérjék fontos szerepet játszanak az immunrendszer megfelelő működésében. Ellenőrző pontként -„checkpoint”- az immunrendszer negatív regulátorai. A checkpoint kifejezés alatt az immunrendszer azon negatív regulátor elemeit értjük, amelyek a T-sejtek végrehajtó funkcióit legátolják. Bizonyos molekulák és sejttípusok az immunválasz ellenőrző pontjaiként csökkentik az effektor T-lymhocyták sejt-, és szövetkárosító hatását komplex jelátviteli hálózatot képezve. Fiziológiásan az autoimmun folyamatokat gátolják. Ugyanakkor a tumorok mikrokörnyezetében az effektorsejtek tumorellenes hatását csökkentik. Ez lehetővé teszi a tumorok számára a túlélést és a proliferációt.
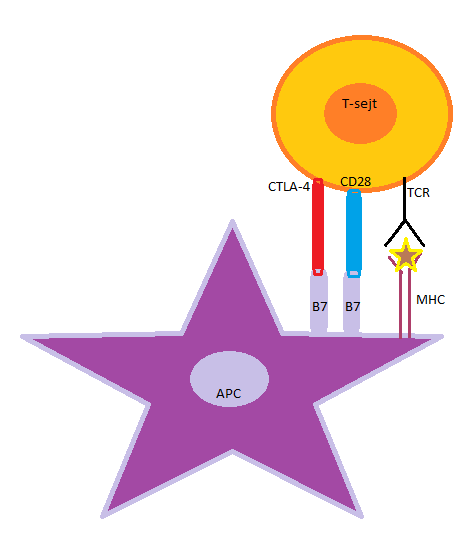
Mikor a T-sejt CD28 kostimulációs molekulája kapcsolódik az antigénprezentáló sejt expresszált B7 molekula családhoz, beindul IL-2 citokinek termelése. Ez eredményezi a naiv T-lymphocyták klonális osztódását és effektor T-sejtekké történő differenciálódását. A B7 receptor nemcsak kostimuláló molekulához kapcsolódhat, hanem gátló/koinhibitor CTLA-4 molekulához is. Ha ez a fehérje (CTLA-4 intracellulácisan tárolt) kijut a sejtfelszínre, akkor kompetitív módon gátolja a CD28-függő kostimulációt, ezzel pedig az effektor T-sejt-válasz gátlását eredményezi (2.ábra).
|
2. ábra: Az anitgénprezentáló sejt (APC) B7 receptorának kapcsolódása a T-sejt CD28 kostimulációs és gátló CTLA-4 molekulájához. Ezzel megszületik a kostimuláció kompetitív gátlása. |
A „checkpoint” mechanizmus ismeretében az onkológia jelentős figyelmet fordított az immunsejtekre, mint potenciális terápiás célpontokra.
Ha a kostimuláló szignálokat erősítjük (T-sejt kostimulációs molekulája: CD28) és a koinhibitor szignálokat blokkoljuk (T-sejt gátló hatású fehérjéi: CTLA-4, PD-1), akkor a tumorellenes effektor T-sejt-válasz sokszorosára fokozódhat. Ezt a mechanizmust használják ki tumorellenes terápiák során. A koinhibitor fehérjék működését specifikus antitestekkel bolokkolják.
A legintenzívebben kutatott negatív checkpoint regulátorok:
CTLA-4 / CD152 (cytotoxic T lymphocyte (CTL-) associated antigen-4)
PD-1 / CD279 (programmed cell death protein-1)
PD-L1 / CD274 / B7-H1 (programmed cell death protein-1 ligand) (Türk-Mázló és Rajnavölgyi, 2017).
CTLA-4
CTLA-4 helyeződése, mechanizmusa, szerepe
A citotoxikus-T-lymphocyta-antigén-4 (CTLA-4) egy negatív immunszabályozó fehérje, mely nagy része intracelluláris endoszómákban foglaltan, kisebb része dimer formában konstitutívan expresszálódik a T-regulátor sejteken, az aktivált T-sejteken pedig upregulált molekulaként (megnövekedett denzitású receptor molekula) szerepel, illetve dendritikus sejtekben is megtalálható.
Mind a TCR-MHC, mind a CD28- B7-kapcsolódásból származó stimuláló jelek a CTLA-4 fehérjét tartalmazó vezikulák exocitózisához, és a CTLA-4 sejtfelszínen való kifejeződéséhez vezetnek. Ez a folyamat “feedback” mechanizmuson alapul, amely az erősebb TCR jel hatására több CTLA-4 sejtfelszínre való transzlokációját vonja maga után.
A CTLA-4 különböző szuppresszív funkciókkal gátolja a T-sejtek aktiválódását, beleértve a CD28-val való versenyt, a T-regulátor sejtek gátló funkciójának szabályozását, mint például a transzendocitózist, az adhézió és a motilitás szabályozását. A CTLA-4 által közvetített T-regulátor sejtek szuppressziója fontos szerepet játszik a perifériás tolerancia és az autoimmun betegségek megelőzésében (Mitsuiki és mtsai, 2018).
A CTLA-4 egy CD28 homológnak tekinthető, azonban sokkal nagyobb kötési affinitással rendelkezik. A CD28-tól eltérően a CTLA-4 B7-hez való kötődése nem eredményez stimuláló jelet. Mint ilyen, ez a versenyképes kötés megakadályozhatja a CD28-B7-kötődés által létrehozott jel kialakulását. A CD28- B7/CTLA-4 - B7 kötődés egymáshoz viszonyított aránya határozza meg, hogy egy T-sejt aktiválódik-e vagy gátlódik. A B7-hez kötődő CTLA-4 gátló jeleket eredményez, amely ellensúlyozza a CD28-B7 és TCR- MHC kötődés stimuláló jeleit.
A gátló mechanizmus során megtörténhet a TCR-immunszinapszis közvetlen gátlása, a CD28 vagy e receptorfehérje jelátviteli útjának gátlása, illetve az APC-T-sejt kapcsolódásának akadályozása a megnövekedett T-sejt motilitás miatt (Buchbinder és Desai, 2016).
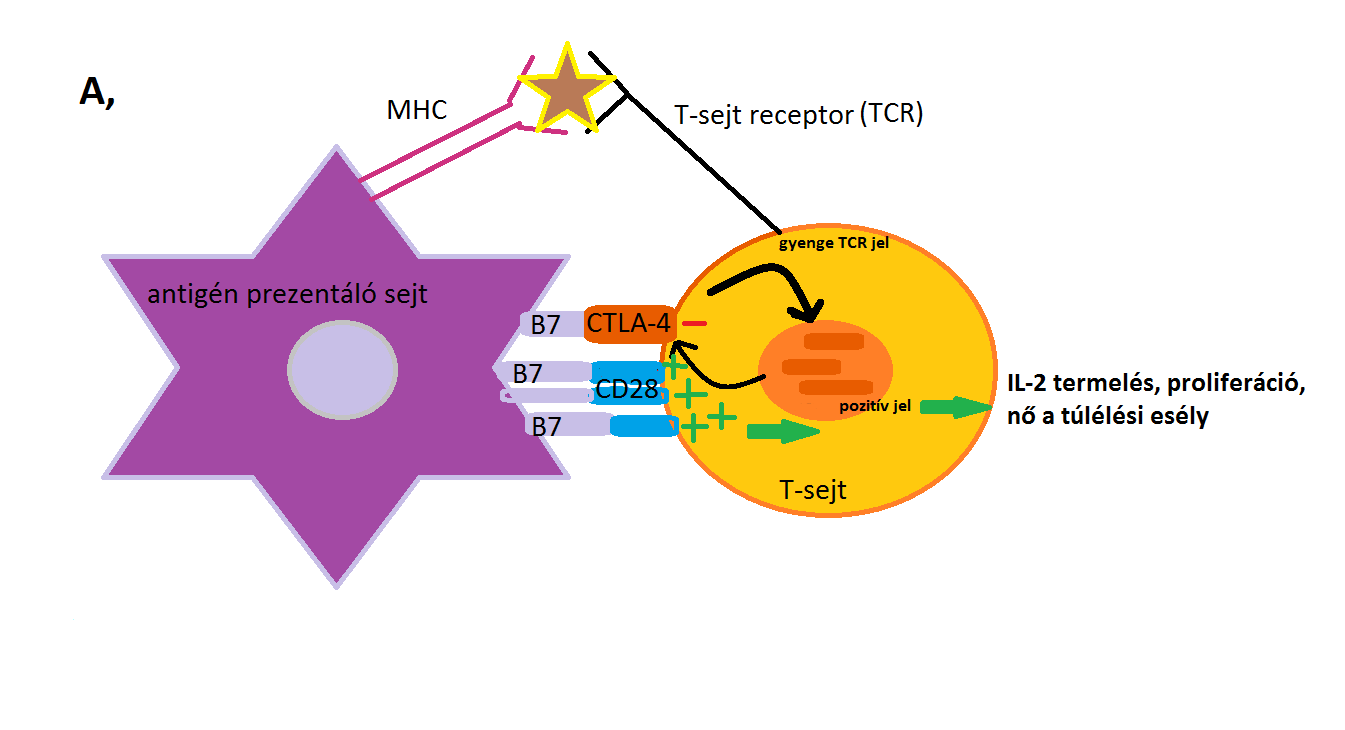
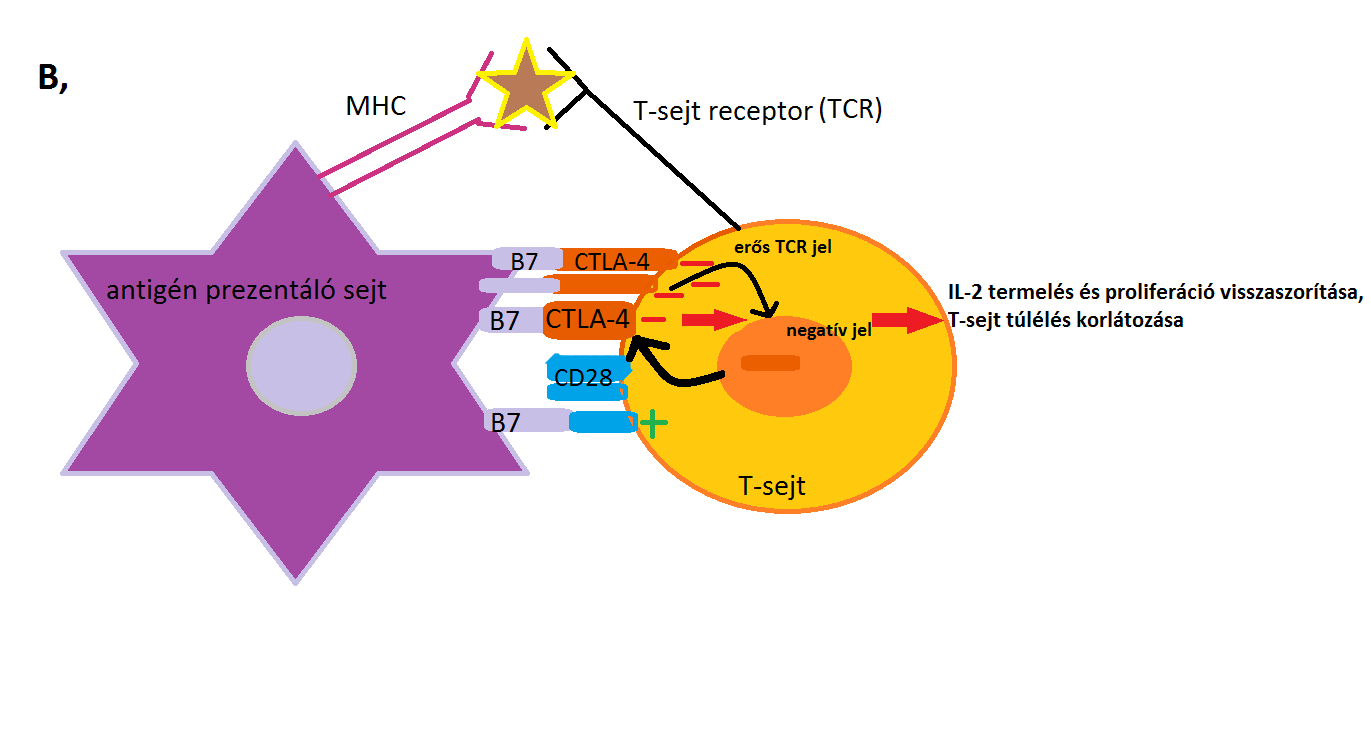
Az alábbi 3., 4. ábra mutatja be a CTLA-4 fentebb leírt mechanizmusait.
|
3. ábra: A, része: T-sejtek CTLA-4 által közvetített gátlása. A T-sejtek akkor aktiválódnak, ha a TCR-MHC kapcsolódás és CD28-B7 kapcsolódás egyidejűleg történik. A gyenge TCR inger esetén a CD28- B7 kötődés dominál, ami pozitív aktiváló jelet eredményez és ez IL-2 termeléshez, a T-sejtek proliferációjához vezet, és nő a túlélési esély. |
|
3. ábra: B, része: Erős TCR inger esetén a CTLA-4 expressziója kifejezettebbé válik a sejtfelszínen a celluláris endoszómákból. A CTLA-4 verseng a CD28-cal a B7 molekulákkal való kötődésért. A megnövekedett CTLA-4- B7 kapcsolódás negatív jelet eredményez, amely visszaszorítja az IL-2 termelést és a proliferációt, és korlátozza a T-sejt túlélését. |
|
4. ábra: A CTLA-4 mediált T-regulátor sejt gátlási mechanizmusa. A T-regulátor sejten expresszálódott CTLA-4 kapcsolódik az APC B7 molekulájához, ez B7 internalizálódást okoz az antigénprezentáló sejten. Emiatt a T-sejtek CD28-B7 kötődés mediálta kostimuláció hiánya csökkent T-sejt proliferációhoz és leredukált effektor funkcióhoz vezet. |
CTLA-4 gátlása tumoros megbetegedések kezelésében
A CTLA-4 általi szabályozás hozzájárul az immunszupresszív állapot fenntartásához és lehetőség nyílik tumor kialakulására. A molekula működésének gátlásával jelentősen befolyásolni lehet az immunválasz kimenetelét (Türk-Mázló és Rajnavölgyi, 2017).
Erre fejlesztették ki az anti-CTLA-4 ipilimumab(Yervoy gyógyszer hatóanyaga) és a tremelimumab alkalmazásán alapuló immunterápiát. Mindkét hatóanyag áttétképző melanomás megbetegedéseknél tartós klinikai választ mutatott. Sajnos a tremelimumab nem tartotta statisztikailag szignifikánsan az általános túlélést (Postow és mtsai, 2015).
Az ipilimumab alkalmazását 2011-ben a Food and Drug Administration (FDA) dacarbazinnal kezelt betegek számára jóváhagyta.
Az ipilimumab alkalmazásának hatékonyságát alapvetően két tanulmány támasztotta alá. Az egyik olyan áttétes melanomában szenvedő betegcsoportokat vizsgált, amelyeknél az első vonalban alkalmazott kemoterápia nem csökkentette a tumor progresszióját. Azon betegek átlagos túlélési ideje 6,4 hónapról 10,4 hónapra emelkedett, akik a szokásos kemoterápiás vakcina mellé, vagy anélkül ipilimumab kezelést kaptak. A másik jelentős vizsgálat azt az eredményt hozta, hogy azok a betegek, akik dacarbazin kezelés mellett ipilimumabot kaptak, átlagosan 2,1 hónappal tovább éltek, mint azok, akik ebben nem részesültek (Türk-Mázló és Rajnavölgyi, 2017).
Más rosszindulatú daganatok esetén - nem kissejtes tüdőrákos betegeknél, számos hasnyálmirigyrákban és prosztatarákban szenvedő betegnél-, a CTLA-4 antitestterápia bizonyos előnyöket mutatott (Buchbinder és Desai, 2016).
Sajnos a sugárkezelés után az ipilimumab nem javította a teljes túlélést a placebóval összehasonlítva. Bár ez a vizsgálat negatívnak bizonyult, az ipilimumab előnyös lehetett a kedvező prognosztikai jellemzőkkel rendelkező betegek számára, de ez további tanulmányokat igényel.
A tremelimumab, másik CTLA-4 blokkoló antitest, válaszokat mutatott a rosszindulatú mellhártyadaganatokban (mesothelioma) szenvedő betegeknél, azonban ezek a vizsgálatok még nem zárultak le (Postow és mtsai, 2015).
Összességében az elmúlt 10 év statisztikai adatai igazolták, hogy a CTLA-4 molekula blokkolásával a betegek 20%-ánál tartós remissziót sikerült elérni (Türk-Mázló és Rajnavölgyi, 2017).
PD-1
PD-1 helyeződése, mechanizmusa, szerepe
A PD-1 a kostimulátor receptorok B7/CD28 családjának tagja. Az immunglobulin szupercsaládba tartozó I-es típusú transzmembrán protein, amely a sejtfelszínen monomer formában jelenik meg.
A molekula, a CTLA-4-el ellentétben nem csak T-sejteken fejeződik ki, hanem a natural killer-, a T- és B-sejtek, a monocyták és dendritikus sejtek, valamit a follicularis segítő T-sejtek felszínén is.
A PD-1 mulekula két ismert liganduma a PD-L1 és a PD-L2. A PD-1 ligandumainak eloszlása szintén eltér a CTLA-4 ligandumaiétól, szélesebb körben expresszálódnak. A PD-L1-et leukociták, nem haemopoetikus sejtek nem morfoid szövetekben expresszálják, továbbá parenchimális sejteken indukálhatók gyulladásos citokinek vagy tumorigén jelátviteli útvonalak segítségével. A PD-L1 expressziója számos különböző tumor típuson is megtalálható. A PD-L2 elsősorban dendritikus sejteken és monocitákon expresszálódik, de számos más immunsejtben és nem immunsejtben is indukálható. Előbbi elsősorban a nem lymphoid, utóbbi a primer immunszervekben hat (Keir és mtsai, 2008; Parry és mtsai, 2005).
A PD-1/PD-L1 kötődés rosszindulatú tumorok kialakulásánál az effektor T-sejt aktivitás gátlásának kritikus komponense. A tumorspecifikus T-sejtek felszínén a PD-1 koinhibitorikus molekula kifejeződése jelentősen fokozódik. Az epithel- és vérsejtekből induló tumorok sejtfelszínén a PD-L1 molekulák száma emelkedik meg.
A PD-1/PD-L1 útvonal a gyulladásos folyamatok mérséklése céljából, ezáltal a túlzott szövetkárosodás elkerülése miatt alakult ki. Elsősorban olyan szövetekben fejti ki gátló hatást, ahol éppen immunválasz zajlik, tehát az effektor fázis alatt, főként a perifériás szövetekben.
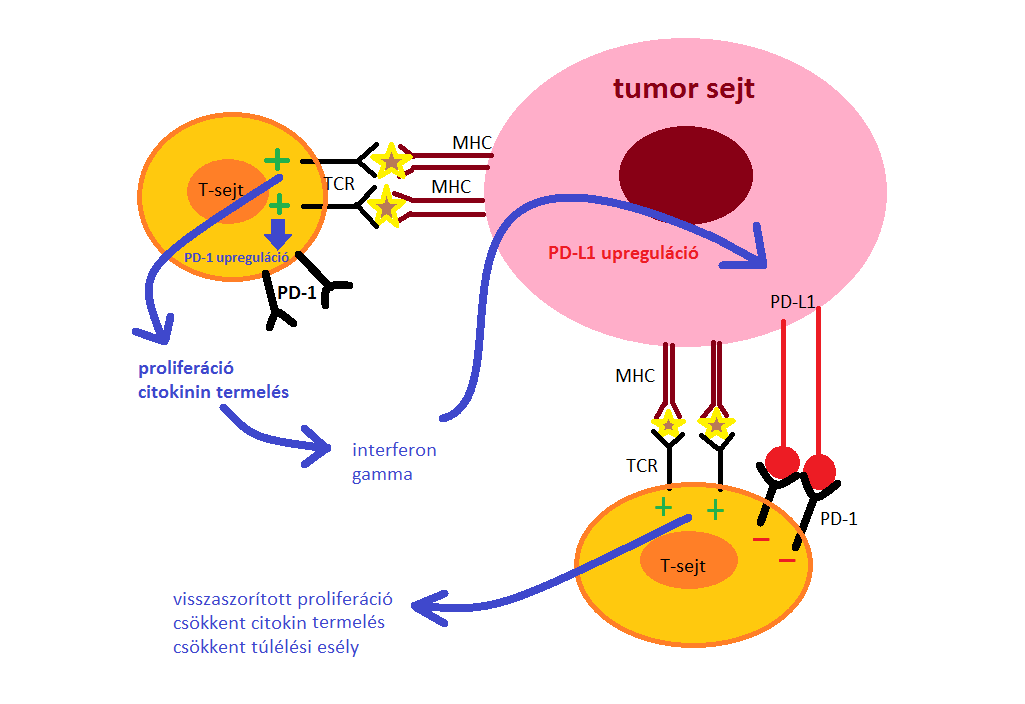
Amikor egy T-sejt felismeri az MHC-komplex által a célsejten expresszált antigént, gyulladásos citokineket termel, amelyek megindítják a gyulladásos folyamatot. Ezek a citokinek PD-L1 expressziót eredményeznek a szövetben, aktiválva kapcsolódásukkal a T-sejten lévő PD-1 fehérjét, ami immuntoleranciát eredményez, ezáltal az immunrendszer elveszíti a kontrollt, hogy gyulladásos reakciót hozzon létre, még akkor is, ha hatásos antigének vannak jelen (5.ábra mutatja be a folyamatot).
|
5. ábra: A T-sejtek PD-1 mediálta gátlása A tumorantigéneket felismerni képes T-sejt aktiválható, és ennek következtében proliferációra, gyulladásos citokin termelésére és a sejthalál elkerülésre bírható. A hosszabb ideig fennálló TCR jel egy éppen zajló immunválasz során megnövekedett PD-1 expressziót okozhat. A tumorsejtek PD-L1-et expresszálhatnak az emelkedett citokin koncentráció és/vagy egyéb onkogenikus jelátviteli útvonalak által. A PD-1/PD-L1 kötődés gátolja a TCR által kiváltott pozitív jel kialakulását, csökkent proliferációhoz, citokin termeléshez és túlélési esélyekhez vezetve. |
PD-1 szabályozza a T-sejt aktiválódását a PD-L1 és PD-L2 ligandumok kötődésével. Az aktiválódott T-lymphocyták által termelt citokinek hatására a PD-1 ligandumai fokozottabban fejeződnek ki a dendritikus és az epithel sejteken, csökkentve az immunmediált szövetkárosodást, azáltal, hogy gátlódik az interferon-gamma, a tumor nekrózis faktor-alfa és az IL-2 citokintermelés és a T-lymphocyták proliferációja, illetve túlélése. Ha a T-sejt receptor és a PD-1 kötődik, a PD-1 által generált jelek megakadályozzák a kulcsfontosságú TCR jelátviteli intermedierek foszforilációját, amely megszakítja a korai TCR jelátvitelt és csökkenti a T-sejt aktiválódást.
Bizonyos tumorokban, leginkább a melanómákban, ez a védekező funkció kiesik a PD-L1 túlzott expressziója miatt, és ennek eredményeként a tumor megkerüli az immunrendszer támadását. A PD-L1 tumor expressziója ugyanakkor egy olyan daganatra utalhat, amely az immunválaszt kikerüli, és ennek eredményeként potenciális biomarkerként szolgálhat a klinikai vizsgálatok számára, azonban nem minden PD-L1 expresszáló daganat reagál a PD-1-re / PD-L1 inhibitorokra. Ezzel szemben megjegyezhetjük, hogy a PD-L1-negatív tumorok is reagálhatnak ezekre az ágensekre. A kérdéssel kapcsolatos további kutatások jelenleg is zajlanak (Alsaab és mtsai, 2017).
PD-1 gátlása tumoros megbetegedések kezelésében
A ligandumkötés gátlása hozzájárulhat az effektorsejtek tumorellenes aktivitásának hatékonyságához. A PD-1 blokád az effektor fázis alatt működik a perifériás T-sejtek immunfunkciójának helyreállítása érdekében. A klinikai vizsgálatok azt mutatják, hogy a PD-1-et és a PD-L1-et blokkoló antitestek megbízhatóan hatnak számos előrehaladott ráktípusra.
A monoklonális antitestek (mAb-ok) a checkpoint-gátló gyógyszerek egy csoportját alkotják. Az anti-PD-1 és PD-L1 mAb-k közül több kimagasló eredményeket mutat a klinikai vizsgálatokban. Jelentősen csökkenthetik a toxicitást a tolerálható határokon belül és közben képesek a szilárd tumorok zsugorítására, illetve a fejlett tumorok és metasztázisok elnyomásra, összességében javítva a betegek túlélési esélyeit.
Jelenleg nem tisztázott, hogy a PD-1, vagy a PD-L1 inhibitorok hatékonyabbak-e, a hatékonyság függ a beteg paramétereitől, mint például annak neme, életkora és a megbetegedés típusa.
Az FDA 2014-ben hagyta jóvá az erre a célra kifejlesztett, anti-PD-1 ellenanyagot tartalmazó nivolumab (Opdivo gyógyszer hatóanyaga) alkalmazását. Ezen szerek nagyon ígéretes eredményeket mutattak nem kissejtes tüdőrákkal, előrehaladott melanomával, vesesejtes carcinomával és más szilárd jellegű tumorokkal szemben, minimális mellékhatások jelentkezésével. A nivolumab alkalmazása legfőképp megelőzően ipilimumabot kapott melanomás betegek kezelésében bizonyult sikeresnek. A melanoma az egyik legnehezebben gyógyítható daganat típus, a legtöbb hagyományos citotoxikus gyógyszerrel való kezelés nem hoz kielégítő eredményt. Az egyéves túlélést alapul véve 30,8%-al nőtt a nivolumabot kapott betegek túlélési aránya a csak dacarbazinnal kezeltekhez képest. A kezelés továbbá fej- és nyaki laphámsejtes carcinoma, nem kissejtes tüdőrák, vesét érintő tumorok, valamit Hodgkin –lymphoma esetén is sikeresnek bizonyult.
A pembrolizumabot (Keytruda gyógyszer hatóanyaga) az FDA 2016-ban hagyta jóvá visszatérő vagy áttétes fej- és nyaki laphámsejtes megbetegedések kezelésére. A Keytruda- kezelésre a vizsgált betegek 23%-a reagált pozitívan 6 hónapig, vagy annál hosszabb ideig.
A PD-1 inhibitorokat sikerrel alkalmazzák kombinált terápiában is. Kombinálható más checkpoint-inhibitorokkal, például a CTLA-4 gátló ipilimumabbal, kináz-inhibitorokkal, mint a mitogén-aktivált protein-kináz, amely a BRAF mutáció hatékony szabályozója, amely felelős a bőr melanoma metasztázis kialakulásáért, továbbá alkalmazzák kemoterápiás szerekkel egyetemben is (Alsaab és mtsai, 2017).
Tumorterápiák mellékhatásai és kombinált terápiák
Mellékhatások
A checkpoint blokád jelentős tumorellenes előnyöket okozhat, ellenben nemcsak a tumorspecifikus immunválaszokat fokozza, hanem egyedi autoimmun reakció megjelenésével társulhat (irAE = immune-related adverse events) (Postow és mtsai, 2015). A checkpoint-mechanizmus gátlása potenciálisan immunológiai eredetű, úgynevezett immunmediálta mellékhatások megjelenésével járhat. A leggyakrabban jelentett ilyen tünetek a kiütés vagy pruritus megjelenése, gasztrointesztinális rendellenességek jelentkezése, vagy endokrin elváltozások (Buchbinder és Desai, 2016).
Ezek bár eltérnek a hagyományos kemoterápia vagy a célzott terápia által okozott mellékhatásoktól, a 3. vagy 4. fokozatú toxicitás aránya az immunellenőrző pont blokáddal (kb. 10-20%) nem nagyobb, mint sok standard kemoterápia vagy célzott terápia esetén (Postow és mtsai, 2015).
Ezen mellékhatások gyakorisága ipilimumab alkalmazása mellett magasabb volt (20%), mint pembrolizumab kezelés mellett (10-13%). Ezt okozhatja a nagyobb mértékű T-sejt proliferáció, a csökkent T-regulátor mediálta immunszupresszió CTLA-4 blokkolás által, vagy az, hogy csökkent PD-1 gátlás által több T-set klón aktiválódik.
Hypophisitist jelentettek az ipilimumabbal kezelt betegek 2-4%-ánál, míg a PD-1 gátló szerekben részesült betegeknél ez az arány kevesebb, mint 1%. Azonban ez a jelenség lehetséges, hogy az eltérő immunmechanizmusok helyett a CTLA-4 tobozmirigysejtek felszínén való megjelenéséhez, és ezáltal az ipilimumab endokrin sejtekhez való kapcsolódásához köthető.
PD-1 helyett a PD-L1 gátlása kissé különböző eredményeket hozhat, azonban klinikai adatok jelenleg limitáltan állnak rendelkezésre. A kezeléshez köthető mellékhatások PD-L1 inhibitorok esetén valamivel kisebb mértékben jelentkeztek a tesztek során, azonban az immunmediált mellékhatások egyenlően jelen voltak a két csoport között (Buchbinder és Desai, 2016).
A dermatológiai, máj, endokrin és egyéb, kevésbé gyakori gyulladásos események valószínűleg az általános immunválasz fokozódásából erednek. Kortikoszteroidokkal, tumor nekrózis faktor α antagonistákkal, mikofenolát-mofetillel vagy más szerekkel való ideiglenes immunszuppresszió gyakran szükséges. A korai felismerés és kezelés fontos a súlyosság csökkentésében (Postow és mtsai, 2015).
Kombinált terápiák
Elméletben mind a CTLA-4, mind pedig a PD-1 és a PD-L1 gátlás nagyobb számú T-sejt proliferációjához vezethet az immunválasz korai szakaszában, visszaállíthatja az előzőleg kimerült T-sejtek aktivitását és csökkentheti a T-regulátor sejt mediálta immunszupressziót. Tanumányok igazolták a tumorellenes hatás erősödését a gátlószerek két típusának kombinálása esetén az egyik típus kizárólagos alkalmazásával szemben, igazolva ezzel a komponensek immunszabályozásban betöltött különböző szerepét.
A kezelésre adott pozitív válasz és a progressziómentes túlélés aránya növekedett az ipilimumab-nivolumab kombinációval kezelt áttétes melanomás betegeknél szemben az egyedül ipilimumabbal kezeltekkel szemben. Az objektív válasz aránya 58- illetve 19%, a progressziómentes túlélés időtartama 11,5 illetve 2,9 hónap volt. A CDLA-4 és PD-1 gátló szerek kombinált alkalmazását más tumortípusok esetében is vizsgálják, úgy mint előrehaladott nem kissejtes tüdőrák (NSCLC) és vesesejtes rák (RCC) esetében. Metasztázisos RCC-nél az adatok szintén a kombinált terápia nagyobb sikerességét (38-44%) vetítik elő a kizárólagos PD-1 gátlással szemben (20-22%). Korai adatok tüdőrák-vizsgálatokból azt mutatják, hogy NSCLC esetén a kombinált terápia nem jár a tumorellenes aktivitás növekedésével, azonban kissejtes tüdőrák esetén igen.
A kombinált terápia alkalmazása eredményesnek bizonyulhat, azonban nagyobb toxicitást is mutathat. Előzőleg kezeletlen melanoma és kissejtes tüdőrák esetében a gyógyszerhasználat okozta mellékhatások előfordulásának aránya a kombinált terápia esetén 54-55%, kizárólagos ipilimumab kezelés esetén 24-27%, egyedül nivolumab alkalmazása esetén pedig 15-16% volt. A megelőző CTLA-4 gátlás nem okozza a későbbiekben PD-1 gátlókkal kezelt betegekben immunmediált mellékhatások megjelenésének növekedését, ezért a kétféle terápia egymást követő alkalmazása is felmerül mint lehetőség a párhuzamosan történő használat mellett (Buchbinder és Desai, 2016).
Összegzés
Az immunrendszer fontos szerepet játszik a rák szabályozásában és felszámolásában. Azonban a rosszindulatú daganat kialakulásában számos immunrendszeri mechanizmus vesz részt, amely megakadályozza a hatékony tumorellenes immunitást. A CTLA-4-re és PD-1 / PD-L1-re irányuló checkpoint-blokkoló antitestekkel végzett immunterápia javította a különböző rosszindulatú daganatokkal rendelkező betegek kilátásait (Postow és mtsai, 2015).
A tumorterápiás vizsgálatok során sok kérdés maradt fenn, mint például az autoimmun reakció megjelenése, az immunközvetített toxicitás optimális kezelése például kortikoszteroidokkal, és a kombinált megközelítések legmegfelelőbb értékelése annak megállapítására, hogy a CTLA-4 vagy PD-1 / PD-L1 blokád hatékonyságát növelik-e. Az előzetes adatok arra utalnak, hogy a CTLA-4 és PD-1 útvonalak egyidejű blokkolása a CTLA-4 vagy PD-1 gátláshoz képest önmagában vagy szekvenciában fokozott hatékonyságot eredményez, és további bizonyítékot szolgáltat ezeknek az ellenőrzési pontoknak a tumorellenes immunválaszok szabályozásában betöltött különálló szerepéről (Buchbinder és Desai, 2016; Postow és mtsai, 2015).
Eddig három immunellenőrzési pontot engedélyeztek a melanoma kezelésére. A három közül kettő tüdőrákra is engedélyezett.
A CTLA-4, PD-1 és PD-L1 inhibitorok vizsgálatai aktív klinikai fejlesztésekben részesülnek és potenciálisan forradalmasíthatják a előrehaladott rákos betegek jövőbeni kezelési lehetőségeit (Buchbinder és Desai, 2016).
Források
Irodalomjegyzék
- Alsaab, H.O.; Sau, S.; Alzhrani, R.; Tatiparti, K.; Bhise, K.; Kashaw, S.K.; Iyer, A.K. (2017): PD-1 and PD-L1 Checkpoint Signaling Inhibition for Cancer; Immunotherapy: Mechanism, Combinations, and Clinical Outcome. Frontiers in Pharmacology 8: 561. doi: 10.3389/fphar.2017.00561
- Buchbinder, E.I.; Desai, A. (2016): CTLA-4 and PD-1 Pathways. American Journal of Clinical Oncology 39: (1) 98-106. doi: 10.1097/coc.0000000000000239
- Ishida, Y.; Agata, Y.; Shibahara, K.; Honjo, T. (1992): Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. The EMBO Journal 11: (11) 3887-3895
- Keir, M.E.; Butte, M.J.; Freeman, G.J.; Sharpe, A.H. (2008): PD-1 and its ligands in tolerance and immunity. Annual Review Immunology 26: 677–704. doi: 10.1146/annurev.immunol.26.021607.090331
- Knudson, K.M.; Hicks, K.C.; Alter, S.; Schlom, J.; Gameiro, S.R. (2019): Mechanisms involved in IL-15 superagonist enhancement of anti-PD-L1 therapy. Journal for Immunotherapy of Cancer 7: (1) 82. doi: 10.1186/s40425-019-0551-y.
- Krummel, M.F.; Allison J.P. (1996): CTLA-4 engagement inhibits IL-2 accumulation and cell cycle progression upon activation of resting T cells. Journal of Experimental Medicine 183: (6) 2533–2540
- Mitsuiki, N.; Schwab, C.; Grimbacher, B. (2018): What did we learn from CTLA‐4 insufficiency on the human immune system? Immunological Reviews 287: (1) 33-49. doi: 10.1111/imr.12721
- Parry, R.V.; Chemnitz, J.M.; Frauwirth, K.A.; Lanfranc, A.R.; Braunstein, I.; Kobayashi, S.V.;Linsley, P.S.; Thompson, C.B.; Riley, J.L. (2005): CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Molecular and Cellular Biology 25: (21) 9543–9553
- Poschke, I.; Mougiakakos, D.; Kiessling, R. (2011) Camouflage and sabotage: tumor escape from the immune system. Cancer Immunology Immunotherapy 60: (8) 1161–1711. doi: 10.1007/s00262-011-1012-8
- Postow, M.A.; Callahan, M.K.; Wolchok, J.D. (2015): Immune Checkpoint Blockade in Cancer Therapy. Journal of Clinical Oncology 33: (17) 1974-1982. doi: 10.1200/jco.2014.59.4358
- Türk-Mázló, A.; Rajnavölgyi, É. (2017): A CTLA-4 rendszer immunológiai és immunonkológiai szerepe: kétélű fegyver? Immunológiai Szemle/Immunology Quarterly 9: (1) 18-22
Ábrajegyzék
1.ábra: saját készítésű, forrás:https://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_Immunologia/ch13.html (13.4.ábra)
2.ábra: saját készítésű, forrás: Türk-Mázló, A.; Rajnavölgyi, É. (2017): A CTLA-4 rendszer immunológiai és immunonkológiai szerepe: kétélű fegyver? Immunológiai Szemle/Immunology Quarterly 9: (1) 18-22 https://immunology.unideb.hu/sites/default/files/upload_documents/isz_2017_1_18_turk_mazlo.pdf (1.ábra)
3., 4., 5. ábra: saját készítésű, forrás: Buchbinder, E.I.; Desai, A. (2016): CTLA-4 and PD-1 Pathways. American Journal of Clinical Oncology 39: (1) 98-106. doi: 10.1097/coc.0000000000000239 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4892769/