|
Size: 26365
Comment:
|
Size: 26293
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 14: | Line 14: |
| . || {{attachment:rajzocska.png||width="600"}} ||<<BR>>||'''1. ábra:''' ''A profázis kialakulásáért felelős mechanizmusok'' ||<<BR>> ||'''1. ábra:''' ''A profázis kialakulásáér'' || |
. || {{attachment:rajzocska.png||width="600"}} ||<<BR>>||'''1. ábra:''' ''A profázis kialakulásáért felelős mechanizmusok'' |
| Line 19: | Line 18: |
| || || |
A migrén élettani háttere
Contents
Abstract
A migrén az egyik legelterjedtebb, fejfájással és egyéb kellemetlen tünetekkel járó betegség, amelyre legtöbbször az időjárás változások előtt panaszkodnak az emberek. Munkánkban különböző forrásokból összeszedve az információkat, mutatjuk be a rendellenesség átfogó kórképét és lehetséges patofiziológiai magyarázatait. Kitérünk a gyógyszeres és a táplálkozással összefüggő kezelésre, valamint egy állatorvosláshoz köthető, egyedi esettanulmányra, amely egy cocker spániel migrénes kezeléséről készült.
A migrén patofiziológiája
- A migrén lefolyása négy szakaszra bontható, melyben a tünetek eltérőek. Ez a négy periódus a profázis, a migrén aura, a fejfájás fázisa és az utófázis. A következő bekezdések a négy szakasz jellemző tüneteit és lehetséges élettani okait mutatják be.
Profázis
- Az előtünetek akár három nappal is megelőzhetik a következő fázist. A tünetek közé tartoznak a változások a hangulatban és az aktivitásban, ingerlékenység, kimerültség, fáradékonyság, bizonyos ételek megkívánása, ismétlődő ásítozás, nyakfájás és fokozott hangérzékenység. Ezek a tünetek nem kizárólag erre a szakaszra jellemzőek, hanem kitarthatnak a további szakaszokban is. Az előtünetek természetéből következik, hogy sok migrénbeteg meg tudja mondani, ha rohama lesz. Az okok a dura materhez vezethetők vissza, aminek nociceptív receptorai ingerlés hatására VIP anyagokat bocsátanak ki, mint a CGRP (calcitonin gene regulated peptid) és a substance P. Ez utóbbi szekrétum serkenti a mastocyta degranulációt, amely során histamin és prostaglandinok kerülnek a sejt környezetébe. Ezek az anyagok növelik az érfal permeabilitását és vasodilatatiot okoznak. A érfal ellazulását és a permeabilitás növekedését a VIP anyagok direkten is serkentik, valamint ingerlik az endothelt. Az endothel ennek hatására nitrogen-monoxidot bocsát ki, ami szintén vasodilatatiot kelt. Az előfázis tünetei nagymértékben hipotalamusz eredetűek, ezt a képalkotó eljárások eredményei is alátámasztják, amelyekkel növekedést mutattak ki a tünetek megléte alatt a hipotalamuszon átáramló vér mennyiségében, ami a vasodilatatio következménye. Ezek a folyamatok és a substance P, valamint a CGRP direkt jelenléte ingerli a n. trigeminus fájdalomérző receptorait, amelyek afferens pályái a trigeminus magba juttatják az információt. A magból a thalamusba, majd a cortexbe jut. A trigeminus ideg a fő érzőidege az arcnak, ebből következnek a főleg homlok és orr környékén jelentkező fájdalmak. A folyamatot sematikusan az 1. ábra illusztrálja.
- ||
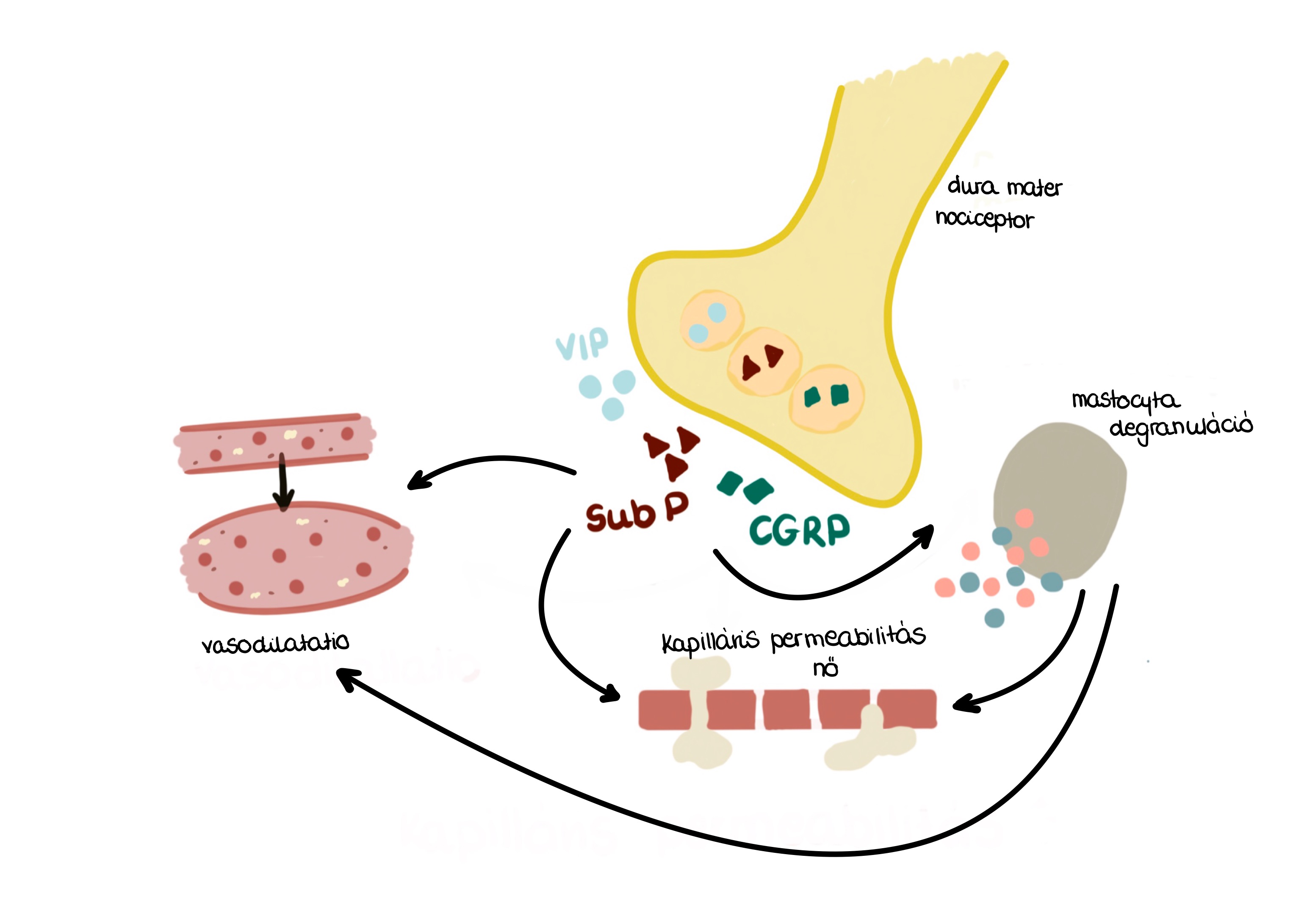 ||
||
||1. ábra: A profázis kialakulásáért felelős mechanizmusok
Migrén aura
- A migrénes rohamoknak lehet úgynevezett aurája, amikor a klasszikus fejfájás mellett egyéb tünetek jelentkeznek. A betegek körülbelül egyharmada számol be idegrendszer eredetű elégtelenségről a migrénes időszak alatt. A leggyakoribb tünetek a vizuális érzékelésben fordulnak elő, ilyen a felerősödött színérzékelés vagy foltok kiesése a látótérből, akár a kettő egyszerre. A szenzoros és a motoros működésben, illetve a beszédben is lehetnek kieső funkciók. Ezek a kapcsolt tünetek általában nincsenek elválasztva a fejfájás fázisától. Egyelőre ismeretlen okok miatt megnő a szervezet serotonin szintje, ezért a serotonin molekulák kapcsolódnak az 5-HT1 receptorokhoz, ezzel vasoconstrictiót váltanak ki, illetve egy depolarizációs hullámot indítanak meg. Ez a depolarizációs hullám felel a migrén aura tüneteiért. Érdekes módon a nem aurás migrénnél a serotonin szint alacsony marad, ezért vasodilatatio zajlik le és ingerlődnek a trigeminus ideg nociceptiv receptorai. A szintén gyakran előforduló émelygés és hányás egy másik anyaghoz, a dopaminhoz köthető. A hypothalamus ventromedialis magjai érzékelik a szervezet dopaminszintjét, amely fiziológiás körülmények között az evésre lecsökken, de a migrénes roham alatt végig alacsony. Ez váltja ki az emésztőrendszerhez kötődő panaszokat.
Fejfájás
- A migrénes rohamok legismertebb tünete a fejfájás, ami rendkívül sokféle lehet, ezt részletesen a 2. és 3. ábra mutatja be, amelyek az International Classification of Headache Disorders harmadik kiadása alapján készültek.
2. ábra: Az aurás migrén feltételei az ICHD-3 alapján.
3. ábra: Az aurával nem rendelkező migrén feltételei az ICHD-3 alapján.
Utófázis
- A lezáró szakasz tipikus tünetei a fáradtság, nehéz koncentráció, nyakfájdalom. Észrevehető, hogy ezek az előszakaszra is jellemzőek, azonban az még nem tisztázott, hogy ezek a fejfájás alatt is jelen vannak, vagy utána újra kialakulnak. Goadsby és mtsai, 2017.)
A migrén gyógyszeres kezelése
- Ebben a részben az akut migrén gyógyszeres kezeléséről, annak hatékonyságáról lesz szó. Sok lehetőség okán a pácinsek választhatnak általuk preferált gyógyszereket, hatékonyság, mellékhatások és anyagi vonzat alapján. Három kezelési mód javasolt a fejfájás súlyossága alapján. Az első vonalú terápiában az enyhébb fájdalmak csillapítására nem-szteroid gyulladáscsökkentőket használnak, míg súlyosabb esetben triptánnal történik a kezelés. Második vonalbeli terápiát ritkábban alkalmaznak a gyógyszer mellékhatása, ára és a függésre való hajlam miatt. A refrakter migrén kezelése a legdrasztikusabb.
Első vonalbeli terápiák
- Az enyhébb és közepesen súlyos migrén kezelésére alkalmazzák a nem szteroid gyulladáscsökkentőket (NSAIDek). Ide tartozik az aszpirin és az ibuprofen. Az aszpirin 1000mg-os dózisban hatásos de a gyomorirritáció kockázata itt a legnagyobb. Az ibuprofen placebo-kontroll vizsgálatából kiderült, hogy a teljes fájdalomcsillapításhoz ajánlott a gyógyszert ismételten szedni, ugyanis magas a felezési ideje. Acetaminophen, aszpirin és koffein kombinációja hatásosnak bizonyult az első vonalbeli terápiában, bár a NSAIDek a placebónál hatékonyabbak, inkább csak az elérhetőségük miatt alkalmazzák. Másik használatos gyógyszercsoport a triptánok, melyek hatékony kezelést eredményeznek az első vonalbeli terápiában. Ezek a farmakonok 5-hidroxi-triptamin antagonisták, így specifikus migrén ellenes szerek, és viszonylag kevés mellékhatást váltanak ki. Hatásmechanizmusuk ugyanaz, azonban alkalmazási módjuk eltérő, így személyre szabhatóak a tünetekre. A betegek érzékenysége genetikai okokból kifolyólag más lehet a különböző gyógyszerekre. A triptánok akkor a leghatékonyabbak, ha a roham kezdetekor alkalmazzák őket. A standard dózisok a betegek 42-76%-ánál két órán belül csökkentette a fejfájást, 18-50%-ánál pedig teljesen meg is szüntette. Nem feltétlen hatásosak minden betegnél, előfordulhat hogy az ismétlő kezelés sem enyhíti a tüneteket, azonban ha a fejfájás elmúlik és 24 órán belül kiújul, akkor valószínűleg sikeres volt a fájdalomcsillapítás. A triptán naproxennel való kombinálása csökkentheti a migrén kiújulásának valószínűségét. Mellékhatás lehet fáradtság, szédülés, mellkasi diszkomfort, aluszékonyság és hányinger, ezek beadási módonként változnak. A triptánok hatékonyak, bár a költségek miatt gyakran második vonalbeli szernek használják őket.
Másod vonalbeli terápiák
- Ezen farmakonok azért tartoznak a második vonalbeli szerek közé, mert káros mellékhatásuk lehet, az adagolásuk módja bonyodalmas (pl. parenterális) és költségesek. Az intranazalisan adott dihidroergotamin hatékonysága bizonyított, de alacsonyabb a receptorspecificitása mint a triptánoknak, ezért több mellékhatást vált ki. Ilyen jelentős tünet az émelygés, illetve érösszehúzó hatása miatt lábgörcsöt és zsibbadást okozhat. Terhes nőkben nem megengedett az alkalmazása. Hányás csillapításra dopamin antagonistákat alkalmaznak, gyakran parenterálisan, ezek azonban ritkán extrapiramidális mellékhatásokat okozhatnak.
Refrakter migrén kezelése
- A parenterálisan alkalmazott szerek közé tartozik a dihidroergotamin (DHE45), azonban triptán beadása utána 24 órát várni kell az érszűkítő szerek használatával. Ennek okán érdemesebb az első vonalú terápiában előnyben részesíteni a nem-szetorid gyulladáscsökkentőket és hányáscsillapítókat. Használnak emellett magnézium-szulfátot intavénásan (1-2g), ami az auraval rendelkező migrén kezelésében hatékony, illetve szintén intravénásan valportátot, de ennek a hatásosságáról szóló kutatások ellentmondásosak. A fejfájás kiújulása ellen parenterális kortikoszteroidok alkalmazhatók. Ebben a kezelési szakaszban opioidok is számításba jöhetnek, de óvatosan és ritkán szabad alkalmazni, mivel könnyen függőséghez vezetnek. Gyermekekben a gyógyszeres kezelések kevésbé bizonyultak hatékonynak, nem különül el szignifikánsan a placebora adott választól. Az elsővonalú szerek közül az ibuprofen tűnt a legmegbízhatóbbank, triptánok közül almotriptan és rizatriptan engedélyezett az Egyesült Államokban. Sumatriptan kiskorúaknak nem forgalmazható, bár az bizonyult a leghatékonyabbnak. Koszorúér betegeknél a triptánok és érszűkítők ellenjavaltak, ez esetben acetaminofen, aszpirin és koffein kombinációja a leghatásosabb kezelési mód. (2. Mayans és mstai, 2018)
Tévhitek és igazságok a migrénnel kapcsolatban
4. ábra. (Papetti és mtsai, 2021.)
A táplálkozás és a migrén kapcsolata
- A kifejezés: „bél-agy tengely” egy kétirányú kapcsolatot jelez a tápcsatorna és a központi idegrendszer között, kutatások bizonyították, hogy a migrén kapcsolatban van a gasztrointesztinális rendszer betegségeivel mint a Helicobacter pylori fertőzés , irritábilis bél szindróma, cöliáka. Ámbár a kapcsolat összes faktora még nem tisztázott, a felmérések kimutatták, hogy valószínűleg köze van bizonyos gyulladás keltő anyagokhoz (mint a IL-1β, IL-6, IL-8, and TNF-α), a mikrobiális rendszerhez, neuropeptidekhez, a serotonin jelpályához, stress hormonokhoz és tápnyagokhoz. Neuropeptidek, mint a CGRP, SP, VIP, NPY, hatással vannak a mikrobiára, elpusztítanak több bélbaktériumot is, és valószínűleg fontos szerepet foglalnak a bél-agy tengely kialakításában. A következő ábra (4. ábra) a bél-agy tengelyt hivatott vázlatosan ábrázolni.
5. ábra: A bél-agy tengely vázlatos ábrázolása. A kép forrása: https://en.wikipedia.org/wiki/Gut%E2%80%93brain_axis
Helycobacter pylori fertőzés
- Jelenlegi tudásunk szerint olyan betegekben akik helicobacter pylori fertőzöttek, és a mikrobiomjuk jelentős része elpusztult, a migrén jóval erősebben jelentkezik. A helicobacter pylorival fertőzött emberek 45%-a küzd migrénnel, míg az egészséges kontroll csoport 33%-ot mutatott. Bizonyítékok támasztják alá, hogy a helicobacter pylori eradikációja összefüggésbe hozható a migrénes tünetek enyhítésével. Továbbá egy randomizált, kontroll vizsgálatban hasonlították össze a helicobakter pylori eradikációs kezelésének hatásait a placebóval olya migrénes betegeknél, akik kezelésben részesültek. Beszámoltak arról, hogy a vizsgálat végén a helicobakter pylori kiirtásos kezelésében részesült betegek migrénnel összefüggő tüneteik alacsonyabbak voltak , mint a placebo csoportban. A helicobakter pylori fertőzés egy tartós krónikus gyulladás, ami miatt a szervezetben megjelennek és fokozottan termelődnek a gyulladásos mediátorok és vazoaktív vegyületek. Az indukált immun-, gyulladásos- és vaszkuláris válaszok, valamint az ezeket követő immunsejtek, gyulladásos és vazoaktív ágensek felszabadulása a gyomor nyálkahártyájában végül az agyi fájdalomra érzékeny struktúrák túlérzékenységéhez vezethet, továbbá a szerotonin, az SP és a VIP neuroendokrin felszabadulása a baktérium által okozott gyulladásos állapot miatt megváltozik. Azt mutatták ki, hogy a CGRP szintje megemelkedett a Helicobakter pylori által kiváltott nyombélfekélyben az egészséges egyénekhez képest, ezenkívül magasabb IL-10 plazmaszintet figyeltek meg migrénes rohamok során. Egyes tanulmányok is alátámasztják, miszerint a helicobakter pilory-fertőzés IL-12 és IL-10 emelkedett szintjével jár. Az eddig ismert minden adat azt mutatja, hogy a két kórkép kapcsolatban áll egymással, ámbár ez még kutatások tárgyát képezi, a kellő bizonyítékok hiányában.
Irritábilis bél szindróma
- A migrénben szenvedők, akiknek kórtörténetében szerepel a hosszú, magas frekvenciájú fejfás, gyakrabban alakul ki az irritábilis bél szindróma. Ez a két betegség osztozik a tulajdonságokon, amik át tudják formálni a mikroflórát, ezzel hatnak a bél-agy tengelyre és a gyulladás mértékére. Az irritábilis bél szindróma Crohn-betegségből és fekélyes vastagbélgyulladásból áll. Egy eset-kontroll vizsgálat kimutatta, hogy a fejfájás gyakorisága magasabb volt az IBSZ-ban szenvedő egyénekben, mint a kontrollcsoportban, 7% helyett 46%. Egy brazil kutatás szerint a migrén prevalenciája kétszerese volt az IBSZ-ás egyénekben az általános populációhoz képest. A pontos mechanizmus nem tisztázott, de az IBSZ álltal generált autoimmun-gyulladásos válaszok, felszívódási zavar, endotheliális diszfunkció, valamint a rendellenességre felírt immunszuppresszív kezelések szerepet játszhatnak az IBD és a migrén közötti összefüggés hátterében álló patofiziológiában.
Cöliáka
- A cöliáka egy gluténpeptid okozta, a genetikailag fogékony egyénekben előfordul betegség. Számos neurológiai megnyilvánulást figyeltek meg a cöliákával kapcsolatban, mint például epilepszia, ataxia, cerebelláris ataxia, hangulati zavarok, encephalitis, perifériás neuropátia, neuromuszkuláris rendellenességek, demencia, tanulási zavarok, és migrén. Tanulmányok kimutatták, hogy a cöliákás betegeknél nagyobb a migrén prevalenciája, mint az egészséges kontrolloknál, betegek körülbelül 21-28%-ának van migrénje, sőt a migrén kezdeti kórjelző lehet . A két kórkép összefüggése számos párhuzamos mechanizmusra vezethető vissza, ideértve a glutén által indukált proinflammatorikus citokinek hatását, Ezekről úgy gondolják, hogy növelik a CGRP-szintet, ami felszívódási zavar miatt kialakuló vitamin- és makroelemek hiányát, az értónus zavarait, az idegrendszer túlérzékenységét idézi elő. Vannak olyan tanulmányok, amelyek arra utalnak, hogy a gluténmentes diéta bevezetése hatékony lehet a migrén gyakoriságának csökkentésében is.
Direkt és indirekt összefüggések
- A táplálkozási tényezők befolyásolhatják azokat a mechanizmusokat, amelyeken keresztül a mikrobiom kezeli a bél egészségét és az immunrendszer működését. A rövid láncú zsírsavak neuroprotektív tulajdonságokkal rendelkeznek. Például a butirát sója, a nátrium-butirát serkenti a sejtproliferációt és differenciálódást. A butirát gyulladáscsökkentő hatást is mutat az agyban azáltal, hogy elnyomja a TNF-α szintézisét. A gyors és szélsőséges étrendi változások közvetlenül érintik a bél mikrobáit, mivel befolyásolják a bélmikrobiom béta-diverzitását, azaz a fajok forgalmát. A gyulladást okozó citokinek, mint például a TNF-α, IL-1β és IL-6 befolyásolhatják a trigeminális útvonal nociceptív válaszait, és szerepet játszhatnak a migrénes fájdalom kiváltásában, ez azért kritikus nekünk mert a bélpermeábilitás és a gyulladási állapot szorosan összefügg.
Neuropeptidek szerepe
- A glutamát, mint serkentő neurotranszmitter, különböző hatásokon keresztül szerepet játszik a migrén patofiziológiájában, a migrénes betegek plazmájában megemelkedett glutamátszintről számoltak be a kontroll alanyokhoz képest. Ennek a neurotranszmitternek a bél-agy tengelyben való szerepét tanulmányozták. A glutamát befolyásolhatja a gyulladást és az oxidatív stresszt a gastrointestinális apparátusban, ami már az említetteknek megfelelően gyulladásos faktorokon keresztül kapcsolatban lehet a migrénnel. A kolecisztokinint (CCK) enteroendokrin sejtek szintetizálják a vékonybél nyálkahártyájában, az emlősök agyában (thalamus, PAG), a gerincvelőben. A CCK gátolja a gyomor kiürülését és a savszekréciót, serkenti az epehólyag összehúzódását és a hasnyálmirigy szekrécióját, valamint a CCK1 receptoron keresztül jóllakottság érzést vált ki az agyban. Ez a receptor működése a vagus afferens terminálisokon tovább erősíti az endokrin és parakrin együttműködés hipotézisét. Interakciója dopaminnal, szerotoninnal, glutamáttal, hipotalamusz hormonokkal és neuropeptidekkel megmagyarázza a CCK specifikus szerepét a viselkedésben, a hangulatban és az extrapiramidális működésben, A CGRP-hez hasonlóan a CCK-t is a PAG állítja elő és mint ahogy már említettük, a migrén egyik fő markere, a CGRP, ami gátolja a gyomorsavszekréciót, és elnyomhatja a táplálékfelvételt. (4. Arzani és mtsai, 2020)
Zsírok szerepe
- Tanulmányok alapján az alacsony zsírtartalmú diéták hatását vizsgálták a migrén megelőzésére. Az étrendi zsírbevitel csökkentése három hónapig csökkentette a fejfájás intenzitását, gyakoriságát és a gyógyszerfogyasztást. Egy kutatásban krónikus migrénben szenvedő felnőtteket véletlenszerűen választottak ki, aszerint, hogy magas omega-3 és alacsony omega-6 tartalmú vagy csak alacsony omega-6-ot tartalmazó étrendre álltak át. A magas omega-3 és alacsony omega-6 diétát követő egyének fejfájása nagyobb mértékben javult, mint a csak alacsony omega-6-tartalmú diétát követő migréneseknél. A kísérlet konklúziója hogy a két eikozanoid útvonal, az omega-6 és az omega-3 közötti egyensúly hozzájárul a gyulladás szabályozásához, az omega-6 zsírsavak elősegítik az értágulatot míg a magas zsírtartalmú étrend hiperkoagulabilitást vált ki.
Vitaminok szerepe
- Számos tanulmány értekezik arról, hogy a vér D-vitamin szintje összefüggésbe hozható a migrénnel/fejfájással. Felvetették, hogy ennek a vitaminnak a hiánya magasabb lehet a migrénben szenvedő betegeknél, mint a fejfájástól mentes emberekben. A D-vitamin-pótlás kedvező hatásairól is beszámoltak a migrénes rohamok intenzitására és gyakoriságára.
Diéták
- Egy klinikai vizsgálatban 350 migrénes beteget soroltak be az alacsony glikémiás indexű diéta csoportba vagy a profilaktikus gyógyszerek csoportjába 1:1 arányban. Egy hónappal az étrendi korlátozások után a rohamok gyakorisága jelentősen csökkent mind a diétás, mind a gyógyszeres csoportban. A rohamok súlyossága mind a 30., mind a 90. napon csökkent a gyógyszeres csoportban, de csak a 90. napon a diétás csoportban. Kimutatták, hogy az elhízás csökkenti a bél permeabilitását és befolyásolhatja a bél mikrobiom összetételét. Az elhízás növelheti az epizodikus és krónikus migrén kockázatát, Feltételezték, hogy az elhízás és a fejfájás közötti kapcsolat közös patofiziológiai jellemzőknek tulajdonítható. Kutatások azt mutatják, hogy a CGRP plazmaszintje emelkedett elhízott felnőtteknél, ami migrénes betegeknél is kimutatható. A migrénre vonatkozó speciális diéták kialakításánál, figyelembe kell venni a speciális eseteket és a migrén típusát is. Álltalánosságban a ketogén, magas folsavtartalmú, alacsony zsírtartalmú, módosított Atkins-diéták, valamint a magas omega-3/alacsony omega-6-tartalmú diéták jótékony hatást mutattak, lényegük, hogy elősegítsék a neuroprotekciót, javítsák a mitokondriális működést, kompenzálják a szerotoninerg diszfunkciót, csökkentsék a CGRP-szintet és elnyomják az ideggyulladást. Az alacsony glikémiás étrendet is javasolják, mert ez a diéta a gyulladásos állapot csökkentésére való. Kimutatták, hogy a nátriumszint magasabb a migrénes betegek liquor-jában, mint a kontrolloknál, különösen fejfájás esetén. Az alacsony nátrium tartalmú étrend viszont több tényezőtől is függ, amelyeket ki kell értékelni, mielőtt jótékony hatásúnak tekintenék a migrén kezelésére. Míg az étrendről bebizonyosodott, hogy védelmet nyújt az idősek számára, a fiatal női populációban, akiknek nincs magas vérnyomása és alacsony a BMI-jük, a magas nátriumtartalmú étrend a pozitív hatású, így ezt a diétát javasolt a betegcsoporthoz igazítani. (5. Gazerani, 2020.)
Létezik-e migrén kutyákban?
- A migrén állatokban nem diagnosztizált betegség, bár emberi vonatkoztatások miatt készítettek már állati modelleket is a migrén tanulmányozására, gyógyszerek fejlesztésére. Ámbár kutyában is volt ilyen kísérlet, arra a kérdésre, hogy kutyában van e migrén, nem vagyunk biztosak. A következő esettanulmányban a vizsgált kutya az emberi migrén minden kritériumának eleget tett. Egy ivartalanított nőstény cocker spánielben 6 hónapos kora óta figyeltek meg rohamokat, melyek félelemmel, vonyítással jártak. A megfigyelt rohamok a következőképpen zajlottak le ennél a kutyánál: 2 órával a roham kezdete elött a kutya a félelem jeleit mutatta, elcsendesedett sokszor a bútor alá bújt, került mindenféle kontaktust. Bizonyos idő elteltével nyüszíteni kezdett, nem ivott, nem evett, még ha felkínálták neki akkor sem, ez kezdetben 2-4 óráig is eltarthatott majd rosszabbodni kezdett, volt alkalom mikor 3 napig is eltartott. Alkalmanként a hányinger jelei is mutatkoztak rajta úgy, mint hiperventilláció, gyakori nyelés, illetve volt rá precedens hogy hányt is a kutya. A roham elmúlta után 1-2 napig még bágyadt volt, majd vissza tért eredeti aktivitásaihoz. Eleinte évente 1-2 alkalommal jelentkeztek ezek a rohamok majd addig fajult az állapota hogy havonta 1-2-szer is előjöttek. Sem orvosok, sem a tulajdonos nem tudtak különösebb kiváltó okról beszámolni, bármikor jelentkezhettek a tünetek. Állatorvosok vizsgálták már a roham lefolyása alatt is, de nem tudták megállapítani a gócpontját a fájdalomnak, hiába kezelték többféleképpen is, az alkalmazott anyagok (opiátok, diazepám, aceprozamin és nem szteroidos gyulladás csökkentők) nem hatottak a rohamokra és laboreredmények kifejezetten jók voltak. Etológusok is vizsgálták, fizikai és mentális állapota egészségesnek bizonyult. Az MRI és a gerincvelő folyadék analízisek mind normálisnak bizonyultak, számos vizsgálat és kezelés mind hatástalannak bizonyult. Mikor migrénre kezdték kezelni szignifikáns változást észleltek, bár a kutyának ugyanúgy voltak rohamai, időtartamuk lerövidült, intenzitásuk drasztikusan lecsökkent. A tünetei, mint a fényérzékenység, vonyítás, a fej lógatása, étvágytalanság, letargia, megszűntek. A gazda arról is beszámolt, hogy ha már a tünetek közben adagolták neki a gyógyszert, bár nem múlt el a fájdalom, de mérséklődött körülbelül 30 percre a kezelés után. 18 hónap elteltével a kutya életszínvonala szignifikánsan javult, a havi 1-2 roham egy rohamra csökkent 2-3 havonta, a tulajdonos pedig határozottan kijelentette hogy a kutyája életszínvonala annyival emelkedett hogy teljesen elvetette az eutanázia gondolatát amit az előzőekben már megfontolásra vett. Bár az állatorvosi hivatásban még a migrént nem diagnosztizálják, ez az eset annyira hasonlított rá, hogy a jövőben figyelemmel kell lenni az ilyen esetekre is. (6. Pleassas és mtsai, 2013.)
Konklúzió
Az eddig leírtakat összevetve elmondhatjuk, hogy a migrén egy bonyolult lefolyású, idegrendszeri rendellenességeken alapuló betegség, amelynek rendkívül sok köze lehet a beteg életmódjához, különös tekintettel a táplálkozásra. Többféle kezelése is ismert, de mivel továbbra sem ismerjük a betegség teljes kórélettani folyamatait, ezért a leghatékonyabb gyógymódok kifejlesztése még várat magára. Az állatorvosi gyakorlatban eddig nem sok szó esett migrénes esetekről, azonban láthatjuk, hogy a jövőben ez is jelentőséggel bírhat és nem szabad kihagyni a felmerülő diagnózisok közül.
Irodalomjegyzék
- P. J. Goadsby, P. R. Holland, M. Martins-Oliveira, J. Hoffmann, C. Schankin, S. Akerman (2017.): Pathophysiology of Migraine: A Disorder of Sensory Processing. American Physiological Society
- . L. Mayans, A. Walling (2018.): Acute Migraine Headache: Treatment Strategies. American Family Physician 97: (4) 243-251
L. Pepetti, R. Moavero, M. A. N. Ferilli, G. Sforza, S. Tarantino, F. Ursitti, C. Ruscitto, F. Vigevano, M. Valeriani (2021.): Truths and Myths in Pediatric Migraine and Nutrition. PubMed Central
- M. Arzani, S. R. Jahromi, Z. Ghorbani, F. Vahabizad, P. Martelletti, A. Ghaemi, S. Sacco, M. Togha (2020.): Gut-brain Axis and migraine headache: a comprehensive review. The Journal of Headache and Pain 21: (15)
P. Gazerani (2020.): Migraine and Diet. Pub.Med. 6. N. Plessas, H. A. Volk, P. J. Kenny (2013): Migraine-like episodic pain behavior in a dog: can dogs suffer from migraines? PubMed.
