|
Size: 26399
Comment:
|
← Revision 109 as of 2016-04-26 07:18:01 ⇥
Size: 26421
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 79: | Line 79: |
| Feltételezik, hogy a depresszió kialakulásának egyik oka a noradrenalin csökkent jelenléte, tehát bizonyos szimpatikus jelek alacsony aktivitása. Egyes vizsgálatok a serotoninerg- és dopaminerg-rendszer normál működésének felborulását is bizonyították. ^2 ^(Mistrova, E. és msai, 2015) | Feltételezik, hogy a depresszió kialakulásának egyik oka a noradrenalin csökkent jelenléte, tehát bizonyos szimpatikus jelek alacsony aktivitása. Egyes vizsgálatok a serotoninerg- és dopaminerg-rendszer normál működésének felborulását is bizonyították.^7^ (V. Maletic és msai, 2007)<<BR>> |
A neurokinin receptorok jelátviteli rendszere
Contents
1. Abstract
Cikkünkben először a neurokinin nevű peptideket, és receptoraikat jellemezzük. A neurokininek közül a substance P-re fektetjük a hangsúlyt, amely a legrégebb óta ismert, és legjobban kutatott neurokinin. Megemlítjük a substance P szintézisét, előfordulását a szervezetben, és általános hatásait. Ezután röviden jellemezzük a neurokinin-1 receptort, majd kitérünk a G-protein kapcsolt jelátvitelre.
Később szót ejtünk a neurokininek szerepéről a függőségek csillapításában, és antidepresszánsként való felhasználásukról. Végül a fájdalomérzékelésben, és az erre adott válaszokban való részvételük kerül szóba. Ennek keretében írunk egy patkányokon végzett kísérletről, amely a nocicepciót vizsgálta.
2. Neurokininek és neurokinin receptorok
A neurokininek vagy tachykininek a legnagyobb peptid-családnak számítanak. Több mint negyven típusát izolálták az alacsonyabb rendű gerincesektől az emlősökig. Emlősökben azonban csupán a substance P, a neurokinin A és a neurokinin B található meg. Ezen neuropeptidek más-más hatással bírnak, és különböző receptorokra hatnak. A neurokininek perifériás érzőidegekből felszabadulva neurogén gyulladási folyamatokért felelnek. Emellett expresszálódnak a központi idegrendszerben is, és szerepet játszanak a fájdalomtranszmisszióban és -érzékelésben, valamint felelősek bizonyos autonóm reflexek és viselkedési formák kialakulásáért.2 (Mistrova, E. és msai, 2015)
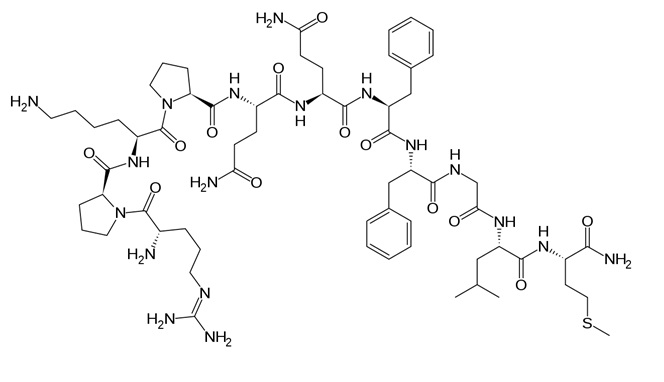
A legjelentősebb – és egyben legrégebb óta ismert – tachykinin a substance P, amelyet először tehén hypothalamusból izoláltak a hetvenes években, és sokáig az egyetlen emlős tachykininnek hitték.2 (Mistrova, E. és msai, 2015)
|
A substance P-t a TAC-1 gén kódolja, amely magában foglalja a neurokinin A szekvenciáját is. Ezzel szemben a TAC-3 gén csak a neurokinin B-t kódolja. A TAC-1 transzkripciója során egy pre-messenger ribonukleotid képződik, amely az alternatív splicing során α, β, γ és δ izomerekké alakulhat. A substance P ezek közül az összesből képződhet, míg a neurokinin A csak a β-ból és a γ-ból. Ebből következik, hogy a substance P önmagában is szintetizálódik, míg a neurokinin A csak substance P-vel együtt. Mindkettő folyamatosan termelődik, raktározódik és közösen ürítődik. A szintézis után a substance P vezikulákba kerül, és a centrális valamint a perifériás elsődleges érző neuronokhoz szállítódik, ahol felhasználódik. (A centrális idegrendszer idegsejtjeiben egyébként négyszer kevesebb található, mint a perifériásban.) 2 (Mistrova, E. és msai, 2015)
Bár ismert, hogy a substance P a központi és a perifériás idegrendszerben található, pontosabb elhelyeződése erősen kutatott terület. Kísérleti patkányokon immunhisztokémiai módszerekkel mutathatunk ki tachykinineket. Azonban mivel a tachykininnek csak a C-terminális végére specifikus antiszérumot használunk, a különböző tachykininek elkülönítése nem lehetséges. Ezen kísérletek bizonyították azonban, hogy a substance P együtt szintetizálódik, egy helyen lokalizálódik, és együtt szekretálódik az neurokinin A-val.2 (Mistrova, E. és msai, 2015)
A substance P-nek már rengeteg hatását felfedezték. Részt vesz az idegszövet fejlődésében és növekedésében, a sebgyógyulásban, a memória javításában, a keringés és a légzés mechanizmusának szabályozásában, illetve hatással van a nyálmirigyek szekréciójára és a gyulladásra. Ezeken felül befolyásol több egyéb folyamatot is a központi idegrendszerben, úgy mint érzelmi viselkedés, stressz, idegesség és depresszió.2 (Mistrova, E. és msai, 2015)
Fontos megemlíteni továbbá, hogy a tachykinin receptorok képesek más neurotranszmitterek funkciójának regulálására is (például serotonin és dopamin).
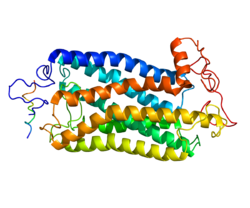
A neurokininek biológiai hatásait a neurokinin- vagy tachykinin-receptorok közvetítik.Ezen receptorok egyaránt megtalálhatók a központi és a perifériás idegrendszer ideg- és gliasejtjeiben. A tachykinin-receptorok eltérő affinitással kötik a különböző tachykinineket. A neurokinin-1 receptor legjobban a substance P-t köti, a neurokinin-2 a neurokinin A-t, a neurokinin-3 pedig a neurokinin B-t.2 (Mistrova, E. és msai, 2015)
|
A neurokinin receptorok hét hidrofób transzmembrán szegmensből illetve extra- és intracelluláris hurkokból álló, G-protein kapcsolt receptorok. Három hurok extracellulárisan három pedig citoplazmatikusan található. A kettes és hármas transzmembrán fehérje az agonisták és antagonisták megkötéséért felel, a hármas ezen kívül a G-proteint is kapcsolja.2 (Mistrova, E. és msai, 2015)
A neurokinin-1 receptor nagyon hasonló emberben, egérben, patkányban és tengerimalacban. Patkányban és emberben például 90%-os egyezést mutattak ki. Ez hasznos lehet különböző fájdalomcsillapítók és antipszichotikumok, antidepresszánsok tesztelésénél.2 (Mistrova, E. és msai, 2015)
3. A G-protein kapcsolt jelátvitel
A G-protein kapcsolt receptoroknak rengeteg típusa ismert. Ezek mind extracellulárisan, membránba ágyazódva helyezkednek el. Az EC jelzőmolekula kötődése után ezen receptorok IC jelátviteli utakat aktiválnak.3 (Dogra, S. és msai,2015)
A többi G-protein kapcsolt receptorhoz hasonlóan a neurokinin-receptorok ligand-kötésének következménye a receptor konformáció-változása. Ennek következménye az IC G-protein receptorhoz való kapcsolódása.3 (Dogra, S. és msai,2015)
A G-protein aktiválódik, alfa-alegysége GTP-t köt. A leváló alfaalegység hathat környező ioncsatornákra illetve enzimekre. Ez vezethet stimuláláshoz vagy lehet inhibitorikus hatású. A G-protein kapcsolt receptorok az adenil-cikláz enzim befolyásolásával hatnak az IC cAMPszintre, ezzel pedig közvetetten befolyásolják a protein-kináz A aktivizációját. Aktiválhatnak foszfolipáz A2-t, amely a membrán-foszfolipidek arachidonsavvá való hasításáért felelős. Ebből aztán különböző gyulladás-mediátorok képződnek. A G-protein befolyásolhatja továbbá a foszfolipáz C aktivitását is, amely PIP2-ből képez IP3 secunder messengert és diacil-glicerint (DAG). Az IP3 az IC kalcium-raktárakat mobilizálja, a DAG pedig protein-kináz C-t aktivál. A neurokinin-receptorok azonban egyéb enzimek aktiválásában is nagy jelentőségűek (például a későbbiekben említett protein-kináz B és a signal-regulated kinase (ERK 1 és 2) aktiválásáért). 3 (Dogra, S. és msai,2015)
A neurokinin-1 receptor által kódolt intracelluláris jelátviteli út rendszer- és sejtspecifikus. A microgliákban és astrocytákban például a substance P kötődése a receptorhoz aktiválja a foszfolipáz-C-t. Ennek hatására ideiglenesen megemelkedik a sejt IP3- és DAG-koncentrációja. Ezzel ellentétben, az erek simaizmában a neurokinin-1 receptor stimulus hatásra aktiválja az adenilciklázt, ezáltal csökkenti az intracelluláris kalcium koncentrációt, ami a simaizmok elernyedéséhez és az ér tágulásához vezet. Az endothel sejtekben a neurokinin-1 receptor ingerlése a miozin foszforilációjához vezet, ami segíti az aktin és miozin kapcsolódását, valamint a sejt összehúzódását az intercelluláris rés alakjának változásához vezetve. Ennek eredményeképp a plazma fehérjék átfolynak az ér lumenéből az interstitialis térbe (ennek szerepe van a neurokininek már említett gyulladás-keltő hatása során).2 (Mistrova, E. és msai, 2015)
A receptor-signaling végét feltételezhetően az jelenti, ha a receptor-ligand komplex internalizálódik, és megtörténik az enzimatikus bontás.
Több tanulmány témája volt a G-protein kapcsolt jelátvitel hatása a mentális egészségre. Egy 2016-os indiai kutatás a G-protein kapcsolt receptorok epigenetikus szabályozásának pszichés betegségekre való hatását kereste. Az epigenetikus módosulásoknak eddig három, az élő szervezetben előforduló, és fenntartható típusát fedezték fel: a DNS-metilációt, a hiszton-fehérjék szerkezetváltozásait (metiláció, acetiláció, foszforiláció) és a nem-kódoló RNS-hez kapcsolt gének kikapcsolását. Ezen módosítások jelenleg is intenzív kutatás célját képezik. Egy 2013-as kutatás például bebizonyította a G-protein kapcsolt receptorok epigenetikus szabályozásának hatását az egészséges idegi fejlődésre és agyi működésre. Bebizonyosodott emellett az a tény is, hogy kapcsolat van ezen mechanizmusok és központi idegrendszeri illetve pszichiátriai rendellenességek - többek között a klinikai depresszió különböző formái, a skizofrénia, a PTSD, és különböző függőségek - között.3 (Dogra, S. és msai,2015)
A neurokinin-1 receptor működésének intenzitására epigenetikus módosítások mellett egyéb faktorok is hatással vannak.
Bizonyított, hogy a neurokinin-1 receptornak két formája van, amelyek csak hosszúságukban különböznek. Köszönhetően az alternatív splicingnak az neurokinin-1 receptor gén kódolhat egy 407 aminosavból álló receptort és egy 311 aminosavból állót. A rövidebb kisebb affinitással köti a substance P-t mint teljes hosszúságú társa, és egyéb biológiai hatásokban is különbözik. A működés intenzitásának szabályozásában fontos szerepe van az amino-terminális végen található két glikozilált N-végnek. A glikozilált forma a stabilizációban segít. A nem glikozilált akár 50%-al alacsonyabb affinitást mutat a substance P-re. Mindemellett a neurokinin-1 receptor autoreceptorként is működik, és a saját ürítését szabályozza.2 (Mistrova, E. és msai, 2015)
4. A neurokininek szerepe a függőségben
A függő erős késztetést érez arra, hogy rendszeresen magához vegye függősége tárgyát (drog, alkohol) vagy megtegyen valamit (szerencsejáték, internetfüggőség), akkor is ha tudja, hogy káros. A függőség kialakulásának számos oka van. Egyrészt a genetikai hajlam örökölhető, másrészt nagy szerepük van a különböző környezeti hatásoknak.3 (Dogra, S. és msai,2015)
A drogok többféle neurotranszmitter-útvonalat módosíthatnak, de a leggyakoribbak a dopaminerg-, az opioiderg- és a noradrenerg-rendszerre gyakorolt hatások. A dopaminerg-rendszer és a kokain által kiváltott mechanizmusok szabályozásában vesz részt a neurokinin-1-substance P jelrendszer. Kutatások bizonyították, hogy neurokinin-1-antagonisták csökkentik a kokain utáni vágyat, a heroinfogyasztást, és az alkoholivást. 3 (Dogra, S. és msai,2015)
Jutalommal asszociált agyterületek (például a limbikus rendszer) jelentős mennyiségben tartalmaz neurokinin-1 receptorokat. Egyes kutatások azt bizonyították, hogy a substance P serkentő hatással van a viselkedésre (például patkányokban az önjutalmazásra). 5 (Laura E. Kwako és msai, 2014)
Ugyanakkor a neurokinin-1 receptor működési zavarai kellemes érzetet keltő drogok felvételének emelkedett igényét okozzák. Egereken végzett kísérletekben a neurokinin-1 receptor antagonisták csökkentették az akaratlagos alkohol-felvételt. Patkányokban ezen antagonisták csökkentették a stresszhatást követő alkohol-igényt.5 (Laura E. Kwako és msai, 2014)
Egy 2008-as, nemrég leszokott alkohol-függőkön végzett kísérlet során a neurokinin-1 receptor antagonistái csökkentették az alkohol iránti sóvárgást, és növelték a jóllét érzetét.5 (Laura E. Kwako és msai, 2014)
5. A neurokininek pszichológiai hatásai
Stresszel kapcsolatos rendellenességekben szenvedő embereket vizsgálva kiderült, hogy ezen személyek tachykininjei serkentett átvitelt mutatnak. Éppen ezért különböző tachykininantagonisták alkalmasak lehetnek antidepresszánsként vagy antipszichotikumokként. 3 (Dogra, S. és msai,2015)
Megfigyelték, hogy gyakoribbá váltak a szorongásos viselkedések substance P intracerebroventricularis adása után egerekben és patkányokban is. 6 (A.J. Porter, 2015)
A depresszió egy tartósan fennálló hangulatzavar, mely során a beteg levertnek, rosszkedvűnek, fáradtnak, üresnek érzi magát. Lelki tünetei az intenzív szomorúság, csalódottság érzése, a beteg úgy érzi kihasználják, elveszti érdeklődését a külvilág iránt. Negatívan gondol magára, alacsonyabb rendűnek, visszataszítónak találja magát. Gyakran megfigyelhető a motiváció hiánya, lelassulás, elfelejtenek dolgokat. Pszichiátriai tünetek mellett okozhat fizikai bántalmakat is (például étvágytalanság, álmatlanság, cselekvési képtelenség, fejfájás, szédülés).
Feltételezik, hogy a depresszió kialakulásának egyik oka a noradrenalin csökkent jelenléte, tehát bizonyos szimpatikus jelek alacsony aktivitása. Egyes vizsgálatok a serotoninerg- és dopaminerg-rendszer normál működésének felborulását is bizonyították.7 (V. Maletic és msai, 2007)
Súlyos depresszióban szenvedő betegeknél egyébként két kutatás során is emelkedett substance P szintet figyeltek meg.6 (A.J. Porter, 2015)
Preklinikai tesztek során felismerték, hogy a neurokinin-1 receptor antagonisták hatása hasonlít egyes antidepresszánsokéhoz. Ezen antagonistákkal végzett kezelés csökkentette az immobilitást mind patkányokban, mind egerekben, medencékben végzett tesztek alatt (forced swim test) valamint futóegerekben olyan tesztek alatt, melyben farkuknál fogva akasztják fel őket (tail suspension test).6 (A.J. Porter, 2015)
Vizsgálták a neurokininek hatását az ADHD-ra is. Az ADHD (Attention Deficit Hyperactivity Disorder, azaz figyelemhiányos hiperaktivitás-zavar) a lakosság 8-12%-át érintő pszichiátriai betegség. Ahogy neve is mutatja, tünetei a hiperaktivitás, figyelemzavar, feledékenység és a gyenge impulzuskontroll. A betegeken megfigyeltek bizonyos agyi területek közötti kommunikációs zavart, illetve egyes agyterületek csökkent aktivitását. Vizsgálatok kimutatták a dopaminerg-rendszer (melynek szerepe van a motivációban és a jutalom-érzésben), illetve a serotoninerg-rendszer (amelynek szerepe van az eufória és a kényelem érzésében) alacsony aktivitását. Ezek mellett megfigyelték a noradrenalin csökkent szintjét is, amely koncentráció-zavart és figyelemhiányt okoz.6 (A.J. Porter, 2015)
Knock-out egereken figyelték meg, hogy a neurokinin-1 receptor hiánya az ADHD-val azonos tüneteket okoz, és rontja a dopaminerg-, serotoninerg- és noradralinerg-rendszer jelátvitelét. Így feltételezhető, hogy a neurokinin-receptorok szabályozzák – vagy legalábbis módosítják – az említett jelátviteli utakat. Ezért okozhat hiányos működésük figyelemzavarokat, motivációhiányt (ami egyébként a depresszióra is jellemző tünet).6 (A.J. Porter, 2015)
6. A neurokininek szerepe a fájdalomérzékelésben
A tachykininek azonban nem csak a mentális betegségekre, hanem a fizikai fájdalomra is hatással vannak.
A legújabb definíció szerint, melyet az IASP (International Association for the Study of Pain) fogalmazott meg 1979-ben; a fájdalom „olyan kellemetlen szenzoros és emocionális élmény, amelyet a szövetek aktuális vagy potenciális károsodása okoz”.
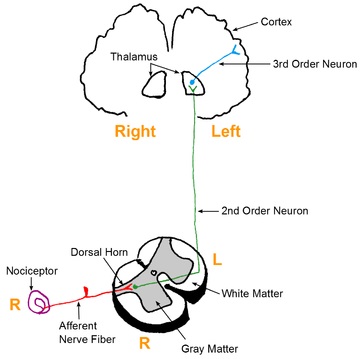
Normál esetben egy ártalmas inger perifériás nociceptív (fájdalomérző) receptorokat ingerel, amelyek az ingerületet a gerincvelő dorsalis szarvába közvetítik. Innen az információ először az agytörzsbe, majd innen az agykéregbe jut. Itt történik meg a fájdalmas inger realizációja.4 (Yoshihiro Nakata és msai, 2014)
|
A fájdalomban kétféle nociceptív érzékenység vesz részt. Az egyik a perifériás érzékenység, amit okozhat szöveti károsodás, különböző betegségek (például daganat vagy arthritis), illetve a gyulladás-mediátorok megemelkedett száma is. A másik nociceptív érzékenység pedig a központi. Erre jellemző a gerincvelői és agyi fájdalomérző idegsejtek nagyfokú aktivizációja, amely gyakran okoz krónikus fájdalom-állapotokat.4
A fájdalomérzetek által kiváltott viselkedésnek két fázisa van; a kezdeti akut, és az azt követő krónikus fázis.4 (Yoshihiro Nakata és msai, 2014)
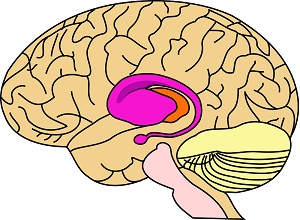
A striatum – mely a nucleus caudatus és a putamen együttese – sok motoros funkcióért (például tudatos mozgások koordinálása, tudattalan reflexmozgások), és egyéb hatásokért (tanulás, döntéshozás, motiváció) felelős.
|
Kutatások azt bizonyították, hogy a striatum aktiválása elektromos jelekkel majmokban csökkenti a fájdalomra adott reakciókat. Ugyanakkor ezen agyterület működési zavaraiban szenvedő betegek (traumás sérülés, stroke, Parkinson-kór, Tourette-szindróma) gyakran mutatnak krónikus fájdalmi betegségeket (centrális neuropátia, dystonia). Tehát a striatumnak jelentős szerepe van a fájdalomra adott reakciók kiváltásában. Ez azt jelenti, hogy a striatum fontos szerepet játszik a nociceptív (fájdalomelkerülő) reflexek szabályozásában is.4 (Yoshihiro Nakata és msai, 2014)
A striatumban – és a környező agyi területekben – nagyobb mennyiségű substance P termelődik, melyet az itt található neurokinin-1 receptorok érzékelnek. Mivel azonban a neuronok és a gliasejtek nem veszik fel a substance P-t, az képes extraszinaptikusan hatni az neurokinin-1 receptorokra is. 4 (Yoshihiro Nakata és msai, 2014)
A substance P – amely fájdalmas hatásra szabadul fel a központi idegrendszerben – antinociceptív és neuroprotektív hatása révén részt vesz az endogén fájdalom-regulációban. Az is bizonyított, hogy a nociceptív reflex kiváltása előtti neurokinin-1 receptor antagonista kezelés akadályozza a substance P antinociceptív hatását. Kutatók azt fedezték fel, hogy a substance P-neurokinin-1 receptor kapcsolat a G-protein utak közül főleg a protein-kináz B és a signal-regulated kinase (ERK 1 és 2) aktiválásáért felel, ezek foszforilálásával. Az ERK 1 és 2 aktiválása a gerincvelő dorsalis szarvában neuron-stimulációhoz vezet. Ezért az neurokinin-1 receptor működésének befolyásolása fontos lehet az antinocicepció szempontjából.4 (Yoshihiro Nakata és msai, 2014)
Egy 2014-es japán kutatás során patkányok hátulsó lábába subcutan formalint injektáltak, aminek hatására neuropathiás fájdalomra adott nociceptív reflexek (felemelés, nyalogatás, rágcsálás) jelentkeztek. Kapszaicin-injekció beadása – szintén a hátulsó lábba – hyperérzékenységhez és fájdalmi viselkedéshez vezetett.4 (Yoshihiro Nakata és msai, 2014)
A formalin-injekció beadása után 120-180 perccel szignifikáns EC substance P-szint emelkedést észleltek a striatumban. Emelkedést mutatott továbbá az ERK 1 és 2 aktivitás is. Ez azt jelenti, hogy a fájdalmas ingert kiváltó formalin hatására a striatumban a substance P hatására bekövetkező ERK1/2 aktivitás reflexesen nőtt. Amennyiben a formalin-injekció után substance P-t adagoltak a striatumba hosszú ideig, az ERK 1 és 2 aktivitás szintén megemelkedett, és lerövidült a fájdalom-reflexek ideje. Amikor azonban csak egyszer fecskendeztek be substance P-t, az nem okozott hasonló változást (sem az ERKfoszforilációt, sem a fájdalmi viselkedést tekintve). Ez azt bizonyítja, hogy a substance P jelátviteli rendszere nem egy akut transzmisszió, hanem inkább folytatólagos, és a substance P térfogata is számít. A beadás utáni akut fázist azonban még a hosszú ideig tartó substance P adagolás sem csökkentette.4 (Yoshihiro Nakata és msai, 2014)
Amikor az ERK 1 és 2 foszforilációját MEK1/2 inhibitorral gátolták (ezt 30 perccel a formalin beadása után injektálták a contralateralis striatumba), a fájdalom-reflexek hosszabb ideig voltak megfigyelhetők. Hasonló hatásai voltak az neurokinin-1 antagonista adagolásának is.4 (Yoshihiro Nakata és msai, 2014)
Kapszaicin hatására akut fájdalmi viselkedés mutatkozott a beadás utáni 2-3 percben, amit további 30 percig tartó hyperérzékenység követett. A kísérletben a folyamatos substance P adagolás az akut fázisra nem volt hatással, a hyperszenzitivitást azonban csökkentette. Amikor a substance Pvel együtt az ERK 1 és 2 foszforilációját gátló MEK1/2 inhibitort vagy neurokinin-1 receptor antagonistát is befecskendeztek, a substance P antinociceptív hatása lecsökkent. Ez bizonyítja, hogy az neurokinin-1 receptor által indukált ERK-aktivizáció szabályozza a bőr hyperérzékenységét.4 (Yoshihiro Nakata és msai, 2014)
Rágcsálókon végzett egyéb kísérletek során izgató hatású anyagokat (bizonyos aminosavak, neuropeptidek, katekolaminok) fecskendeztek a striatumba. Ez gátolta a formalinnal kiváltott neuropathiás fájdalomra adott nociceptív reflexeket. Ez azt bizonyítja, hogy a striatum stimulálása fokozódó substance P-felszabaduláshoz vezet.4 (Yoshihiro Nakata és msai, 2014)
Megfigyelték azt is, hogy fájdalmas inger hatására a striatum különböző területein a substance P-aktivitás eltér. Így a contralateralis striatumban jelentős mértékű ezen anyag felszabadulása, míg az ipsilateralis striatumban nem. Ezért feltételezhető, hogy a nociceptív reflexek szabályozása elsősorban a contralateralis striatum feladata. A fájdalomra adott válasznak azonban csak a krónikus fázisa enyhíthető, amely valószínűleg a leszálló fájdalom-facilitátor jelek gátlásával történik.4 (Yoshihiro Nakata és msai, 2014)
Egy másik kutatás azt bizonyította, hogy a substance P módosítja az opioid receptorok jelátviteli rendszerét, serkentve az endocitózis utáni újrahasznosításukat. Ezen receptoroknak a fájdalomcsillapításban van jelentős szerepük.1 (Bowman és msai, 2015)
Mindezek miatt a substance P-neurokinin-1 receptor jelátviteli út stimulálása alkalmas lehet klinikai fájdalomcsillapításra.4 (Yoshihiro Nakata és msai, 2014)
Ennek ellenére a substance P fájdalmat csillapító hatására vonatkozó eddigi kutatások nem sok reménnyel kecsegtettek. Ezen eredmények tehát jelenleg is intenzív kutatás célját képezik.
7. Konklúzió
Megállapíthatjuk, hogy a tachykinineknek jelentős szerepük van mind a pszichiátriai, mind a fizikai fájdalom regulálásában. Elsődleges „céljuk” a fájdalomérzet csökkentése. Receptoraik túlműködése éppen azért válthat ki vágyakozást jó-érzetet keltő anyagok iránt, mert ahhoz hogy a neurokininek kifejthessék fájdalomcsillapító hatásukat, jelentős ideig kell az extracelluláris térben maradniuk (ahogy ezt a nocicepciót vizsgáló patkány-kísérlet bizonyította). Ám ha a receptorok túlzott aktivitása miatt a sejtek nagymértékben internalizálják a tachykinineket, azok fájdalomcsillapító hatása csökken.
Alapvető működésekhez, motivációhoz azonban szükség van szimpatikus hatású molekulák jelenlétére is a szervezetben. Ezért ha a substance P hatása túlzottan érvényesül, és elnyomja a szimpatikus jeleket, a cselekvő- és koncentrálóképesség csökkenhet. Ennek következtében kialakulhatnak különböző figyelem- vagy motiváció-zavaros betegségek, mint például a depresszió vagy az ADHD, amely betegségeknél a noradrenalinerg-, serotoninerg- és dopaminerg-rendszerek zavarait mutatták ki.
A neurokinineknek jelentős szerepük van a fájdalomérzet csökkentésében is, amelyet a fent említett kísérlet is bizonyít. Ezen vizsgálat arra is rámutatott, hogy a substance P jelátviteli rendszere egy elhúzódó folyamat, így csak a krónikus fájdalomérzetet képes csökkenteni.
8. Hivatkozások
1. Bowman et al., CellAutonomous Regulation of MuOpioid Receptor Recycling by Substance P (2015) http://dx.doi.org/10.1016/j.celrep.2015.02.045
2. Mistrova, E., et al., Role of substance P in the cardiovascular system, Neuropeptides (2015), http://dx.doi.org/10.1016/j.npep.2015.12.005)
3. Dogra, S., et al., Epigenetic regulation of G protein coupled receptor signaling and its implications in psychiatric disorders. Int J Biochem Cell Biol (2016), http://dx.doi.org/10.1016/j.biocel.2016.03.012
4. Yoshihiro Nakata et al., Continuous infusion of substance P into rat striatum alleviates nociceptive behaviour via phosphorylation of extracellular signalregulated kinase 1/2 (2014)
5. Laura E. Kwako et al.,The neurokinin1 receptor antagonist aprepitant in comorbid alcohol dependence and posttraumatic stress disorder: a human experimental study (2014)
6. A.J. Porter, The role of neurokinin1 receptor in behaviour and cognition: an intaraction with the brain renin angiotensine system and its implications for attention deficit hyperactivity disorder (2015)
7. V. Maletic et al., Neurobiology of depression: an integrated view of key findings (2007)
Képek: https://commons.wikimedia.org/wiki/Main_Page
1. kép: substance P
2. kép: neurokinin-1 receptor
3. kép: nociceptív inger
4. kép: a striatum területe

 1.
1.  2.
2.  3.
3.  4.
4.