Fém-oxid expozíció által okozott májfunkciózavar
Contents
Bevezetés
A máj a fő szerv, ahol az exogén anyagok metabolizálódnak és végül kiválasztódnak. Ezért az exogén anyagoknak kitett májsejtek májműködési zavarokat, sejtkárosodást és akár szervi elégtelenséget is okozhatnak.
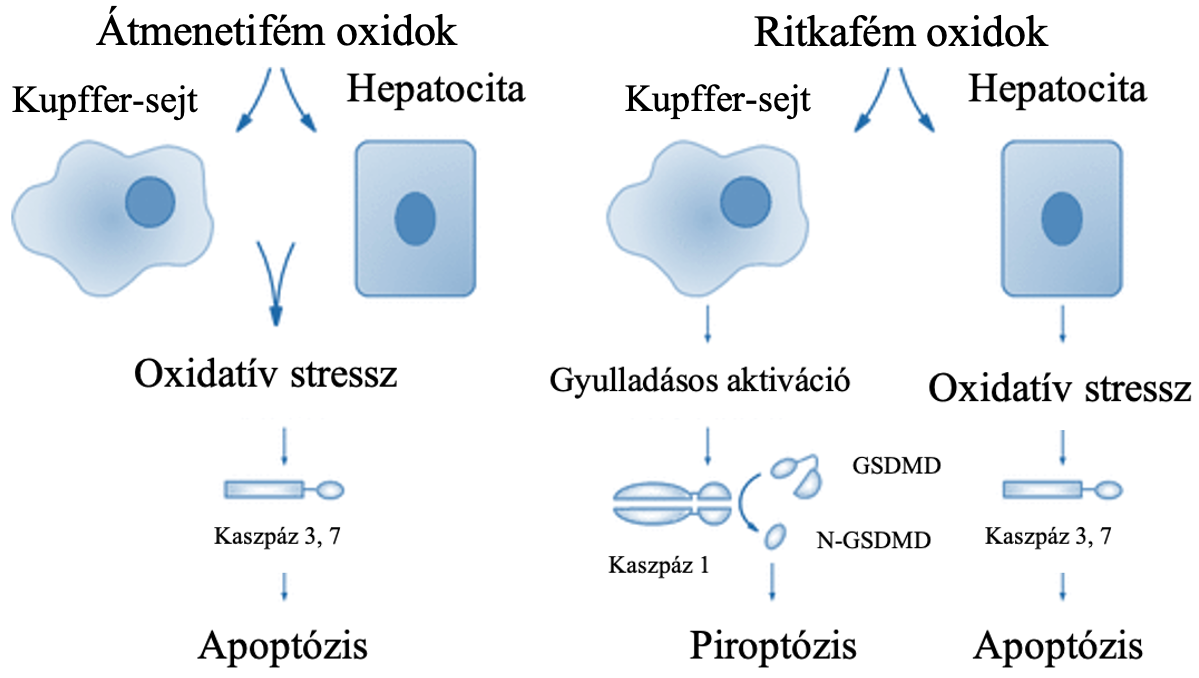
A máj és a mononukleáris fagocitarendszer a mesterséges nanoanyagok gyakori felhalmozódási célpontja. Ezek bejutása akár a részecskék felvételével és elterjedésével, akár a terápiás és képalkotó nanorészecskék szisztémás beadása során is megtörténhet. Nemcsak a Kupffer-sejtek és a hepatociták között figyelhetőek meg hatásbeli különbségek, hanem az átmenetifém oxidok, a ritkaföldfém oxid nanorészecskék toxikológiai profiljában is. A prooxidatív átmenetifém oxidok a kaszpáz 3 és 7 aktiválódását indukálták, ami apoptotikus sejthalált eredményezett mindkét sejttípusban. A ritkaföldfémek lizoszómakárosodást, gyulladásos aktivációt, kaszpáz 1 aktivációt és piroptózist indukáltak a Kupffer-sejtekben (1.ábra). A piroptózist sejtduzzanat, membrán hólyagosodás és megnövekedett membrán permeabilitás kísérte, de ez pórusképző fehérje, gasdermin-D (GSDMD) leütésével visszafordítható volt (Mirshafiee és mtsai, 2018).
|
1. ábra: Átmenetifém oxidok és ritkafém oxidok hatása a hepatocitákra és Kupffer-sejtekre. [Vahid és mtsai (2018) ábrája alapján] |
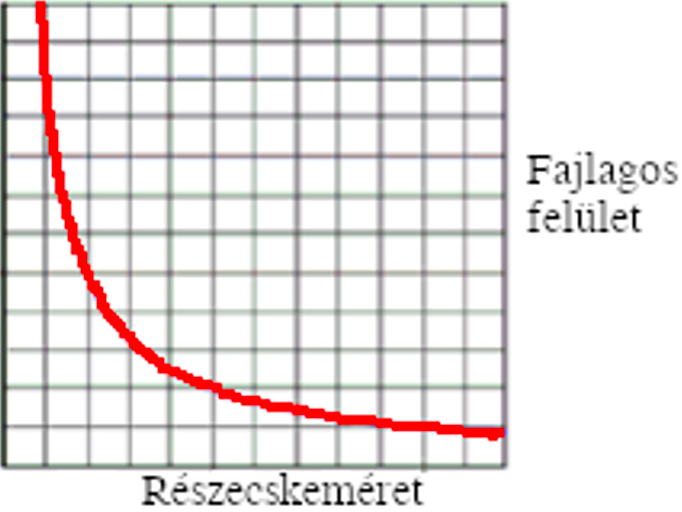
A szervezetbe jutó anyagok hatása az átmérő csökkenésével jelentősen megváltozik, ez a fajlagos felület növekedésével magyarázható (2.ábra). Feltételezések szerint a kisebb részecskeméret nagyobb fajlagos felülettel és reaktivitással jár, így a nanorészecskék több iont bocsáthatnak ki az intracelluláris felvételhez és mobilizációhoz, ami magasabb biológiai hozzáférhetőséget eredményez, mint a mikrorészecskéknél.
|
2. ábra: A fajlagos felület (Y tengely) és a részecskeméret (X tengely) változásának összefüggése. [Pándics (2008) ábrája alapján] |
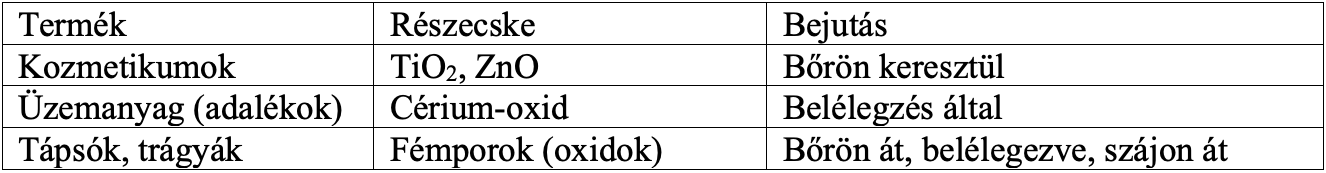
A későbbiekben szereplő fém-oxid nanorészecskék főként kőzetmállásból származó nanoporok, fő forrásaik a sivatagos területek. Azonban az erdőtüzek füstje, illetve az aeroszolok szintén nagy mennyiségben tartalmaznak 100 nm körüli szemcséket, amelyek elsősorban a fémek oxidjaiból, főleg Fe-, Si- és Al-oxidokból állnak. Ezenkívül nagy mennyiségben található a forrasztás, hegesztés révén keletkező fémgőzökben is, de nanorészecskék keletkezhetnek akár grillezés, olajban sütés, felületek felhevítése során is. A szervezetbe főleg belégzés útján vagy bőrön keresztül jutnak, de orális expozíció is előfordulhat bizonyos környezetben, bizonyos esetekben. Vizes oldataukra a bőr nem permeábilis, míg a vizes-olajos oldatukra nézve igen, a pórusoknál és haj follikulusainál fokozottan. Összegezve tehát nanorészecskék az emésztőrendszerrel, inhalácóval, intravasculáris injekcióval, és dermálisan is képesek bejutni a szervezetbe, a keringés pedig egyenesen továbbítja ezeket a májba (Pándics, 2008) (3.ábra).
|
3. ábra: Különböző fém-oxid nanorészecskék bejutásának módja. [Pándics (2008) ábrája alapján] |
Hegesztési füst inhaláció útján kifejtett toxicitása a májra
A hegesztési füst számos potenciálisan mérgező nemfémet és fémet tartalmaz. Utóbbira példa a vas, a mangán, a króm és a nikkel, de a füst összetételére jelentős hatással vannak a hegesztés körülményei és a hegesztő elektróda. A hegesztés a különböző szervrendszerekre igen káros hatással bír. Elsősorban a légzőszervi megbetegedésre fókuszálnak tanulmányok. Ekkor funkcióváltozások következhetnek be a tüdőben, megjelenhet bronchitis, tumor, valamit kialakulhat az úgynevezett öntőláz (hegesztőláz). Ezeken felül a cardiovascularis szervrendszer különböző betegségei jelentkezhetnek, akut myocardialis infarktus (acute myocardial infarct), angina pectoris, krónikus ichaemiás szívbetegség, szívroham és szívelégtelenség.
A hegesztési füstnek a májra is jelentős hatása van. Chuang és mtsai (2010) kimutatták, hogy az inhaláció útján bekerült nanorészecskék DNS-szál törést okoznak tüdő-, vese- és májszövetben. Arra a következésre jutottak, hogy az akut expozíció oxidatív stresszt okoz, valamint lipid peroxidációs hatást, mivel MDA (malondialdehid) keletkezik. A DNS-re kifejtett hatás idővel rendeződhet.
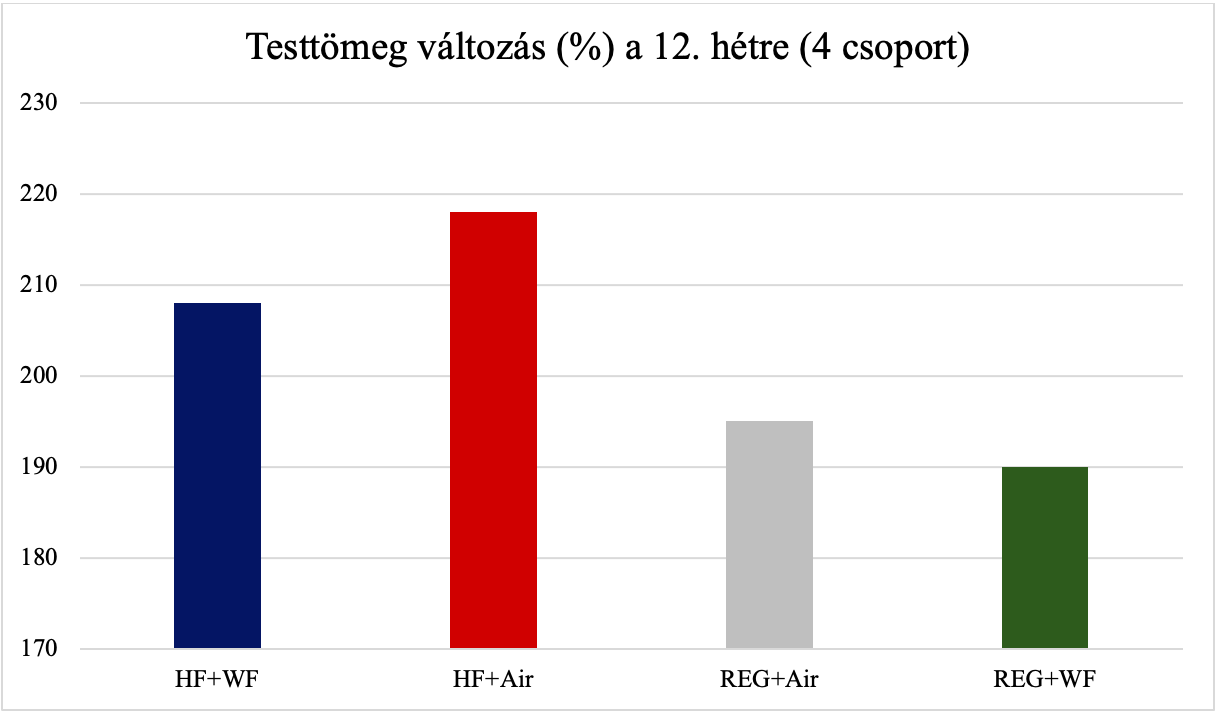
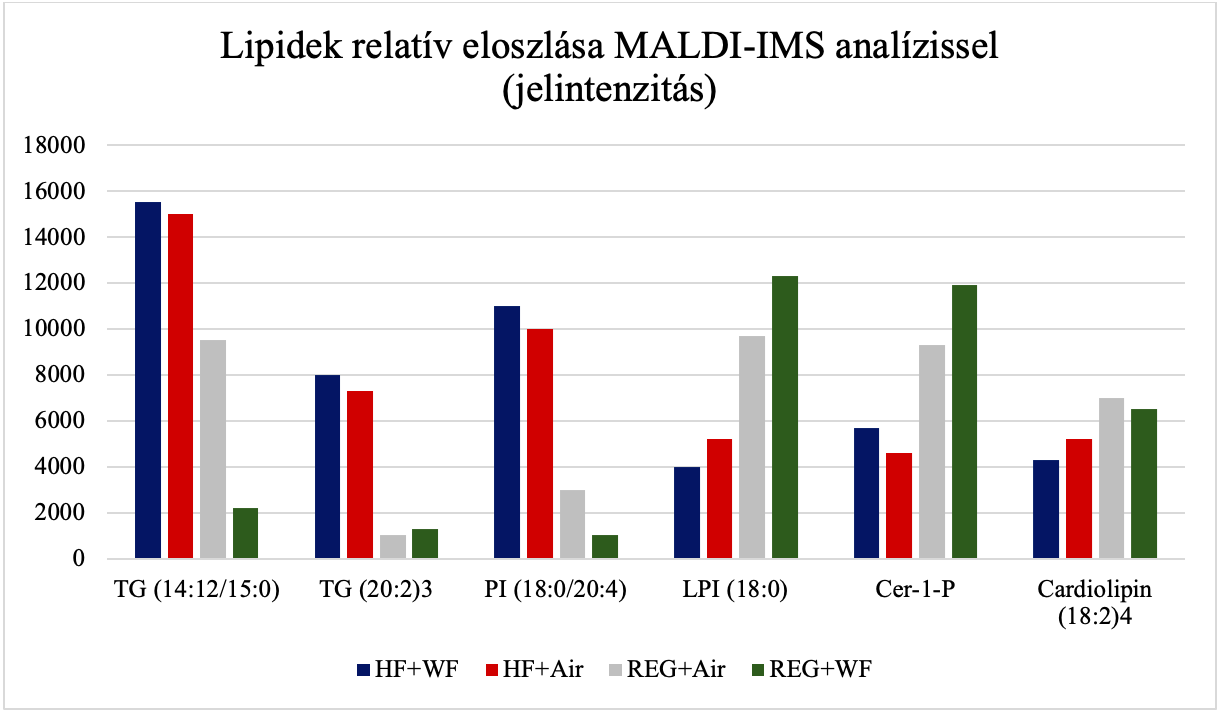
Egy kutatás (Boyce és mtsai, 2020) négy kísérleti csoporton keresztül kimutatta, hogy mind a magas zsírtartalmú étrend, mind az inhalált hegesztési füst változtatja egyes trigliceridek és lipidek jelenlétét a májban, más és más módon, viszont önmagában a hegesztési füst nem eredményez nem alkoholos zsírmájat, mint a magas zsírtartalmú étrend. Emellett a különbözően kezelt csoportok testtömeg változása (12. hétre) nem volt azonos, valamint a májból készített szövettani metszetek is eltértek egymástól (4. ábra). A kutatás azt is kimutatta, hogy hegesztési füst hatására megnövekedik a ceramid-1-foszfát szint is (5. ábra), mely fontos szerepet játszik az eikozanoid-útvonalban, mely elsődleges mediátor a gyulladás iniciációjában.
|
4. ábra: Testtömeg változás (Y tengely) a 12. hétre mind a négy csoportnál. REG+WF=normál takarmányon tartott, hegesztési füstnek kitett állatok. REG+Air=normál takarmányon, tiszta levegőben tartott állatok. HF+WF=magas zsírtartalmú takarmányon tartott, hegesztési füstnek kitett állatok. HF+Air=magas zsírtartalmú takarmányon, tiszta levegőben tartott állatok. [Boyce és mtsai (2020) ábrája alapján] |
|
5. ábra: Lipidek relatív eloszlása MALDI-IMS analízissel kimutatva a különböző kezelési csoportokban. HF+WF=magas zsírtartalmú takarmányon tartott, hegesztési füstnek kitett állatok. HF+Air=magas zsírtartalmú takarmányon, tiszta levegőben tartott állatok. REG+Air=normál takarmányon, tiszta levegőben tartott állatok. REG+WF=normál takarmányon tartott, hegesztési füstnek kitett állatok. [Boyce és mtsai (2020) ábrája alapján] |
Ezen felül Shen és mtsai (2018) kimutatták, hogy a hegesztési füst szoros kapcsolatban áll a szisztémás gyulladással is.
Tanulmányozott fém-oxidok
Cink-oxid
A cink-oxid nanorészecskék gyakori összetevők kozmetikai termékekben. A cink-oxid oxidatív stresszt okoz a májsejtekben. Egy kutatás ( Syama és mtsai, 2013) a nanorészecskék méretét hivatott tanulmányozni, valamint az oxidatív stressz okozta DNS károsodást, amit 8-OHdG (8-oxo-2-dezoxiguanozin) biomarker mérésével határoztak meg egér májban. A kutatás azt mutatta, hogy 50μg/ml cink-oxid nanorészecske 50%-kal növelte a sejtpusztulás. Valamint a 8-OHdG szint is jelentősen változott. Az adatok kimutatták, hogy koncentráció függően csökken a sejtek életképessége, csökken az antioxidáns és nő a 8-OHdG szint a cink-oxidnak kitett egér májsejtekben.
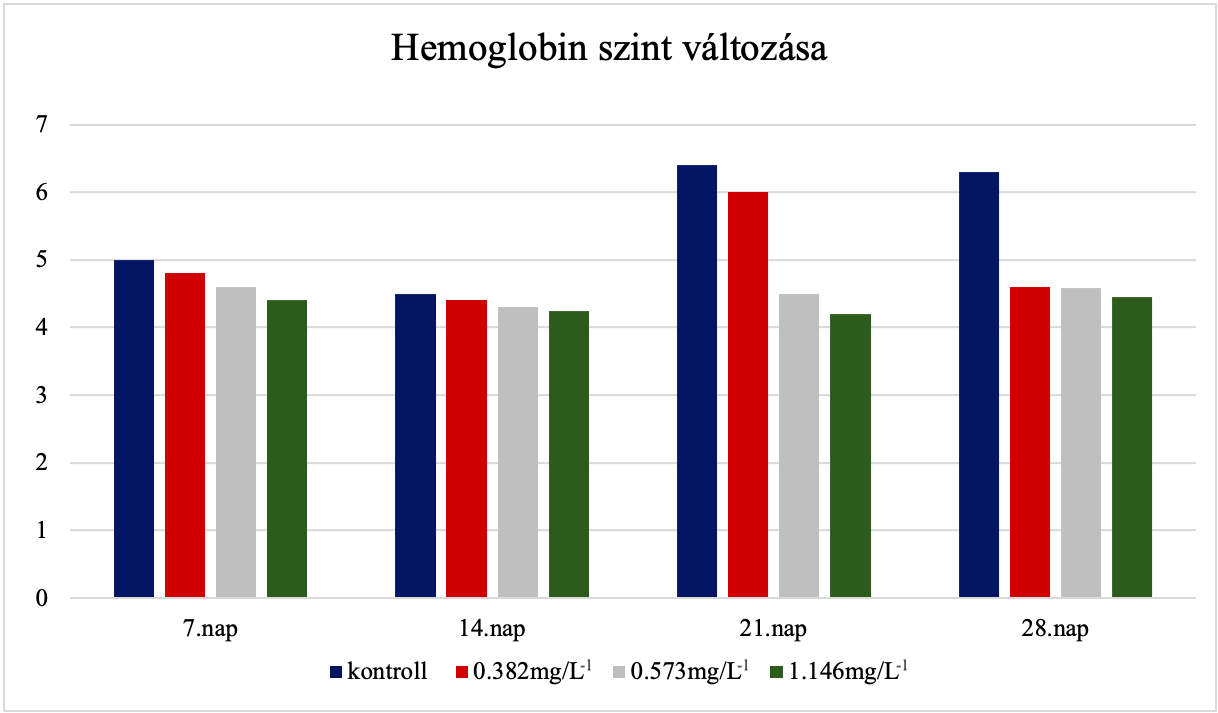
Rajkumar és mtsai (2022) kimutatták, hogy a cink-oxid nanorészecskék jelentős elváltozásokat tudnak okozni a sejtekben és különböző vérparaméterekben. A hemoglobin (Hb), hematokrit (Hct) és vörösvértestek (RBC) száma jelentősen csökkent a kezelt halakban (6. ábra). Ezen kívül Az MCH és MCHC értékek nőttek, ami anémiára utal. A cink-oxid májsejten belül sejti degenerációt és sejtelhalást okoz magasabb koncentrációkban.
|
6. ábra: A hemoglobin szint változása különböző cink-oxid koncentrációk esetén. [Rajkumar és mtsai (2022) ábrája alapján] |
Watson és mtsai (2015) bebizonyították, hogy egyelőre még a cink-oxid nanorészecskék nem alkalmazhatóak nanogyógyszerként, mivel csökkentették a Kupffer-sejtek motilitását és később májkárosodást okoztak (7. ábra). De a máj baktériumölő funkciói nem változtak. Ezeket a hátrányokat kell ellensúlyozni, hogy biztonságos nanogyógyszer lehessen.
A cink-oxid káros hatásainak visszafordításáról is számos tanulmány létezik. A naringerin egy citrusból származtatott flavonoid. El-wafaey és mtsai (2021) kimutatták, hogy a naringerin ellensúlyozza a cink-oxid nanorészecskék májra való negatív hatásait. A cinkoxiddal kezelt patkányok májában megnőtt az enzimaktivitás, felborult az oxidáns/antioxidáns egyensúly, nőttek a gyulladásos reakciók ezen felül morfológiai májelváltozások is bekövetkeztek. A naringerin ezeket a hatásokat visszafordította.
Vas-oxid
A vas oxidjai közül a vas(III)-oxid, természetbeli nevén magnetit, egy mágneses tulajdonságú vas-oxid, melyet diagnosztikában, valamint különböző gyógyszeres kezelésekben, például szisztémás szállítóként használhatunk.
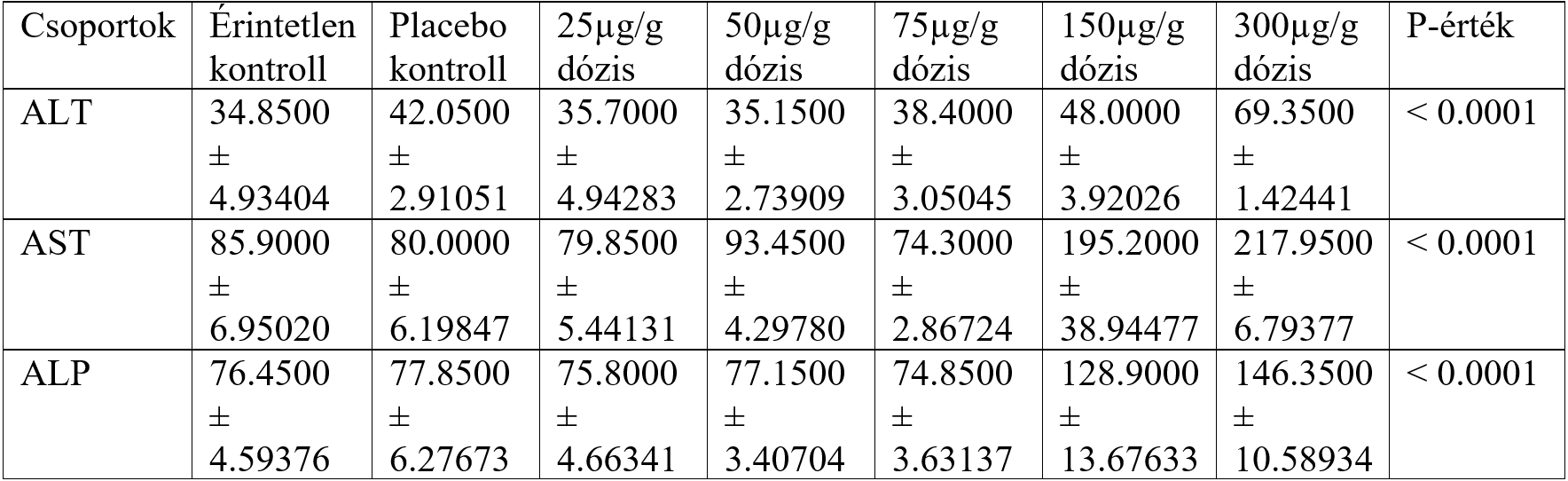
A vas-oxid nanorészecskék azonban bizonyos mennyiségben toxicitással rendelkeznek. Ezt vizsgálták Parivar és mtsai (2016). Kimutatták, hogy bizonyos dózis fölött egerekben egyes májenzimek koncentrációjában változás következik be. A máj toxicitását az AST, ALT és ALP enzimek emelkedése jelzi, mely szignifikánsan be is következett a kísérletek során (8.ábra).
|
7. ábra: Különböző dózisú vas-oxid nanorészecskék hatására bekövetkező enzimkoncentráció változások. ALT=Alanin-aminotranszferáz. AST=Aszpartát-aminotranszferáz. ALP=Alkalikus-foszfatáz. [Parivar és mtsai (2016) ábrája alapján] |
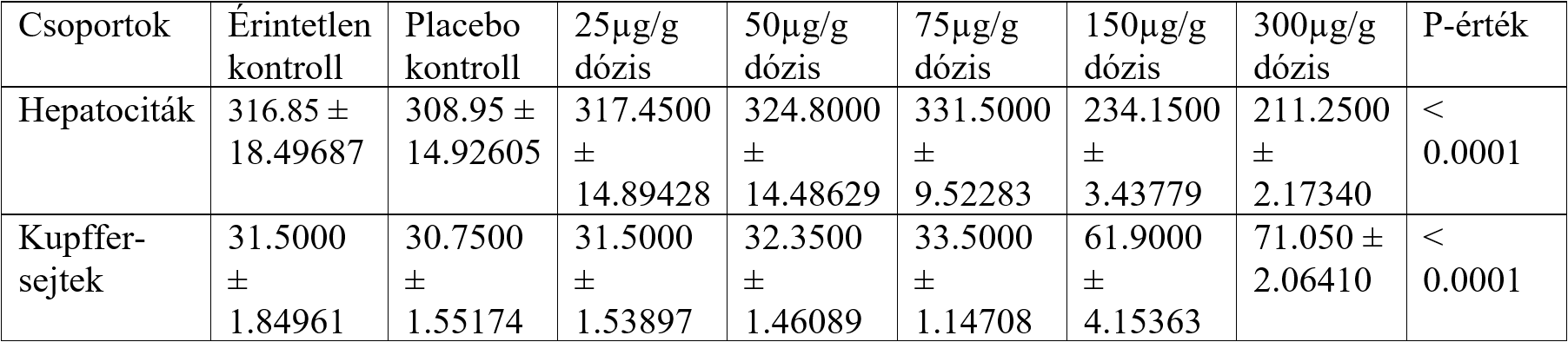
Emellett a Kupffer-sejtek száma növekedett, a hepatociták száma pedig csökkent a májszövetben bizonyos dózis fölött (9.ábra).
|
8. ábra: Különböző dózisú vas-oxid nanorészecskék hatására bekövetkező változás a Kupffer-sejtek és a hepatociták számában. [Parivar és mtsai (2016) ábrája alapján] |
A kutatás alapján dózisfüggő a vas-oxidok májra való toxicitása.
Nikkel-oxid
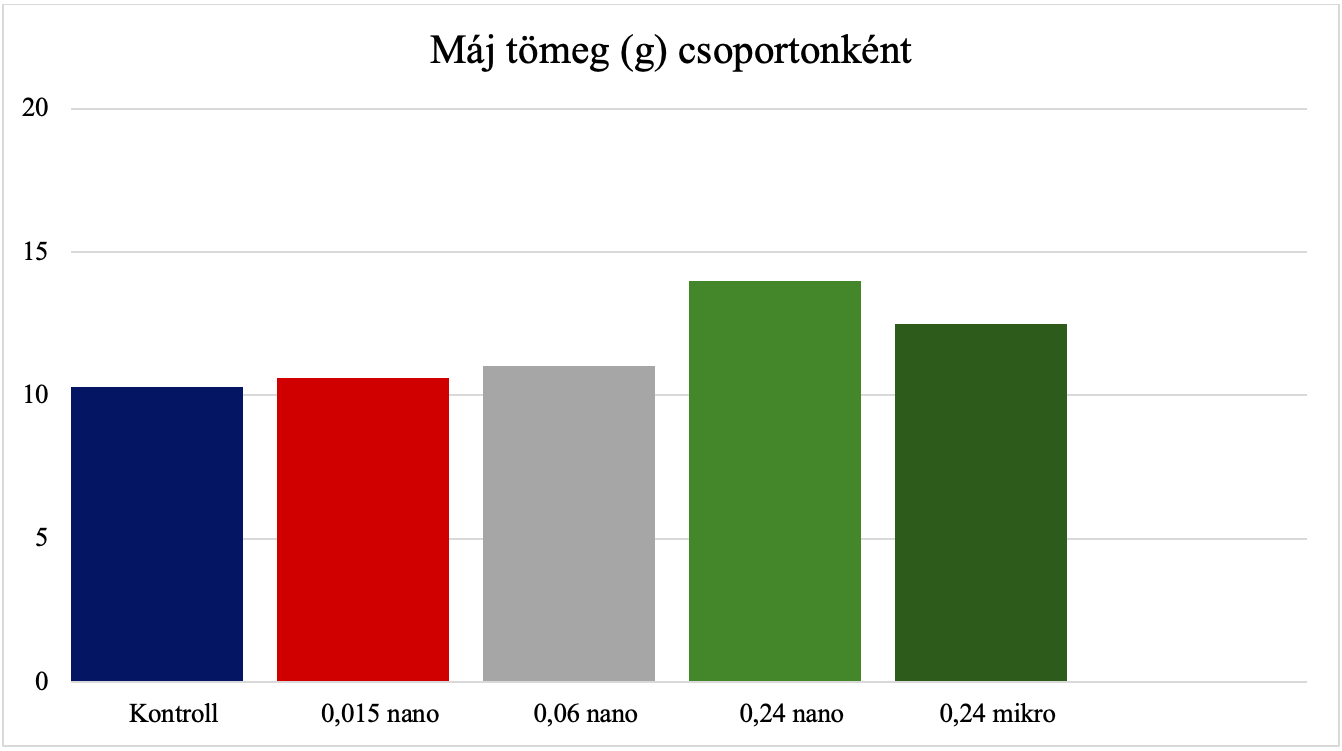
Yu és mtsai (2017) kimutatták, hogy nikkel-oxid hatására megnövekedett a máj nedves tömege és a testtömeghez viszonyított együtthatója (10. ábra), valamint patológiás elváltozások voltak láthatók, melyek ödémát és a hepatikus szinusz eltűnést okoznak. A nitrogén-monoxid-szintáz aktivitása, valamint a nitrogén-monoxid tartalom megemelkedett. Ezen felül a májszövetben kimutatható volt a hidroxilgyök, a lipid-peroxidáció, a kataláz, a glutation-peroxidáz, a teljes szuperoxid-diszmutáz és antioxidáns kapacitás kóros elváltozása. A nikkel-oxid nanorészecske által kiváltott májtoxicitás összefüggésbe hozható patkányok nitratív és oxidatív stresszével egyaránt.
|
9. ábra: A máj tömegének változása egyes kezelési csoportokban. [Yu és mtsai (2017) ábrája alapján] |
A nano-nikkel-oxid intratracheális csepegtetéssel történő beadása az oxidációs folyamatok és az antioxidánsok egyensúlyának felbomlásához, valamint nitratív stressz kialakulásához vezetett patkányokban (Yu és mtsai, 2017). A májtoxicitás összefüggésbe hozható a nitratív stresszel, az oxidatív stresszel és a hem-oxigenáz-1 és metallotionein-1 mRNS nano-nikkel-oxid által indukált abnormális expressziójával.
Réz-oxid
A réz toxikózis örökletes formái emberben és kutyában is előfordulnak. Emberben a Wilson-kór a legjobban tanulmányozott réztúlterhelési rendellenesség, amely az ATP7B réztranszportert kódoló gén mutációiból ered. A réz toxikózis olyan formáit is felismerik, amelyeknek még nem ismert ok-okozati génje, gyakran kisgyermekeknél is. Bár előrelépés történt az emberben előforduló rézanyagcsere-zavarok genetikai hátterének feltárásában, a betegségek mechanizmusával és a réz homeosztázisával kapcsolatos számos kérdés megválaszolatlan maradt.
A réz toxikózisban szenvedő Bedlington terrier kutyafajtán végzett genetikai vizsgálatok azonosították a COMMD1 gént, amelyről korábban nem volt ismert, hogy részt vesz a réz anyagcseréjében. A bedlington terrier mellett számos más kutyafajta szenved örökletes réz toxikózisban, és hasonló fenotípusokat mutatnak, mint a réztárolási rendellenességekkel küzdő emberek. A legtöbb emberi populáció heterogenitásával ellentétben a fajtatiszta kutyapopulációban a genetikai struktúra homogén, ami előnyös a komplex betegségek molekuláris genetikájának feltárásához. Fieten és mtsai (2012) a Bedlington terrieren végzett munkájukban összefoglalják a COMMD1 funkcióival kapcsolatos vizsgálatokból tanultakat, leírják az örökletes réz toxikózis fenotípusait más kutyafajtákban, és megvitatják a kutyák réztoxikózisának genomszintű asszociációs vizsgálatainak lehetőségeit. Az emlősök rézanyagcseréjének és rézanyagcsere-zavarainak megértése közelebb visz minket ahhoz, hogy képesek legyük gyógyítani illetve megelőzni az emberben kialakuló betegséget.
Az ATP-áz 7B gén mutációja által okozott Wilson-kór az egyetlen olyan genetikailag jellemzett emberi betegség, amely gátolja az epével történő rézkiválasztást és a mérgező réz felhalmozódását a májban és esetenként az agyban (Haywood és mtsai 2016).
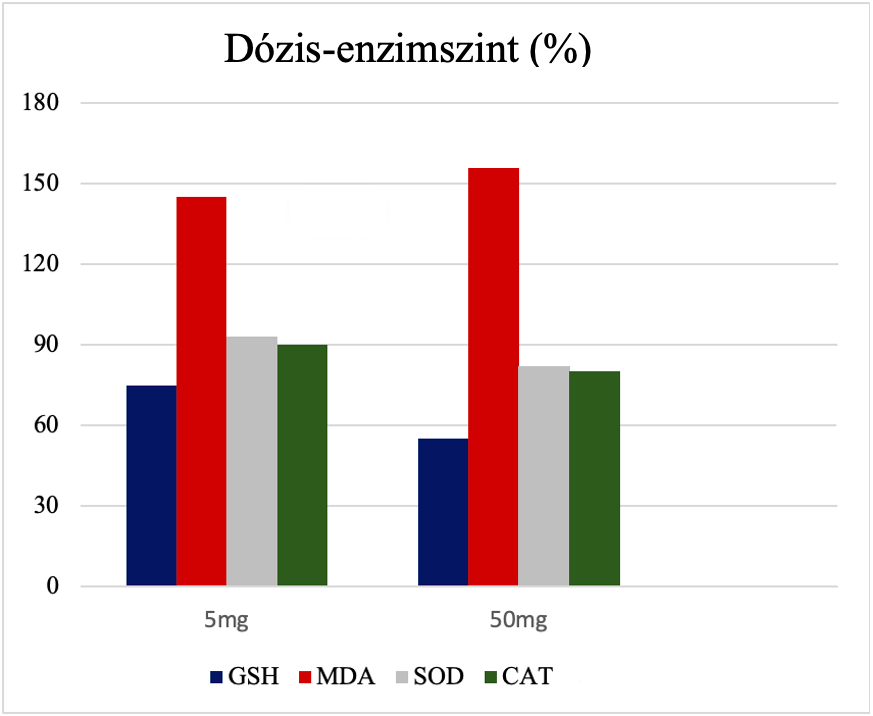
A réz-oxid nanorészecskék szájon át történő adagolása patkányoknak szignifikáns dózisfüggő változást okozott az antioxidáns enzimaktivitásokban. Egy tanulmány a patkányok májszövet-homogenizátumainak felülúszójának glutation (GSH), kataláz, szuperoxid-dizmutáz (SOD), lipidperoxidációs termék (MDA) tartalmát vizsgálta. A GSH, kataláz (CAT) és SOD aktivitás szignifikánsan csökkent, míg a lipidperoxidációs termék (MDA) szintje emelkedett (11.ábra). A csökkent glutation-, kataláz- és SOD-aktivitás statisztikailag szignifikáns csökkenése az antioxidáns enzimszintek csökkenését jelenti a réz-oxid nanorészecskék expozícióját követően, a lipid-peroxidációs szintek jelentős növekedése pedig a szövetkárosodást és az oxidatív stresszt jelzi. Tehát a réz-oxid nanorészecskék orális expozíciója patkányoknak jelentős toxicitást okoz a májban, és ennek oka lehet az oxidatív stressz. 14 napig nem volt elhullás. A fenti eredmények megerősítik a réz-oxid nanorészecskék májtoxicitását és oxidatív stressz indukálását patkánymájban 14 napos expozíciót követően.
Bebizonyosodott, hogy a réz-oxid nanorészecskék toxicitást és oxidatív stresszt okoznak mind in vivo, mind in vitro. Oxidatív stresszt, gyulladást és ennek következtében a fehérjék, membránok és DNS károsodását okozhatják (Narsimha és Anreddy, 2018).
|
10.ábra: Enzimszintek a különböző kezelési csoportokban. GSH=glutation. MDA=lipidperoxidációs termék. SOD=szuperoxid-dizmutáz. CAT=kataláz. [Narsimha és Anreddy (2018) ábrája alapján] |
Fu (2015) bebizonyította, hogy a réz-oxid nanorészecskék jelentős toxicitást fejtenek ki a HepG2 (humán hepatokarcinóma sejt) sejtekre, reaktív oxigénfajták (ROS) képződése és génexpressziós folyamatok mellett. Az antioxidáns N-acetil-L-cisztein jelentősen csökkenti a nanorészecskék által kiváltott citotoxicitást, alátámasztva azt, hogy az oxidatív stressz hozzájárul a réz-oxid nanorészecskék citotoxicitásához. A nanorészecskék koncentrációfüggő módon intracelluláris reaktív oxigént generáltak HepG2 sejtekben.
Mangán-dioxid
Környezetünkben egyre gyakrabban jelennek meg mangán-dioxid nanorészecskék. Szerepük van a szennyvíztisztításban, a gyógyszerszállításban, valamint a biodiagnosztikai képalkotásban is. A mangán-dioxid nanorészecskék képesek bejutni a szervezetbe inhalációval, injekcióval (a véráramba), vagy akár a bőrön keresztül. Méretükből adódóan a vér-agy gáton is lehetőségük lehet átjutni.
Hafez és mtsai (2018) kimutatták, hogy a mangán-dioxid nanorészecskék szignifikánsan csökkentik a májfunkciókat, megemelik az AST, ALD és ALP enzim szintet, mely jelzi a máj toxicitását (12. ábra). A D-vitamin valamilyen szinten ezt normalizálta.
Mindezek mellet a mangán-dioxid hatására emelkedett a szérum bilirubin és albumin koncentráció, valamint a vér glükózkoncentrációja is nőtt. Ezeket az értékeket a D-vitamin ugyancsak csökkentette. A szérum protein koncentrációja is átrendeződött a nanorészecske hatására, a D-vitamin ezt helyrehozta.
A D-vitamin antioxidáns hatással is bír. Egy részről membrán antioxidáns, más részről serkenti a glutation-peroxidázt, a glutationt, a katalázt és a szuperoxid dizmutázt.
Egy másik kutatás (Hussain és mtsai, 2005) kimutatta, hogy mangán-oxid nanorészecskék hatására bizonyos dózis felett a májsejtek sejtmembránja sérül in vitro, melyet LDH szivárgás jelzett.
Titánium-oxid
A titánium-dioxid egy széles körben használt adalékanyag festékekben, műanyagokban, ételekben és kozmetikai termékekben. Yu és mtsai (2017) kimutatták, hogy a titánium-oxid nanorészecskék főleg a májban és a tüdőben halmozódnak fel. A genotoxicitás eredményei azt mutatták, hogy a DNS károsodás nukleotidok oxidálásából következett. Jól elkülöníthető génexpressziókat mutattak ki titánium-oxidnak kitett máj és tüdő sejtekben. A génexpresszió eredménye, hogy a sejtek metabolikus homeosztázisa felborul, oxidatív stressz, gyulladás és csak tüdőben sejtelhalás következik be.
Konklúzió
A fém-oxid nanorészecskék több különböző szervrendszerre is markáns hatással vannak, ezek mellett szisztémás problémákat, például gyulladást tudnak okozni. A hatásokkal kapcsolatba hozható az oxidatív stressz, mely legtöbb esetben indukálja a károsodásokat, funkcióbeli változásokat.
Fém-oxid nanorészecskék előfordulhatnak táplálékban, mellyel könnyen bejutnak mind az emberi, mind az állati szervezetbe. Ezen felül egyes nanorészecskék akkumulálódhatnak a májban és egyéb szervekben, azokban károsodást okozva, valamint ezúton állati eredetű táplálék bevitele során is bekerülhetnek a szervezetbe. A fentebb leírt hegesztési füst inhalációja is egy módja a fém-oxidok bejutásának. A fém-oxid nanorészecskék egyre nagyobb mértékű előfordulása a környezetünkben indokolja, hogy további kutatásokat végezzenek a témában.
Irodalomjegyzék
1. Vahid Mirshafiee, Bingbing Sun, Chong Hyun Chang, Yu-Pei Liao, Wen Jiang, Jinhong Jiang, Xiangsheng Liu, Xiang Wang, Tian Xia, and André E. Nel (2018): Toxicological Profiling of Metal Oxide Nanoparticles in Liver Context Reveals Pyroptosis in Kupffer Cells and Macrophages versus Apoptosis in Hepatocytes, American Chemical Society, 12, 4, 3836–3852
2. Pándics Tamás (2008): A nanorészecskék környezetegészségügyi hatásainak elemzése, EGÉSZSÉGTUDOMÁNY, LII. ÉVFOLYAM, 3. SZÁM
3. Cheng-Hung Chuang, Chong-En Huang, Hsiu-Ling (2010): DNA strand breakage and lipid peroxidation after exposure to welding fumes in vivo, Mutagenesis, Volume 25, Issue 1
4. Greg R. Boyce, Mohammad Shoeb, Vamsi Kodali, Terence G. Meighan, Katherine A. Roach, Walter McKinney, Samuel Stone, Matthew J. Powell, Jenny R. Roberts, Patti C. Zeidler-Erdely, Aaron Erdely, James M. Antonini (2020): Welding fume inhalation exposure and high-fat diet change lipid homeostasis in rat liver, , Toxicology Reports 7 1350–1355
5. Sipeng Shen, Ruyang Zhang, Jinming Zhang, Yongyue Wei, Yichen Guo, Li Su, Feng Chen and David C. Christiani (2018): Welding fume exposure is associated with inflammation: a global metabolomics profiling study, Shen et al. Environmental Health
6. S. Syama, S.C. Reshma, P.J. Sreekanth, H.K. Varma & P.V. Mohanan (2013): Effect of Zinc Oxide nanoparticles on cellular oxidative stress and antioxidant defense mechanisms in mouse liver, Toxicological & Environmental Chemistry, 95:3, 495-503,
7. Krishnasamy Sekar Rajkumar, Palaniyappan Sivagaami, Arunachalam Ramkumar, Anbazhagan Murugadas, Veeran Srinivasan, Sridhar Arun, Ponnusamy Senthil Kumar, Ramasamy Thirumurugan (2022): Bio-functionalized zinc oxide nanoparticles: Potential toxicity impact on freshwater fish Cyprinus carpio,:Chemosphere,Volume 290
8. Watson C, Molina R, Louzada A, Murdaugh K, Donaghey T, Brain J. (2015): Effects of zinc oxide nanoparticles on Kupffer cell phagosomal motility, bacterial clearance, and liver function. Int J Nanomedicine.;10(1):4173-4184
9. Dalia Ibrahim El-wafaey, Ola Elsayed Nafea & Eman Mohamed Faruk (2021): Naringenin alleviates hepatic injury in zinc oxide nanoparticles exposed rats: Impact on oxido-inflammatory stress and apoptotic cell death, Toxicology Mechanisms and Methods 32:1, 58-66
10. Kazem Parivar, Fatemeh Malekvand Fard, Mahdieh Bayat, Seyed Moayed Alavian and Mahsa Motavaf (2016): Evaluation of Iron Oxide Nanoparticles Toxicity on Liver Cells of BALB/c Rats, Iran Red Crescent Med J. 18(1): e28939.
11. Shu Yu, Fangfang Liu, Chen Wang, Jingyi Zhang, An Zhu, Lingyue Zou, Aijie Han, Jin Li, Xuhong Chang, Yingbiao Sun (2017): Role of oxidative stress in liver toxicity induced by nickel oxide nanoparticles in rats, Molecular Medicine Reports, 3133-3139
12. Hille Fieten, Peter A. J. Leegwater, Adrian L. Watson and Jan Rothuizen (2012): Canine models of copper toxicosis for understanding mammalian copper metabolism, Mammalian Genome volume 23, pages 62–75
13. Susan Haywood, Mike Boursnell, Michael J. Loughran, James Trafford, Diana Isherwood, Xuan Liu, Lisa Olohan, Stuart D. Carter (2016): Copper toxicosis in non-COMMD1 Bedlington terriers is associated with metal transport gene ABCA12, Journal of Trace Elements in Medicine and Biology Volume 35, Pages 83-89
14. Rama Narsimha és Reddy Anreddy (2018): Copper oxide nanoparticles induces oxidative stress and liver toxicity in rats following oral exposure, Toxicology Reports Volume 5, Pages 903-904
15. Xin Fu (2015): Oxidative Stress Induced by CuO Nanoparticles (CuO s) to Human Hepatocarcinoma (HepG2) Cells, Journal of Cancer Therapy Vol.06 No.10, Article ID:59778, 6
16. Asghar Ashrafi Hafez, Parvaneh Naserzadeh, Khadijeh Ashtari, Amir Mohammad Mortazavian, Ahmad Salimi (2018): Protection of manganese oxide nanoparticles-induced liver and kidney damage by vitamin D, Regulatory Toxicology and Pharmacology, doi: 10.1016/j.yrtph.2018.08.005.
17. S.M. Hussain, K.L. Hess, J.M. Gearhart, K.T. Geiss, J.J. Schlager (2005): In vitro toxicity of nanoparticles in BRL 3A rat liver cells, Toxicology in Vitro 19, 975-983
18. Shu Yu, Fangfang Liu, Chen Wang, Jingyi Zhang, An Zhu, Lingyue Zou, Aijie Han, Jin Li, Xuhong Chang, Yingbiao Sun (2017): Role of oxidative stress in liver toxicity induced by nickel oxide nanoparticles in rats, Molecular Medicine Reports, 3133-3139
Ábrajegyzék
1. Vahid Mirshafiee, Bingbing Sun, Chong Hyun Chang, Yu-Pei Liao, Wen Jiang, Jinhong Jiang, Xiangsheng Liu, Xiang Wang, Tian Xia, and André E. Nel (2018): Toxicological Profiling of Metal Oxide Nanoparticles in Liver Context Reveals Pyroptosis in Kupffer Cells and Macrophages versus Apoptosis in Hepatocytes, American Chemical Society, 12, 4, 3836–3852
2. Pándics Tamás (2008): A nanorészecskék környezetegészségügyi hatásainak elemzése, EGÉSZSÉGTUDOMÁNY, LII. ÉVFOLYAM, 3. SZÁM
3. Pándics Tamás (2008): A nanorészecskék környezetegészségügyi hatásainak elemzése, EGÉSZSÉGTUDOMÁNY, LII. ÉVFOLYAM, 3. SZÁM
4. Greg R. Boyce, Mohammad Shoeb, Vamsi Kodali, Terence G. Meighan, Katherine A. Roach, Walter McKinney, Samuel Stone, Matthew J. Powell, Jenny R. Roberts, Patti C. Zeidler-Erdely, Aaron Erdely, James M. Antonini (2020): Welding fume inhalation exposure and high-fat diet change lipid homeostasis in rat liver, , Toxicology Reports 7 1350–1355
5. Greg R. Boyce, Mohammad Shoeb, Vamsi Kodali, Terence G. Meighan, Katherine A. Roach, Walter McKinney, Samuel Stone, Matthew J. Powell, Jenny R. Roberts, Patti C. Zeidler-Erdely, Aaron Erdely, James M. Antonini (2020): Welding fume inhalation exposure and high-fat diet change lipid homeostasis in rat liver, , Toxicology Reports 7 1350–1355
6. Krishnasamy Sekar Rajkumar, Palaniyappan Sivagaami, Arunachalam Ramkumar, Anbazhagan Murugadas, Veeran Srinivasan, Sridhar Arun, Ponnusamy Senthil Kumar, Ramasamy Thirumurugan (2022): Bio-functionalized zinc oxide nanoparticles: Potential toxicity impact on freshwater fish Cyprinus carpio,:Chemosphere,Volume 290
7. Kazem Parivar, Fatemeh Malekvand Fard, Mahdieh Bayat, Seyed Moayed Alavian and Mahsa Motavaf (2016): Evaluation of Iron Oxide Nanoparticles Toxicity on Liver Cells of BALB/c Rats, Iran Red Crescent Med J. 18(1): e28939.
8. Kazem Parivar, Fatemeh Malekvand Fard, Mahdieh Bayat, Seyed Moayed Alavian and Mahsa Motavaf (2016): Evaluation of Iron Oxide Nanoparticles Toxicity on Liver Cells of BALB/c Rats, Iran Red Crescent Med J. 18(1): e28939.
9. Shu Yu, Fangfang Liu, Chen Wang, Jingyi Zhang, An Zhu, Lingyue Zou, Aijie Han, Jin Li, Xuhong Chang, Yingbiao Sun (2017): Role of oxidative stress in liver toxicity induced by nickel oxide nanoparticles in rats, Molecular Medicine Reports, 3133-3139
10. Rama Narsimha és Reddy Anreddy (2018): Copper oxide nanoparticles induces oxidative stress and liver toxicity in rats following oral exposure, Toxicology Reports Volume 5, Pages 903-904