Contents
Bevezetés
A mitokondriumok a sejt anyagcseréjében alapvető fontosságúak, az ATP-termelés, és egyéb intermedier bioszintetikus reakciók helyszíneként szolgálnak. Ez a sejtorganellum saját cirkuláris DNS-sel rendelkezik, de génjeinek egy része az evolúció során áthelyeződött a nukleáris örökítő anyagba (Nunnari és mtsai, 2012; Johnston és mtsai, 2016). Ez okozza, hogy mind az mitokondriális (mtDNS), mind a nukleáris DNS (nDNS) mutációi okozhatnak rendellenességeket a mitokondriumok szerkezetében, amelyek klinikai manifesztációi különböző anyagcsere-betegségek, vagy neurológiai kórképek (Chinnery 2014; Gorman és mtsai, 2016).
Okok az abnormális mitokondriális működésre
A mitokondriális betegségek jelentős részében a légzési lánc funkciója károsodik, ami maga után vonja a csökkent energiatermelést, így a sejt károsodását. A légzési lánc több, mint 70 polipeptidből épül fel, melynek többségének aminosav sorrendjét a nDNS kódolja, és szintézise a citoplazmában zajlik, csupán 13 polipeptid transzkripciója és transzlációja kötött a mtDNS-hez (Larsson; Clayton, 1995; Chinnery, 2014). A betegségek csoportosításának egyik alapja, hogy a mutáció melyik örökítőanyag-állományt érintette (Koopman és mtsai, 2012), a teljes kategorizálás azonban sokkal összetettebb. Klinikailag hasonló tünetek eltérő szerkezeti rendellenességre, és különböző, azokat kiváltó mutációkra vezethetőek vissza.(Chinnery, 2014) Például ophthalmoplegia externát okozhat az mtDNS-ben egy egyetlen nukleotidot érintő pontmutáció, egy deléció, vagy a gén patogén alléljének jelenléte is (Finsterer, 2019). Másrészről azonos mutációk különbözőképpen fejeződnek ki, más személyeknél más tünetek jelentkeznek, azaz alacsony a genotípus-fenotípus korreláció (Chinnery, 2014). Az A3243G mitokondriális gén mutációja például klinikai tünetként okozhat általános izomgyengeséget, terhelési intoleranciát, nagyothallást, diabetes mellitust vagy súlyos encephalopatiát visszatérő epilepsziás rohamokkal (Chinnery, 2014; Gál és mtsai, 2008). A mitokondriális betegségek előfordulása az emberi társadalomban 1:8500 (Gorman és mtsai, 2015). Ha a mutáció az ivarsejteket is érinti, akkor a betegség öröklődik, így viszont a mtDNS-t érintő defektusok csak anyai ágon adhatóak tovább.(Gorman és mtsai, 2016; Lightowlers és mtsai, 1997). A mitokondriális rendellenességek fő okai (Chinnery, 2014):
- nukleáris DNS mutációja:
- a légzési láncot érinti: strukturális fehérje-alegységet, enzim-kötő faktort, transzlációs faktort kódoló gén (Leigh-szindróma, hepatopathia, ketacidosis, myopathia, látóideg-bénulás, encephalopathia)
- többszörös DNS deléció (autoszomális progresszív külső szembénulás, mitokondriális neurogastrointestinális encephalomyopathia)
- egyéb, pl: lactacidosis, cardiomyopathia, Q10-koenzim hiány
- mitokondriális DNS mutációja:
- szerkezeti mutációk: deléció, duplikáció (Kearns-Sayre-szindróma, krónikus progresszív külső szembénulás, nagyothallás, diabetes)
- pontmutáció (Leber-féle veleszületett vakság, Leigh-szindróma)
- tRNS-gének (mitokondrialis encephalomyopathia laktátacidózissal és stroke-szerű tünetekkel, cardiomyopathia, diabetes)
- rRNS-gének (süketség)
Születéskor a szervezet sejtjeiben lévő mitokondriumok örökítőanyag tartalma megegyezik (homoplazmia), a petesejtből származik. Az egyedi élet során a mtDNS-t érintő mutációk következtében számos mutáns változat jelenik meg a szervezetben az eredeti allél mellett, azaz a mitokondriális DNS különböző változata lesznek jelen. (heteroplazmia) (Melton, 2004). A mitokondriális betegségek klinikai heterogenitásának magyarázata, hogy más emberekben az azonos mutációk különbőző arányban vannak jelen, tehát eltér a heteroplazmia mértéke (Nunnari és mtsai, 2012). Jól megfigyelhető ez a jelenség a fehérjét kódoló gének mutálódásakor. Az ATP-áz enzim alegységét érintő T8993C/G mutáns allél előfordulása korrelál a klinikai tünetek súlyosságával: alacsony ráta esetén retinopathia, ataxia figyelhető meg, míg a magas heteroplazmia öröklődő Liegh-szindrómát okoz (Holt és mtsai, 1988; Nunnari és mtsai, 2012). Az emberi populációban az átlagos heteroplazmia 1-2% közötti (Smigrodzk és mtsai, 2005).
Szerkezeti abnormalitások
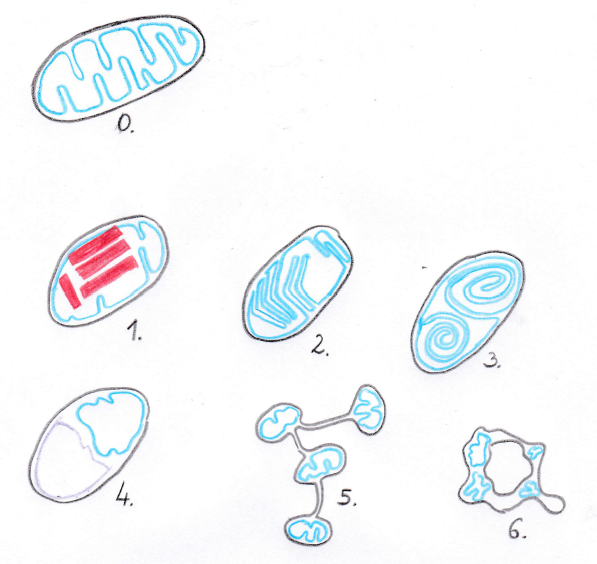
A normális felépítésű mitokondrium vázát egy külső és egy belső biológiai membrán alkotja, belül a mitokondriális mátrix, a kettő között pedig az intermembrán tér foglal helyet. A belső membrán betüremkedéseket, (cristae) képez a mátrix felé, de nem hoz létre rekeszeket (Vincent és mtsai, 2016; 8). A mitokondriális szerkezeti abnormalitások (1. ábra) közül ismert a 1. kristályos zárványok, 2. crista-linearizáció, 3. koncetrikus crista-rendeződés, 4. mátrix kompartmentizáció, 5. nanocsatornák képződése, 6. fánk alak(Vincent és mtsai, 2016).
- Kristályos zárványok: a kristályos zárványok téglalap alakú merev képletek a mitokondriumok belsejében. Mutáció miatt a belső membrán kreatin-shuttle mechanizmusának csökkent aktivitása miatt a mártixban kreatin hiány alakul ki, ami a kreatin-kináz (CK) enzim génjének fokozott transzkripciójához és transzlációhoz vezet. Az így felszaporodó CK rigid zárványokat képez a mátrixban (Eppenberger-Eberhardt és mtsai, 1991).
- Crista-linearizáció: a membrán normális betüremkedései mellett megjelennek különálló, kiegyenesedett, vagy szögben törő membránképződmények, amelyek fokozott elektrondenzitása és megváltozott fluiditása a normálistól eltérő fehére- és lipidkomponensek jelenlétére, valamint más cardiolipin összetételre utal (Vincent és mtsai, 2016).
- Koncentrikus crista-rendeződés: a belső membrán betüremkedései nem normális, a külső membránhoz visszatérő képeltek, hanem koncentrikusan, „hagymahéjszerűen” rendeződnek el. Ez az abnormális membránrendeződés összefüggést mutat az ATP-áz enzim hibás dimerizációjával (Paumart és mtsai, 2002).
- Mátrix kompartmentizáció: normális struktúrájú mitokondriumok esetében a mátrix folytonos önmagával, nem alakulnak ki benne rekeszek. Más esetben viszont létrejönnek benne elkülönült kompartmentek, amelyek a normális crista-képletek hiányát okozzák. A rekeszeket határoló abnormális egy- vagy kétrétegű membránok megnövekedett elektrondenzitása megváltozott molekuláris mintázat bizonyítéka. A hibás membránfúziók következtében a mátrix akár közlekedhet is a citoplazmával, ami gyulladásketlő anyagok vérkeringésbe való bejutását teszi lehetővé, így elősegítve szervkárosodási folyamatokat (Zhang és mtsai, 2010).
- Nanocsatornák képződése: 50-200 nm átmérőjű csatornák képződése, amelyek összekötnek különálló mitokondriumokat. Élettani szerepük még nem teljesen tisztázott, de bizonyára szerepet játszik a mitokondriumok közti kommunikációban, molekulák átjuttatásában, viszont megkönnyíti defektusok terjedését is (Vincent és mtsai, 2016).
- Fánk alak: mitokondriumok fokozott fúziója, vagy az osztódás elmaradása megnyúlt, elágazó struktúrákat eredményez. Ha a megnövekedett sejtorganellum önmagával fúzionál, akkor fánk alakú mitokondrium jön létre. Ez utóbbit legalább 34%-os heteroplazmia okozhatja (Vincent és mtsai, 2016).
A mutációk következtében kialakuló abnormális szerkezeti változatok, melyek elektronmikroszkóppal vizsgálhatók, a normális anyagcsere-folyamatok megváltozását okozzák, így összetett metabolikus és neurológiai kórképeket idézhetnek elő (Vincent és mtsai, 2016).
|
1. ábra: Normális és abnormális szerkezetű mitokondriumok (0. normál mitokondrium, 1. kristályos zárványok, 2. linearizáció, 3. koncentrikus crista-rendeződés, 4.kompartmentizáció, 5. nanocsatornák, 6. fánk alak); színek: fekete=külső membrán, kék (és lila)=belső membrán, piros=zárvány |
Okozott betegségek
Mitokondriális abnormalitások az Alzheimer-kórban
Wang és mtsai (2008) kimutatták, hogy Alzheimer-kóros betegekből vett fibroblasztok EM képén a mitokondriumok szignifikánsan hosszabbak voltak, több pedig összekapcsolódott és hálózatot képzett. Ennek hátterében valószínűleg a DLP1 (dynamin-like protein 1) fehérje csökkenése áll, mivel kísérletesen megfigyelték, hogy normál emberi fibroblasztokban a DLP1 kiütése és domináns-negatív DLP1 termeltetése ugyan ezeket a változásokat okozza valamint a beteg fibroblasztokban a DLP1 túltermeltetése helyreállította az abnormális változásokat. Ezen kívül e fehérje csökkenése révén a mitokondriumok főleg a perinukleáris területre csoportosultak. Az APP-re (amyloid precursor protein) vonatkozó kísérletek kimutatták, hogy annak túl expresszálása következtében rendkívül megnőtt a normálistól eltérő fragmentált, pontszerű struktúrát mutató mitokondriumok száma (a vad típusnál az 50, a mutáns típusnál a 80%-ot is meghaladta), valamit itt is megfigyelték, hogy a mitokondriumok a perinukleáris terület körül halmozódtak fel, máshol viszont alig voltak.
Más vizsgálatokból leírták a reaktív oxigén-formák megnőtt termelését, a csökkent ATP-termelést, a membránpotenciál csökkenését és a csökkent differenciálódó-képességet. Továbbá csökkent a DLP1 és OPA1 fehérje szintje és nőtt a Fis1 (mitochondrial fission 1 protein), ami a mitokondriumok töredezéséhez vezet. Valószínűleg mindez nagy hatással van az Alzheimer beteg neuronok mitokondriumainak fragmentálódására, ami fontos szerepet játszik a mitokondriumok funkcióvesztésében (Barsoum és mtsai, 2006).
A mitokondriumok nagy számban fordulnak elő a szinaptikus terminálisokban, valószínűleg a szinaptikus transzmisszióban részt vevő neuronok fokozott ATP-igénye és a kalcium pufferolása miatt (Sheehan és mtsai, 1997). A fentebb leírt abnormális perinukleáris mitokondrium eloszlásra a szinaptizáló neuronok különösen érzékenyek. Kísérletekből levont következtetések alapján feltételezhető, hogy az ezekben a neuronokban a mitokondriális eloszlás hibái helyi calcium-és energiahiányt okoznak, ezzel a szinaptikus defunkcionalitást okozva (Lacor és mtsai, 2007).
Mitokondriális abnormalitások cardiovascularis betegségekben
A szív ischaemiája a mitokondriumok fragmentációjához vezet azáltal, hogy Dnp1 hasadási protein termelése up-regulálódik. Egészséges szívben a Dnp1 folyamatos gátlása óvja meg a mitokondriumot a feldarabolódástól és az apoptózistól (Ong és mtsai, 2010). A túltermelődött Dnp1 pro-apoptotikus komplexet képez az Mfn2 (mitofusion-2) és BAX (Bcl-2-associated X-protein) fehérjével a külső membránon, ami MPTP-k (mitokondriális permeabilitási pórus) nyitásához és citokróm-c felszabadulásához vezet, ami a mitokondriumok fragmentációját és a cardiomyocyták apoptózisát indukálja (Karbowski és mtsai, 2002).
Victor és mtsai (2009) kimutatták, hogy ha az elektrontranszport-lánc leválasztódik az ATP-termeléstől, az a reaktív oxigén-formák szintjének növekedéséhez vezet, ami által növekszik a lipidek és fehérjék oxidációja. Növekszik az oxidált LDL (alacsony sűrűségű lipoprotein) szint, az erekben gyulladások alakulnak ki és gátlódik az endothel funkciója, mindez pedig érelmeszesedéshez vezet.
A mitokondriális kreatinin-kináz a légzési lánc aktivitás szabályozásában játszik szerepet és kreatininből állít elő foszfokreatint, ami szerepet játszik a myocardium ATP-puffer tartalmának fenntartásában (Jacobus, 1985). Az enzim reaktívabb oktamer és kevésbé aktív dimer alakjának egyensúlya felborul szívbetegségben a dimer felé a fokozott oktamer disszociáció (Soboll és mtsai, 1999) és az oktamerből való inaktív krisztalloid képződés miatt (Stadhouders, 1994). Ez a légzés ellenőrzésének romlásához és a szív nagyobb ATP-fogyasztása miatti foszfokreatin hidrolízishez vezet. Ez végső soron csökkent ATP szintet eredményez, ami a szív teljesítményét csökkenti (Ashrafian, 2002).
Az inzulinfüggő jelátvitel zavara vagy korlátozott működése szabályozza a lipidek mitokondriális β-oxidációjáról való rugalmas áttérést a glükóz-felhasználásra csökkent lipid-szint esetén. Ekkor a szív ATP-készlete fokozatosan kimerül, mivel a csökkent zsírsav-oxidációt nem pótolja növekedett glükóz-oxidációval (Neglia és mtsai, 2007).
Ismert a sejtekben az autofágia jelensége is, amely a károsodott, funkcióját vesztett mitkondriumok eltávolítását jelenti. Egyes hatások, pl. akut szív-ischaemia reperfúziós károsodás az autofágia csökkenéséhez és a hibás mitokondriumok felhalmozódásához vezet. Ennek következtében oxidatív stressz és a cardiomyocyták apoptózisának növekedése lép fel (Campos és mtsai, 2016).
Mitokondriális zavarok a szemészetben
A domináns szem atrophia genetikai betegség, amely elsősorban a retina ganglion sejtjeire és idegrostjaira hat. Főleg a sejtmagi DNS OPA1 génjében történt mutáció okozza (Delettre és mtsai, 2000), amelyben a dynamin-függő GTP-áz enzim van kódolva. Ennek szerepe van a mitokondrium struktúrájának karbantartásában és a cytokróm-c megkötésében. Az OPA1 fúziós fehérje, szerepe van a mitokondriális hálózat és a membránpotenciál fenntartásában. Így ennek csökkenésével e két funkció hiányát követi a cytokróm-c túlzott felszabadulása és az apoptotikus kaszpáz aktiválódása (Olichon és mtsai, 2003).
Liu és mtsai (2011) kimutatták, hogy a Leber-féle optikai neuropathia mindkét szemben a központi látás fájdalommentes elvesztésével jár. Hátterében három pontmutáció áll a mtDNS légzési-lánc 1-alegységén. Egy genomszintű expressziós profilozási tanulmány kimutatta, hogy a betegségben szenvedők leukocytáiban a háromból az egyik pontmutáció (G11778A) az OPA1 expresszió down-regulációját okozza, ami feltételezhetően fragmentált mitokondrium hálózatot, a mitokondriális membránpotenciál megváltozását valamint a n. opticus mitokondriumaiban a cristák strukturális rendezetlenségét eredményezi (Abu-Amero és mtsai, 2010).
A diabéteszes retinopathia pathogenezisében szerepet játszik a retinális mitokondrium progresszív diszfunkciója hyperglicaemia fennállásakor, a mtDNS károsodása valamint a retina kapilláris sejtjeiben a felgyorsult apoptózis. Ennek hátterében a MMP2 (matrix-metalloprotinase-2) áll, amely aktiválódva a Hsp60 (heat shock protein 60) fehérjén keresztül roncsolja a mitokondriális membránt, valamint károsítja a connexin 43-at, ami az apoptózist aktiválja (Mohammad és Kowluru, 2010, 2011).
A glaukóma az egyik leggyakoribb oka a vakságnak. A látóideg mitokondriumai különösen érzékenyek a légzési kapacitás károsodására, ami szelektíven károsítja a retina ganglion sejtjeit (Osborne és mtsai, 2010). Ju és mtsai (2010) kimutatták, hogy az OPA1 (optic atrophy 1) fehérje túlexpressziója az egér retinális ganglion sejtjeire védő hatással van: csökkenti az apoptózis mértékét, ami valószínűleg csökkent glaukomális változásokhoz vezet.
Pearson-szindróma
A Pearson-szindróma (Perason Syndrome, PS) egy újszülöttekben előforduló, ritka, több szervrendszert érintő betegség, jellemző klinikai tünetei közé tartozik a sideroblasztos anaemia (a gerincvelő vérképzési zavara), laktát-acidózis, a hasnyálmirigy exokrin enzimtermelésének zavara és a fejlődésbeli visszamaradás. Gyakori ezek mellett a vese- és májelégtelenség kialakulása is. A betegséget a mitokondriális DNS 4.977 kbp hosszú szakaszának deléciója okozza,az oxidatív foszforilációban részt vevő komponenseket kódoló génszakaszok kivágódása történik a mtDNS-ből. A részeletes analízis kimutatta, hogy a mutáció a NADH-dehidrogenáz négy alegységét, a citokrómoxidáz és az ATPáz egy-egy alegységét érinti (Rotig és mtsai, 1989). Ezáltal a légzési lánc nem képes betölteni feladatát, a sejt energiaellátottsága sérül. Különböző típusú szövetekben is kimutatható a deléció, ami azt sugallja, hogy mtDNS sérülése még az embrionális fejlődés során történik. A betegség nagy százalékban okoz korai halált az újszülöttekben, azokban a gyerekekben, akik viszont túlélik a korai szakaszt, a Kearns-Sayre-szindróma alakul ki (Saneto, Russel P., 2017).
Kearns-Sayre-szindróma
A Kearns-Sayre-szindróma (Kearns-Sayre Syndrome, KSS) egy több szervrendszert érintő betegség, amely 20 éves kor előtt jelentkezik, CPEO (chronic progressive external ophthalmoplegia) és a retina pigmentsejtjeinek degradációja (retinitis pigmentosa) formájában. Jellemző tünet még a szív ingerületvezetésének megszakadása (szívblokk), cardiomyopathia, cerebelláris ataxia, kognitív képességek csökkenése, halláskárosodás, izomgyengeség és endocrinopathia (Saneto, Russel P., 2017). A mtDNS-ben bekövetkezett deléció okozza ezt a kórképet. A betegek mind heteroplazmitást mutatnak (mind normál, mint deléción átesett mtDNS megtalálható a sejtjeikben), a nagyobb mértékben érintett szövetek (például agy vagy izomszövetek) nagyobb arányban tartalmaznak sérült mtDNS-t, ez azonban egyénenként tág keretek között változó lehet (27-85%). A deléció mértéke sem egységes, 1.3-7.6 kbp között változik (Nils-Göran Larsson és mtsai, 1990). Bár a betegség pontos háttere, súlyosságának függvénye és előrehaladottságának szabályozó tényezői még nem teljes mértékben ismertek, az MT-CO1, MT-CO2 vagy MT-CO3 gének legalább egyikének deléciójával összefüggésben állnak ezek a tényezők (Grady és mtsai, 2014).
Állatorvosi vonatkozás
A mitokondriomok szerkezetében fellépő abnormalitások nem csak humánorvosi, hanem állatorvosi esetekben is felelőssé tehetők bizonyos kórképek kialakulásában. Van Driessche és mtsai (2015) ismeretlen eredetű izombántalomban szenvedő lovak Musculus quadriceps femoris izmának post mortem elektronmikroszkópos vizsgálatával kimutatták, hogy a betegségük összefüggésbe hozható megnyúlt alakú mitokondriumokkal, melyek a normálisnál kevesebb cristát tartalmaznak. Kutyák esetében az idegsejtek perikaryonjában és axonjában óriásivá fúzionált mitokondriumok neurodegeneráción, a Purkinje-sejtek számának csökkenésén és a nagy- és kisagy neuropiljének szerkezeti fellazulásán keresztül vezet encephalomyelopathiahoz (Brenner és mtsai. 1997). Fell és mtsai (1975) szarvasmarhák enterocytáiban lévő mitokondriumok rendellenes méretbeli növekedését vizsgálták, és mutattak ki kapcsolatot rézhiány okozta hasmenéses betegségekkel.
Terápiás lehetőségek és nehézségek
A mitokondrium létfontosságú sejtalkotója test szinte minden sejtjének. Nem csoda tehát, hogy a mitokondrium szerkezetében, genomjában bekövetkezett változás súlyos klinikai tüneteket eredményez, amelyek egyelőre tüneti kezeléssel enyhíthetőek, de teljes mértékben még nem gyógyíthatók. Az utóbbi években azonban jelentős előrelépés következett be mind a mitokondrium általános működésének megértésében, mind az okozott betegségek kórokozó folyamatainak feltárásában. Ezek ismeretében különböző terápiás stratégiákat dolgoztak ki a kutatók a rendellenességek kezelésére. Két tág csoportra oszthatók ezen stratégiák: egy „általános” terv, amely széles körben alkalmazható különféle betegségeknél, és egy „adott betegséghez igazított” stratégia, amely egy specifikus kórkép esetében alkalmazható. Az első csoportba tartozik:
- a mitokondrium biogenezisének aktivációja/regulációja
- a mitokondrium autofágiájának aktivációja/regulációja
- a mitokondrium apoptózisának inhibiciója
- toxikus vegyületek eliminálása
- a légzési lánc sérült elemeinek kikerülése
- sejtmag-átültetés
A második csoportban megfogalmazott módszerek:
- egyes betegségek jellegzetes toxinjainak megkötése
- nukleotidok pótlása
- gének és sejtek lecserélése
A felsorolt stratégiák mind több irányból is megközelíthetőek: gyógyszeres kezeléssel; géntranszferrel a hiányzó vagy javító fehérje kifejeződésért; őssejt- vagy szervátültetéssel (Viscomi és mtsai, 2015). A klinikai vizsgálatok nehézségét az adja, hogy nagy a geno- és fenotípusos változatosság a betegek körében, ezért nem könnyű megfelelő nagyságú alanycsoportokat kialakítani, akik ugyan azzal a genetikus változattal rendelkeznek, hogy elvégezhető legyen egy megbízható, statisztikailag véletlenszerű, kettős-vak kísérlet, placebo kontrollal (Kanabus és mtsai, 2013). További problémát vet fel a mitokondrium mátrixának elérése is, mivel a hatóanyagoknak számos membránon keresztül kell hatolniuk, hogy a célterületre kerülhessenek (Heller és mtsai, 2012). Néhány technika azon alapul, hogy a bejuttatni kívánt molekulát egy olyan jelzőfehérjéhez kapcsolják, amit a sejt in vivo azoknak a fehérjéknek a megjelölésére használ, ami a citoplazmában keletkezik, de a mitokondriumban hasznosul. Másik módszer azon alapul, hogy liposzóma carrierekbe helyezik el a bejuttatni kívánt hatóanyagokat és egyéb molekulákat, amik segítik ezek megfelelő helyre jutását (Yamada és mtsai, 2007).
Források
- Abu-Amero, K. K.; Bosley, T. M.; Hellani, A.; Jeber, M. (2010): Genome-wide Expression Profile of LHON Patients with the 11778 Mutation. British Journal of Ophthalmology 94: (2) 256– 259
- Alston, C. L.; Blakely, E. L.; Chinnery, P. F.; Feeney, C.; Gomez, N.; Gorman, G. S.; Horvath, R.; Mc Farland, R.; Ng, Y.; Schaefer, A. M.; Taylor, R.W.; Turnbull, D.M.; Yu-Wai-Man, P. (2015): Prevalence of Nuclear and Mitochondrial DNA Mutations Related to Adult Mitochondrial Disease. Annals of Neurology 77: (5) 753-759
- Apostolova, N.; Herance, R.; Hernandez-Mijares, A.; Rocha, M.; Victor, V. M. (2009): Oxidative Stress and Mitochondrial Dysfunction in Atherosclerosis: Mitochondria-Targeted Antioxidants as Potential Therapy. Current Medicinal Chemistry 16: (35) 4654–4667
- Arnaud, B.; Astarie-Dequeker, C.; Belenguer, P.; Delettre, C.; Ducommun, B.; Gigarel, N.; Griffoin, J-M.; Grosgeorge, J.; Hamel, C. P.; Kaplan, J.; Lasquellec, L.; Lenaers, G.; Lorenzo, C.; Pelloquin, L.; Perret, E.; Turc-Carel, C. (2000): Nuclear Gene OPA1, Encoding a Mitochondrial Dynamin-Related Protein, is Mutated in Dominant Optic Atrophy. Nature Genetics 26: (2) 207–210
- Ashrafian, H. (2002): Cardiac Energetics in Congestive Heart Failure. Circulation 105: (6) 44–45
- Baricault, L.; Belenguer, P.; Gas, N.; Guillou, E.; Lenaers, G.; Olichon, A.; Valette, A. (2003): Loss of OPA1 Perturbates the Mitochondrial Inner Membrane Structure and Integrity, Leading to Cytochrome C Release and Apoptosis. Journal of Biological Chemistry 278: (10) 7743–7746
- Barsoum, M. J.; Bossy, B.; Bossy-Wetzel, E.; Cui, J.; Ellisman, M. H.; Gerencsér, Á. A.; Gräber, S.; Kovács, I.; Kushnareva, Y. E.; Lee, W. D.; Liot, G.; Lipton, S. A.; Martinou, J-C.; Perkins, G. A.; Waggoner, J.; White, A. D.; Youle, R. J.; Yuan, H. (2006): Nitric Oxide‐Induced Mitochondrial Fission is Regulated by Dynamin‐Related GTPases in Neurons. The EMBO Journal 25: (16) 3900-3911
- Bechara, L. R. G.; Bozi, L. H. M.; Campos, J. C.; Ferreira. C. B.; Lima, V. M. (2016): Mitochondrial Quality Control in Cardiac Diseases. Frontiers in Physiology 7: 479
- Blakely, E. L.; Campbell, G.; Falkous, G.; Gorman, G. S.; Grady, John P.; Mc Farland, R.; Mc Nally, R. J.; Nesbitt, V.; Ratnaike, T.; Schaefer, A. M.; Taylor, R. W.; Turnbull, D. M. (2014): Disease Progression in Patients with Single, Large-Scale Mitochondrial DNA Deletions. Brain 137: (2) 323–334
- Brdiczka, D.; Jahnke, D.; Schlattner, U.; Schmidt, A.; Soboll, S.; Wallimann, T.; Wendt, S.; Wyss, M. (1999): Octamer-Dimer Transitions of Mitochondrial Creatine Kinase in Heart Disease. Journal of Molecular and Cellular Cardiology 31: 857–866
- Brenner, O.; Cummings, J. F.; de Lahunta, A.; Monachelli, M.; Summers, B. A. (1997): A Canine Encephalomyelopathy with Morphological Abnormalities in Mitochondria. Acta Neuropathologica 94: (4) 390-397
- Brèthes, D.; Coulary, B.; di Rago, J. P.; Mueller, D. M.; Paumard, P.; Schaeffer, J.; Soubannier, V.; Vaillier, J.; Velours, J. (2002): The ATP Synthase is Involved in Generating Mitochondrial Cristae Morphology. The EMBO Journal 21: (3) 221-230
- Brohi, K.; Chen, Y.; Hauser, C. J.; Itagaki, K.; Junger, W.; Raoof, M.; Sumi, Y.; Sursal, T.; Zhang, Q. (2010): Circulating Mitochondrial DAMPs Cause Inflammatory Responses to Injury. Nature 464: (785) 104-107
- Buniel, M. C.; Clemente, A. S.; Furlow, P. W.; Klein, W. L.; Lacor, P. N.; Velasco, P. T.; Viola, K. L.; Wood, M. (2007): A Beta Oligomer-Induced Aberrations in Synapse Composition, Shape and Density Provide a Molecular Basis for Loss of Connectivity in Alzheimer’s Disease. The Journal of Neuroscience 27: (4) 796–807
- Casadesus, G.; Fujioka, H.; Moreira, P.; Siedlak, S.; Su, B.; Wang, X.; Wang, Y.; Zhu, X. (2008): Amyloid-beta Overproduction Causes Abnormal Mitochondrial Dynamics Via Modulation of Mitochondrial Fission/ Fusion Proteins. Proceedings of the National Academy of Sciences of the United States of America 105: (49) 19318–19323
- Caterina, A.; Ciardetti, M.; Ciociaro, D.; Gastaldelli, A.; L’Abbate, A.; Marraccini, P.; Menichetti, L.; Natali, A.; Neglia, D.; Pellegrini, P.; Testa, R.; Vecoli, C. (2007): Impaired Myocardial Metabolic Reserve and Substrate Selection Flexibility during Stress in Patients with Idiopathic Dilated Cardiomyopathy. American Journal of Physiology-Heart and Circulatory Physiology 293: (6) 3270–3278
- Chinnery P. F. (2014): Mitochondrial Disorders Overview. Gene Reviews® [Internet]
Chinnery, P. F.; DiMauro, S.; Gorman, G.; Hirano, M.; Koga, Y.; Mc Farland, R.; Thorburn, D. R.; Turnbull, D. M.; Zeviani, M. (2016): Mitochondrial Diseases. Nature Reviews Disease Primers 2: 16080
- Chinnery, P. F.; Howell, N.; Lightowlers, R. N.; Turnbull, D. M. (1997): Mammalian Mitochondrial Genetics: Heredity, Heteroplasmy and Disease. Trends in Genetics 13: (11) 450-455
- Davis, R. E.; Miller, S. W.; Parker, W. D.; Parks, J. K.; Sheehan, J. P.; Swerdlow, R. H.; Tuttle, J. B. (1997): Calcium Homeostasis and Reactive Oxygen Species Production in Cells Transformed by Mitochondria from Individuals with Sporadic Alzheimer’s Disease. The Journal of Neuroscience 17: (12) 4612–4622
- Duong-Polk, K. X.; Ellisman, M. H.; Ju, W-K.; Kim, K-Y.; Lindsey, J. D.; Weinreb, R. N. (2010): Increased Optic Atrophy Type 1 Expression Protects Retinal Ganglion Cells in a Mouse Model of Glaucoma. Molecular Vision 16: 1331–1342
- Eppenberger, H.M.; Eppenberger-Eberhardt, M.; Messerli, M.; Müller, M.; Riesinger, I.; Schwarb, P.; Wallimann, T. (1991): Adult Rat Cardiomyocytes Cultured in Creatine-deficient Medium Display Large Mitochondria with Paracrystalline Inclusions, Enriched for Creatine Kinase. Journal of Cell Biology 113: (2) 289-302
- Fell, B.F.; Dinsdale, D.; Mills, C.F. (1975): Changes in Enterocyte Mitochondria Associated with Deficiency of Copper in Cattle. Research in Veterinary Science 18: (3) 274-281
- Finsterer, J. (2019): Mitochondrial Ophthalmoplegia Is Not Only due to mtDNA Deletions. Yonsei Medical Journal 60: (2) 230-231
- Frank, S.; Fuller, M.; Gaume, B.; Jeong, S. Y.; Karbowski, M.; Lee, Y. J.; Nechuhstan, A.; Santel, A.; Smith, C. L.; Youle, R. J. (2002): Spatial and Temporal Association of Bax with Mitochondrial Fission Sites, Drp1 and Mfn2 During Apoptosis. Journal of Cell Biology 159: (6) 931–938
- Friedman, J.R.; Nunnari, J. (2014): Mitochondrial Form and Function. Nature 505: (7483) 335-343
- Fujioka, H.; Su, B.; Wang, X.; Zhu, X. (2008): Dynamin-like Protein 1 Reduction Underlies Mitochondrial Morphology and Distribution Abnormalities in Fibroblasts from Sporadic Alzheimer’s Disease Patients. The American Journal of Pathology 173: (2) 470–482
- Gál, A.; Szabó, A.; Pál, Zs.; Pentelényi, K. (2008): Maternálisan Öröklődő Diabetes Mellitus, Nagyothallás, Krónikus Progresszív Ophthalmoplegia Externa és Myopathia mint az mtDNS A3243G-mutáció Következménye. Orvosi Hetilap 149: (34) 1593-1598
- Guan, M. X.; Ji, Y.; Li, C.; Li, Y.; Lin, B.; Liu, X-L.; Qu, J.; Sun, Y-H.; Wei, Q-P.; Yang, L.; Yuan, Y.; Zhang, J.; Zhang, Y.; Zhao, F.; Zhou, J.; Zhou, X. (2011): Leber’s Hereditary Optic Neuropathy is Associated with the T12338C Mutation in Mitochondrial ND5 Gene in Six Han Chinese Families. Ophthalmology 118: (5) 978–985
- Hausenloy, D. J.; Ong, S. B. (2010): Mitochondrial Morphology and Cardiovascular Disease. Cardiovascular Research 88: (1) 16–29
- Heller, A.; Brockhoff G.; Goepferich, A. (2012): Targeting Drugs to Mitochondria. European Journal of Pharmaceutics and Biopharmaceutics 82: (1) 1–18
- Holme, E.; Kristiansson, B.; Larsson, N.; Oldfors, A.; Tulinius, M. (1990): Progressive Increase of the Mutated Mitochondrial DNA Fraction in Kearns-Sayre Syndrome. Pediatric Research 28: (2) 131-136
- Ji, D.; Kamalden, T. A.; Majid, A. S. A.; Manso, A. G.; Olmo-Aguado, S.; Osborne, N. N. (2010): Light Effects on Mitochondrial Photosensitizers in Relation to Retinal Degeneration. Neurochemical Research 35: (12) 2027–2034
- Johnston, I. G.; Williams, B. P. (2016): Evolutionary Inference across Eukaryotes Identifies Specific Pressures Favoring Mitochondrial Gene Retention. Cell Systems 2: (2) 101-111
- Kanabus, M.; Heales, S. J.; Rahman, S. (2014): Development of Pharmacological Strategies for Mitochondrial Disorders. British Journal of Pharmacology 171: (8) 1798–1817
- Kowluru, R. A.; Mohammad, G. (2010): Matrix Metalloproteinase-2 in the Development of Diabetic Retinopathy and Mitochondrial Dysfunction. Laboratory Investigation 90: (9) 1365–1372
Kowluru, R. A.; Mohammad, G. (2011): Novel Role of Mitochondrial Matrix Metalloproteinase-2 in the Development of Diabetic Retinopathy. Investigative Ophthalmology & Visual Science 52: (6) 3832–3841
- Nunnari, J.; Suomalainen, A. (2012): Mitochondria: in Sickness and in Health. Cell 148: (6) 1145-1159
- Saneto, Russel P. (2017): Genetics of Mitochondrial Disease. Advances in Genetics 98: 63-116
- Van Driessche, K.; Chiersa, K.; Ducatellea, R.; Van Coster, R.; van der Kolk, J.H. (2015): Ultrastructural Mitochondrial Alterations in Equine Myopathies of Unknown Origin. Veterinary Quarterly 35: (1) 2-8
- Vincent, A.E.; Davey, T.; Falkous, G.; Feeney, C.; Gorman, G.S.; Mannella, C.; Mc Farland, R.; Ng Y.S.; Picard, M.; Schaefer, A.M.; Taylor, R.W.; Turnbull, D.M.; White, K. (2016): The Spectrum of Mitochondrial Ultrastructural Defects in Mitochondrial Myopathy. Scientific Reports 6: (1) 30610
- Viscomi, C.; Bottani, E.; Zeviani, M. (2015): Emerging Concepts in the Therapy of Mitochondrial Disease. Biochimica et Biophysica Acta 1847: (6-7) 544-557
- Yamada, Y.; Akita, H.; Harashima, H.; Kamiya, H.; Kogure, K. (2007): Mitochondrial Drug Delivery and Mitochondrial Disease Therapy – an Approach to Liposome‐based Delivery Targeted to Mitochondria. Mitochondrion 7: (1-2) 63–71
Ábrajegyzék
- 1. ábra: Saját készítés, Vincent és mtsai alapján