|
Size: 16879
Comment:
|
← Revision 45 as of 2014-12-03 16:00:54 ⇥
Size: 17076
Comment:
|
| Deletions are marked like this. | Additions are marked like this. |
| Line 12: | Line 12: |
| . (Kép forrása: Wikipedia) | . ''(Kép forrása: Wikipedia) '' |
| Line 26: | Line 26: |
| . (Kép forrása: Wikipédia) | . ''(Kép forrása: Wikipédia) '' |
| Line 45: | Line 45: |
| {{http://www.wiki.vetphysiol.hu/AllvanyFeherjek?action=AttachFile&do=get&target=1.kép+javított.png|1.kép javított.png|height="376",width="588"}} (Kép forráda: Saját rajz Ferrel és mtsai, (2000) nyomán) | {{http://www.wiki.vetphysiol.hu/AllvanyFeherjek?action=AttachFile&do=get&target=1.kép+javított.png|1.kép javított.png|height="376",width="588"}} ''(Kép forrása: Saját rajz Ferrel és mtsai, (2000) nyomán) '' |
| Line 49: | Line 49: |
| . Az első fontos eredmény ezekből a tanulmányokból, hogy egy állványnak képesnek kellene lennie növelni egy kaszkád által termelt output mennyiségét, de csak akkor ha nincs túl sok az állvány fehérjéből. Amint az állvány koncentráció meghaladja azt a szintet amit a protein kináz koordinál, a kaszkád output-ja csökkeni fog. [[attachment:2.kép (2).jpg]] | . Az első fontos eredmény ezekből a tanulmányokból, hogy egy állványnak képesnek kellene lennie növelni egy kaszkád által termelt output mennyiségét, de csak akkor ha nincs túl sok az állvány fehérjéből. Amint az állvány koncentráció meghaladja azt a szintet amit a protein kináz koordinál, a kaszkád output-ja csökkeni fog. . {{http://www.wiki.vetphysiol.hu/AllvanyFeherjek?action=AttachFile&do=get&target=2.kép+(2).jpg|2.kép (2).jpg|height="298",width="662"}} '' (Kép forrása: Saját rajz, Ferrel és mtsai(2000) nyomán) '' . |
Contents
Az állványfehérjék szerepe a jelátvitelben
A biológiában, az állványproteinek kulcsfontosságú szerepet játszanak a jelátvitelben. Habár még nem teljesen tisztázott a funkciójuk, a tudomány jelen álláspontja szerint feladatuk kapcsolat és/vagy kötések létesítése többféle jelátviteli folyamat, különböző faktorai között. Ezen túl protein komplexek létrehozásában lehet szerepe. Ily módon ezek az anyagok szabályozzák a jel transzdukciót és segítenek lokalizálni a jelátviteli komponenseket a sejt specifikus helyeire, úgy mint: a plazmamembrán, cytoplazma, Golgi, sejtmag, endosomák és mitokondriumok.
Első sikeres felfedezés
Az első jelátviteli állványfehérje, melyet felfedeztek a Ste5 volt, amit egy sörélesztő gombából (Saccharomyces cerevisiae ) mutattak ki. Az Ste5 protein egy állványfehérje amely irányítja a MAP kináz kaszkád feromon válaszát az élesztő sejteknek. Az Ste5 protein három különböző doménnel rendelkezik, amelyek multikináz complex képzésére képesek a Ste11, Ste7 és a Fus3 proteinkinázokkal. ( Choi és mtsai ,1994) (A protein kinázok olyan kémiai enzimek amelyek kémiailag módosítanak más fehérjéket úgy, hogy foszfát csoportokat építenek rájuk ami funkcionális változást okoz a célfehérjén. Ez a folyamat a foszforiláció.)
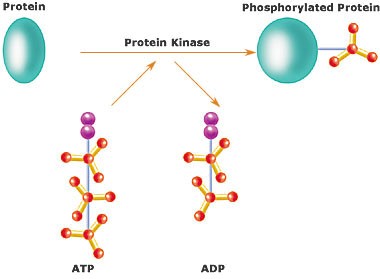
(Kép forrása: Wikipedia)
Az állványfehérjék főbb funkciói
- Az állványfehérjék legalább négy féle képen funkcionálnak:
- összekötik a jelátvivő komponenseket,
- ezeket lokalizálják a sejt specifikus helyein,
- szabályozzák a jel transzdukciót pozitív és negatív visszajelzésekkel ( feedback),
- szelektálják a helyes jelző fehérjéket a többi proteintől.
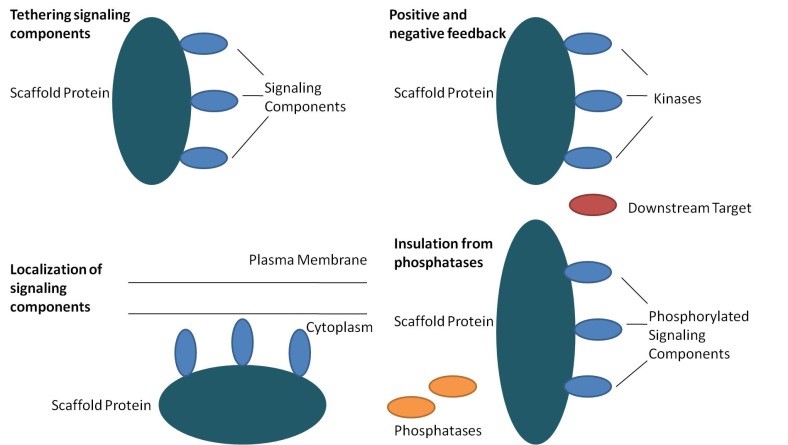
(Kép forrása: Wikipédia)
Jelátvivő komponensek összekötése
Ez a tevékenység az állványfehérjék legalapvetőbb funkciója. A jelátvivő komponensek komplexbe gyűjtése képes növelni a jelző specifitását. Ezzel a tevékenységgel megelőzve a szükségtelen interakciókat a jelző proteinek között, és növelve a jelzés hatásosságát, valamint a komponensek közelségi és effektív koncentrációját. Egy gyakori példa arra, hogy az állvány proteinek hogyan növelik a specifitást, hogy egy állványfehérje megköt egy protein kinázt, ezáltal biztosítja a specifikus kináz foszforilációt. Továbbá, néhány jelátvivő fehérjének többszörös interakciókra van szüksége, hogy aktiválódhasson, és az állvány kötés képes lehet biztosítani ezeket a kapcsolatokat egy kölcsönhatáson keresztül aminek eredménye egy többszörös módosítás. ( Ferrell és mtsai., 2000) Az állváványfehérjék katalitikus hatásúak is lehetnek. Kapcsolatba lépve a jelző proteinekkel, így ezeknek a jelző komponenseknek a konformáció változását okozzák. Ezek a változások hathatnak serkentőleg és gátlólag is ezen komponensek aktivitására. Példának okául ilyen az Ste5 állványfehérje mitogen-aktivált protein kináz (MAPK) útja. Az Ste5 feltételezett feladata a direkt kapcsoló jelzés a Fus3 MAPK-on keresztül úgy, hogy katalitikusan feloldja ezt a különös kinázt, hogy aktiválódhasson a MAPKK Ste7 által.
Jelátvivő komponensek lokalizációja
Az állványfehérjék a sejtek specifikus helyeire lokalizálják a jelátvivő reakciókat. Ez a folyamat fontos lehet a köztes termékek helyi termelődésének biztosításában. Ilyen különös példa erre a folyamatra az A-kináz rögzítő fehérje (AKAPs) amely feladata a ciklikus-AMP függő proteinkináz sejten belüli lokalizációja. Ez a lokalizáció képes arra, hogy szabályozza a protein kináz-A-t (PKA) amelynek eredménye a helyi foszforiláció a PKA által.(Wong és mtsai 2004)
Feedback szabályozás
Sok hipotézis szól arról, hogy az állványfehérjék koordinálják a pozitív és negatív visszajelzéseket, amelyek mesterséges állványfehérjékből és matematikai modellekből származtathatóak. Három kináz jelző kaszkádban az állványfehérjék megkötik mind a három kinázt, ezzel növelve a kináz sajátosságát és lekorlátozva a szignál erősségét azáltal, hogy egy irányba limitálja a kináz foszforiláció lefolyását. Ezek a képességek talán összefüggésben állnak az állványfehérjék többi funkciójával úgy mint a kinázok és az állványfehérjék kölcsönhatásának stabilizálása, a bazális foszfatáz aktiváció a sejten belül, a protein lokalizáció és az expresszió szintjei a jelátvívő komponenseknek.(Levchenko és mtsai, 2000)
Védelem az inaktiváció ellen
Ezek a jelátvívő utak gyakran inaktiválva vannak különböző enzimek által úgy, hogy megfordítják az aktiváció állapotát és/vagy megindítják a jelátvivő komponensek degradációját. Az állványfehérjék egyik fő feladata éppen ezért az, hogy megvédje az aktivált jelátvivő molekulákat az inaktiválástól/degradációtól. Matematikai modellek kimutatták, hogy a kinázoknak egy kaszkádban állványfehérjék nélkül nagyobb az esélyük arra, hogy defoszoforilálják őket a foszfatázok, mielőtt ők egyáltalán képesek lennének foszforilálni a cél folyamatokat. (Levchenko és mtsai, 2000)
Mit is csinálnak valójában az állványfehérjék?
A sarjadó élesztő párosodott feromon útjában, az Ste5 állványfehérje teljes mértékben kritikus a jelek átvitelében. Mikor az Ste5 megjelenik, a jelek továbbadódnak Ste11/Ste7p/Fus3p mitogen aktivált protein kináz (MAPK) kaszkádnak, és a feromon kapcsolat serkenteni tudja kapcsolódást. Amikor az Ste5 hiányzik, a jelek nem érik el a kaszkádot és a feromon nem teszi lehetővé a kapcsolatot. De pontosan miért is ilyen fontos az állványfehérje? Egyértelmű-e, hogy az Ste5p a kapcsolódó kinázokat a megfelelő IC helyre lokalizálja a jel fogadásához, vagy elszállítja őket a végcél irányába ( egy lehorgonyzó funkció)? Esetleg enged-e a kaszkádnak nagyobb, vagy gyorsabb kimeneteli (out-put) produkciót (egy gyorsító, katalizáló funkció)?
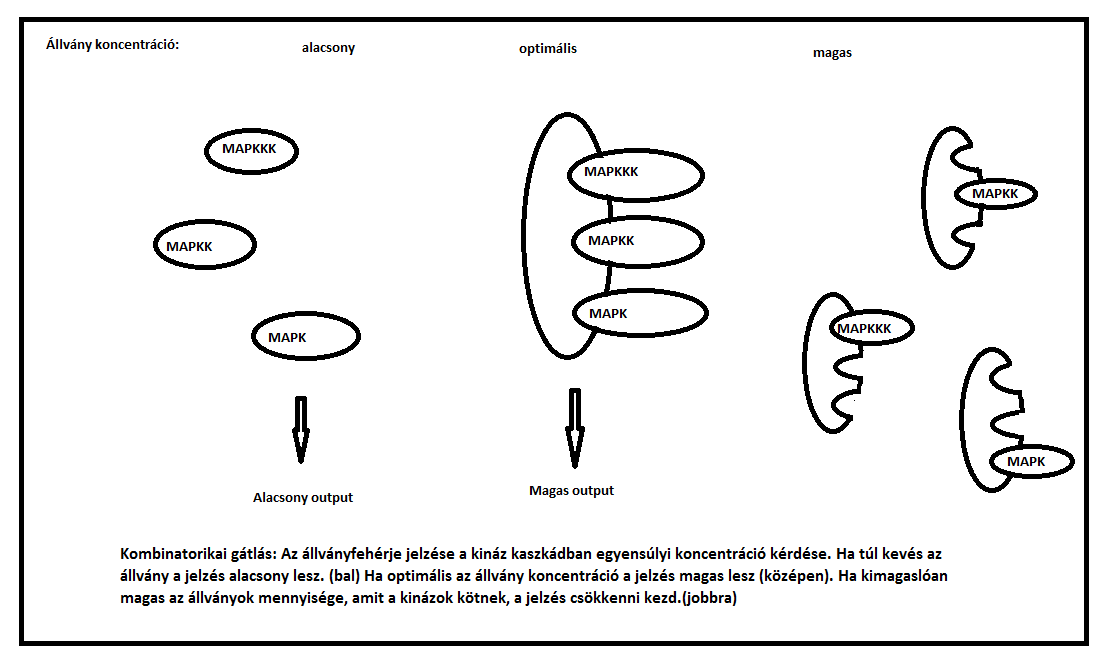 (Kép forrása: Saját rajz Ferrel és mtsai, (2000) nyomán)
(Kép forrása: Saját rajz Ferrel és mtsai, (2000) nyomán)
Mielőtt az előbb említett lehetőség célzott lehetne, meg kell értenünk, hogy az állvány-kináz mely körülmények között tudja növelni a jelzőkaszkád out-putját, mint ahogy egy állvány csinálhatja a jelző mechanizmusokat. Új lapok Bray, Lay, Levchenko, Bruck, és Sternberg-től izgalmas betekintést nyújtottak ebbe a kérdésbe egy számítógépes szimuláció segítségével, ami az állványok jelző rendszerét mutatja be.
- Az első fontos eredmény ezekből a tanulmányokból, hogy egy állványnak képesnek kellene lennie növelni egy kaszkád által termelt output mennyiségét, de csak akkor ha nincs túl sok az állvány fehérjéből. Amint az állvány koncentráció meghaladja azt a szintet amit a protein kináz koordinál, a kaszkád output-ja csökkeni fog.
.jpg) (Kép forrása: Saját rajz, Ferrel és mtsai(2000) nyomán)
(Kép forrása: Saját rajz, Ferrel és mtsai(2000) nyomán)
A nagyon magas állvány fehérje koncentráció határán egyetlen állvány molekula sem fog kötni egy kináz molekulánál többet, és ezért a kaszkád output-ja nagyon alacsony lesz. Az állvány kétfázisú hatása hasonló, mint a precipitin reakcióban levő egyensúly az antitest és antigén koncentráció között. Egy makroszkópos üledék produkciója csökkenthető úgy is, hogy túl sok az antigén, vagy úgy is,hogy túl kevés az antigén. Ez a jelenség régóta úgy ismert, hogy a “prozone effect”. Éppen ezért, Bray és Lay utalnak arra, hogy a magas koncentrációjú állvány gátló hatású, mint egy prozone effect. Levchenko, Bruck, és Sternberg javasoltak egy alternatív kifejezést- “kombinatorikai gátlás”, ami talán sokkal nyilvánvalóbb a modern füleknek. Ez a hatás meglehetősen általános; minden rendszerben ahol egy állványfehérje szerű protein (B) kötődik kettő vagy több proteinhez (A és C), hogy egy funkcionális komplexet alkosson (A-B-C), a B protein szint növelése kezdetben növelni, majd csökkenteni fogja az A-B-C komplex egyensúlyi szintjét. A kombinatorikai gátlás elmagyarázza, hogy a Jun NH2-terminal kináz (JNK) kaszkád állvány JIP-1, a JNK jelzés feltételezett segítője eredetileg miért úgy tűnt, hogy a JNK jelzés mechanizmus gátlója.
- Ennek a gátló hatása egy túltermelő fenotípusból volt következtetve, és amikor túltermelte ennek a hatását akkor ez egy prozone gátlás volt; egy élettanilag ellentétes hatás. Hasonlóan, a feltételezett állvány protein KSR-1, pozitívan tudja befolyásolni a Ras jelzést alacsony szintű termelésen, és negatívan tudja befolyásolni a Ras jelzést magas szintű termelés esetén. Az elmélet, hogy egy fehérje túltermelése csökkenteni tudja a jelzést, most méltányolt. Ami viszont kevésbé az, hogy egy kináz túltermelése maga szintén tudja csökkenteni az output-ját (kimenetelét) egy állványzott kaszkádnak, feltéve, hogy a kinázoknak nagy affinitásuk van egymáshoz.
Úgy tűnik, ennek az erős affinitásnak a feltételezése az élesztő kaszkádban kapcsolódó Fus3p és Ste7p-nek köszönhető. Lássuk, hogy a túl sok kináz miért csökkentheti le a jelátvitelt egy állványozott kaszkádnál, tekintve a képződését egy állványt tartalmazó komplexnek, -egy MAPKKK, MAPKK és MAPK- olyan körülmények között, ahol a kinázok egyike, a MAPK, magas koncentrációt mutat. Egy ezen három kinázból álló komplex egy állványmolekulán csak akkor képes átalakításra, ha van néhány állványmolekula, amely nem kötött MAPK-hoz, amely majd kötni tudná a MAPK-MAPKK komplexeket, vagy ha van néhány szabad MAPKK, amely képes az állvány-MAPK komlexet kötni. Viszont, ha MAPK eléggé nagy koncentrációban van jelen, lesz egy kevés állványozott és szabad MAPKK is. Mindkét fehérje kötött lesz a MAPK komlexekben.
A másik fontos eredmény a szimulációkból, hogy az állványfehérje azonnali választ produkál és átalakul egy minőségibb fehérjévé. Annak megértéséért, hogy ez miért történik, először azt kell megérteni, hogy miért várható egy állványfehérje nélküli kaszkádtól azonnali reakció (switchlike response). Az állandósult aktivitása néhány jelátvivőnek -magába foglalva A MAPK-t, ERK2-t, MAPK-kinázt és a MEK1 –et- „magasabb, mint a lineáris funkciók” a koncentrációra nézve, vagy az aktivitása az ellentétes oldali aktivitátoruknak. Az ilyen válaszok ultraérzékeny válaszoknak lettek elnevezve („ultrasensitive responses”), és ők képesek kifejlődni a hasonló mechanizmusokból, mint a Cooper-aktivitás: a szaturációs effektusokból, vagy a sztöchiometrikus inhibitorok (proteinek, amelyek kötnek és inaktiválják az ellentétes oldali aktivitátorokat) közül. Ha a különböző ultra érzékeny szignál átvivőket egymásra rakjuk egy jelző kaszkádban, az összesített válasza a kaszkádnak megközelít egy másodlagos funkciót. Pédául tegyük fel, hogy minden egyes kináz egy hármas-kináz kaszkádból választ mutat, ami olyan meredek, mint a cooperatív enzim Hill coefficiense ami 2. Így az összesített válasza a kaszkádnak a saját Hill coefficiense, azaz 2*2*2=8 (feltűnően magas („meredek”) válasz: például a hemoglobin Hill koefficiense az oxigén kötésére nézve 2,8). Egy 10 szintes kaszkád Hill-koefficiense ezek szerint már 1024.! Így ezeknek a kaszkádoknak nagyon nagy potenciálja van, hogy nagyon magas azonnali választ generáljanak. Egy különösen jól tanulmányozható kísérleti rendszer, a Xenopus ( békák rendjébe tartozó nem) petesejt kivonata: az biztos, hogy a lényeges MAPK kaszkád (Mos/MEK1/ERK2) generálja a választ, ami egyre inkább ultraérzékenyebb lesz, ahogy a kaszkád csökken.( Huang, C.-Y.F., and Ferrell, J.E., Jr. (1996) Ultrasensitivity., in the nitrogen-activated protein kinase cascade.) Az még a jövő zenéje, hogy vajon tényleg ez a közös kaszkád generálja az azonnali válaszokat, de ha igen, akkor ez egy esetleges magyarázat lehet arra, hogy miért épít a természet gyakran feleslegesnek tűnő szinteket a jelátvitelbe.
Levchenko, Bruck és Sternberg rámutat arra, hogy az álványfehérje képes megelőzni a kináz-kaszkádot egy azonnali reakció indukálásától. Például abban az esetben, amikor a MEK1 aktiválja az ERK2-t ez megjelenik, hiszen úgy tűnik, hogy az ultraérzékenység nagy része erre a két lépésre vezethető vissza, ami egy nem-processzív kettős foszforiláció, melyen keresztül a MEK1 aktiválja az ERK2-t. Az álványfehérje képes lenne az ERK2 foszforilációját átalakítani folyamatossá azzal, hogy átformálja nem ultraérzékennyé. Az állványfehérje képes ellensúlyozni más forrásait az ultraérzékenységnek, különösképp ha a protein-kinázok csak nagyon lassan képesek átváltani állvány funkcióról. (átváltanak állványról, csak nagyon lassan.) Ebben az esetben, egy álványozott kináz kaszkád hasonlít egy szilárd jelátviteli gépezetre, egy jel átszállítódik egy kinázról a következőre erősítés, hígulás, vagy moduláció nélkül.
- Másrészről, egy állvány képes lenne az ellenkező hatásra is, azaz egy minőségibb kaszkád választ átalakítani egy azonnali rakcióvá. Tegyük fel, hogy egy nem álványozott kaszkád eredményez egy nem ultraérzékeny, hanem egy minőségibb Michaelian választ, 1-es Hill coefficienssel. Aztán hozzáadva egy állvány fehérjét, ami csupán dimerként funkcionál. Úgy tűnik, hogy mind a Ste5p-nél és mind a Jip-család állvány fehérjéinél ez a helyzet. Ha a két állvány monomer függetlenül kellett volna hogy aktiválódjon azért hogy dimerizálódjon, az eredmény egy ultraérzékeny válasz volna 2 feletti Hill-koefficienssel. Így az állvány átvált egy Michaelian választ ultraérzékenyre.
A legfontontosabb kérdés hogy vajon valódi állvány-kaszkádok mutatják-e ezeket a becsült tulajdonságokat. A kombinatorikus gátlás kivételével, amelyre már vannak pozitív kísérleti bizonyítékok, nincs túl sok kísérleti eredmény-se pozitív, se negatív- ezen állvány-model feltevésekre. Ez a tény bemutatja, hogy még nem tudunk túl sokat a biokémiai in vivo vagy in vitro állványfehérje kutatási lehetőségekről. Vajon erősítik, gyorsítják a jelátvitelt, vagy csak lokalizálják őket? Vajon sérülékenyek az állványozott rendszerek? Figyelembe véve az egyes komponensek kontrációjának megzavarását. Vajon jobban osztályozott választ adnak, vagy azonnali rekciót, esetleg egyiket sem ? Visszafogják a jelek felerősítését, megelőzik a jelek csillapítását, vagy egyik sem ? Minden állványfehérje rendelkezik bizonyos általános tulajdonságokkal, mint pl a kombinatorikus gátlás ? Mely helyzetek azok, ahol az állvány funkciók jelentősen külöböznek állványról állványra? Bray, Lay, Levchenko, Bruck és Sternberg teóriái egyfajta keretként szolgálnak a továbbiakra nézve, hogy mi is az állványok igazi szerepe. Igen érdekes meghatározni, hogy valójában mit is csinálnak. ( Ferrell és mtsai , 2000)
Irodalomjegyzék:
- Choi, Kang-Yell; Satterberg, Brett; Lyons, David M.; Elion, Elaine A. (1994). "Ste5 tethers multiple protein kinases in the MAP kinase cascade required for mating in S. cerevisiae". Cell 78 (3): 499–512
- Ferrell, J.E., Jr., What do scaffold proteins really do? Sci STKE, 2000. 2000(52): p. PE1
- Levchenko, A., J. Bruck, and P.W. Sternberg, Scaffold proteins may biphasically affect the levels of mitogen-activated protein kinase signaling and reduce its threshold properties. Proc Natl Acad Sci U S A, 2000. 97(11): p. 5818–23.Wong, W. and J.D. Scott, AKAP signalling complexes: focal points in space and time. Nat Rev Mol Cell Biol, 2004. 5(12): p. 959–70.
- Wong, W. and J.D. Scott, AKAP signalling complexes: focal points in space and time. Nat Rev Mol Cell Biol, 2004. 5(12): p. 959–70.
- .
