Itt írjon a(z) Alzheimer-Krankheit_Viren-ról/ről
Virale Auslöser von Alzheimer
Anfang der 1990er Jahre wurde der Auslöser von Alzheimer erstmals mit Viren in Verbindung gebracht. Seitdem wird stetig geforscht, welche Viren das Risiko an Alzheimer zu erkranken, erhöhen. Ruth Itzhaki, Professorin an der Universität in Manchester forscht seit über 30 Jahren an der Verbindung von Alzheimer und Viren. Besonders im Fokus stehen die Herpes-Viren und seit Neustem auch Corona-Viren (insbesondere Sars-CoV-2) (Eimer et al., 2018).
Die Theorie, dass Viren ein möglicher Auslöser von Alzheimer sind, steht der Amyloid-Theorie gegenüber. Neuste Forschungen zeigen jedoch, dass β-Amyloid, abhängig von Alter und Genetik, das Gehirn vor viralen Infekten schützen und somit Alzheimer bis zu einem gewissen Grad vorbeugen könnte (Abbott, 2020).
Contents
Viren und Alzheimer
In der Amyloid-Theorie wird erklärt, dass Alzheimer durch eine Ansammlung an Amyloid-β-Peptiden (Amyloid-Plaques) in den Zwischenräumen des Gehirns ausgelöst wird. Dies steht aber im Widerspruch zur Viren-Theorie. Denn genau diese Plaques sollen die Infektion verhindern und Alzheimer vorbeugen können. Post mortem können Plaques auch bei Menschen ohne Alzheimer-Erkrankung gefunden werden, so Kritiker der Amyloid-Theorie. Die Kritiker weisen zudem darauf hin, dass bei Behandlungen gegen Plaques keine Erfolge beobachtet werden können. Die Versuche, in welchen Plaques aufgelöst werden sollten, hätten weder zu einer Verlangsamung, noch zu einer Heilung von Alzheimer geführt.
Anhänger der Amyloid-Theorie erwidern jedoch, dass dies daran läge, dass Plaques meist zu spät entdeckt wurden und als Schlussfolgerung nicht mehr behandelbar wären. Die untersuchten Plaques weisen unterschliedliche Strukturen auf und auch die verschiedenen Vorgeschichten der Menschen spielen beim Misserfolg eine Rolle. Ein weiterer Faktor ist die Genetik: Mutationen führen zu erhöhter Amyloid-Produktion und den daraus resultierenden Entzündungen.
Itzhaki spricht sich klar gegen die Kritik an der Infektions-Hypothese aus. In ihren eigenen Forschungen berichtet sie über die vermehrte Entdeckung des Herpes Simplex Virus 1 in Gehirnen von verstorbenen Alzheimer-Patienten. Das Amyloid-Peptid stellt dabei für Itzhaki ein wichtiges Merkmal und nicht die Ursache der Krankheit dar (Abbott, 2020).
Herpes
Besonders im Fokus bei viralen Auslösern der Alzheimer-Krankheit stehen Herpes-Viren. Mittlerweile findet man sehr viele Forschungen, welche das Auftreten dieser Viren mit Alzheimer in Verbindung bringen.
HSV-1
Allen voran steht das Herpes Simplex Virus 1, welches in einer hohen Anazhl Alzheimer-Patienten vorgefunden wurde. Interessanterweise haben sich die Viren in den Amyloid Plaques im Temporalen und Frontalen Cortex befunden. Itzhaki hebt hervor, dass eine ungewöhnlich hohe Zahl an Alzheimer-Patienten HSV-1 im Nervengewebe aufweisen, ohne je an einer Encephalitis gelitten zu haben. Auffällig ist, dass Menschen ohne das APOE4-Gen keine Risiken für einen Ausbruch von Alzheimer aufweisen. Menschen mit dem APOE4-Gen ohne Herpes-Infektion zeigen ein genauso geringes Risiko für einen Alzheimer-Ausbruch. Bei einer HSV-1-Infektion in Kombination mit dem APOE4 ist das Risiko, an Alzheimer zu erkranken, bis zu 12 mal höher, als ohne dieses Gen, laut Itzhaki. Bei wiederholter Reaktivierung des latenten Virus wird außerdem die Produktion von β-Amyloid angeregt, wodurch es zunehmend zu einem kognitiven Abbau kommt. Dieser löst final die Demenz aus (Duarte et al., 2019).
Itzhaki’s Theorie wird von mehreren neueren Studien bekräftigt: Interessant ist, dass fast alle Alzheimer-Patienten folgende Gemeinsamkeiten aufweisen: Hohes Alter, eine latente Infektion von HSV-1 und die Präsenz des APOE4-Gens.
Gestützt wird dies überdies in einer Studie von Deatly, in der 17 von insgesamt 21 Alzheimer-Patienten positiv auf das latente HSV-1 RNA Virus im Nervus Trigeminus getestet wurden (Deatly et al., 1990). Eine der vielen Maus-Studien untersucht die Latenz von HSV-1 im Ganglion trigeminale und im Gehirn und vergleicht dabei in vivo und ex vivo Ergebnisse. Ex vivo reaktiviert sich HSV-1 häufiger im Ganglion Trigeminale als im Gehirn. In vivo zeigt sich allerdings, dass die Anzahl viralen Genoms in den Hirnarealen signifikant größer ist, als im Ganglion trigeminale. Das unterstreicht auch die frühere und größere Reaktivationszahl im Gehirn (Yao et al. 2014).
Zusätzlich zum Temporal- und Frontallappen ist HSV-1 auch im Hippocampus entdeckt worden (Jamieson et al. 1992). Weitere Studien vergleichen die Präsenz von APOE4 in Kombination mit dem HSV-1, sowie das Varicella zoster virus (VZV). VZV wurde jedoch bei keinem der Alzheimer-Probanden nachgewiesen. Lediglich die Studien, welche einen Zusammenhang zwischen HSV-1 und dem APOE4-Gen nachweisen, kann man als repräsentativ bezeichnen (Sait et al. 2021).
Blut-Hirn-Schranke
Eine erhöhte Permeabilität der Blut-Hirn-Schranke (BHS) begünstigt die Durchlässigkeit von Viren und Bakterien ins Gehirn. Bei gesunden Menschen ist die Permeabilität jedoch zu gering, als dass Bakterien und Viren ins Gehirn gelangen können. Gründe für eine erhöhte Permeabilität sind unter Anderem Tumore, Krankheiten wie Multiple Sklerose, Parkinson oder auch Medikamente wie Penicillin (welches beispielsweise gegen Meningitis verabreicht wird) (Daneman, 2012). Zusätzlich dazu kann die Herpes Simplex-Encephalitis die Blut-Hirn-Schranke stören und HSV-1 somit unbegrenzten Einlass gewähren (Liu et al. 2019). Weitere Störungen der Blut-Hirn-Schranke können durch Hypertonie, Rauchen, Hypercholesterolämie und Altern auftreten (Bradshaw und Venkatesan, 2016).
Eine Studie an Mäusen, welchen das HSV-1 intraperitoneal injiziert wurde, zeigt, dass HSV-1 erst im Blut, danach zunehmend in verschiedenen Hirnarealen (Ventrikel, Cortex, Cerebellum, Mesencephalon) nachgewiesen werden kann. Am Wichtigsten ist das Mittelhirn, welches eine zentrale Rolle in der Blutzirkulation spielt. Anatomisch gesehen steht das Mittelhirn in enger Verbindung mit den Glandulae Adrenales und dem Nucleus Suprachiasmaticus des Hypothalamus. Beim Menschen ist die Theorie, dass Viren über die BHS ins Gehirn gelangen noch umstritten. Wahrscheinlicher ist, dass das HSV-1 über sensorische Nerven über das ZNS ins Gehirn gelangt und einen Alzheimer-Ausbruch begünstigt (Burgos et al. 2002) (Liu et al. 2019).
Auswirkungen von HSV-1, die zu Alzheimer führen
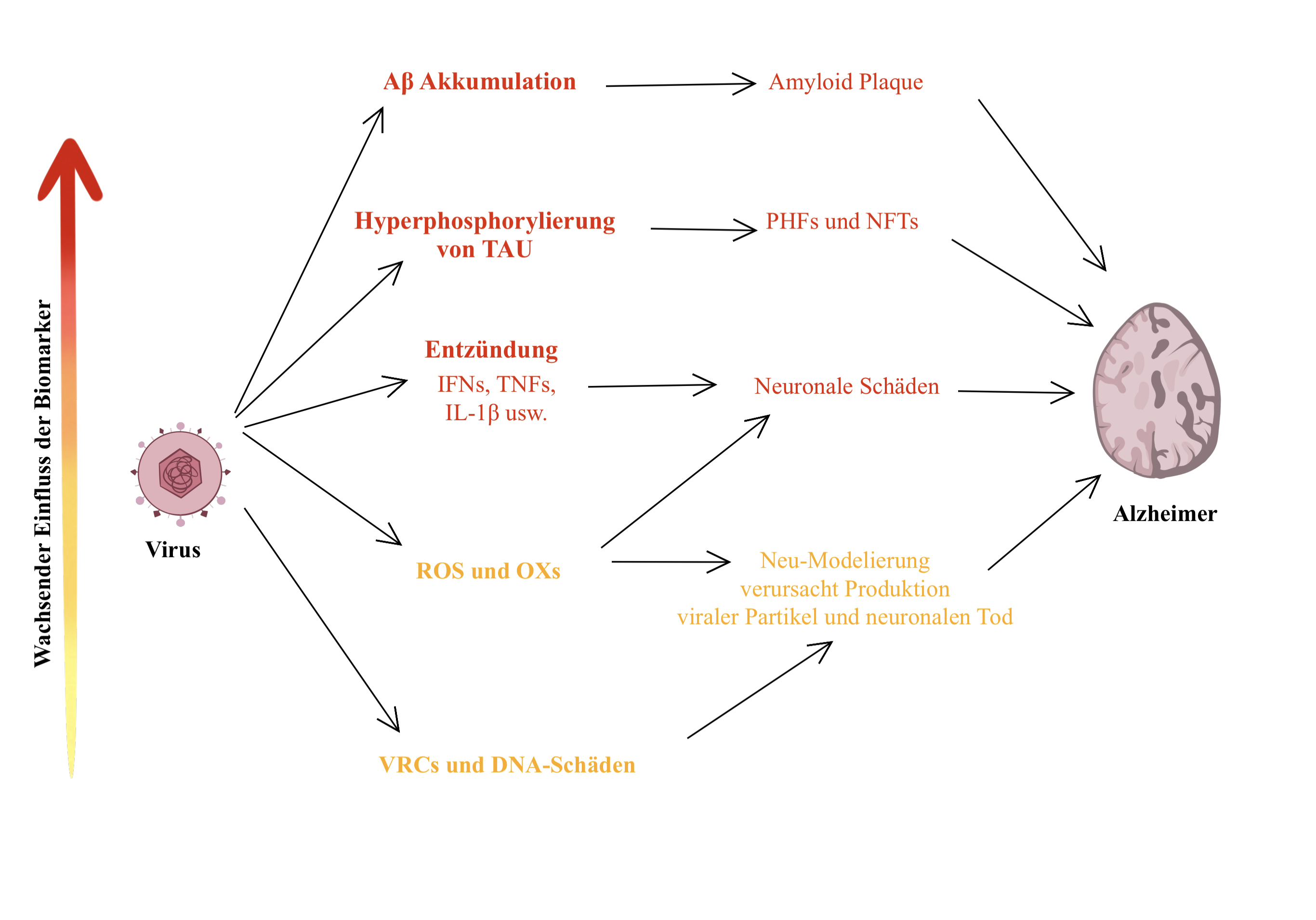
|
Abbildung 1: Wege, wie HSV-1 zu Alzheimer führen kann |
Zusammenhang zwischen HSV-1 und β-Amyloid Plaques
Verschiedene Forscher untersuchten, in Anwesenheit von β-Amyloid, Fibroblasten, Neuronen und Epithelzellen in Kombination mit HSV-1. β-Amyloid kann als Mikrobizid fungieren und somit an die Oberfläche vom Herpes simplex Virus binden. Netzartig umschließt das β-Amyloid den Virus und verhindert damit, dass HSV-1 an gesunde Zellen andockt (Soscia et al. 2010).
Dies kann kurzzeitig von großem Vorteil sein, da es die Infektion nachhaltig unter Kontrolle hält. Wird HSV-1 jedoch durch Stress oder andere Trigger reaktiviert, kann dies zu einer Akkumulation von β-Amyloid führen. Übermäßige β-Amyloid-Akkumulationen bilden Plaque, welcher wiederum einen Ausbruch von Alzheimer begünstigt (Abb. 1) (Sait et al., 2021).
Entzündungen
Entzündungen rufen proinflammatorische Cytokine, beispielsweise Interferone (IFN) oder den TNF (Tumornekrosefaktor), hervor. Es wird angenommen, dass HSV-1 maßgeblich dazu beiträgt, nach Reaktivation eine Entzündung in Alzheimer-Gehirnen zu verstärken. Grund dafür sind virale Replikationskompartimente, welche durch das HSV-1 gebildet werden. Die daraus resultierenden DNA-Schäden führen zur Apoptose der Nervenzellen. Im Endeffekt führt dies zu einem weit verbreiteten Absterben von Nervenzellen, was wiederum den Hauptgrund für Alzheimer darstellt (Sait et al. 2021). Vor allen Dingen betroffen sind ältere Menschen und Menschen mit einem geschwächten Immunsystem (Yao et al. 2014).
Die Produktion von IFN hemmt virale Infektionen und stimuliert das Immunsystem. Bei einer exzessiven Produktion, wie bei einer chronischen Entzündung (beispielsweise durch die HSV-1-Infektion) ist IFN jedoch schädlich für das Gehirn (Sait et al. 2021). Zwei Interferone spielen eine zentrale Rolle bei solchen Entzündungen: IFN-λ und IFN-γ. Im Gehirn von Alzheimerpatienten ist der IFN-λ-Spiegel konstant erhöht, welcher dafür zuständig ist, die Infektion von HSV-1 einzudämmen (Costa et al. 2017). Eine übermäßige IFN-γ-Produktion provoziert die β-Amyloid-Akkumulation, welche die Amyloid-Plaque-Bildung fördert. Auch die Aktivität von NF-κB wird verstärkt. NF-κB ist zuständig dafür, die Stickstoff-Oxid-Synthase (iNOS) zu vereinfachen (Lirk et al. 2002). Bei akuten Entzündungen ist dies ein physiologischer Prozess. Pathologisch, bei chronischen Entzündungen, führt dies jedoch zu einer Anhäufung von Entzündungen im Alzheimer-Gehirn (Abb. 1) (Cymerys et al. 2019).
Hyperphosphorylierung von TAU
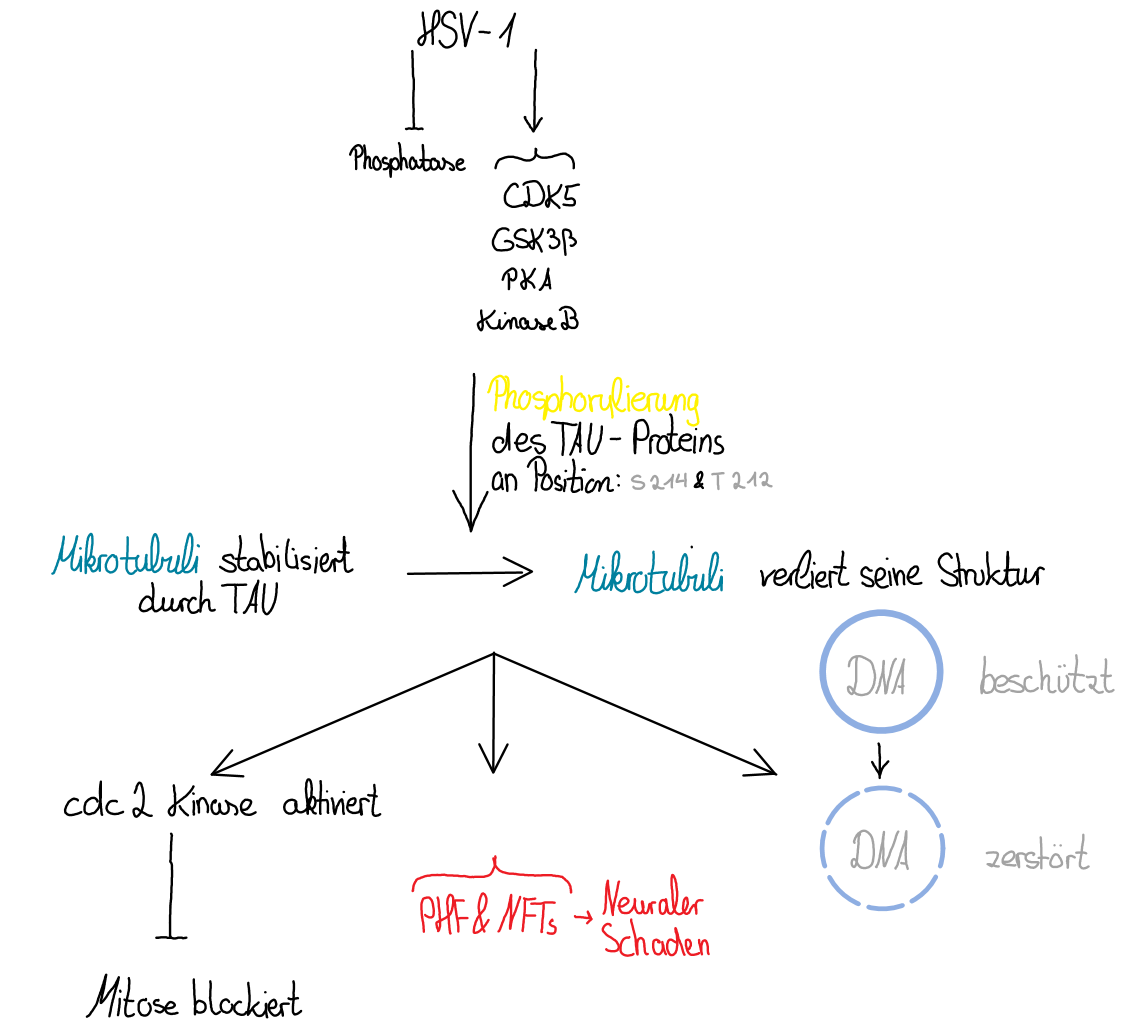
|
Abbildung 2: Auswirkungen der Hyperphosphorylierung von TAU |
Durch das HSV-1 wird die Hyperphosphorylation des TAU-Proteins evoziert. Bei der Phosphorylierung verliert das Protein seine Löslichkeit und bildet gepaarte helikale Filamente, was Neuronen zerstört. So kann es zu neurodegenerativen Krankheiten, wie Alzheimer führen (Zambrano et al. 2008). Die Dichte der Filamente korreliert mit den Schweregrad des HSV-1-Ausbruchs und der Demenz. Interessant ist dabei, dass das TAU-Protein bei Alzheimer-Erkrankten in der Regel hyperphosphoryliert auffindbar ist. Eine Hyperphosphorylierung von TAU unterstützt das Eindringen von HSV-1 in die Neuronen (Abb. 2).
Im Normalfall beschützt das gesunde TAU-Protein die DNA vor Mutationen und Schäden in den Mikrotubuli. Wird das TAU jedoch geschwächt durch die Hyperphosphorylierung ist die Apoptose unumgänglich (Sait et al. 2021).
DNA-Schäden
HSV-1 ist bekannt dafür, die Reparatur-Systeme der DNA zu stören (Smith und Weller, 2015). NHEJ ist zuständig für die Erkennung und Reparatur von Doppelstrangbrüchen, aber auch von einigen Einzelstrangbrüchen. Auch passt NHEJ Basen-Fehler an (Chang et al. 2017).
Die Infektion von HSV-1 exprimiert ICP0, welches die Adaption des viralen Genoms in der Wirtszelle kontrolliert. Die viralen Replikationskompartimente von HSV-1 führen zu viraler Replikation und Transkription, welche schon durch die TAU-Phosphorylation erhöht ist. ICP0 ist eine Ligase, welche sich an DNA-PKcs bindet und infolgedessen den Abbau dieser DNA-PKcs hervorruft (Lees-Miller et al. 1996). Auf diese Weise verliert NHEJ seine ursprüngliche Funktion und der programmierte Zelltod setzt ein (Sait et al. 2021).
APOE4 in Zusammenhang mit HSV-1
Apolipoproteine (APOE) regulieren Lipide im Blut. Am bekanntesten ist das APOE3, welches die Clearance von β-Amyloid reguliert. Im Gegenzug dazu spielt APOE4 eine zentrale Rolle beim Lipid-Transport. APOE4 bildet gleichzeitig einen Risikofaktor für Alzheimer, da es nicht in der Lage ist, β-Amyloid zu binden. Das führt zu einer erhöhten Aggregation von β-Amyloid in Neuronen.
In mehreren verschiedenen Tierversuchen wurden Mäuse untersucht, welche das APOE4-Gen besaßen. Als Kontrolle verglich man APOE3- oder APOE-Knockout Mäuse. Alle Mäuse wurden mit HSV-1 infiziert. Abschließend wurden die Ergebnisse der HSV-1 Spiegel aller Mäuse verglichen. Die Viruslast in den Gehirnen der APOE4-Mäusen war eindeutig höher, als bei APOE3-, oder APOE-Knockout-Mäusen. Letztere wiesen die niedrigste Viruslast auf. Alle Tierversuche bewiesen damit einen Zusammenhang zwischen der Verbreitung von HSV-1 im Gehirn und den APOE4-Allelen. Daraus lässt sich vermuten, dass das APOE4-Allel in Kombination mit HSV-1 eine wichtige Rolle beim Alzheimer-Ausbruch spielt (Piacentini et al. 2014).
Verhinderung der Reaktivierung von HSV-1
Bei der Behandlung von HSV-1, HSV-2, Herpes Zoster und Windpocken wird weitest gehend Valacyclovir verabreicht (Devanand, 2018). In neueren klinischen Studien wird Valacyclovir Menschen mit erhöhtem Alzheimer-Risiko verabreicht, um eine Herpes-Infektion zu verhindern. Bisher gibt es noch keine vergleichbaren Studien und somit keine eindeutigen Ergebnisse, dass dieses Medikament auch eine Alzheimer-Erkrankung verhindern kann (Sait et al. 2021).
Weitere Herpes-Viren, die mit Alzheimer in Verbindung gebracht werden können
Unter den Herpes-Viren können neben HSV-1 auch noch HHV-2, VZV, CMV, HHV-6 und EBV Nervenzellen infizieren und in eine latente Infektion übergehen.
CMV
Barnes et al. führte eine Studie durch, welche einen Zusammenhang zwischen dem Auftreten vom Cytomegalovirus (CMV), sowie ein erhöhtes Risiko für kognitiven Abbau und den daraus resultierenden Ausbruch von Alzheimer untersuchte (Barnes et al. 2015). Weitere unabhängige Studien bestärkten Barnes’ Ergebnisse. Nur CMD4+ T-Zellen reagierten positiv auf das CMV-Antigen. CMD4+ T-Zellen stehen in enger Verbindung mit der Erhöhung mehrerer Alzheimer-Marker. CMV-Patienten weisen somit ein erhöhtes Risiko für Alzheimer auf (Sochocka et al. 2017).
VZV
Das Varizella Zoster Virus (VZV) löst bei jüngeren Menschen Windpocken aus, bei älteren Menschen kann das Virus, reaktiviert, eine Latenz entwickeln. Diese Patienten leiden nicht mehr an Windpocken, sondern an der Gürtelrose. Eine Reaktivierung von VZV bewirkt eine Entzündung in den Zwischenwirbelganglien, sowie den Hirnnervganglien (= Gürtelrose), was oft zu Nervenschmerzen führt. Dies könnte möglicherweise eine bestehende Alzheimer-Erkrankung beeinflussen. Allerdings ist dies noch nicht bewiesen (Sochocka et al. 2017).
HHV-2, HHV-6, EBV
Studien über das Humane Herpes Virus-2 sollten beweisen, dass es bei einer Infektion von Neuroblastomzellen zu einer Anhäufung von TAU-Protein und β-Amyloid-Peptiden kommt, was eventuell mit Alzheimer in Verbindung stehen könnte (Sochocka et al. 2017). Es gibt jedoch keine vergleichbaren Studien.
Carbone et al. fanden in einer weiteren Studie bei Alzheimer-Patienten eine Zunahme von Eppstein-Barr-Virus-positiven oder Humanem Herpes Virus-6-positiven peripheren Blutleukozyten. Diese Studie wurde aber ebenfalls nicht weiter bestätigt (Carbone et al. 2014).
Weitere Viren, welche mit Alzheimer in Verbindung gebracht werden können
Hepatitis C
Jüngste Untersuchungen deuten auf einen Zusammenhang mit Hepatitis C (HCV) und dem Auftreten von Alzheimer hin. Mehrere Studien befassten sich in den letzten Jahrzehnten damit, dass ein HCV Ausbruch auch kognitive Störungen hervorrufen kann. Aktuelle Ergebnisse bekräftigen die Theorie. Allerdings sind die genauen Auslöser noch nicht geklärt (Senzolo et al. 2011). Vermutet werden einerseits eine direkte neurotoxische Wirkung des HCV auf das Gehirn oder indirekt neurotoxisch über zerebrale Entzündungen. HCV ist eine primär auf die Leber wirkende Infektion. Interessant ist, dass sich die viralen Sequenzen in ZNS und Leber unterscheiden. Das deutet darauf hin, dass sich das Virus, abhängig von seinem Standort, unterschiedlich verhält. Durch eine Infektion von Makrophagen kann das HCV die Blut-Hirn-Schranke überwinden und ins Gehirn gelangen. Die Immunzellen sondern dadurch eine große Menge an Cytokinen ab und führen schlussendlich zur Apoptose der Neurone (Sochocka et al. 2017).
Wie auch beim HSV-1 existiert auch beim HCV eine Studie zu antiviralen Medikamenten und deren Wirkungen. Bei Hepatitis C kann Aciclovir auf minimal beeinträchtigende Weise die virale DNA-Replikation hemmen. Somit sind Aciclovir, wie auch Valaciclovir (bei Herpes-Viren), Hoffnungsträger bei der Verminderung des Alzheimer-Risikos. Noch bleiben Studien ohne eindeutige Ergebnisse (Sochocka et al. 2017).
Corona-Viren
SARS-CoV-2 führt zu einer Dysregulation vom Renin-Angiotensin System (RAS). Ebenso führt Alzheimer zu einer Dysregulation von RAS, was somit einen Zusammenhang von Alzheimer und Covid-19 impliziert (Piekut et al. 2022).
Sars-CoV-2 kann eine gestörte Blut-Hirn-Schranke überwinden und das Gehirn infizieren. Eine Störung in der Blut-Hirn-Schranke tritt häufig bei älteren und immungeschwächten Menschen auf. Vermutet wird, dass Sars-CoV-2 entweder neuronale Zellen direkt infiziert oder durch das Spike-S1-Protein die Ausbreitung von aggregiertem TAU die Sekretion extrazellulärer Vesikel erleichtern könnte. Schlussendlich infiziert dies weitere Zellen in direkter und indirekter Nachbarschaft (Villa et al. 2022).
Gemeinsame Risikofaktoren von Sars-CoV-2 und Alzheimer
Alter
Hohes Alter begünstigt eine erhöhte Permeabilität der Blut-Hirn-Schranke. Dadurch wird der Mensch anfällig für neuronale Infektion des Sars-CoV-2 im Gehirn. Über das Spike-Protein dringt SARS-CoV-2 in die Makrophagen ein, welche dadurch eine hohe Menge an SASP (en: senescene-associated secretory phenotype) produzieren. SASP führt zu einer β-Amyloid-Akkumulation und zu einer TAU-Hyperphosphorylierung. Bekannterweise können diese Faktoren, genauso wie HSV-1, einen Alzheimer-Ausbruch begünstigen (Villa et al. 2022).
APOE4-Gen
Äußerst interessant ist, dass, wie auch beim HSV-1, ein Zusammenhang zwischen dem APOE4-Gen und der Infektion von SARS-CoV-2 beobachtet werden kann. Jüngsten Studien zufolge könnte APOE4 sowohl bei regulären Neuronen als auch Astrozyten eine erhöhte Anfälligkeit für SARS-CoV-2 verursachen. Es gibt Hinweise darauf, dass APOE4 zudem auch für die Apoptose von Astrozyten verantwortlich ist, was den Schweregrad der COVID-19 verstärkt. Hauptsächlich bei einer schweren COVID-19-Erkrankung, in Verbindung mit dem APOE4-Gen, kann es zu einer Demenz kommen. Frühe Anzeichen dafür sind Bewusststeinsstörungen und Delir während einer COVID-19-Erkrankung. Auch hier sind sind weitere Studien nötig, um die existierenden Theorien weiter zu belegen (Villa et al. 2022).
Fazit
Dass Viren eine Alzheimer-Infektion beeinflussen können, lässt sich nicht mehr bestreiten. Zahlreiche Studien haben bereits einen Zusammenhang, speziell zwischen Herpes und Alzheimer feststellen können. Die Forschung steckt noch immer in den Anfangsstadien. Trotzdem gibt es vielversprechende Ansätze, welche vor allem prädispositionierten Menschen einen Hoffnungsschimmer geben. Ob es in naher Zukunft auch durch Viren eine Möglichkeit zur Heilung von Alzheimer geben wird, bleibt offen. Wir blicken gespannt auf eine positive Entwicklung in der Zukunft.
Quellenverzeichnis
Literaturverzeichnis
Abbott A. (2020): Are infections seeding some cases of Alzheimer's disease? Nature. 587: (7832) 22-25 https://www.nature.com/articles/d41586-020-03084-9
Barnes L.L.; Capuano A.W.; Aiello A.E.; Turner A.D.; Yolken R.H.; Torrey E.F.; Bennett D.A. (2015): Cytomegalovirus infection and risk of Alzheimer disease in older black and white individuals. The Journal of Infectious Diseases 211: (2) 230–237 https://academic.oup.com/jid/article/211/2/230/2910562
Bradshaw M. J.; Venkatesan A. (2016): Herpes Simplex Virus-1 Encephalitis in Adults: Pathophysiology, Diagnosis, and Management. Neurotherapeutics 13: (3) 493-508 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4965403/
Burgos J. S.; Sastre I.; Valdivieso F.; Bullido M. J.; Ramirez C. (2002): Involement of Apolipoprotein E in the Hematogenous Route of Herpes Simplex Virus Type 1 to the Central Nervous System. Journal of Virology 76: (23) 12394-12398 https://journals.asm.org/doi/10.1128/JVI.76.23.12394-12398.2002
- Carbone I.; Lazzarotto T.; Ianni M.; Forti P., Masliah E.; Gabrielli L., Licastro F. (2014) Herpes Virus in Alzheimer's Disease: Relation to Progression of the Disease. Neurobiology of Aging 35: (1) 122-129
Chang H. H. Y.; Pannunzio N. R.; Adachi N.; Lieber M. R. (2017): Non-Homologous DNA End Joining and Alternative Pathways to Double-Strand Break Repair. Nature Reviews Moecular Cell Biology 18: (8) 495–506 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7062608/
Costa A. S.; Agostini S.; Guerini F. R.; Mancuso R.; Zanzottera M.; Ripamonti E.; Racca V.; Nemni R.; Clerci M. (2017): Modulation of Immune Responses to Herpes Simplex Virus Type 1 by IFNL3 and IRF7 Polymorphisms: A Study in Alzheimer's Disease. Journal of Alzheimer's Disease 60: (3) 1055-1063 https://content.iospress.com/articles/journal-of-alzheimers-disease/jad170520
Cymeris J.; Kowalczyk A.; Mikołajewicz K.; Słońska A.; Krzyzowska M. (2019) Nitric Oxide Influences HSV-1-Induced Neuroinflammation. Oxidative Medicine and Cellular Longevity: doi: 10.1155/2019/2302835.eCollection 2019. https://pubmed.ncbi.nlm.nih.gov/30886672/
- Daneman R. (2012): The Blood-Brain Barrier in Health and Disease. Annals of Neurology 72: (5) 648-672
- Deatly A. M.; Haase A. T.; Fewster P. H.; Lewis E.; Ball M. J. (1990): Human Herpes Virus Infections and Alzheimer's Disease. Neuropathol. Appl. Neurobiol 16: (3) 213-223
Devanand D. P. (2018): Viral Hypothesis and Antiviral Treatment in Alzheimer’s Disease. Current Neurology and Neuroscience Reports 18: (9) 55 https://link.springer.com/article/10.1007/s11910-018-0863-1
Duarte L. F.; Farías M. A.; Álvarez D. M.; Bueno S. M.; Riedel C. A.; González P. A. (2019): Herpes Simplex Virus Type 1 Infection of the Central Nervous System: Insights Into Proposed Interrelationships With Neurodegenerative Disorders, frontiers in Cellular Neuroscience: doi: 10.3389/fncel.2019.00046.eCollection 2019. https://www.frontiersin.org/articles/10.3389/fncel.2019.00046/full
- Eimer W. A.; Kumar D. K. V.; Shanmugam N. K. N.; Rodriguez A. S.; Mitchell T.; Washicosky K. J.; György B.; Breakefield X. O.; Tanzi R. E.; Moir R. D. (2018): Alzheimer's Disease-Associated β-Amyloid Is Rapidly Seeded by Herpesviridae to Protect against Brain Infection. Neuron 99: (1) 56-63
- Jamieson G. A.; Maitland N. J.; Wilcockf C. M.; Itzhaki R. F. (1992): Herpes Simplex Virus Type 1 DNA is present in specific Regions of Brain from aged People with and without Senile Dementia of the Alzheimer Type. The Journal of Pathology 167: (4) 365-368
Lees-Miller S. P.; Long M. C.; Kilvert M. A.; Lam V.; Rice S. A.; Spencer C. A. (1996): Attenuation of DNA-Dependent Protein Kinase Activity and Its Catalytic Subunit by the Herpes Simplex Virus Type 1 Transactivator ICP0. Journal of Virology 70: (11) 7471–7477 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC190814/pdf/707471.pdf
Lirk P.; Hoffmann G.; Rieder J. (2002): Inducible Nitric Oxide Synthase - Time for Reappraisal. Current Drug Targets - Inflammation & Allergy 1: (1) 89-108 https://pubmed.ncbi.nlm.nih.gov/14561209/
- Liu H.; Qiu K.; He Q.; Lei Q.; Lu W. (2019): Mechanism of Blood-Brain Barrier Disruption in Herpes Simplex Encephalitis. Journal of Neuroimmune Pharmacology 14: (2) 157-172
Piacentini R.; De Chiara G.; Li Puma D. D.; Ripoli C.; Marcocci M. E.; Garaci E.; Palamara A. T.; Grassi (2014): HSV-1 and Alzheimer’s Disease: More than a Hypothesis. Frontiers in Pharmacology doi: 10.3389/fphar.2014.00097.eCollection 2014. https://www.frontiersin.org/articles/10.3389/fphar.2014.00097/full
Piekut T.; Hurla M.; Banaszek N.; Szejn P.; Dorszewska J.; Kozubski W.; Prendecki M. (2022): Infectious Agents an Alzheimer's Disease. Journal of Integrative Neuroscience 21: (2) 73 https://www.imrpress.com/journal/JIN/21/2/10.31083/j.jin2102073/htm
Sait A.; Angeli C.; Doig A. J.; Day P. J. R.: Viral Involvement in Alzheimer's Disease. ACS Chemical Neuroscience 12: (7) 1049-1060 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8033564/#ref19
Senzolo M.; Schiff S.; D'Aloiso C. M.; Crivellin C.; Cholongitas E.; Burra P.; Montagenese S. (2011) Neuropsychological Alterations in Hepatitis C Infection: The Role of Inflammation. World Journal Gastroenterology 17: (29) 3369-3374 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3160562/
Smith S.; Weller S. K. (2015): HSV-I and the Cellular DNA Damage Response. Future Virology 10: (4) 383–397 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4508672/
Sochocka M.; Zwolinska K.; Leszek J. (2017): The Infectious Etiology of Alzheimer's Disease. Current Neuropharmacology 15: (7) 996-1009 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5652018/
Soscia, S. J.; Kirby J. E; Washicosky, K. J.; Tucker S. M.; Ingelsson M.; Hyman B.; Burton M. A.; Goldstein L. E.; Duong S.; Tanzi R. E.; Moir R. D. (2010): The Alzheimer's Disease-Associated Amyloid β-Protein is an antimicrobial Peptide. PLOS ONE 5: (3) doi: 10.1372/journal.pone.0009505. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0009505
Villa C.; Rivellini E.; Lavitrano M.; Combi R. (2022): Can SARS-CoV-2 Infection Exacerbate Alzheimer's Disease? An Overview of Shared Risk Factors and Pathogenetic Mechanisms. Journal of Personalized Medicine 12: (1) 29 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8780286/
Yao H.-W.; Ling P., Tung Y.-Y.; Hsu S.-M.; Chen S.-H. (2014): In Vivo Reactivation of Latent Herpes Simplex Virus 1 in Mice Can Occur in the Brain before Ocurring in the Trigeminal Ganglion. Journal of Virology 88: (19) 11264-11270 https://journals.asm.org/doi/10.1128/JVI.01616-14
- Zambrano Á.; Solis L.; Salvadores N.; Cortés M.; Lerchundi R.; Otth C. (2008): Neuronal Cytoskeletal Dynamic Modification and Neurodegeneration Induced by Infection with Herpes Simplex Virus Type 1. Journal of Alzheimer's Disease 14: (3) 259–269
Abbildungsverzeichnis
Abbildung 1: Wege, wie HSV-1 zu Alzheimer führen kann: Eggs Réanne, nach Sait A.; Angeli C.; Doig A. J.; Day P. J. R.: Viral Involvement in Alzheimer's Disease. ACS Chemical Neuroscience 12: (7) 1049-1060 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8033564/#ref19
Abbildung 2: Auswirkungen der Hyperphosphorylierung von TAU: Preiß Janina, nach Sait A.; Angeli C.; Doig A. J.; Day P. J. R.: Viral Involvement in Alzheimer's Disease. ACS Chemical Neuroscience 12: (7) 1049-1060 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8033564/#ref19