Az Alzheimer- és a Parkinson-kór mint a legfőbb neurodegeneratív betegségek patogenezise
Az Alzheimer- és a Parkinson-kór napjaink legjelentősebb neurodegeneratív betegségei közé tartoznak. Folyamatos és egyre gyorsuló terjedésük miatt az elmúlt évek neurológiai kutatásaiban kiemelt szerepet kaptak e két betegség patogenezisének megértésére irányuló törekvések.
Contents
Alzheimer-kór
|
A kezdetek
1906 novemberében a klinikai pszichiáter és neuroanatómus, Alois Alzheimer (lásd 1. ábra) az agykéreg egy sajátságos súlyos betegségi folyamatát jelentette be a 37. Dél-Nyugat Németországi Pszichiáter Találkozón, Tubingen-ben.
Az első leírt eset alapjául Auguste D.-ről készített hosszútávú tanulmány szolgált. Jelentésében jellegzetes plakkokról és neurofibrilláris kötegekről írt. Alzheimer 1909-ben további 3 megfigyelését, 1911-ben pedig Josef F. „csak-plakkos” esetét publikálta. Utóbbiról 1995-ben kiderült, hogy ez a már dokumentált betegség egy korábbi fázisa (Neundörfer és Hippius, 2003).
Habár felfedezéseit korának tudósai nem értékelték, munkássága megalapozta a jövőbeli neurodegeneratív betegségekre irányuló kutatásokat.
Napjainkban
Becslések szerint 2015-ben mintegy 46,8 milló ember élt együtt demenciával világszerte. Ez a szám szinte duplázódik húszévente: eléri a 74,7 milliót 2030-ra és a 131,5 milliót 2050-re. Az emelkedés a fejlődő országokban jelentősebb. Ma a demenciában szenvedők 58%-a alacsony- és közép-jövedelmű országokban él; ez a szám 2050-re 68%-ra fog emelkedni. Legnagyobb mértékű a növekedés Kínában, Indiában és ezen országok dél-ázsiai és csendes-óceáni szomszédjaiban. A demográfiai öregedés az elmúlt évszázad során az egészségügyben bekövetkezett fejlődést igazolja. Sokan élnek hosszabb és egészségesebb életet, ezért a világ populációjának egyre nagyobb hányadát teszik ki idősebb emberek. A demencia főleg az idős embereket érinti, bár manapság egyre több esetet írnak le 65 éves kor alatt. Évente 9,9 millió újabb demenciás esetet diagnosztizálnak világszerte, vagyis 1 új esetet minden 3,2 másodpercben. (Alzheimer's Disease International)
Tünetek
Az első tüneteket gyakran tévesen az öregedéshez vagy stresszhez kötik. Részletes neuropszichológiai vizsgálatokkal évekkel a kritérium-tünetek megjelenése előtt diagnosztizálható az érintett személy.
Kezdeti fázisban a rövidtávú memória elvesztése tűnik fel. A figyelem, tervezés, alkalmazkodás és absztrakt gondolkodás zavara is megfigyelhető. Enyhe kognitív károsodás (Mild Cognitive Impairment – MCI) sokféle tünetként megnyilvánulhat, de a legdominánsabb a memóriavesztés. Egy kis százaléknál a nyelvekkel – főleg a zsugorodó szókincs, szavak csökkent gördülékenysége mind az írott és beszélt nyelvben -, feladat-végrehajtással, mozgás elvégzésével (apraxia), érzékeléssel (agnosia) kapcsolatos nehézségek kifejezettebbek az emlékezetzavarnál (Khyade és mtsai, 2016).
Az Alzheimer-kór nem hat minden memória-területre egyforma mértékben. Régebbi emlékek, szemantikus (jelentésbeli, jelentéstani) és implicit (a test emlékei, sokszor ismételt mozdulatokhoz köthető, pl.: villa-használat) memória sokkal kevésbé érintett, mint a rövidtávú emlékek. A kór előrehaladtával a beszédzavarok nyilvánvalóbbá válnak, mivel a beteg nem képes szókincsét megfelelően előhívni, ez folyamatos téves kifejezések használatához (paraphasia) vezet. Az olvasási és írási készségek fokozatosan eltűnnek. Az emlékezet-zavarok odáig fajulnak, hogy a beteg már a rokonait sem ismeri fel. Az eddig érintetlen hosszútávú memória is sérül. Gyakori az elkalandozás, érzékenység, változó hangulat, ami agresszív kitörésekhez, síráshoz, az ellátással szembeni ellenálláshoz vezet (Khyade és mtsai, 2016).
Az Alzheimer-kórban szenvedők mintegy 30 %-ában kialakul valamilyen tévképzet. Az érintettek elfelejtik határaikat (anosognosia) és azt, hogy betegek. Inkontinencia kialakulása ebben a fázisban gyakori Khyade és mtsai, 2016).
A végső fázisban a beteg teljesen az ellátóitól függ. A beszéd teljes elvesztése következik be. Az agressziót (ami ugyan jelen lehet továbbra is) apátia és kimerültség váltja fel (Khyade és mtsai, 2016).
A halál oka általában valamilyen külső tényező mint fertőzések, tüdőgyulladás, nem pedig az Alzheimer-kór (Khyade és mtsai, 2016).
Patogenezis
Szinapszisok a neurodegeneratív betegségekben
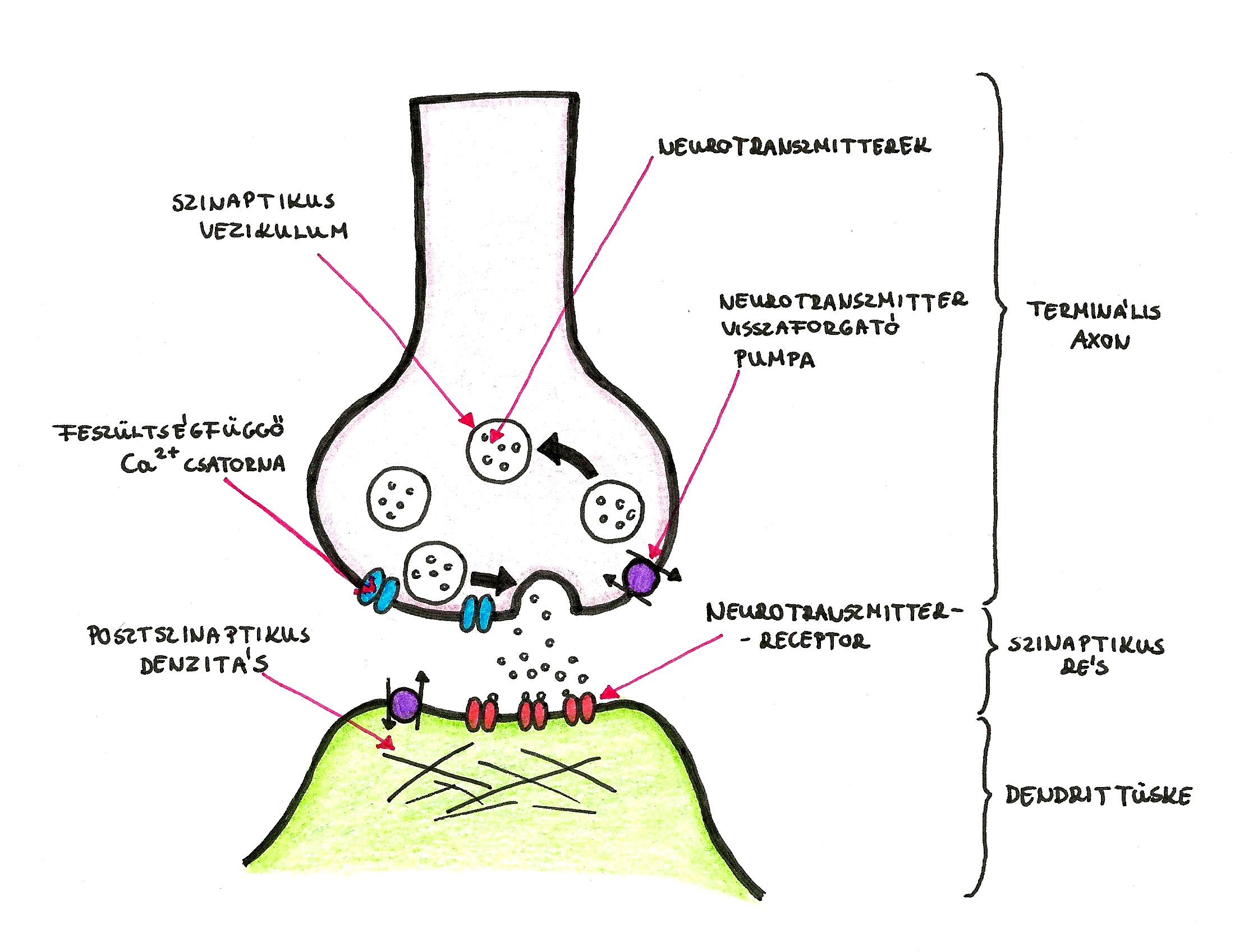
Az idegrendszer működésének alapvető egységei a sejtek között létrejövő szinapszisok. Az információ a preszinaptikus axonvégtől indul és a benne lévő neurotranszmitterek szinaptikus résbe bocsátásával, ezen anyagok a postszinaptikus membránon való megkötődésével kerül át a szomszédos idegsejt dendritjére. A szinapszisok egyik legfontosabb jellemzője a strukturális és funkcionális plaszticitás, és az, hogy különböző kóros körülmények hatására károsodásuk fokozott. Valójában éppen változékonyságuk teszi őket olyan sérülékennyé, a szinaptikus plaszticitást tekintik a neurodegeneratív kóros szimptómák kialakulásához szükséges központi tényezőnek. Több betegség erre az elméletre épül, köztük az Alzheimer- és Parkinson-kór is (Bae és Kim, 2017).
|
Bevezetés
A szinapszis az agyi működés alapvető egysége. A szinapszis preszinaptikus felében vezikulákban („hólyagokban”) tárolódnak azok a kémiai anyagok, pontosabban neurotranszmitterek, melyek a posztszinaptikus membránra kerülve lehetővé teszik két idegsejt között az információátadást (lásd 2. ábra). A neurotranszmitter-leadás fontos helyszíne az ún. aktív zóna, ahol több létfontosságú struktúra foglal helyet, mint például a feszültségfüggő kalcium-csatornák és a sejt-adhézióban (összetapadásban) résztvevő molekulák. A szinaptikus vezikulák kis endoszómális egységek, melyek neurotranszmittereket tartalmaznak és közvetett vagy közvetlen módon több mint száz különböző fehérjével állnak kapcsolatban a normális működés érdekében (Bae és Kim, 2017).
A kritikus kérdés, hogy hogyan tárolódnak ezek a kémiai ingerületátvivő anyagok és hogyan van szabályozva átkerülésük a posztszinaptikus membránra. A szinaptikus vezikula exocitózisának (anyagkibocsátásának) szabályzásáért elsősorban a kalciumion felel. A vezikulák anyagainak visszanyerése folyamatosan, többféleképen történik. Viszont a jelátviteli mechanizmusnak ez a morfológiai és fiziológiai épsége változatos idegrendszeri betegségek eredményeképpen könnyen sérül . Strukturális és funkcionális tekintetben a szinaptikus vezikulák és proteinek (fehérjék) kimerülésétől, a neurotranszmisszó és a kalcium szabályozásának leromlásáig számtalan ok állhat kimutathatóan a neurodegeneratív betegségek mögött. Továbbá a preszinaptikus struktúrák kialakuló elégtelen működése a legkorábbi tünete az idegi betegségeknek. Az Alzheimer-kór egyike a legjelentősebb idegrendszeri betegségeknek. E betegség esetében több kóros faktort fedeztek fel, többek között az amiloid-béta plakkokat, neurofibrilláris kötegeket és az ApoE4-et. Azonban a konkrét kórok meghatározása további kutatásokat igényel (Bae és Kim, 2017).
Idegvégződések az Alzheimer-kórban
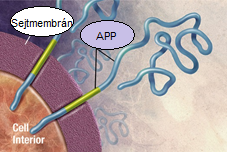
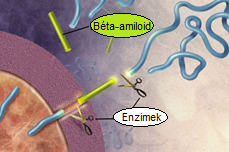
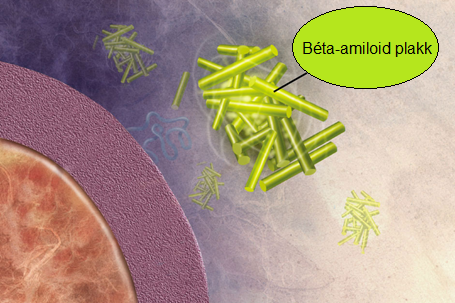
A legismertebb idegrendszeri betegség lefolyása viszonylag gyors. Az idegsejtek pusztulása miatt folyamatos memóriavesztéshez, szellemi leépüléshez, végül halálhoz vezet. Az Alzheimer-kór kialakulásának jól ismert oka az amiloid-béta plakkok oligomerizációja (több alkotóelem összekapcsolódik) az amiloid prekurzor proteinből (APP), BACE és gamma-szekretáz enzimek segítségével (lásd 3. ábra, 4. ábra, 5. ábra). Másik indukálója eme betegségnek a Tau protein mutációja vagy átalakulása, mely neurofibrilláris fonadékká tud összecsapódni vagy helikális filamentumokba áll össze. Kezdetben az aggregátumok (összecsapódott anyagok) a sejten belül, majd az idegsejtek károsodásával, végül pusztulásával sejten kívül halmozódnak fel (Kálmán, 2006).
|
|
|
||
Kiderült, hogy a kialakulás valószínűségének mértékét genetikai faktorok is befolyásolják, mint például az apolipoprotein E4. Ez az APP transzkripciójához szükséges gén a 21. kromoszómán található, emiatt ennek a kromoszómának a triszómiája által létrejövő Down-kór kialakításában is részt vesz a fent ismertetett mechanizmus. Nem Down-szindrómás egyéneknél eme génhely mutációja okoz amiloid-béta plakkokat (Hardy és Selkoe, 2002). Habár a kór genetikai hátterének nagy része ismert, több faktor még mindig bizonytalan.
Amiloid prekurzor protein (APP) és béta-amiloid
|
Az amiloid prekurzor protein, mely a preszinaptikus idegvégződések működésében vesz részt, 40 vagy 42 aminosavból álló amiloid-bétává átalakulva, más sejtekkel és sejttörmelékekkel plakkokat kialakítva legfőbb tényezője az Alzheimer-kór kialakulásának (Kálmán, 2006). Az APP a szinaptikus egység negatív szabályzója, emellett a szinaptikus működésnek az élettani modulációjában is részt vesz. Az APP feltehetőleg központi fehérjeként szolgál a preszinaptikus aktív zónában (PAZ) és a hippokampális hálózat egy lényeges szabályzó anyaga (Bae és Kim, 2017).
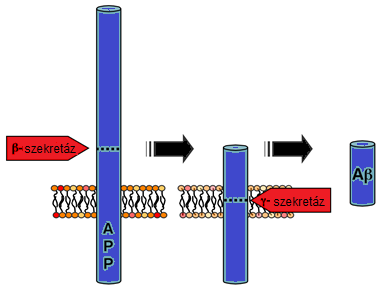
Az APP-ből hasítással amiloid-béta keletkezik BACE (béta-szekretáz) és gamma-szekretáz segítségével (lásd 6. ábra). Az amiloid-béta oligomer aggregációja során egyfajta fonadékot hoz létre, mely az idegvégződések szerkezetét befolyásolja, így degradálva a preszinaptikus peptidtermelést. Az oldható amiloid-béta megköt egy APP-t, amely APP-APP homodimer kialakulását serkenti. Kóros esetben a megnövekedett amiloid-béta koncentráció megzavarja az ingerületátvivő anyagok leadását a vezikulumokon keresztül. Ehhez társul még, hogy a preszinaptikus mitokondriumokat „legyengíti”, működésüket károsítja, így a preszinaptikus idegsejt kisebb vezikulákat tud kialakítani (Bae és Kim, 2017).
Az agy szövetközi folyadékából arra a következtetésre jutottak, hogy az amiloid-béta-szint összefüggésben áll a szinaptikus aktivitással. Minél aktívabb, annál több az amiloid-béta a szövetközi folyadékban. Az amiloid-béta létrejöttét az APP-ból (mely kis vezikulákban vagy endoszómákban történik távolabb a plazmamembrántól) összefüggésbe hozták még a neuroszekrétumok exocitózisával. Az amiloid-béta termelését és felszabadulását az aktivitásfüggő szinaptikus jelátvitel és az idegsejtek végbunkóinak endocitózisa szabályozza (Bae és Kim, 2017). Az Alzheimer-kór kialakulása az amiloid-béta szintézisének és lebontásának sebességéből adódik, mivel ezen anyag okolható a Tau proteint tartalmazó neurofibrilláris fonadékok kialakulásáért (Hardy és Selkoe, 2002).
Béta-szekretáz (BACE)
Az amiloid-béta patológiás esetben való kialakulásában a béta-szekretáz (BACE) a legfontosabb tényező. Viszont a BACE nemcsak kóros esetekben, hanem a szervezet normális működésében is alapvető fontosságú, a szinaptikus kapcsolat élettani működésében van szerepe. Az APP hasítása a szinaptikus vezikulumokhoz köthető, mely révén a BACE1 serkentő idegi kapcsolatok működését csökkenti (Bae és Kim, 2017).
Tau
A mikrotubulus rendszerhez kötött Tau protein aggregációja neurofibrilláris fonadék vagy páros helikális filamentum kialakításával az Alzheimer-kór hátterének egyik alappillérét adja. Viszont a Tau az idegrendszer szinapszisainak normális működéséhez is szükséges; e fehérje felelős a mikrotubulus és a szinaptikus proteinek stabilitásáért, valamint az axonális transzpont szabályzásáért. Emellett a szinapszisok felépítésében és fenntartásában is részt vesz (Bae és Kim, 2017).
A hiperfoszforilált Tau mind a pre- mind a postszinaptikus oldalon megtalálható. A preszinaptikus végen gyengíti a mikrotubulusok stabilitását, amely a szinaptikus vezikulumok számát csökkenti. A Tau a szinapszis kóros működésében életkorhoz kötődő túltermelődése révén vesz részt, ezáltal drasztikusan lecsökkentve a vezikulumok számát. A Tau protein az APP-vel együtt súlyosbítja a szinaptikus ingerületátvitel károsodásának mértékét, így a kettő együtt vesz részt az Alzheimer-kór kialakításában (Bae és Kim, 2017).
Apolipoprotein (APOE)
Az apolipoprotein feladata az apolipolipoproteinek, koleszterin és egyéb zsír-jellegű anyagok szállítása. Az APOE-t is összefüggésbe hozták az Alzheimer-kór kialakulásával, emellett szoros összefüggésben áll az amilod-bétával, ami szintén a kór egy kialakító eleme (Bae és Kim, 2017). A központi idegrendszerben az apolipoproteinek helyezik el az általuk szállított koleszterint. Idegi sérülés esetén az APOE kifejeződésének mértéke megváltozik, így a membránokba kerülő koleszterin mennyiségére is közvetlen hatással van. Az APP helyzete szerint a membrán rafton (a sejthártyának ezen részén több fontos funkcióval rendelkező pl. fehérje helyezkedik el) belül és azon kívül is lehet. Normális esetben az APP inkább a sejthártya raftokon kívül helyezkedik el, mert ezen területek koleszterinben szegényebbek. Ha az APOE kóros változásai miatt a koleszterinkoncentráció eltérő lesz, az APP a lipidraftokhoz kerül, ahol a gamma- és béta-szekretáz enzimek találhatók, melyek belőle az Alzheimer-kórt kialakító amiloid-bétát képezik (Kálmán, 2006).
Kezelés
Az Alzheimer-kór egyre nagyobb teherként nehezedik a fejlődő országok társadalmaira, és az orvosokra vár a feladat egy eredményes gyógymód megteremtésére, mivel a betegek száma folyamatosan nő.
Jelenleg elfogadott anti-Alzheimer terápiák – kolinészteráz-inhibítorok és N-metil-D-aszpartát receptor antagonista memantin – egy mérsékelt lehetőségként állnak fenn, kombinációs terápiában használhatók. Alternatív terápiák térhódítása is megfigyelhető, mint például a nemszteroid gyulladáscsökkentők, E-vitamin, szelegilin (deprenyl), Ginkgo biloba-kivonatok, ösztrogének, sztatinok, viselkedés- és életmódbeli változtatások (Farlow és mtsai, 2008).
Az Alzheimer-farmakoterápia első 15 éve az acetilkolin-tartalmú neuronok tovaterjedő degenerációjára koncentrált. A kolinészteráz-inhibítorok az acetilkolinészteráz, így a kolinerg neurotranszmisszió blokkolására szolgálnak (Farlow és mtsai, 2008).
A memantin az első elfogadott gyógyszer középsúlyos- és súlyos Alzheimer esetén. A memantin egy nemkompetitív antagonistája az N-metil-D-aszpartát receptoroknak. Ezekhez kötik ugyanis a glutamáterg diszfunkciót, mely a receptorokon keresztül hatalmas kalciumion-beáramláshoz vezet, ami neuronhalált eredményez (Farlow és mtsai, 2008).
Az alternatív terápiák közül legtöbb pozítív hatására még nem találtak bizonyítékot. A Ginkgo biloba-t antioxidáns tulajdonsága és neuroprotektív hatása miatt ajánlják (Farlow és mtsai, 2008).
Parkinson-kór
A kezdetek
|
James Parkinson (lásd 7. ábra) (1755. április 11. – 1824. december 21.) angol fizikus, sebész, gógyszerész, geológus, paleontológus és politikai aktivista volt. Leghíresebb 1817-es, az Esszé a Reszketéses Hűdésről (Essay on the Shaking Palsy) című munkája, melyben egy olyan betegségről ír, mely később Parkinson-kór néven válik ismertté.
I. eset : 50 év körüli férfi, aki kertészként dolgozott. Bal kezének enyhe remegésében nyilvánultak meg tünetei. Nem jelentkezett nála se reuma, se fejfájás, sem hirtelen rohamok.
II. eset: Egy elsőfokú bíróságon esküdtként dolgozó 62 éves férfi, a kórtól már 8-10 éve szenvedett. Esetében beszédzavarok, hajlott test és remegés volt megfigyelhető. Botja nélkül biztosan minden lépésénél elesett volna, mert csak a talpa elülső részére támaszkodott. Állítása szerint a betegség gyakran tört rá, vélhetően az életmódjában bekövetkezett változások miatt.
III. eset: 65 éves féri, atletikus alkattal (egykori matróz). A végtagok, a fej és az egész test mozgása túl vehemens volt, hogy rázkódásnak lehessen nevezni. Járásra teljességgel képtelen volt, teste oly mértékben hajlott volt, mintha egy nagy erő húzná a járda felé. Állítása szerint tünetei egy spanyol börtönben eltöltött hosszabb idő után jelentkeztek.
IV. eset: 55 éves férfi, 5 éve remegő karokkal.
V. eset: Parkinson csak távolról látta, de a tünetek kifejezettsége miatt biztos volt benne, hogy a korábban megfigyelt kórról van szó. Járását csak kísérője biztosította, aki az előre- illetve hátrabillegését volt hivatott ellensúlyozni.
VI. eset: 72 éves, betegségének kiváltójaként semmit sem tudott megnevezni. Habár emlékezett, hogy 20 évvel ezelőtt lumbágóban szenvedett. Bal karjának gyengesége először 10-12 éve jelentkezett, melyet hamarosan remegés követett. Erre 3 évre a tünetek a jobb karjában is jelentkeztek. Ezután következett a teste, majd a beszéde is zavarttá vált. A következő 3 év során lábai is érintettek lettek. Később jobb oldala lebénult. Ennek elmúltával a remegés erősebben tért vissza. Jelenlegi állapotában a remegések epizodikusak, akár kétperces szünetek is lehetnek egyes rohamok közt.
A tünetek ilyen részletes leírása hatalmas segítséget nyújtott a betegség patogenezisének megismeréséhez (Parkinson, 1817).
Napjainkban
Amerikában 1 millióan élnek Parkinsonnal. Ugyanitt évente újabb 60 000 esetet diagnosztizálnak. ( A nem diagnosztizált esetek számát nem lehet megbecsülni.)
Világszerte több mint 10 millióan szenvednek Parkinson-kórban.
Előfordulási valószínűsége az életkor előrehaladtával nő, de az érintettek mintegy 4 %-a 50 éves kor alatti.
Férfiaknál 1,5-szer nagyobb valószínűséggel alakul ki PD. (Parkinson's Disease Foundation)
Tünetek
|
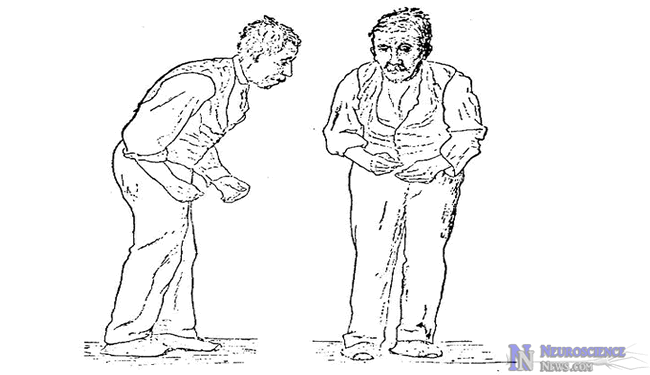
A Parkinson-kórban szenvedők betegségük során mind motoros és nemmotoros tüneteket produkálnak. Jellegzetes az ún. ’Parkinson-tartás’ (lásd 8. ábra).
A betegség korai állapotában az 5 leggyakoribb tünet a lassúság, remegés, merevség, fájdalom és a szaglás vagy ízlelés elvesztése. Késői fázisban ez az 5: a változékony reakció a gyógyszerekre, hangulatingadozások, nyáladzás, alvászavarok és remegés volt (Politis és mtsai, 2010).
A motoros tünetek közé tartozó fő triád: a remegés, a merevség, lassultság (bradykinesia) (Politis és mtsai., 2010).
A nemmotoros tünetek fontossága az utóbbi időben vált nyilvánvalóvá. Ide tartoznak a hangulatingadozások, fájdalom, alvászavar, kognitív hanyatlás és az autonóm folyamatok diszfunkciója. A depresszió, légzési nehézségek, alvászavarok, székrekedés (constipatio) már a motoros zavarok kialakulása előtt is megjelenhet (Politis és mtsai, 2010).
A betegség során előforduló tünetek: - szélsőséges reakciók a gyógyszerre; hangulatingadozások; nyáladzás; alvászavarok; remegés; fájdalom; hólyag-problémák; széklet-problémák; esések; étvágy- és súlycsökkenés; lassúság; fáradtság; szexuális diszfunkció; hallucinációk, tévképzetek; „nyugtalan-láb”; beszédzavar; írás zavara; szaglás, ízlelés elvesztése; izzadás; nyelés-zavarok; memória-zavarok; merevség; „lefagyás”. A nyáladzás ebben az esetben a nyelés frekvenciazavara, nem pedig a hiperszekréció miatt alakul ki. A fájdalom főleg a mozgásszervek fájdalmában (musculoskeletal), illetve korai Parkinson esetén viszcerális, késői Parkinsonnál pedig a mozgászavar okozta fájdalommal egészül ki. Az esetek mintegy felében jegyeztek fel depressziót (Politis és mtsai, 2010).
Patogenezis
Bevezetés
A Parkinson-kór a dopaminerg-neuronok (olyan idegsejtek, amik dopamint használnak neurotranszmitterként) halálával járó betegség az agy substantia nigra pars compacta nevű részében (Franco és mtsai, 2015).
A substantia nigra a középagyban található, dopamint tartalmazó idegsejtek alkotta terület. Két része van: a pars reticulata és a pars compacta. A betegség az utóbbi részt érinti. Az itt található, dopaminerg-neuronok funkciója összetett, leginkább szabályozzák, befolyásolják a finomabb mozgásokat, illetve szerepet tulajdonítanak nekik a tanulási folyamatokban is (Franco és mtsai, 2015).
A Parkinson-kórról biztosan tudni, hogy ezeknek a dopamint tartalmazó sejteknek az elhalása áll a betegség hátterében, de számos tényező tisztázatlan még, többek között, hogy mi is okozza a sejtek degenerációját, majd pusztulását. Egy hipotézis szerint a mitokondrium elégtelen működése játszhat közre benne (Franco és mtsai, 2015).
|
A mitokondrium szerepe
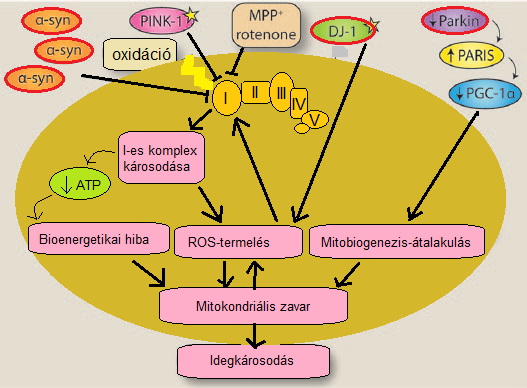
A mitokondrium egy sejtszervecske, ami energiát állít elő és raktároz a sejt számára. Egy saját, cirkuláris DNS-molekulával rendelkezik, ez kódolja a működéséhez szükséges fehérjéket. Számos anyagcsere-folyamat helyszínéül szolgál, valamint itt található a légzési lánc, ahol a biológiai oxidáció utolsó szakasza zajlik. A légzési láncot 5 komplex alkotja, ezek közül az I. komplex jelentős a betegség szempontjából (Franco és mtsai, 2015).
Ez a komplex működése közben szuperoxid aniont (O²¯) termel. A szuperoxid anion egyike azoknak az igen reaktív anyagoknak, amiket szabad gyököknek nevezünk (ezeken belül is a ROS-csoporthoz tartozik, vagyis a Reactive Oxygen Species-hez). Ezek párosítatlan elektront tartalmaznak és reakcióba lépnek más molekulákkal pl. fehérjékkel, lipidekkel vagy akár DNS-sel. A reakció eredményeképpen módosítják azok szerkezetét, ezzel károsítva őket. Az I. komplexet gátolva, megakadályozzák az elektronok áramlását a légzési láncon, miközben nagy mennyiségű ROS-anyag termelődik (lásd 9. ábra) (Franco és mtsai, 2015).
A programozott sejthalál
A mitokondrium szerepet játszik a programozott sejthalál (apoptosis) szabályozásában is. A ROS-anyagok felhalmozódása hozzájárul a sejthalál előidézéséhez. A mitokondriális DNS sérülése aktiválja a pro-apoptikus utakat, beleértve a Bax nevű fehérje a mitokondrium külső membránjára történő transzlokációját. Ez a protein apoptózis-szabályozó szereppel bír azáltal, hogy a citokróm-c enzimet a citoszolba jutattja a légzési láncból, csökkentve a küszöbét a mitokondrium-függő apoptózisnak (Franco és mtsai, 2015).
Posztmortem Parkinson-kóros betegek agyából kimutatták a károsodott lipideket, fehérjéket, a sérült I. komplexet és a megnövekedett ROS-termelés egyéb jeleit. A mitokondrium működésének megváltozása szerepet játszik a Parkinson-kór patogenezisében, de egyelőre nem bizonyított, hogy ok vagy okozat. Önmagában vélhetően nem okoz dopaminerg sejthalált, lehetséges, hogy egy bonyolult, több faktoros patogenetikus folyamat része (Franco és mtsai, 2015).
Az oxidatív stressz szerepe
A neuronok nagy O2 igényű sejtek, ugyanakkor kevés antioxidánssal rendelkeznek. Az antioxidánsok védő faktorok pl. enzimek: szuperoxid-dizmutáz, glutation peroxidáz, melotinin, karotinoidok, amik a sejt normál működése során termelődött instabil és potenciálisan citotoxikus molekulák, a szabad gyökök elleni védekezést segítik a homeosztázist fenntartva (Jiang és mtsai, 2016).
Oxidatív stressz akkor lép fel a szervezetben, ha túl sok ROS-anyag termelődik. Ezek a citotoxikus anyagok - reakcióba lépve a lipidekkel, fehérjékkel - károsítják, működésképtelenné teszik őket, így a dopaminerg neuronok halálát okozva. A telítetlen lipidek, amik a sejtmembrán felépítésében vesznek részt, hajlamosak leginkább a lipid peroxidációra, ez a szerkezetváltozással járó reakció pedig nem előnyösen módosítja a membrán fluiditását, permeábilitását. A megnövekedett ROS-termelés továbbá zavarhatja a szinaptikus átvitelt, ezzel az idegsejtek működési elégtelenségét okozva (Jiang és mtsai, 2016).
Az oxidatív stresszel összefüggésbe hozható fehérjék
A Parkinson-kórnak két változata ismert: egy öröklődő és egy nem öröklődő, „szórványos” típus. Az utóbbi években több olyan fehérje-molekulát is felfedeztek, amelyek mindkét változat patogenezisében szerepet játszhatnak és összefüggésbe hozhatók az oxidatív stresszel is. Ilyen proteinek: DJ-1, α-synuclein, dardarin (LRRK-2), szuperoxid-dizmutázok (SOD) (Jiang és mtsai, 2016).
DJ-1 / Park7
A DJ-1 fehérje az oxidatív stresszt csökkentve bizonyítottan védi a sejtet a sejthaláltól: zebrahalakban megnövekedett koncentrációban figyelték meg oxidatív stressz alatt, az azonban, hogy hogyan fejti ki hatását még tisztázatlan. Egyúttal kimutatták DJ-1 génkiütött egerekben a légzési lánc és az ATP termelés zavarát (Jiang és mtsai, 2016).
Számos kutatás fordított figyelmet ennek a fehérjének a mutációjára is. Az egyik legjelentősebb mutáció következtében a protein oxidálódik, miközben reagál a megnövekedett ROS-szintre. Ezzel teljesen működésképtelenné válik és növeli a kockázatát az oxidatív stressz megjelenésének a dopaminerg sejtekben. Ez a mutáció-típus egy öröklődő, korán fellépő változatáért felelős a Parkinson-kórnak (Jiang és mtsai, 2016).
Alfa-synuclein
Az α-synuclein egy kisméretű fehérje, a Lewy-testek (proteinek abnormális felhalmozódása idegsejtekben neurodegeneratív betegségek esetén) elsődleges felépítője. Neurotoxicitását a következőképpen fejti ki: felhalmozódva a mitokondrium elégtelen működését okozza, így hozzájárul a ROS-produkció növekedéséhez. A nagy mennyiségben jelenlévő ROS-anyagok serkentik a fehérje felhalmozódását egy ördögi kört generálva (Jiang és mtsai, 2016).
A Parkinson-kór során az α-synuclein károsítja mitokondrium működését, gátolva az I. komplexet, annak funkciója gyengül és így több szuperoxid aniont termel. A dopaminerg idegsejtek pedig még inkább fogékonyabbak az α-synuclein okozta oxidatív stresszre. A betegségben szenvedők substantia nigrájának pars compacta részében kimutatták az extracelluláris α-synuclein indukálta kóros működését a mikroglia sejteknek (immunsejtek a központi idegrendszerben). A mikroglia sejtekben található NADPH+ enzim működésbe lép és fokozza a O²¯ termelést, növelve az oxidatív stresszt (Jiang és mtsai, 2016).
LRRK-2 (Leucine-rich Repeat Kinase 2) / dardarin / PARKS
LRRK-2 egy enzim, melynek mutációja a Parkinson-kór öröklődő változatához vezethet. Az egyes kontinenseken más és más mutáns változata elterjedt a fehérjét kódoló génnek, amik eltérő tüneteket produkálnak a betegség megjelenésében. Ezek a mutációk oxidatív változásokat eredményeznek a makromolekulák felépítésében, ami a neuronok elvesztéséhez vezet. Továbbá felborítják az intracelluláris kalcium-egyensúlyt, így az idegsejt nehezebben tudja megelőzni a mitokondrium degradációját (Jiang és mtsai, 2016).
Kutatások kimutatták, hogy az LRRK-2 a peroxi-redoxin-3 nevű peroxidáz enzimre is káros hatású. Ez az enzim antioxidáns hatással bír, a mutáns dardarin fehérje azonban foszforilálja azt, így csökkentve hatását. A dardarin oxidatív stresszt növelő hatását alátámasztották egy mutáns gént hordozó legyeken végzett kísérlettel, ahol az állatokat kurkuminnal kezelve (antioxidáns hatású) nőtt a túlélési arány (Jiang és mtsai, 2016).
Purinerg receptorok
A purinerg receptorok ioncsatornák a sejtmembránon, amik részt vesznek a sejthalál szabályozásában és a mikroglia válaszreakciókban. A neuronokban, gliasejtekben sok ilyen receptor található. A Parkinson-kór szempontjából 7 altípusa közül a legfontosabb a P2X7 receptor. Ez a receptor található meg a dopaminerg területeken, ahol a dopamin-ürítés szabályozásában kap szerepet. A P2X7R bizonyítottan közreműködik az oxidatív stressz kialakításában, de nem tudni hogyan. Egy új teória szerint van egy nagy intracelluláris része az ioncsatornának, amely számos eltérő jelátviteli utat aktiválva hozzájárul a ROS-termelés fokozódásához (Jiang és mtsai, 2016).
Szuperoxid-dizmutáz (SOD)
A SOD a szervezet egyik legfőbb antioxidánsa. Három formája van: a SOD1 (citoplazma), SOD2 (mitokondriumban) és a SOD3 (extracellulárisan). Szerepük a szuperoxid anion oxigénné és hidrogén-peroxiddá történő átalakítása. A SOD1 expressziója a DJ-1 szabályozása alatt áll, így, ha utóbbi fehérje mutálódik, nem tudja betölteni a feladatát és a SOD1 enzim termelése zavart szenved, kiesik antioxidáns hatása. A SOD2 megakadáyozza a ROS-anyagok diffúzióját a mitokondriumból, ezáltal azok nem halmozódnak fel a szervezetben. Szerepe a Parkinson-kórban még vitatott. Mivel a mitokondriumban lokalizálódik, vélhetőleg közreműködhet az oxidatív stressz kialakításában, valamint nagy mennyiségben kimutatták a betegségben szenvedők frontális agykérgében (Jiang és mtsai, 2016).
Említésre érdemes még a dopamin szerepe az oxidatív stressz kialakulásában, ugyanis a citoszolban felhalmozódva spontán és enzimek által is oxidálódhat, a keletkezett anyagok pedig károsíthatják a fehérjéket, akár az α-synucleint, a DJ-1-et vagy a SOD2-t.
Kezelés
Mivel a Parkinson-kór kialakulásának oka még nem ismert, a jelenlegi kezelések a tünetek enyhítésére és a dopamin növelésére szorítkoznak az érintett agyi régiókban. Hatásosnak bizonyult a gyógynövények közül az ajakosakban lévő baicalin nevű flavonoid, ami megköti a szabad gyököket és gátolja az α-synuclein felhalmozódást. A Ginkgo biloba kivonata hasonló hatással bír, szintén semlegesíti a szabad gyököket így megakadályozva a sejt károsodását (Zhang és mtsai, 2016).
Az oxidatív stressznek fontos szerepet tulajdonítanak a betegség kialakulásában, ezért az antioxidánsokkal való kezelés alternatívát jelenthet. A kurkumin például stabilizálja a mitokondrium funkcióját és bizonyítottan csökkenti a dopaminerg sejthalált. Illetve a korábbiakban említett P2X7R antagonistája át tud jutni a vér-agy gáton és csökkenti a ROS-képződést, ezzel védve a sejteket (Jiang és mtsai, 2016).
Irodalomjegyzék
Alzheimer-kór:
Bae, J. R. ; Kim, S. H. (2017): Synapses in Neurodegenerative diseases. BMB Reports. 2017 Mar 8. pii: 3787
Dr. Kálmán J. (2006): Genomikai és metabolomikai eltérések Alzheimer-kórban és kísérletes modelljeiben. PhD értekezés. Szeged, Alzheimer-kór Kutatócsoport Pszichiátriai Klinika, Szegedi Tudományegyetem. p. 183. URL: http://real-d.mtak.hu/66/1/Kalman_Janos.pdf Megtekintve: 2017. 04. 08.
Farlow, M. R.; Miller, M. L.; Pejovic, V. (2008): Treatment Options in Alzheimer’s Disease: Maximizing Benefit, Managing Expectations. Dementia and Geriatric Cognitive Disorders 25: 408–422
Hardy, J.; Selkoe, D. J. (2002): The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science's Compass 297: 353-356
https://www.alz.co.uk/research/statistics - Alzheimer’s Disease International – The Global Voice on Dementia, 2017. 04. 08.
Khyade, V. B.; Khyade, S. V. és Jagtap, S. G. (2016): Alzheimer’s Disease: Overview. International Academic Journal of Social Sciences 3: (12) 23-38
Neundörfer, G.; Hippius, H. (2003): The Discovery of Alzheimer’s Disease. Dialogues in Clinical Neuroscience 5: (1) 101–108
Parkinson-kór:
Franco, S.; Vila, M.; Perier, C. (2015): The Parkinson Disease Mitochondrial Hypothesis: Where Are We at?. The Neuroscientist; DOI: 10.1177/1073858415574600
Jiang, T.; Sun, Q.; Chen, S. (2016): Oxidative stress: A major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson’s disease and Alzheimer’s disease. Progress in Neurobiology 147: 1–19
Parkinson, J.: An Essay on the Shaking Palsy (Sherwood, Neely, and Jones, London, 1817); Polymeropoulos, M. H.; Lavedan, C.; Leroy, E.; Ide, S. E.; Dehejia, A.; Dutra, A.; Pike, B.; Root, H.; Rubenstein, J.; Boyer, R.; Stenroos, E. S.; Chandrasekharappa, S.; Athanassiadou, A.; Papapetropoulos, T.; Johnson, W. G.; Lazzarini, A. M.; uvoisin, R. C.; DiIorio, G.; Golbe, L. I. and Nussbaum, R. L. (1997): Science 276: 2045
Parkinson’s Disease Foundation - http://www.pdf.org/parkinson_statistics - 2017. 04. 08.
Politis, M.; Wu, K. ; Molloy, S.; Bain, P. G.; Chaudhuri, K. R.; Piccini, P. (2010): Parkinson’s Disease Symptoms: The Patient’s Perspective. Movement Disorders 25: (11) 1646-1651
Zhang, H. ; Tong, R. ; Bai, L. ; Shi, J. ; Ouyang, L. (2016): Emerging targets and new small molecule therapies in Parkinson’s disease treatment. Bioorganic & Medicinal Chemistry 24: (7) 1419–1430
Ábrák
Alzheimer-kór:
1. ábra:https://en.wikipedia.org/wiki/File:Alois_Alzheimer_003.jpg
2. ábra:https://www.thestandrecovery.com/brain-science-what-like-its-hard-part-1/ (újrarajzolva, ez alapján)
3. ábra:https://commons.wikimedia.org/wiki/File:Amyloid_01big1.jpg
4. ábra:https://commons.wikimedia.org/wiki/File:Amyloid_02big1.jpg
5. ábra:https://commons.wikimedia.org/wiki/File:Amyloid_03big1.jpg
6. ábra:https://commons.wikimedia.org/wiki/File:APP_processing.png
Parkinson-kór:
7. ábra:http://www.allaboutparkinsons.com/james-parkinson.html
8. ábra:http://neurosciencenews.com/files/2012/09/parkinsons-disease-symptoms-man.gif
9. ábra:Franco, S.; Vila, M.; Perier, C. (2015): The Parkinson Disease Mitochondrial Hypothesis: Where Are We at?. The Neuroscientist; DOI: 10.1177/1073858415574600