A Herpes Simplex 1 vírus szerepe az Alzheimer-kór kialakulásában
Contents
Bevezetés
Jelenleg az Alzheimer-kór a leggyakoribb időskori megbetegedések egyike, napról napra egyre több idős ember családjának kell szembenéznie ezen neurodegeneratív probléma tüneteivel, amely a magatartásváltozás, kognitív és gondolkodásbeli zavarok és demencia (melynek legfőbb oka az Alzheimer-kór) kialakulása mellett komoly testi leépüléssel is járhat, mindemellett az egyik legköltségesebben kezelhető kórképek között tartják számon.
Mindezek ellenére a betegséget kiváltó tényezők közül nem mindegyik ismert. A magas vérnyomás, depresszió, cukorbetegség, illetve a genetikai hajlam vizsgálata mellett az utóbbi évtizedekben új, a korábbiaktól erőteljesen eltérő kutatási irány is megjelent, amely szerint az Alzheimer-kór kialakulása mögött a bőrön és nyálkahártyán látványos elváltozásokat okozni képes, ám az idegrendszert is érintő 1-es típusú herpesz simplex vírus (HSV-1) fertőzés szövődményeként felhalmozódó amiloid béta fehérjeplakkok, illetve abnormális tau fehérjék állhatnak.
Az összefüggést megalapozó kutatások
Kutatók évtizedek óta folytatnak vizsgálatokat (Abbott, 2020) annak megállapítása érdekében, hogy a herpeszvírusnak lehet-e szerepe agyi leépülést és demenciát okozó betegségekben, amelyek közé az Alzheimer-kór (AD) is tartozik. Kutatástörténeti áttekintésünket a PubMed adatbázisban található publikációk segítségével állítottunk össze. Ezek alapján már az 1960-as években felmerült a lehetőség, hogy a Herpesvirales családba tartozó vírusnak lehet köze demencia kialakulásához (Manzini, 1961). A Herpes simplex vírusok (HSV) kutatása ebből az aspektusból azonban komolyabban az 1980-as évektől kezdődött.
1980-as évek
A ’80-as évek kutatási módszerei nem voltak elég érzékenyek a vírus pontos, differenciált agyi detektálásához, összefüggés kimutatásához, ugyanakkor megállapították, hogy a trigeminus ideg rostjain az agyba juthat a fertőzés.
1980-ban ismeretlenek voltak az AD hátterében álló patogenetikai események, vírusfertőzésre közvetett bizonyítékok utaltak. Alzheimer-kórban elhunyt betegek agyából DNS-t vontak ki, majd hibridizációs módszerrel izolálták. A kimutatott HSV alacsony mennyisége arra engedett következtetni, hogy a fertőzés nem kapcsolódik a betegséghez (Middleton és mtsai, 1980).
1982-ben megállapították, hogy a trigeminális idegrendszerből származó rostok összeköttetésben állnak a limbikus rendszerrel és herpesz encephalitis által gyakran érintett agyterületeket innerválnak, melyek kritikusak a normális memóriafeldolgozás és -felidézés szempontjából, illetve, hogy a n. trigeminuson felkúszó HSV laesiot okoz (Ball, 1982).
1983-ban immunperoxidáz próbával vizsgálták 43 beteg agyát. Az eredmények „véletlen egybeesésre” utaltak, a HSV kórokozóként való jelenlétét nem bizonyították (Mann és mtsai, 1983).
1984-ben spot-hibridizációval kerestek HSV-genom részleteket AD-fertőzött egér és a betegségben elhunyt emberi agyakban. Bár a fertőzött egerekben könnyen kimutathatóak voltak a herpesz szekvenciák, egyik emberi agyban sem sikerült kimutatni ilyen szekvenciákat (Taylor és mtsai, 1984).
1986-ban Alzheimer-típusú demenciában szenvedő betegek agyából származó DNS-sel végzett kísérletek nem mutattak vírusszekvenciát a magasabb központi idegrendszerben. Arra a következtetésre jutottak, hogy ezen az érzékenységi szinten normál esetben nem mutathatók ki itt a vírusok (Taylor és Crow, 1986).
1990-es évek
A ’90-es években megjelent PCR-technika sokkal precízebb detektálást tett lehetővé. Megállapították, hogy a HSV az agy bizonyos területein fordul elő, és – egyéb tényezőkkel együtt – szerepet játszhat az AD kialakulásában.
1991-ben PCR-rel detektálták a vírus timidin-kináz génjét beteg és normál egyedekben, valószínűsítették, hogy a vírus mennyisége (a gének száma), vagy expressziója befolyásolhatja a betegség kialakulását (Jamieson és mtsai, 1991).
1992-ben megvizsgálták, hogy ki lehet-e mutatni hagyományos vírusok nukleinsav-szekvenciáit AD-betegek perifériás vér- és agyszöveteiből. A vizsgált vírusok (köztük a HSV) az alkalmazott érzékenységi szinten nem voltak kimutathatóak, így ezek hatását kizárták (Kittur és mtsai, 1992).
Még ebben az évben PCR vizsgálatot végeztek a korábbihoz hasonlóan, a vírus timidin-kináz génjével, és megállapították, hogy a HSV az agynak bizonyos területein (cortex temporalis, hippocampus) fordul elő – tehát régiófüggő (Jamieson és mtsai, 1992). Három évvel később, ugyancsak PCR vizsgálattal nagyon hasonló eredményre jutottak, valamint örökletes kockázati tényezőként állapították meg az apolipoproteinE 4 (apoe4) változatának génjét, ami a HSV-vel összefüggésben az AD faktora (Lin és mtsai, 1995).
Egy 1997-es kutatásban megerősítették a vírushipotézist és az előzőhöz hasonló együtt járást állapítottak meg a HSV és az apolipoporotein-gén között, ugyanakkor arra jutottak, hogy a két tényező külön-külön nem növeli a betegség esélyét (Itzhaki és mtsai, 1997). 1999-re a HSV1 és apoe4 kölcsönhatásának káros idegrendszeri szerepe elfogadottá vált (Dobson és Itzhaki, 1999).
2000-es évek
A 2000-es években bebizonyították a HSV-genom és más herpeszek jelenlétét az agyban (Cheon és mtsai, 2001), modellt alkottak a HSV terjedésére az idegrendszerben (Satpute-Krishnan és mtsai, 2003), valamint megerősítették a HSV1 és apoe4 kockázati faktor voltát, ezek mechanizmusára és az amiloidok szerepére több kutatás irányult (Shipley és mtsai, 2005).
Egy 2001-es kutatásban kimutatták a HSV1-genom jelenlétét az agyban egy HSV1 indukálta fehérjével együtt, amely gyulladásjelző és -keltő szerepén túl apoptózis előidézője is lehet (Cheon és mtsai, 2001). A következő évben más herpeszfajok agyi jelenlétére találtak bizonyítékot PCR-vizsgálattal, amelyek a HSV1 okozta idegrendszeri károsodást erősíthetik.
2003-ban tintahal nagy axonján modellezték a HSV terjedését, megállapították, hogy a vírus gyors anterográd transzporttal utazik (Satpute-Krishnan és mtsai, 2003).
Ugyanebben az évben kritikai cikk jelent meg a vírushipotézis bírálatára, melyben felhívták a figyelmet a bizonyító kísérletek következetlenségére, arra, hogy a HSV1 fehérjék agyi jelenlétére még mindig kevés a bizonyíték, valamint, hogy a tapasztalt idegrendszeri károsodásokat más fertőzés is okozhatja (Robinson és mtsai, 2004).
2005-ben megerősítették, hogy a HSV1 és az apoe4 allél hordozásának kombinációja erősen növeli az Alzheimer-kór kialakulásának kockázatát. Valamint, hogy az AD kialakulásában feltehetően szerepet játszik egy 39-43 aminosavból álló fehérje - β-amiloid (Aβ) - rendellenes aggregációja vagy lerakódása is, amely egy transzmembrán fehérjéből, az "amiloid prekurzor fehérjéből" hasad le (APP), és ezt a folyamatot a HSV kórosan befolyásolja (Shipley és mtsai, 2005). Két évvel később azt is felfedezték, hogy az apoe4 kockázatához további tényezők is hozzájárulnak (nem, családi kapcsolatok, dózis) (Burgos és mtsai, 2007).
Ezután 2009-ben, a HSV egér és sejtkultúrás vizsgálata alapján, megállapították, hogy a vírus az amiloid plakkok kialakulásának egyik fő okozója, és így valószínűleg jelentős etiológiai tényezője az Alzheimer-kórnak (Wozniak és mtsai, 2009).
A kutatások napjainkig folytatódnak, a HSV szerepe pedig az Alzheimer-kór kialakulásában egyre döntőbbnek látszik (Abbott, 2020).
A vírus hatásai a központi idegrendszerre
Herpeszvírus bejutása a szervezetbe
A herpesz simpelx-1 (HSV1) testváladékkal jut be a nyálkahártyákon keresztül (Tarcsai és mtsai, 2018) és a ganglion nervi trigemini által jut az agyba. Reaktiválódások között ebben a ganglionban található (Devanand, 2018). Reaktiváció esetén az érzőneuronokon keresztül levándorol a száj hámjára, ott ajakherpeszt okoz, vagy az agy irányába indul, itt az Alzheimer-kórhoz (AD) hasonló agyterületeket érintő megbetegedés a herpesz encephalitis (Harris és Harris, 2015).
Fő folyamatok
A HSV1 mechanizmusai az Alzheimer-kór jellegzetes ismertetőjeleinek kialakulásában részt vevő fő folyamatokat ösztönzik, ilyen jelek az amiloid plakkok és a neurofibrilláris csomók (Khokale és mtsai, 2020).
Amiloid plakkok
Az amiloid béta (Aβ vagy Abeta) 36-43 aminosavból álló peptideket jelöl, amelyek az Alzheimer-kórban szenvedők agyában található amiloid plakkok fő összetevői (Hamley, 2012).
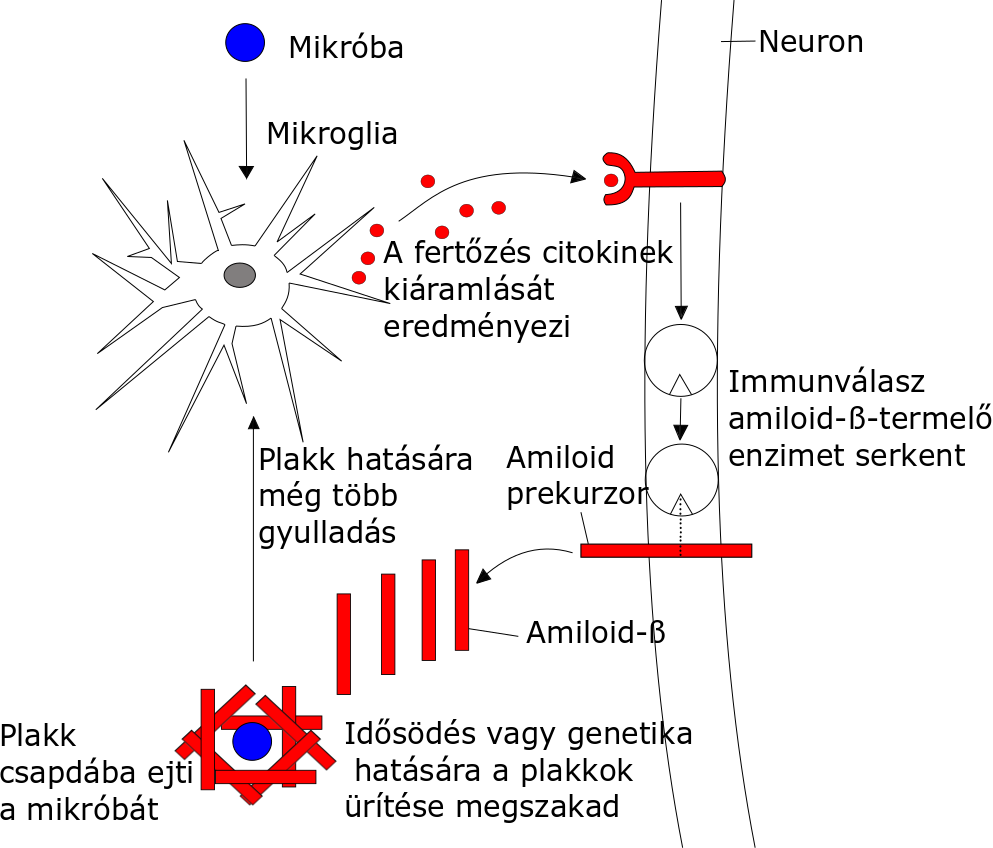
A rövid amiloidláncok az amiloid prekurzor protein hidrolíziséből származnak (1. ábra) (Pohanka, 2018), amiből rengeteg, hosszukban eltérő amiloid keletkezik az α-szekretáz, a β-szekretáz vagy a γ-szekretáz aktivitása révén (Ortega és mtsai, 2013). Az amiloid prekurzorfehérje valószínűleg többféle funkciót lát el a sejtekben, többek között a külső jelek által történő gerjesztést, míg a memóriában és a szaglásban betöltött szerepét is tárgyalja a szakirodalom (Kim és mtsai, 2018). Az amiloid prekurzor fehérje hidrolízise során a reakció az α- vagy β-szekretáz hatására indul. A második lépést a γ-szekretáz közvetíti, amely presenilin néven ismert lényeges részeket tartalmaz (Dolev és mtasi, 2013), és ez a presenilin az, amelyről feltételezik, hogy az amiloid plakkok okozója, mivel a presenilin gének gyakran mutálódtak AD-ben szenvedő betegeknél. Az Abeta 42 kémiai tulajdonságai a metionin fehérjén belüli pozícióján alapulnak. A metionin valószínűleg felelős az Abeta 42 káros tulajdonságaiért, mivel reaktív oxigén keletkezik, ami az amiloid plakkok polimerizációjában vesz részt. A képződött amiloidokban megkötött nehézfémek Fenton-reakciók révén tovább indukálhatják a reaktív oxigéngyökök keletkezését.
|
1. ábra: Mikrobák szerepe a plakképződésben (Abbott, 2020 nyomán) |
Az Abeta az agyban gyulladásos folyamatok kísérője, számos tanulmány követi végig a plakkok kialakulását a HSV1 agyba jutását követően (Khokale és mtsai, 2020).
Az amiloid plakkokat modellállatokon végzett kísérletekkel is vizsgálták, noha az eredmények sok esetben nem közvetlenül ültethetőek át az emberi megbetegedésekre (Abbott, 2020). De Chiara és mtsai (2019) megállapították, hogy a többszörös HSV-1 reaktiváció elősegíti az amiloidogén APP fragmentumok és amiloid-β-felhalmozódását és lerakódását amiloid plakkokban, és a HSV-1 reaktivációk által kiváltott Aβ-felhalmozódás korrelál a fertőzött egerek kognitív károsodásával - az egyedek viselkedési tesztekben memóriazavart mutattak.
Az adatok arra utalnak, hogy a HSV1 az Aβ-termékek és plakkok kialakulásában kulcsszerepet játszik. Azt is kimutatták, hogy a HSV1-fertőzött sejtkultúrákban felhalmozódik a csomók fő összetevője - a tau (P-tau) nevű fehérje abnormális formája (Itzhaki, 2018).
Neurofibrillális csomók
A tau egy nagymértékben oldódó, mikrotubulus-asszociált fehérje, amely főként az axonokban koncentrálódik, és a mikrotubulusokhoz kötődik, ezáltal stabilizálva azok szerkezetét. A felnőtt emberi agyban a MAPT gén alternatív mRNS-splicingje révén hat tau-izoforma fejeződik ki, amelyek mindegyikét kimutatták az Alzheimer-kórral összefüggő elváltozásokban. Minden olyan betegségben, amelyben a tau szerepet játszik, a tau hiperfoszforilálódik, és nem képes kölcsönhatásba lépni a mikrotubulusokkal, neurofibrillális csomókat (NTF) alkot, ami megzavarja az axonális áramlást és kognitív problémákat okoz (Giacobini és Gold, 2013).
A HSV1 az agyban enzimes folyamatokat indukál, amelyek a tau foszforilációjához vezetnek, ezt több vizsgálat is bizonyítja (Harris és Harris, 2018; Harris és Harris, 2015; Mangold és Szpara, 2019; Devanand, 2018; La Rosa és mtsai, 2019). A foszforilált forma, a P-tau, a sejt apoptotikus folyamatainak aktiválási útvonalában fordul elő, sejt szinten az összes apoptotikus test keletkezésével végződő folyamathoz szükséges. Valószínű, hogy az apoptotikus folyamatok és a citoszkeleton neurodegenerációja szorosan összefüggnek, és különböző neurotoxikus ingerek hatására alakulnak ki (Martin és mtsai, 2011). A vírusos kinázok hozzájárulnak a P-tau megjelenéséhez a fajokon átívelő kinázok miatt, mert mind a humán, mind a vírus kinázok foszforilálják a humán és a vírusfehérjéket. Egy másik ok a humán tau és a HSV-vírus-22 fehérje közötti aminosav-homológia (Devanand, 2018).
További molekuláris mechanizmusok
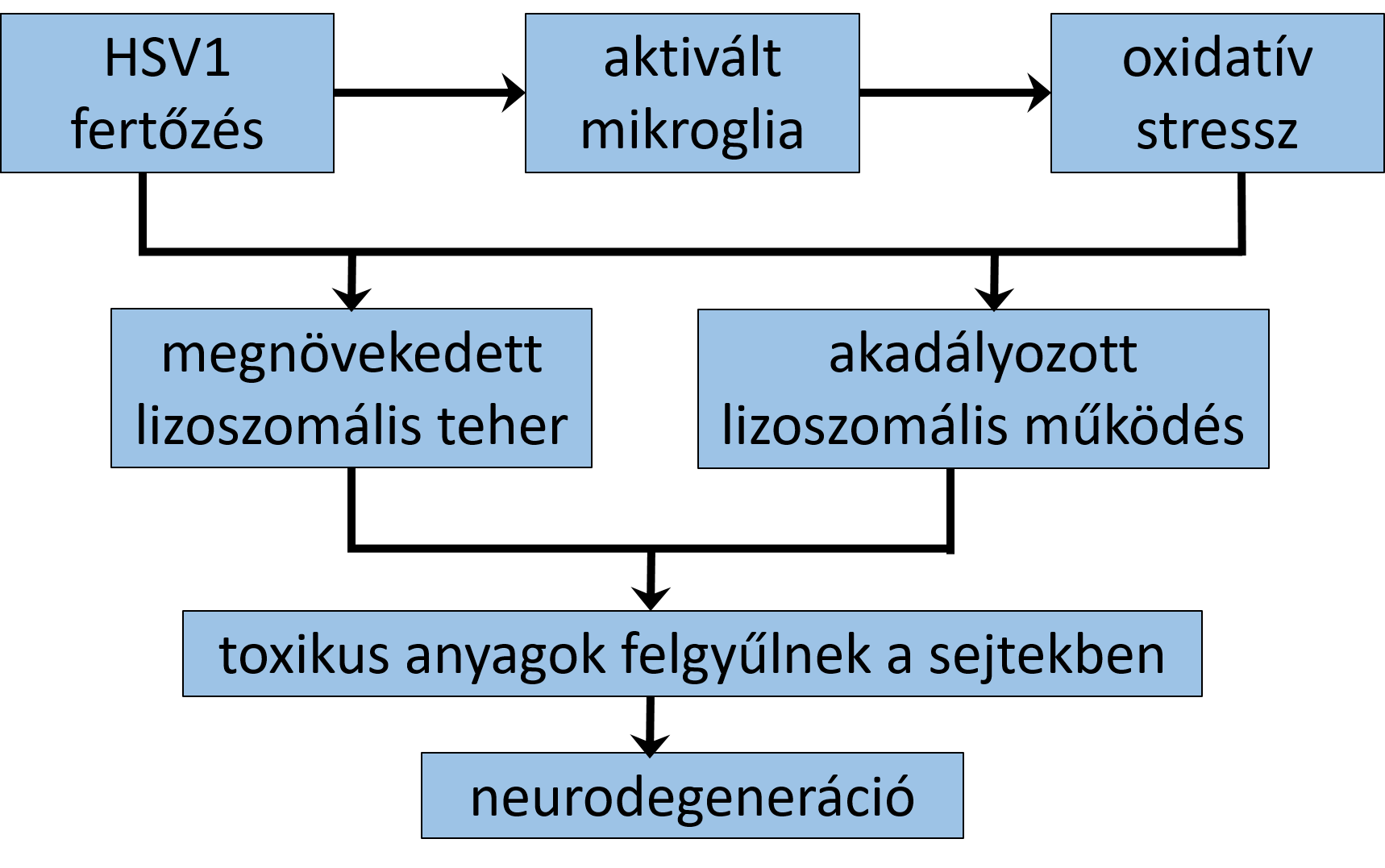
A HSV1 fertőzés gyulladásos folyamatokat indukál, aminek hatására neurodegeneratív szabadgyökös reaktív oxigén (ROS) és reaktív nitrogén keletkezik, amik oxidatív stressz faktorok (Pohanka, 2018). Az oxidatív stressz az AD egyik legkorábbi karakterisztikus ismertetőjele, a károsodás forrásai sokrétűek, és kölcsönhatásban vannak a rendellenes mitokondriumokkal, a redoxi átmenetifémekkel és más tényezőkkel (2. ábra) (Zhu és mtsai, 2007).
|
2. ábra: Neurodegeneráció HSV1 fertőzés hatására (Khokale és mtsai, 2020 nyomán) |
Harris és Harris (2018) megállapították, hogy ha acitokinek átjutnak a vér-agy gáton, kóros neuropátiás kölcsönhatásba lépnek az aggyal. Itzhaki (2018) felhívta a figyelmet a HSV1 fertőzés és a lizoszómális folyamatok károsodása közötti összefüggésre, melynek hatására fokozódik a sejtekben felgyűlt toxikus anyagcseretermékek mennyisége, és sejtkárosító hatása.
Egyéb hipotézisek az Alzheimer-kór kialakulására
Nem bizonyított, hogy környezeti tényezőknek (pl. fejsérülés, vírusok, toxinok, alacsony iskolai végzettség) közvetlen szerepe van az AD patogenezisében. Ikerkutatások alapján, a kór környezeti és genetikai tényezők együttes hatására alakul ki (Gatz és mtsai, 2006).
Genetika
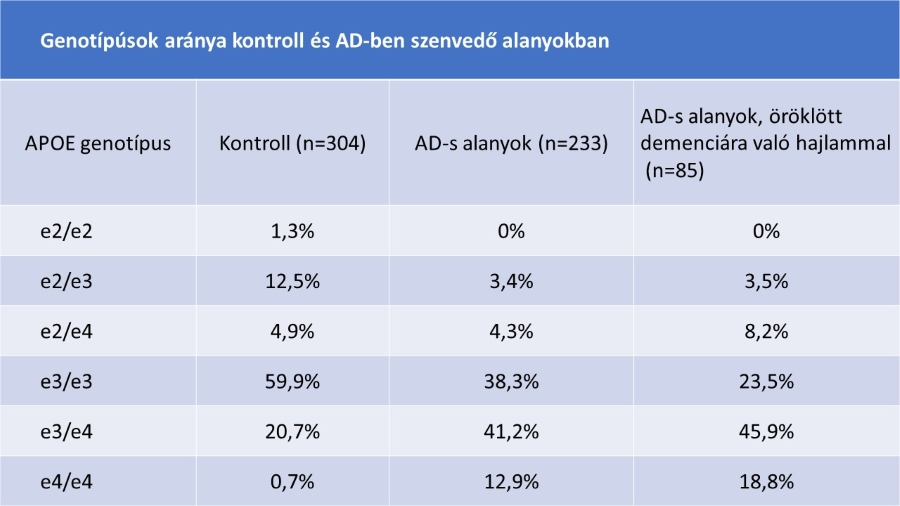
Jól dokumentált az összefüggés a későn jelentkező familiáris Alzheimer-kór (FAD) és az APOE e4 allél között. Úgy tűnik, hogy az APOE e4 allél molekuláris szintű mechanizmusok révén korábbra tolja a betegség kialakulásának korát. Jarvik és mtsai (1996) egy elszigetelt populációt vizsgáltak, kutatásaik alátámasztják az összefüggést (1. táblázat).
|
1. táblázat: A legtöbb családnak a vizsgált populációban hajlama van késői öröklött AD-re (Jarvik G és mtsai, 1996 nyomán) |
Számos egyéb gént vizsgálnak AD-vel kapcsolatban: a SORL1-et a 11q23 kromoszómán, fehérjéje az amyloid (APP) fehérje szállításában vesz részt. Késői AD-ra vonatkozó tanulmányok egy genetikailag izolált holland populáción egyes markereket az alábbi kromoszómákon hoztak összefüggésbe AD-vel: 1q22, 3q23, 10q22, és 11q25.57 (Bird, 2008).
Citomegalovírus
A Rush Alzheimer's Disease Center Religious Orders Study alanyainak szérumát, agy-gerincvelői folyadékát (CSF) és krioprezervált limfocitáit elemezték a citomegalovírus (CMV) fertőzés és az Alzheimer-kór klinikai és patológiai markerei közötti összefüggések szempontjából. A CMV-antitestek szintje összefüggésbe hozható volt a neurofibrilláris csomókkal (NFT-k). Az immuncitokémiai elemzés az amiloid-β indukcióját mutatta ki a 3 klinikai CMV-törzs mindegyikével fertőzött emberi fityma fibroblasztokban (HFF). Ugyanezekben az alanyokban nem volt összefüggés az 1-es típusú herpesz szimplex vírus (HSV-1) antitestszintje és a CMV-antitestek szintje, illetve az Alzheimer-kór klinikai vagy patológiai markerei között. A HFF-ek HSV-1 fertőzése nem indukált amiloid-β-t. Ezek az adatok alátámasztják a CMV és az Alzheimer-kór kialakulása közötti összefüggést (Lurain és mtsai, 2013).
Chlamydia pneumoniae
Számos bakteriális kórokozót összefüggésbe hoztak az Alzheimer-kór kialakulásával. A Chlamydia pneumonia egy obligát intracelluláris baktérium, amelyet először Balin és munkatársai figyeltek meg 1998-ban a postmortem AD agyban, bár a leletet azóta többször megismételték (Dreses-Werringloer és mtsai, 2009). A C. pneumoniae antigének immunreaktivitását mind intracellulárisan a neuronokban, neurogliákban, mind extracellulárisan az Alzheimer-kóros agynak frontális és temporális kérgében C. pneumoniae-specifikus antitestekkel figyelték meg, az amiloid lerakódás régióiban. A C. pneumoniával való fertőzés ötszörösére növeli az AD kialakulásának esélyét, és az AD-betegeknél a kontrollszemélyekhez képest megnövekedett a C. pneumonia-specifikus antitestek szintje a vérkeringésben. A HSV-1-hez hasonlóan az APOE4 alléllal rendelkező AD-betegek is fogékonyabbak a C. pneumonia fertőzésre, mivel az APOE4 nélküli betegekhez képest szignifikánsan nagyobb baktériumterhelést figyeltek meg olyan régiókban, mint a hippokampusz. A C. pneumonia in vitro képes gátolni a neuronális apoptózist, így elősegíti a krónikus fertőzés fenntartását.
Érdekes módon az egerek intranazális fertőzése C. pneumoniával Aβ lerakódást indukált az agyban, amely ko-lokalizálódott a reaktív gliákkal. Ami fontos, hogy a C. pneumonia hónapokkal a fertőzés után is aktív marad az egér központi idegrendszerében (Hammond és mtsai, 2010).
Heliobacter pylori
A Heliobacter pylori egy baktérium, amely az emésztőrendszerben szaporodik, és a közelmúltban kimutatták, hogy jelentős összefüggést mutat a demencia kialakulásával. Idősebb egyéneknél a H. pylori IgG antitestek jelenléte csökkent kognitív teljesítménnyel járt együtt, sőt, kutatások kimutatták, hogy az Alzheimer-kóros betegeknél a szérumban és a liquorban is fokozott H. pylori szeropozitivitás mutatkozik. Arról számoltak be, hogy a H. pylori-fertőzés megszüntetése csökkentette az AD-betegek halálozási arányát, amikor 5 évvel később vizsgálták őket. Továbbá azoknál az AD-betegeknél, akiket kezeltek a fertőzésük miatt, és 2 évig H. pylori-mentesek maradtak, javult a kogníció, mint az első vizsgálatukkor, míg azoknál, akik még mindig pozitívak voltak a baktériumra, tovább romlott. Ez a csoport azt is bizonyította, hogy a H. pylori-filtrát jelentősen növeli a tau-foszforilációt in vitro neurontenyészetekben és in vivo patkány hippokampuszban (McManus és Heneka, 2017).
Parodontitis
A parodontitis szintén az Alzheimer-kór kockázati tényezője, és kimutatták, hogy a parodontitisben szenvedő időseknél nagyobb az amiloid felhalmozódása a központi idegrendszerben, és összefüggést találtak a keringésben lévő emelkedett interleukin(IL)-6 éstumor nekrózis faktor (TNF) α és a parodontitis között (McManus és Heneka, 2017).
Gombás fertőzések
Az elmúlt 3 évben számos jelentés született gombafertőzések Alzheimer-kór progressziójához való hozzájárulásáról. Alonso és munkatársai (2014) mutatták ki először a gombafehérjék és a DNS jelenlétét az AD agyban. Számos különböző fajt detektáltak, köztük Saccharomyces cerevisiae-t, Malassezia globosát, Malassezia restrictát és Penicilliumot (McManus és Heneka, 2017).
Ellenérvek összefoglalása
A bizonyítékok alapján egyértelmű, hogy az Alzheimer-kóros betegek sérülékenyebbek a perifériás fertőzés hatásaira, mint a korban hozzájuk hasonló, egészséges társaik. Fontos, hogy számos specifikus vírusos, bakteriális és gombás fertőzés összefüggésbe hozható az AD kialakulásával, bár az, hogy ezek a kórokozók a demencia közvetlen okozói, vagy a kóros folyamatokat kihasználó mikroorganizmusok, amelyek súlyosbítják az ezeknél az egyéneknél már folyamatban lévő ideggyulladást, még megerősítésre vár. Fontos, hogy az AD-betegek vér-agy gátja lényegesen átjárhatóbb, mint az egészséges személyeké, ami megkönnyíti a perifériás immunsejtek és esetleg e fertőző kórokozók beszivárgását (McManus és Heneka, 2017).
Összegzés
Az elöregedő nyugati társadalom egyik legelterjedtebb népbetegségeként számon tartott Alzheimer-kórt különböző szempontokból vizsgáló tudományos cikkek, szakkönyvek és egyéb publikációk számából kikövetkeztethetjük, hogy a modern orvostudomány megkerülhetetlen fontosságúnak tartja a betegség minél átfogóbb és alaposabb megismerését, működésének megértését.
A HSV-1, valamint az Alzheimer-kór kapcsolata is szinte egyértelműnek mondható, azonban ezt az elméleti jellegű, nem pedig a klinikai gyakorlatba átültethető ismeretanyagot még nem sikerült az alkalmazott orvostudomány fegyvertárába sorakoztatni. Ennek ellenére remélhetjük, hogy mind a megelőzés, mind a betegség hatékony gyógyítása terén viszonylag rövid időn belül új, hatékony módszerek jelennek meg. Ezek közül érdemes kiemelni egyes antivirális szerek alkalmazásában rejlő potenciált.
Irodalomjegyzék
Abbott A (2020): Are infections seeding some cases of Alzheimer’s disease? Nature 587: (7832) 22–25
Alonso R; Pisa D; Marina AI; Morato E; Rábano A; Carrasco L (2014): Fungal infection in patients with Alzheimer’s disease. Journal of Alzheimer's disease: JAD 41: (1) 301–311
Ball MJ (1982): Limbic predilection in Alzheimer dementia: is reactivated herpesvirus involved? The Canadian Journal of Neurological Sciences. Le Journal Canadien Des Sciences Neurologiques 9: (3) 303–306
Ball MJ; Lukiw WJ; Kammerman EM; Hill JM (2013) Intracerebral propagation of Alzheimer’s disease: strengthening evidence of a herpes simplex virus etiology. Alzheimer's & Dementia: The Journal of the Alzheimer's Association 9: (2) 169–175
Bird TD (2008): Genetic Aspects of Alzheimer Disease. Genetics in medicine: official journal of the American College of Medical Genetics 10: (4) 231–239
Burgos JS; Ramirez C; Sastre I; Valdivieso F (2007): Apolipoprotein E genotype influences vertical transmission of herpes simplex virus type 1 in a gender specific manner. Aging Cell 6: (6) 841–842
Cairns DM; Rouleau N; Parker RN; Walsh KG; Gehrke L; Kaplan DL (2020): A 3D human brain–like tissue model of herpes-induced Alzheimer’s disease. Science Advances 6: (19) eaay8828
Cheon MS; Bajo M; Gulesserian T; Cairns N; Lubec G (2001): Evidence for the relation of herpes simplex virus type 1 to Down syndrome and Alzheimer’s disease. Electrophoresis 22: (3) 445–448
Deák J; Jakó M; Bártfai G (2015): Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk. FOCUS MEDICINAE 17: (3) 3–9
De Chiara G; Piacentini R; Fabiani M; Mastrodonato A; Marcocci ME; Limongi D; Napoletani G; Protto V; Coluccio P; Celestino I; Li Puma DD; Grassi C; Palamara AT (2019): Recurrent herpes simplex virus-1 infection induces hallmarks of neurodegeneration and cognitive deficits in mice. PLoS Pathogens 15: (3) e1007617
Devanand DP (2018): Viral Hypothesis and Antiviral Treatment in Alzheimer’s Disease. Current Neurology and Neuroscience Reports 18: (9) 55
Dobson CB; Itzhaki RF (1999): Herpes simplex virus type 1 and Alzheimer’s disease. Neurobiology of Aging 20: (4) 457–465
Dolev I; Fogel H; Milshtein H; Berdichevsky Y; Lipstein N; Brose N; Gazit N; Slutsky I (2013): Spike bursts increase amyloid-β 40/42 ratio by inducing a presenilin-1 conformational change. Nature Neuroscience 16: (5) 587–595
Dreses-Werringloer U; Bhuiyan M; Zhao Y; Gérard HC; Whittum-Hudson JA; Hudson AP (2009): Initial characterization of Chlamydophila (Chlamydia) pneumoniae cultured from the late-onset Alzheimer brain. International journal of medical microbiology: IJMM 299: (3) 187–201
Gatz M, Reynolds CA, Fratiglioni L, Johansson B, Mortimer JA, Berg S, Fiske A, Pedersen NL (2006) Role of genes and environments for explaining Alzheimer disease. Archives of General Psychiatry 63: (2) 168–174
Giacobini E; Gold G (2013): Alzheimer disease therapy--moving from amyloid-β to tau. Nature Reviews. Neurology 9: (12) 677–686
Hamley IW (2012): The Amyloid Beta Peptide: A Chemist’s Perspective. Role in Alzheimer’s and Fibrillization. Chemical Reviews 112: (10) 5147–5192
Hammond CJ; Hallock LR; Howanski RJ; Appelt DM; Little CS; Balin BJ (2010): Immunohistological detection of Chlamydia pneumoniae in the Alzheimer’s disease brain. BMC Neuroscience 11: (1) 121
Harris SA; Harris EA (2015): Herpes Simplex Virus Type 1 and Other Pathogens are Key Causative Factors in Sporadic Alzheimer’s Disease. Journal of Alzheimer's disease: JAD 48: (4) 319–353
Harris SA; Harris EA (2018): Molecular Mechanisms for Herpes Simplex Virus Type 1 Pathogenesis in Alzheimer’s Disease. Frontiers in Aging Neuroscience 10: 48, doi: 10.3389/fnagi.2018.00048
Itzhaki RF (2017): Herpes simplex virus type 1 and Alzheimer’s disease: possible mechanisms and signposts. FASEB journal: official publication of the Federation of American Societies for Experimental Biology 31: (8) 3216–3226
Itzhaki RF (2018): Corroboration of a Major Role for Herpes Simplex Virus Type 1 in Alzheimer’s Disease. Frontiers in Aging Neuroscience 10:324, doi: 10.3389/fnagi.2018.00324
Itzhaki RF; Lin WR; Shang D; Wilcock GK; Faragher B; Jamieson GA (1997): Herpes simplex virus type 1 in brain and risk of Alzheimer’s disease. Lancet 349: (9047) 241–244
Jamieson GA; Maitland NJ; Wilcock GK; Craske J; Itzhaki RF (1991): Latent herpes simplex virus type 1 in normal and Alzheimer’s disease brains. Journal of Medical Virology 33: (4) 224–227
Jamieson GA; Maitland NJ; Wilcock GK; Yates CM; Itzhaki RF (1992): Herpes simplex virus type 1 DNA is present in specific regions of brain from aged people with and without senile dementia of the Alzheimer type. The Journal of Pathology 167: (4) 365–368
Jarvik G; Larson EB; Goddard K; Schellenberg GD; Wijsman EM (1996): Influence of apolipoprotein E genotype on the transmission of Alzheimer disease in a community-based sample. American Journal of Human Genetics 58: (1) 191–200
Khokale R; Kang A; Buchanan-Peart K-AR; Nelson ML; Awolumate OJ; Cancarevic I (2020): Alzheimer’s Gone Viral: Could Herpes Simplex Virus Type-1 Be Stealing Your Memories? Cureus 12: (11) e11726
Kim JY; Rasheed A; Yoo S-J; Kim SY; Cho B; Son G; Yu S-W; Chang K-A; Suh Y-H; Moon C (2018): Distinct amyloid precursor protein processing machineries of the olfactory system. Biochemical and Biophysical Research Communications 495: (1) 533–538
Kittur SD; Hoh JH; Kawas CH; Hayward GS; Endo H; Adler WH (1992): A molecular hybridization study for the presence of Herpes simplex, cytomegalovirus and Epstein-Barr virus in brain and blood of Alzheimer’s disease patients. Archives of Gerontology and Geriatrics 15: (1) 35–41
Korte M; Herrmann U; Zhang X; Draguhn A (2012): The role of APP and APLP for synaptic transmission, plasticity, and network function: lessons from genetic mouse models. Experimental Brain Research 217: (3-4) 435–440
La Rosa F; Agostini S; Bianchi A; Nemni R; Piancone F; Marventano I; Mancuso R; Saresella M; Clerici M (2019): Herpes simplex virus-1 (HSV-1) infection induces a potent but ineffective IFN-λ production in immune cells of AD and PD patients. Journal of Translational Medicine 17: (1) 286
Lin WR; Shang D; Wilcock GK; Itzhaki RF (1995): Alzheimer’s disease, herpes simplex virus type 1, cold sores and apolipoprotein E4. Biochemical Society Transactions 23: (4) 594S
Lurain NS; Hanson BA; Martinson J; Leurgans SE; Landay AL; Bennett DA; Schneider JA (2013): Virological and Immunological Characteristics of Human Cytomegalovirus Infection Associated Wzh Alzheimer Disease. The Journal of Infectious Diseases 208: (4) 564–572
Mangold CA; Szpara ML (2019): Persistent Infection with Herpes Simplex Virus 1 and Alzheimer’s Disease-A Call to Study How Variability in Both Virus and Host may Impact Disease. Viruses 11: (10) 966
Mann DM; Tinkler AM; Yates PO (1983): Neurological disease and herpes simplex virus. An immunohistochemical study. Acta Neuropathologica 60: (1-2) 24–28
McManus RM; Heneka MT (2017): Role of neuroinflammation in neurodegeneration: new insights. Alzheimer's Research & Therapy 9: (1) 14
Manzini B (1961): Herpes zoster associated with acute meningoencephalitis with outcome of dementia. Minerva Medica 52: 798–801
Martin C; Solís L; Concha MI; Otth C (2011): Herpes simplex virus tipo 1 como factor de riesgo asociado con la enfermedad de Alzheimer. Revista médica de Chile 139: (6) 779–786
Middleton PJ; Petric M; Kozak M; Rewcastle NB; McLachlan DR (1980): Herpes-simplex viral genome and senile and presenile dementias of Alzheimer and Pick. Lancet 1: (8176) 1038
Ortega F; Stott J; Visser SAG; Bendtsen C (2013): Interplay between α-, β-, and γ-secretases determines biphasic amyloid-β protein level in the presence of a γ-secretase inhibitor. The Journal of Biological Chemistry 288: (2) 785–792
Pohanka M (2018): Oxidative stress in Alzheimer disease as a target for therapy. Bratislavske Lekarske Listy 119: (9) 535–543
Robinson SR; Dobson C; Lyons J (2004): Challenges and directions for the pathogen hypothesis of Alzheimer’s disease. Neurobiology of Aging 25: (5) 629–637
Satpute-Krishnan P; Degiorgis J; Bearer E (2003): Fast anterograde transport of Herpes Simplex Virus: Role for the amyloid precursor protein of Alzheimer’s disease. Aging cell 2: (6) 305-318
Shipley SJ; Parkin ET; Itzhaki RF; Dobson CB (2005): Herpes simplex virus interferes with amyloid precursor protein processing. BMC Microbiology 5: (1) 48
Tarcsai K R; Nagy K; Ongrádi J (2018): A herpeszvírus-fertőzések újabb vonatkozásai. Egészségtudomány 62: (3-4) 3-24
Taylor GR; Crow TJ; Markakis DA; Lofthouse R; Neeley S; Carter GI (1984): Herpes simplex virus and Alzheimer’s disease: a search for virus DNA by spot hybridisation. Journal of Neurology, Neurosurgery, and Psychiatry 47: (10) 1061–1065
Taylor GR; Crow TJ (1986): Viruses in human brains: a search for cytomegalovirus and herpes virus 1 DNA in necropsy tissue from normal and neuropsychiatric cases. Psychological Medicine 16: (2) 289–295
Turner PR; O’Connor K; Tate WP; Abraham WC (2003): Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory. Progress in Neurobiology 70: (10) 1–32
Wang J-Z; Grundke-Iqbal I; Iqbal K (2007): Kinases and phosphatases and tau sites involved in Alzheimer neurofibrillary degeneration. The European Journal of Neuroscience 25: (1) 59–68
Wozniak MA; Mee AP; Itzhaki RF (2009): Herpes simplex virus type 1 DNA is located within Alzheimer’s disease amyloid plaques. The Journal of Pathology 217: (1) 131–138
Zhu X; Su B; Wang X; Smith MA; Perry G (2007): Causes of oxidative stress in Alzheimer disease. Cellular and molecular life sciences: 64: (17) 2202–2210
Ábrajegyzék
A következő tudományos publikációk alapján készítettük az ábrákat:
1. táblázat: Jarvik G; Larson EB; Goddard K; Schellenberg GD; Wijsman EM (1996): Influence of apolipoprotein E genotype on the transmission of Alzheimer disease in a community-based sample. American Journal of Human Genetics 58: (1) 191–200
1. ábra: Abbott A (2020): Are infections seeding some cases of Alzheimer’s disease? Nature 587: (7832) 22–25
2. ábra: Khokale R; Kang A; Buchanan-Peart K-AR; Nelson ML; Awolumate OJ; Cancarevic I (2020): Alzheimer’s Gone Viral: Could Herpes Simplex Virus Type-1 Be Stealing Your Memories? Cureus 12: (11) e11726