Az asztroglia hatása a memóriára
Contents
Bevezetés
Az idegrendszer felépítésében a neuronokon kívül a szintén ektodermális eredetű gliasejtek is nélkülözhetetlen szerepet töltenek be. Rengeteg fajtájuk ismert és rendkívül sokrétű feladatot látnak el. Többek között segítik a neuronok megfelelő anyagcseréjének fenntartását, mielinhüvelyt hoznak létre az axonok körül, támasztják a neuronokat, részt vesznek a vér-agy gát kialakításában és eltávolítják az elhalt sejteket. (Verkhratsky és Nedergaard, 2018)
Az asztrociták általános jellemzése
Morfológia
Az asztroglia sejtek (asztrociták) a legnagyobb számban előforduló gliasejttípus, ők teszik ki az emlősök agyát alkotó sejtek 20-40%-át. Morfológiájukat tekintve is sokfélék. Szövettanilag két fő típusuk különíthető el: protoplazmatikus és rostos asztroglia, amelyek az agy és gerincvelő szürke-, és fehérállományában egyaránt nagyszámban megtalálhatók. Ezen kívül létezik néhány erősen specializálódott asztroglia sejttípus is, mint például a retinában fellelhető Müller sejtek, vagy a Bergmann sejtek a kisagyban. Az asztrociták onnan kapták a nevüket, hogy számos csillagszerűen kiinduló nyúlvánnyal rendelkeznek, melyekkel kapcsolatban állnak vérekkel, neuronokkal és azok szinapszisaival. Átmérőjük 40-60 mikrométer. Rendkívüli morfológiai sokféleségükhöz hozzájárul, hogy az idegrendszer egyes részein belül nagyfokú regionális és mikrokörnyezeti változatosságot mutatnak. Továbbá nagyon plasztikusak, képesek a neuronhálózatok változásait reverzibilis citomorfológiai változásokkal rövid idő alatt (néhány óra) lekövetni. (Zhou és mtsai, 2019)
Élettani szerepük
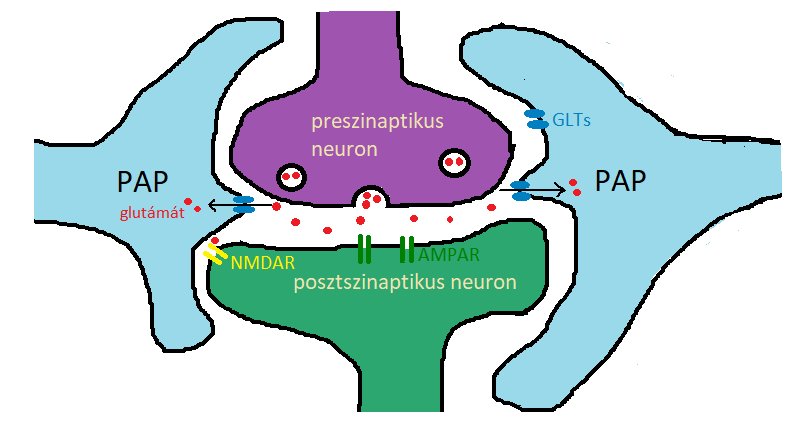
Az asztrociták segítenek fenntartani a központi idegrendszer molekuláris homeosztázisát ionok szállításával, neurotranszmitterek eltávolításával és lebontásával, neurotranszmitter-prekurzorok termelésével és reaktív oxigéngyökök megkötésével. Továbbá glikogént szintetizálnak és energiával látják el a neuronokat. Ezen kívül nyúlványokat bocsátanak a KIR-ben található erekhez, ahol vazoaktív anyagokat juttatnak az érpályába, amivel befolyásolják az idegszövet vérellátottságát, fontos szerepük van a vér-agy gát kialakításában. A vér kémiai összetételét is érzékelik, hozzájárulnak a vér normál elektrolit szintjének és pH-jának fenntartásához. Valamint nélkülözhetetlen szerepet játszanak a szinapszisok kialakulásában. Nem elhanyagolható a szerepük a KIR kórokozókkal szembeni megvédésében sem. Az asztrociták képesek a neuronok közti szinapszisokat rendkívül finom nyúlványokkal (PAP=perisynaptic astrocyte process) körülvenni és befolyásolni az ingerületátvitelt a két idegsejt között, ezáltal képesek módosítani az egyes neuronkörök működését. Ugyanakkor nem minden szinapszist borítanak be az asztrogliák nyúlványai, a borítottság mértéke fajonként és agyterületenként változik. A PAP-ok szerepe vélhetően az, hogy a szinaptikus résbe bekerülő neurotranszmitterek ne tudjanak diffúzióval szétáramlani az extracelluláris térben, egyfajta fizikai akadályt képeznek. Ezen kívül az asztrociták a PAP nyúlványaikon található glutamát transzporterek segítségével képesek a szinaptikus résből aktívan glutamátot felvenni, csökkentve ezáltal a glutamáterg szinaptikus jelátvitel hatékonyságát.
|
1. ábra: A glutamáterg szinaptkius jelátvitel hatékonyságának csökkentése. |
A PAP-ok gyorsan kialakulnak és gyorsan megszüntethetők, plaszticitásuk befolyásolható az adott szinapszis aktivitásának megváltoztatásával. Feltételezik, hogy a PAP-ok plaszticitása befolyásolhat olyan összetett neurofiziológiai folyamatokat, mint a cirkadián ritmus, a tanulás, a memória, vagy a tudatvesztés alvás vagy anesztézia során. (Zhou és mtsai, 2019)
Memória
Fogalma
Az emlékezés a fejlettebb idegrendszerrel rendelkező állatok azon képessége, amely segítségével fel tudnak dolgozni környezeti ingereket és azokról képesek hosszabb-rövidebb ideig információt tárolni. Ez a képesség nagy mértékben növeli a túlélés esélyeit, mivel hatékonyabb alkalmazkodást tesz lehetővé a környezethez, így evolúciós szempontból előnyös képességnek bizonyult.
A memória kialakulásának alapvetően három fő lépése van az információfeldolgozás szempontjából:
- - kódolás/regisztrálás: az információ feldolgozása - tárolás: a kódolt információ elraktározása a KIR-ben és visszaidézhetővé válik - előhívás: az eltárolt információ valamilyen inger hatására történő előhívása (Baddeley és mtsai, 2010)
Emlékezeti rendszerek
Többféle emlékezeti rendszer létezik. Az egyik közülük a rövidtávú memória (STM= short term memory), amely rövid ideig képes kis mennyiségű információt tárolni. Elsősorban az agykéreg frontális lebenyéhez és az azzal kapcsolatban álló asszociációs kéreghez köthető. A hosszútávú memória (LTM) ezzel szemben az az idegi rendszer, amely hosszútávon képes nagy mennyiségű információt tárolni. Működése az egész asszociációs kéreg együttműködésével valósul meg. A biokémiai változások mellett morfológiai változások is elősegítik a kialakulását (szinaptikus plaszticitás).
Az LTM-nek két típusát különíthetjük el:
- A deklaratív (vagy explicit) emlékezet a tényekre és eseményekre való emlékezés együttes elnevezése, amelynek két alrendszerét különíthetjük el: a szemantikus emlékezet, amely a külvilágról való tudásunkat, ismereteinket tárolja; az epizodikus emlékezet, amely az egyedi események felidézését teszi lehetővé. Az implicit memória az LTM másik típusa, amely az előhívás során nem igényel tudatos erőfeszítést. (Baddeley és mtsai, 2010)
Az LTM és az STM egymással szorosan együttműködik az emlékek kialakításakor és azok előhívásakor egyaránt. Ugyanakkor e két rendszer nagy mértékben különálló, hiszen egyes tanulmányok arra jutottak, hogy STM károsodott agysérült emberekben az LTM nem volt érintett és az is előfordulhat, hogy az LTM károsodik és az STM mégis jól funkciónál. Azonban ma már világos, hogy architektúrálisan nem szétválasztható az STM és LTM, így ma már egy komplexebb modellel jellemezhetjük a memóriát (unitary-store model), ami rövid és hosszútávú emlékek átmeneti aktiválódásából áll nagyon is hasonló agykérgi területeken. (Jonides és mtsai, 2008)
A rövidtávú memória átalakulását hosszútávú memóriává a memória konszolidációjának nevezzük.
Emlékezeti modellek
Több emlékezeti modell létezik napjainkban. A legelfogadottabb a “standard munkamemória-modell”. 1974-ben két tudós, Alan Baddeley és Graham Hitch jegyezte fel. Szerintük a memória rendszernek három eleme van. Egyik része a beszédalapú elemek, míg a másik a térbeli és a vizuális információk megjegyzéséért felelős. A kettő egységet egy “központi végrehajtó” irányítja. A három komponens egymással dolgozik, de nem befolyásolják egymást, ha sérül valamelyik.
Az Atkinson-Shiffrin modell mára már elavultnak számít, ugyanis már kikerültek kutatások, miszerint a rövidtávú és a hosszútávú memória között nincsen akkora kapcsolat. Ezen modell alapja az, hogy a rövidtávú memóriába jutnak a külső érzetek, itt történik az emlékezeti stratégia kiválasztása. A hosszútávú memóriába csak ismétlés útján kerül át innen az emlékezet.
A munkamemória-modellnek van még egyéb alternatívája. Randall Engle szerint a kontrollált figyelem hívja elő és tárolja az információkat. Nelson Cowan, pedig a “beágyazott folyamatok modelljével elveti a munkamemória tényét. James Nairne a hívóinger és a célemlék kapcsolatát helyezi a középpontba. (Shallice és Warrington, 1970)
Memória kialakulása
Strukturális változások az agyban
Az agy egy bonyolult ideghálózat, melyben a neuronok szinapszisai meghatároznak folyamatokat, gondolatokat, tárolnak és emlékeket stb. Memória sok idegsejt kapcsolatán alapul, amikor kell, akkor előjön az emlék. Ezt a szinaptikus plaszticitás teszi lehetővé. Ezek a kötések erősödhetnek és gyengülhetnek, attól függően, hogy mennyire gyakran vannak használva. Ezért tanulunk úgy, hogy ismétlünk, és emiatt felejthetünk el dolgokat, ha nem foglalkozunk a fenntartásával. Tehát egy kötés gyengül, ha a preszinaptikus idegsejt nem képes akciós potenciál kiváltására a posztszinaptikus neuronon. Hosszútávú erősödés vagy gyengülést LTP-nek (long-term potentiation) és LTD-nek (long-term depression) hívjuk. Az agyat ért stimulus hatására az idegsejtek egy specifikus része lesz aktív. Szóval, ha például valaki egy autóra gondol, akkor előjön egy kép. Ez mindenkiben máshogy néz ki. Folyamatosan változik az adott szóra, érzetre kialakult kép, hiszen az idegsejtek új kötéseket hoznak létre attól függően, hogy mit használ a személy gyakrabban az emlékei közel. Jelen esetben gyerekkorban az autó képe másképpen néz ki, mint idősebben elképzelve, a neuronhálózat adaptálódott az évek során.
Long term potentiation és neuronkörök stabilizálódása
Az LTP fontos a neuronhálózat fenntartásában. Ez a hosszú idejű erősítés létrejöhet úgy, hogy több receptor jelenik meg posztszinaptikusan vagy preszinaptikusan több transzmitter szabadul fel. Természetesen LTD esetén ez pont fordítva történik meg. Különböző receptorok vesznek részt a folyamatban: AMPA és NMDA (lehet non NMDA receptor is). Az LTP kialakulásának kettő fázisa van. A korai fázisban glutamát hatására aktiválódik az AMPA receptor, ekkora foszforilálódik és érzékenyebb lesz a transzmitterre. Az NMDA receptor depolarizálódik és a csatornán keresztül a magnézium-blokktól megszabadulva kalcium-ion beáramlás történik a szinaptikus résből. A kalcium-ion-függő kinázok (PKC protein kináz C, Ca-calmodulin) aktíválódnak. Retrográd hírvivők szabadulnak fel (arachidonsav, nitrogén-monoxid) szabadulnak fel, és növelik preszinaptikusan a felszabaduló glutamát mennyiségét.
Az LTP késői fázisában a Ca-calmodulin rendszer az adnilát ciklázt és a cAMP kinázt aktíválja. A cAMP kináz cAMP másodlagos hírvivőn keresztül a nucleusba jutva fehérje termelést vált ki, ami új AMPA receptorok létrejöttét jelenti és az idegsejt új dendrit tüskéket hoz létre, ami újabb szinapszisok létrejöttét segíti elő. Ezzel az erősítéssel az idegsejtek közötti kapcsolatok fokozódnak, könnyebben átmegy az akciós potenciál. Non NMDA receptor nyit posztszinaptikusan, ha egyszeri, kis mértékű stimulus éri a dendritet. Így csak rövid idejű, ritka akciós potenciál jöhet létre. (Baltaci és mtsai, 2019; Thiagarajan és mtsai, 2007)
A hippokampuszban az LTP a CA1 piramissejteket válaszait erősíti. Itt is kinázok (PKC, Fyn kináz, stb.) serkentődnek, amik nitrogén-monoxid termelődést hoznak létre. Először a CA3 piramissejt axonok kollaterálisa (másnéven Schaffer kollaterális) ingerlésekor a CA1 sejteknél az NMDA és az AMPA receptorok aktíválódnak. Ez a már fent leírtak alapján kálcium-ion beáramláshoz vezet, ami aktíválja a kinázokat. E folyamat során létrejövő nitrogén-monoxid retrográd úton eljut a Schaffer kollaterális axonjába, ahol serkenti a neurotranszmitter felszabadulás. Így kialakul egy öngerjesztő folyamat, melynek során egyre több nitrogén-monoxid képződik, ami meg egyre több glutamát felszabadulással jár. Ha a bejövő jel tartósan fennáll a késői LTP lép életbe, és több receptor, illetve dendrit képződik, ezzel tovább megmarad az emlék. (Han ét mtsai, 2012)
Az asztrociták és a memória kialakulása közti összefüggés molekuláris szinten
Régen úgy gondolták, hogy a memória kialakulása kizárólag a neuronok működéséhez kötött folyamat, ma azonban már tudjuk, hogy a különféle gliasejtek, így köztük az asztrogliák is befolyásolni képesek a neuronok közti információátadást, tehát olyan komplex folyamatokat is regulálnak, mint amilyen a memória kialakulása. A szabályozó hatást számos mechanizmuson keresztül kifejthetik és ez a terület még ma is kutatás tárgyát képezi. A következő részben röviden ismertetünk néhány olyan konkrét folyamatot, amelyeken keresztül az asztrociták szerepet játszanak a memória kialakulásában. (Alberini és mtsai, 2018)
Az asztrociták szénhidrátanyagcseréje, a laktát és a memória összefüggése
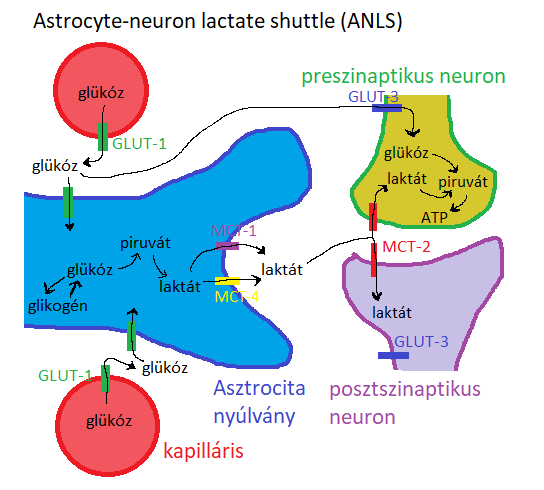
Általánosan elterjedt nézet, hogy stimulált neuronok nagy energiaigényüket a vérből felvett glükóz biológiai oxidációjából fedezik. Azonban Pellerin és Magistretti (1994) kimutatták, hogy az asztrociták aerob glikolízissel laktátot termelnek, amit átadnak a neuronoknak, így azok laktátot tovább bontva energiához jutnak. A jelenség neve ANLS (astrocyte-neuron lactate shuttle). Így a tanulásban is fontos szerephez juthat ez a folyamat, bár erősen vitatott, hogy tényleg így van-e. (Pellerin és Magistretti, 1994)
A tanulmány alapján arra lehet következtetni, hogy a neuronok stimulációja során felszabaduló glutamát egy részét a PAP-okon keresztül felveszik az asztrociták és glutaminná alakítják, ami energiaigényes folyamat. A szükséges energiát a glikogenolízisből nyerik melynek végén a keletkező laktátot átadják a neuronoknak.
|
2. ábra:Asztrocita-neuron-laktát inga. |
Számos tanulmány beszámolt arról, hogy az agy stimulálása fokozza a glikogenolízist, a glükolízist és a glükózfelvételt az asztrocitákban összhangban azzal az elképzeléssel, mi szerint az asztrociták glükóz és glikogén lebontása szükséges az aktivitásfüggő folyamatokhoz, így a tanuláshoz is. (Alberini és mtsai, 2018)
Egy korábbi kísérletben kimutatták, hogy az asztrociták glikogenolízise nélkülözhetetlen a naposcsibék memóriájának kialakulásához. Glikogoén- foszforiláz intracranialis injekciózása dózisfüggő módon meggátolja az asztrociták glikogenolízisét ezáltal gátolva hosszútávú memória kialakulását. (Gibbs és mtsai, 2006)
Adrenoreceptorok és memória
Egy másik kísérletben azt vizsgálták, hogy noradrenalin agonista hatóanyagok miként befolyásolják az asztrociták glükózfelvételét csirkékben. A vizsgálat során használt izoprenalin nevű vegyület ß-adrenorecepetorokra (ß-AR) kifejtett hatása révén az inzulinhoz hasonlóan növelte az asztrociták glükózfelvételét a vérből és ezáltal javította csirkék hosszútávú emlékezőképességét. (Hutchinson és mtsai, 2007)
Piramissejtek ingerlékenysége és vezetési sebessége
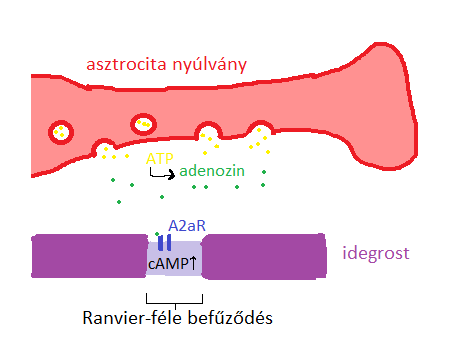
Az asztrogliák képesek az agykéreg piramissejtjeinek befolyásolásával módosítani a memória kialakulását. Az asztrociták a nyúlványaik segítségével megközelítik a mielinizált axonokat és azok Ranvier-féle befűződéseit. Az idegroston végighaladó akciós potenciálsorozat megemeli az asztrocitában az IC kalcium ion koncentrációt, ami ATP- tartalmú vezikulák EC-be történő ürüléséhez vezet. Az EC-ben lévő enzimek a felszabaduló ATP-ből adenozint hoznak létre. A megnövekedett extracelluláris adenozin koncentráció aktiválja a neuron sejtfelszíni G-protein kapcsolt Aˇ2a adenozin receptorokat, aminek hatására megnő a neuronban az IC cAMP szint. Ennek hatására HCN-csatornák nyílnak és az idegsejt depolarizálódik. Ez a mechanizmus megváltoztatja neuron axondombján (AIS= axon initial segment) az ingerlékenységet, tehát befolyásolja az akciós potenciál generálását. Illetve a Ranvier-féle befűződésnél csökkenti az akciós potenciál vezetési sebességét.
|
3. ábra:Akciós potenciál vezetésének csökkentése a Ranvier-féle befűződésnél. |
Az asztrocita tehát képes befolyásolni az AIS-nél az ingerület kialakulását és az idegrostok vezetési sebességének csökkentésével késleltetni tudja az akciós potenciál megérkezését távolabb lévő neuroncsoportokhoz, módosítva ezzel jelek integrációját a postszinaptikus sejtekben és a neuronkörök működését.
Az asztrogliák által fenntartott EC adenozin koncentráció változik alvási és ébrenléti periódus között, így nagy valószínűséggel ebben is szerepet játszanak. (Lezmy és mtsai, 2021)
Rágás és asztrocita szám összefüggése egerekben
Egy másik tanulmányban a rágás megvonásának, a térbeli memória zavarainak és az asztrociták számának összefüggését tárták fel egerekben. A kutatók két csoportot hoztak létre, az egyik csak puha táplálékot kapott (SD: soft diet), a kontrollcsoportot pedig kemény takarmánnyal etették (HD). Három korcsoportban: 3, 6 és 18 hónapos korú egyedekkel végezték a kísérletet. A 3 hónapos csoportban nem volt szignifikáns különbség a HD és az SD csoport között. A 6 hónapos korcsoportnál viszont az SD csoport jelentős térbeli memóriazavart mutatott az elvégzett kísérletekben. A 18 hónapos egereknél mindkét csoportban fennált a térbeli memória sérülése. Az SD egerek hippokampuszát megfigyelve a 6 hónapos korcsoportban jelentős eltérés volt a CA1-es régóban az asztrociták számában és elrendeződésében HD csoporthoz képest. A tanulmány arra enged következtetni, hogy az asztrociták részt vesznek a térbeli memória kialakulásában. (Frota de Almeida és mtsai, 2012)
Egyéb kísérletek
Cannabinoidok (marihuána) hatása az asztrociták CB1R receptorára
Az endocannabinoid rendszernek normális körülmények között a szervezet energia háztartásában, fájdalomérzetében és memóriában is szerepe van. Receptorai a CB1R és a CB2R. A szervezet jelentős részében jelen vannak. Alapvetően a szervezetben képződnek cannabinoidok, amik hatnak ezekre a receptorokra. Marihuána fogyasztása esetén a túlzott cannabinoid (itt THC) bevitele hat a CB1R receptorokra, ezzel sok mellékhatást okozva. Egyik fontos negatív következmény a memória sérülése.
Dr. Marsicano és Dr. Zhang több nemzetközi szakemberrel együtt dolgozva egereken kísérletezett. Elsősorban az érdekelte őket, hogy miért van CB1R receptor az asztroglia sejteken. Azt tapasztalták, hogy azoknál az egereknél, akiknél az asztroglia sejtekről hiányoztak a CB1R receptorok, védve voltak a térbeli munkamemória problémától. Ugyanakkor, amikor a CB1R receptor a neuronokról hiányzott, a THC káros hatása megjelent a munkamemóriájukon. Ezzel igazolták, hogy a cannabinoid mérgezés az asztroglia sejtek CB1R receptorainak aktivációja során jön létre. Illetve ez azt is mutatja, hogy az asztrocitáknak van befolyása, funkciója a munkamemóriára.
Fontos felfedezés, hiszen ezen keresztül már közelebb került a tudomány arra, hogy a marihuána előnyeit kihasználhassa az orvostudomány, a negatív mellékhatások nélkül. Mivel a szerint a különböző sejttípusok más és más CB1R variánsokat expresszálnak, így kiválthatunk hatást cannabinoidokkal az asztroglia sejtek kikerülésével. (Han és mtsai, 2012).
Konklúzió
Az asztrociták az idegrendszer működésében betöltött élettani szerepét csak néhány évtizede kutatják. A fentiekben csak kiemeltünk néhányat a számtalan tanulmányból, ami rávilágít arra, hogy az asztrociták feladata mennyire sokrétű, így az idegrendszer működését alapjaiban befolyásolják. A jövőben is érdemes a működésüket kutatni, mert az idegrendszer komplex működésének minél alaposabb megértésével képesek lehetünk korábban gyógyíthatatlan pszichiátriai kórképek kezelésére. Tehát a memóriazavarral küzdő betegek kezelésének szempontjából is fontos, hogy a jövőben minél több kutatás szóljon az asztrogliák a memória kialakulásában betöltött szerepéről.
Ábrák
1. ábra: Saját, Zhou és mtsai (2019) nyomán
2. ábra: Saját, Alberini és mtsai (2018) nyomán
3. ábra: Saját, Lezmy és mtsai (2021) nyomán
Források
Alberini CM, Cruz E, Descalzi G, Bessières B, Gao V (2018) Astrocyte glycogen and lactate: new insights into learning and memory mechanisms. Glia 66:1244–1262.
Baddeley A, Eysenck MW, & Anderson MC (2010) Emlékezet. Budapest, Magyarország: Akadémiai kiadó
Baltaci SB, Mogulkoc R, Baltaci AK (2019) Molecular Mechanisms of Early and Late LTP. Neurochemical Research 44:281–296.
Frota de Almeida MN, de Siqueira Mendes F de CC, Gurgel Felício AP, Falsoni M, Ferreira de Andrade ML, Bento-Torres J, da Costa Vasconcelos PF, Perry VH, Picanço-Diniz CW, Kronka Sosthenes MC (2012) Spatial memory decline after masticatory deprivation and aging is associated with altered laminar distribution of CA1 astrocytes. BMC Neuroscience 13:23.
Gibbs ME, Anderson DG, Hertz L (2006) Inhibition of glycogenolysis in astrocytes interrupts memory consolidation in young chickens. Glia 54:214–222.
Han J, Kesner P, Metna-Laurent M, Duan T, Xu L, Georges F, Koehl M, Abrous DN, Mendizabal-Zubiaga J, Grandes P, Liu Q, Bai G, Wang W, Xiong L, Ren W, Marsicano G, Zhang X (2012) Acute cannabinoids impair working memory through astroglial CB1 receptor modulation of hippocampal LTD. Cell 148:1039–1050.
Hutchinson DS, Summers RJ, Gibbs ME (2007) β2- and β3-Adrenoceptors activate glucose uptake in chick astrocytes by distinct mechanisms: a mechanism for memory enhancement? Journal of Neurochemistry 103:997–1008.
Jonides J, Lewis RL, Nee DE, Lustig CA, Berman MG, Moore KS (2008) The Mind and Brain of Short-Term Memory. Annual Review of Psychology 59:193–224.
Lezmy J, Arancibia-Cárcamo IL, Quintela-López T, Sherman DL, Brophy PJ, Attwell D (2021) Astrocyte Ca2+-evoked ATP release regulates myelinated axon excitability and conduction speed. Science 374:eabh2858.
Opitz B (2014) Memory function and the hippocampus. Frontiers of Neurolology Neuroscience 34:51–59.
Pellerin L, Magistretti PJ (1994) Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences 91:10625–10629.
Shallice T, Warrington EK (1970) Independent functioning of verbal memory stores: a neuropsychological study. Quarterly Journal of Experimental Psychology 22:261–273.
Thiagarajan TC, Lindskog M, Malgaroli A, Tsien RW (2007) LTP and adaptation to inactivity: overlapping mechanisms and implications for metaplasticity. Neuropharmacology 52:156–175.
Verkhratsky A, Nedergaard M (2018) Physiology of Astroglia. Physiological Reviews 98:239–389.
Zhou B, Zuo Y-X, Jiang R-T (2019) Astrocyte morphology: Diversity, plasticity, and role in neurological diseases. CNS Neuroscience & Therapeutics 25:665–673.