Contents
Bevezetés
A COVID-19 egy elsősorban légúti- és légzőszervi tüneteket okozó megbetegedés, melyet a SARS-CoV-2 vírus okoz, amely 2019-ben jelent meg, Wuhanban. Az Egészségügyi Világszervezet (WHO) 2019, december 31-én jelentette be az első fertőzést. A járvány 2020 március 11-én kitört Kínából, világ járvánnyá nyilvánították (WHO) és május 30-án már 5 899 866 fertőzöttet, valamint 364 891 covid fertőzésben elhunytat regisztráltak. Ekkor a legtöbben az Egyesült Királyságban, majd Brazíliában és Oroszországban betegedtek meg. A terjedés három lehetséges formája levegő útján cseppfertőzéssel, direkt kontaktussal egy fertőzött személlyel, illetve indirekt kontaktussal egy kontaminált tárggyal vagy felülettel.
Vírus tulajdonságai
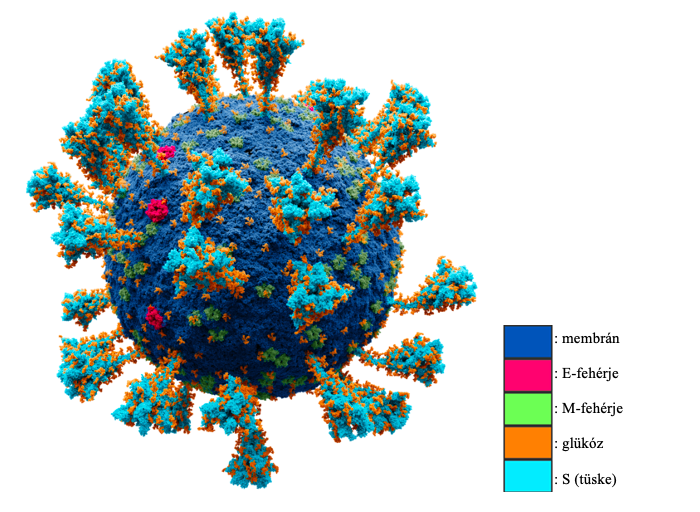
A SARS-CoV-2 a vírusok taxonómiai rendszerében a Coronaviridae családba, azon belül a Betacoronavirinae alcsaládba tartozik. SARSr-CoV (súlyos akut légzőszervi szindrómához kapcsolódó koronavírus) faj egyik törzse, a másik a SARS-CoV-1, amely 2002-2004 között okozott világjárványt. A Baltimore-féle rendszerben a IV. csoportba tartozik, tehát szimplaszálú, pozitív-szenz RNS genommal rendelkezik, ami kb. 30 ezer bázisból épül fel, azonban a klasszikus szaporodási stratégiától eltérő, korai transzkripcióval és korai transzlációval hozza létre saját építő molekuláit. A virion (vírusrészecske) gömb alakú, átmérője 50-200 nanométer közé tehető, lipidburokkal rendelkezik. Akárcsak a többi koronavírust, négy nagyobb egység építi fel: S egység, spike, ezek a vírus tüskéi, melyek a sejtek receptorához képesek kötődni, az E egység, a burok (envelope), rendelkeznek lipidburokba ágyazódó M membránrésszel és N egység, ami a nukleokapszid, az örökítőanyagot tartalmazza. A tüske S proteinekből épül fel, melynek S1 alegysége kötődik a sejtfelszíni receptorokhoz, S2 alegység pedig katalizája a vírus és a sejt membránjainak fúzióját. Az 1. ábra a SARS-CoV-2 vírus pontos modelljét mutatja, ahol minden egyes gömb, egy atomot jelöl. (Wang és munkatársai, 2020)
|
1. ábra: Tudományosan pontos atommodell a SARS-CoV-2 vírus szerkezetéről |
2019 végén jelent meg a SARS-CoV2 (Severe Acute Respiratory Syndrome Coronavirus 2) vírus, és az okozott betegsége a COVID-19. Azóta a COVID örökítő anyaga mutálódott, így új variációk jöttek létre. Ezek közül a legjelentősebbeket a WHO a görög ábécé betűivel jelölte meg (alfa, béta, gamma, delta és omikron). Ezen kívül jegyeztek még fel kevésbé fontos variánsokat is. Az egyes ilyen mutációk különböznek fertőzőképességükben és virulenciájukban. Jelenleg a leggyorsabban terjedő változatnak az omikront tartják, míg a legsúlyosabb tüneteket a delta variáns okozza. Az egyes mutációk befolyásolhatják a koronavírus ellen kialakított immunológiai védettségünket.
Koronavírus alfa variáns: Ez a változat 2020 végén jelent meg az Egyesült Királyságban. Gyorsabb terjedésének köszönhetően hamar domináns lett. Az alfa-változat 23 mutációt tartalmaz az eredeti variánshoz képest, ebből nyolc a vírus tüskefehérjében található. A variáns 50 százalékkal gyorsabban terjed, mint az új típusú koronavírus eredeti változata. Az amerikai járványvédelmi központ szerint pedig a tünetek is súlyosabbak az alfa esetében. Egy friss jelentés szerint a törzs genomiális elemzése új, mutációk okozta szekvencia-variációt talált. Kimutatták, hogy az új változatok jobb kölcsönhatást mutatnak a gazdasejt-receptorokkal, például az ACE2-vel a hámsejteken. Ez lehetővé teszi a vírus számára a jobb fertőzőképességet, ami magasabb vírusszintet okoz és megnövekedett átviteli sebességet.
Koronavírus béta variáns: Szintén 2020 végén jelent meg a COVID-19 béta variánsa, amit Dél-Afrikában azonosítottak először. A béta variáns 50 százalékkal gyorsabban terjed, mint a koronavírus eredeti, Wuhanban felfedezett változata. Ezen kívül a béta súlyosabb megbetegedést és magasabb halálozási kockázatot jelenthet, mint az eredeti koronavírus.
Koronavírus gamma variáns: Ez a variáns feltehetőleg Brazíliában jött létre, 2020 decemberében írták le először. Megjelent más országokban is de mai napra visszaesett a jelenléte. Ez a variáns, fokozott átvihetőséget mutat és 16 mutációkat halmozott fel.
Koronavírus delta variáns: A COVID delta variánsát 2020 decemberében írták le először Indiában. Gyorsan terjed, magas a fertőzőképessége és nagyobb eséllyel okoz súlyos tüneteket. Kétszer olyan fertőzőképes, mint a Wuhanban megjelent eredeti koronavírus.
Koronavírus omikron variáns: 2021 novemberében kezdték feljegyezni a megjelenését. Hamarosan számos más országban is fellelhető volt a COVID új változata és jelenleg a legtöbb megbetegedést okozza. Az omikron az eddig ismert leggyorsabban terjedő variáns. Kimutatták (Yusha és mtsai, 2022), hogy az új variáns tüskefehérjére több mint 30 mutációt tartalmaz, amelyek többnyire az Omicron variáns tüskeproteinjének receptor-kötő doménjében helyezkednek el. Ezenkívül három másik deléció és egy inszerciós mutáció van jelen a tüskefehérjén kívül. Az eddigi változatokkal ellentétben az omikron változat tüskefehérjében sokkal több mutáció található, emiatt gyorsabban terjed és a vakcinák kevésbé hatékonyak ellene. Az új Omicron variáns hamis negatív eredményt adhat a polimeráz láncreakciós tesztekben ami további fertőződéseket von maga után, hisz senki nincs tudatában a betegségének, így a fertőződött emberek karantén hiányában, továbbadják a vírust. Ezeken kívül feljegyeztek még kevésbé fontos variánsokat is mint például: Éta, Ióta, Kappa, Lambda és Mű. Ezeket a WHO mind figyelemmel követendő variánsnak nyilvánította.
Éta variáns: Az éta variáns az Egyesült Királyságban és Nigériában lett azonosítva először 2020 decemberében.
Ióta variáns: Az ióta variánst novemberében azonosították először New York-ban. Az ióta variánst 43 országban jelent meg eddig.
Kappa variáns: A kappa variánst 2020 októberében azonosították először Indiában. A kappa változatot 52 országban azonosították eddig.
Lambda variáns: A lambda variáns jelenlétét Peruban igazolták először 2020 augusztusában, és 29 országban azonosították eddig. Leginkább a Dél-Afrikai országokban terjedt el
Mű variáns: A mű variánst, januárjában írták le, Kolumbiában. A mű-változatot 39 országban mutatták ki eddig, és nagyobb járványgócok kialakulását okozta Dél-Amerikában és Európában is. (Kovácsfi, 2021)
Központi idegrendszer alapvető működése és az azt befolyásoló covid hatásmechanizmusa
Központi idegrendszer alapvető működése:
Az idegrendszer két részre osztható: központi és környéki idegrendszerre. A központi idegrendszerhez tartozik (CNS) az agy és a gerincvelő. A környéki idegrendszer (PNS) főleg idegekből áll, amelyek a központot kötik össze a szervezettel. A gerincvelő a csontos gerinccsatornában halad, idegsejtek (szürkeállományban) és idegrostok (fehérállományban) együttese alkotja. A gerincvelőt feloszthatjuk cervicalis, thoracalis, lumbalis és sacralis szakaszokra. A rostok a gerincvelőt a dorsális és ventrális gyökéren hagyják el, melyek aztán egyesülnek és páros gerincvelői idegeket alkotnak. A dorsális gyökéren az afferens, spinális érző ganglion, a ventrális gyökéren effektor, mozgató rostok találhatók. Neuronok nagyrésze a központi idegrendszerben helyezkedik el, de a perifériás ganglionokban, és bizonyos szervek neuronjaiként a Perifériás idegrendszerben is megtalálhatóak. Ez a bonyolult kapcsolat teszi lehetővé az inger áramlását, mely aztán válaszadást vált ki és így létrejön a szervezet egészséges működése. A COVID ezeket a neurológiai működéseket teszi tönkre, több ponton károsítva azt. A neurodegeneratív betegség jelentése egy olyan állapotot foglal magába, amelyek elsősorban az emberi agy neuronjait érintik, és ezáltal az életminőség romlásához vezethet. (Andalib és mtsai, 2021)
|
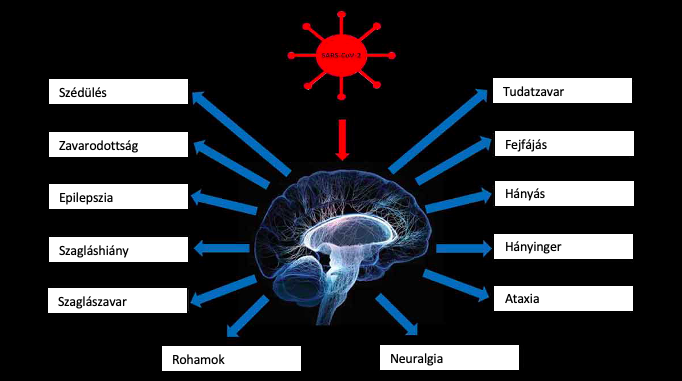
2. ábra: COVID-19 fertőzést okozta leggyakoribb idegrendszeri tünetek |
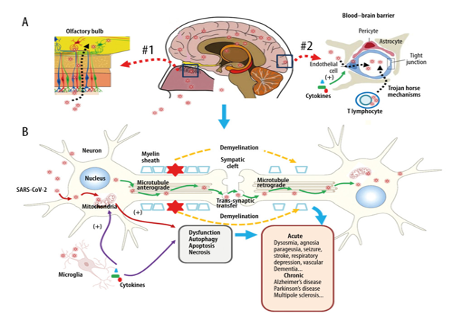
A vírus idegrendszerben való jelenlétének bizonyítására több kísérletet végeztek, melyek pozitív eredményt adtak. Elhalálozott betegek boncolása kimutatta, hogy a vírus RNS jelen van a központi idegrendszerben. Bár a neurológiai megnyilvánulások többnyire a COVID-19 súlyos eseteiben jelentkeznek, mégis a fertőzés nem súlyos eseteinél is megfigyelhetők. . Calina és mtsai (2020) kimutatták, hogy a szív- és érrendszeri betegségekben szenvedő betegeknél fokozott a neurológiai tünetek kockázata. Azonban a SARS-CoV-2 látens lehet a központi idegrendszerben, így fennáll az a lehetőség, hogy a „gyógyult” betegek egy későbbi időpontban neurológiai tüneteket mutassanak. Desforges és mtsai (2020) kimutatták, hogy a COVID központi idegrendszerbe való bejutásának két fő módja van (hematogén és perifériás idegi útvonal), amely aztán fertőzéshez vezet. A vírus ezt követően számos mechanizmuson keresztül hat az idegrendszerre, például a renin angiotenzin rendszer (RAS) zavarán át. Hematogén úton a légutat megfertőző vírus a véráramon keresztül eljuthat a központi idegrendszerbe a vér-agy gát néven ismert szigorú akadály leküzdésével. A vér agy gát [blood–brain barrier (BBB)] egy igen kis áteresztőképességgel rendelkező határfelület, amely elválasztja az erekben keringő vért az agyfolyadéktól. A BBB miatt az idegszövet nemcsak a fertőző ágensek számára nehezen átjárható, hanem az immunsejtek átjutását is megnehezíti. Emiatt a microglia sejtek az egészséges agyban és gerincvelőben inaktívak, a CNS gyulladásos megbetegedéseiben azonban immunológiai szempontból aktívvá válnak. A citokinek azok a molekulák a szervezetben, melyek jeleznek az immunsejteknek, hogy kórokozó van a szervezetben, amit el kell pusztítani. Kismennyiségű jelenlétük természetesen szükséges a normális immunreakciók kiváltásához, nagy mennyiségű megjelenésük a szervezetben azonban erőteljes immunválaszt produkál, és ilyenkor az immunsejtek saját szervezetünk sejtjeit is károsíthatják, így ez a tünetek további súlyosbodását okozza. Fuzhou és mtsai (2020) kimutatták, hogy a gyulladásos mediátorok számának növekedése, amelyet „citokinviharnak” neveznek, magyarázatot adhat arra, hogy egyes COVID-19-es betegeknél a vírus miért károsít több szervet is, és bizonyítja a központi idegrendszerre gyakorolt hatásait. Nagyszámú gyulladást elősegítő citokin felszabadulás növeli a vaszkuláris permeabilitást, a kóros véralvadást és a többszörös szervi elégtelenséget. Ezek a citokinek, elősegítik a COVID bejutását a BBB-n keresztül az agyba. A citokinvihar, mint immunrendszer válasza a COVID fertőzés során, a vér-agy gát lebomlásával járhat. A légúti szövetek COVID-19 általi fertőzése károsodott gázcseréhez vezet, ami központi idegrendszeri hipoxiához, ezáltal idegi működési zavarokhoz vezet. Mind a citokinvihar, mind a hipoxia, amelyek gyakran jelen vannak a fertőzés súlyos állapotában, hozzájárulhatnak ahhoz, hogy a BBB jobban átjárható legyen a vírus számára. Ezek az eredmények alátámasztják, hogy a vírus megváltoztathatja a BBB-t és behatolhat az agyba, ott neurológiai tünetek megjelenését okozza, végzetes mikrotrombusok kialakulását fokozza, sőt agyvelőgyulladás előfordulását is növeli. A második útvonal, a perifériás ideg, utat biztosíthat a vírus számára, hogy egy axonális transzporton keresztül bejuthasson a központi idegrendszerbe. Az angiotenzin-konvertáló enzim II (ACE2) jelenléte, egy receptor, amely elengedhetetlen a COVID sejtbejutásához. A vírus bejuthat a szaglóidegekbe az ACE2-n keresztül. Az elektronmikroszkópos felvételek kimutatták, hogy a vírus kötődik az ACE2 receptorhoz, és endocitózissal és exocitózissal bejut az érrendszeri endotélsejtekbe, ezáltal eléri a vírus sejt-sejt átvitelét így a könnyen bejuthat a makrofágok citoplazmájába is azáltal, hogy a felszínen ACE2-hez kötődik. A vírust tartalmazó makrofágok „trójai faló” mechanizmussal működnek, hogy például a központi idegrendszerbe vándorolhassanak.
|
3. ábra: A vírus bejutása a szervezetbe |
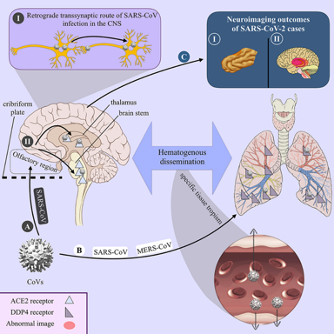
A COVID két fő úton jut be a központi idegrendszerbe (3. ábra). A szaglási útvonalon (1. az A-ban) és a vér-agy gáton. (2. az A-ban.) A vírus endocitózissal közvetlenül vándorolhat be a központi idegrendszerbe, a gyulladásos citokinek által kiváltott megnövekedett áteresztőképesség és a “trójai faló” mechanizmuson keresztül. (B) A membrán receptorhoz, az ACE2-höz való kötődés után a vírus RNS-ei bejutnak és további károsodásokat okoznak.
Covid okozta megbetegedések
A legtöbb covid fertőzött enyhe légzőszervi megbetegedésekről, valamint lázról számol be, azonban idővel világossá vált, hogy a betegség több szervet és szervrendszert is érint. Vizsgált páciensek 90 %-nál jelentkezett legalább 1 idegrendszeri tünet. Ezek közül a leggyakoribb nem specifikus tünetek általában fejfájás, zavartság és szédülés, ritkábban ataxia és epilepsziás roham. Felmérések alapján minél súlyosabb a fertőzés (egyszeri patogénmennyiség, víruskitettség időtartama), annál több idegrendszeri rendellenességet tapasztal a páciens. 2020 februárjában Moriguchi és társai elsőként mutatták ki a SARS-CoV-2 RNS-ét egy 24 éves férfi agy-gerincvelői folyadékjából vett mintában. Ezentúl akut súlyos légzészavar (ARDS) miatt. Franciaországban Helms és munkatársai (2020) kórházba kerülő covid fertőzött betegek kétharmadánál találtak a piramispálya károsodására utaló jeleket. A tünetek, melyek a fertőzés korai fázisában kórjelző értékűek, az ízlelés és szaglás részleges vagy teljes hiánya. Jelen tudományos állás szerint a szaglás kiesése nem kizárólag idegrendszeri tünet. Kutatások eredményei alapján a vírus a bulbus olfactorius (szaglóhagyma) körül található őssejtek és támasztósejtek ACE2 receptorához kötődik, és így károsítja a szaglószervet. A bulbus olfactorius idegsejtjei ugyanis nem tartalmaznak sejtfelszíni ACE-2 receptorokat, így jelen állás szerint ezekhez nem tud közvetlenül kötődni a vírus (Harapan és mtsai 2021). Klopfenstein és mtsai (2020) kutatásában (2020) az anosmia, azaz a szagérzékelés teljeskörű kiesése átlagosan 9 napig tartott, a betegek 20%-ában 14 napnál tovább. A fertőzés kezdeti szakaszában a vírus magas koncentrációban van jelen a nyálban, az ACE2 receptorok a szájüreg nyálkahártyáján is megtalálhatók. Ezáltal az itt található sejtek működése módosul, következmény lehet fekélyes ínygyulladás is, valamint replikálódhat a foggyökérhártyán és annak kapillárishálózatának segítségével a vérkeringés útján más szervekhez is eljuthat. Az ízlelőbimbók az orrnyálkahártyában lévő őssejt populációból regenerálódnak, ám ez a folyamat a vírus által serkentett citokinek jelenlétével megállítható, mely nagyban hozzájárul az ízérzés kieséséhez. A szükséges receptorok az eddig említetteken kívül megtalálhatók még a vékonybél enterocytáin, az érhálózat epithel sejtjein, a vesében és az agyban. Utóbbit tekintve a legjelentősebb területek az agytörzs, a nucleus paraventricularis, a nucleus tractus solitarius és a rostrális ventrolaterális medulla. A központi idegrendszerre gyakorolt hatása azonban nem csak a receptoroknak köszönhető; a bejutott vírus megindítja a cytokinek felszabadulását, amely szisztémás gyulladásos válasz-reakcióhoz vezet (SIRS). A gyulladást monocyták és macrophágok által termelt interleukinek okozzák, melyek szabályozzák az immunválaszt, ezáltal stimulálják a többi monocytát, valamint B- és T-limfocytákat és a monocyta kemotaktikus fehérje felszabadulását. Ez az anyag felelős a monocyták átjutásáért a vér-agy gáton, mely annak gyulladását és permeabilitásának növekedését okozhatja, majd még több gyulladásos citokin kerül az agyba. Végül neuroinflammáció és neurológiai tünetek jelentkeznek (Divani és mtsai, 2020)
|
4. ábra: A másik lehetséges út az agyba a rostacsont lyuggatott lemezén át vezet, a szaglóhagyma közelében. |
A vírus azonban nem csak közvetlenül, az idegrendszerbe bejutva tudja befolyásolni azt. Ha eléri a tüdőt, ott gyulladást, valamint ödémát okoz. Ez gátolja az alveolárisok kapillárisaiban zajló gázcserét, hypoxemiát (alacsony véroxigénszint), később az agyban is hypoxiát eredményez értágulat, hyperemia és agyödéma kíséretében (4.ábra). Emiatt alakul ki fejfájás, szédülés, súlyosabb esetben módosult tudatállapot, kóma. Szintén ide sorolható a stroke. A fokozott thrombus képzés a hypoxiás állapot velejárója, az ekkor jelentkező véralvadási zavarok vezethetnek trombózishoz. (Alomari és mtsai, 2020)
Tünetek gyerekeknél
A tapasztalat azt mutatja, hogy a gyerekek ritkábban szenvednek covid okozta tünetekben. Ennek magyarázata, hogy az ő sejtjeiken kevesebb ACE2 receptor expresszálódik, így a betegséget is kisebb eséllyel kapják el. Az enkefalopátia azonban jellemző velejárója a fertőzötteknél. A gyerekek tartós lázzal küzdenek, az immunrendszer hirtelen túlműködése miatt gyulladás alakul ki a szívben, a tüdőben, a vesékben, az agyban és a gyomor-bélrendszeri szervekben. A többszervi gyulladásos betegség (MIS-C), mint covid okozta szövődmény tünetei egybeesnek a Kawasaki-betegséggel. Egyik különbség, hogy míg a Kawasaki-betegség az élet első 5 évében van túlsúlyban, addig a MIS-C inkább az iskolás gyermekeket érinti. Emellett a MIS-C-re jellemző a szívizom működési zavara, emiatt abban megnő a B-típusú natriuretikus peptid (BNP) és az N-terminális pro B-típusú natriuretikus peptid (NT-proBNP) termelődése. A Kawasaki-betegeknél ezzel szemben a koszorúerek érintettsége dominál és a BNP, valamint NT-proBNP szint kevésbé emelkedik meg. (Ciftdogan és mtsai, 2022)
Poszt-covid tünetek, azok időbeli fennmaradása
A covid mindemellett azonban a páciensek jelentős részében a fertőzésből való gyógyulás után is jelentős egészségügyi problémákat okoz, amelyek akár hónapokig eltartó úgynevezett post-covid tünetekként jelentkeznek. Időtartamát tekintve beszélhetünk rövid-távú (short-term), illetve hosszú távú (long-term) covid tünetekről. Ezek időbeli fennmaradása eltérő, a rövid távú tünetek általában pár hét alatt megszűnnek, a hosszabb távúak azonban hónapokig fennmaradhatnak. Ahogy az Augustin és munkatársai (2021) kutatása alapján is látszik, a COVID19 okozta megbetegedést, a legkülönbözőbb fennmaradó tünetek követhetik, akár olyan betegek esetén is, akik nem szorultak a fertőzés aktív folyamata alatt kórházi kezelésre. A leggyakoribb panaszokat három nagyobb kategóriába lehet sorolni: kardiológiai, pulmonológiai, illetve neurológiai tünetek.
Leggyakrabban a tüdőt, illetve légzőszervet érintő tünetek jelentkeznek egyaránt a betegség lefolyása alatt és után még akár hónapokkal is. Mivel a SARS-CoV-2 az ACE2 receptorokhoz tud kötődni, képes a tüdő alveolus sejtjeit károsítani, ezáltal a surfactant termelése csökken, mely csökkentené a felületi feszültséget, és növelné a tágulékonyságot a tüdőben. Ebből egyértelműen következik, hogy a légzésfunkciók romlanak, a légvétel egyre nehezebb lesz. Súlyos akut esetben ezért szorulnak a betegek mesterséges lélegeztetésre. Amennyiben ezt az állapotot túlélik, jelentős tüdőkárosodás maradhat fenn, melynek regenerációja akár hosszú hónapokig eltarthat. Vannak azonban olyan esetek is, ahol kórházi kezelésre nem szoruló betegek is átmeneti nehézlégzésről és fáradékonyságról számolnak be. Ennek oka részben szintén a tüdő alveolussejtjeinek károsodása, viszont hozzájárul a már korábban említett, covid okozta citokinvihar is. Egyes esetekben az ACE-2 receptorok hiánya miatt felhalmozódik az angiotensin II a szervezetben, mivel az nem tud átalakulni, ez pedig hozzájárul egy ún. akut légzési distressz szindróma (ARDS) kialakulásához. Ezek a kóros folyamatok mind hosszútávú tüneteket produkálhatnak, illetve a gyógyulás utáni időszakaszban immunszupresszív (immunrendszeri gyengeség) állapotot okozhatnak, amely hajlamosít egyéb légzőszervi megbetegedésekre is. A köhögés hosszútávú fennmaradásához a köhögési reflexet kiváltó idegsejtek károsodása járul hozzá. (Hidvégi, 2022)
Gyakoriak még a neurológiai tünetek, különösen az íz-és szaglásvesztés, mely mind a fertőzés alatt, egyes esetekben pedig mind a gyógyulás után akár hónapokig megmarad. Egyes esetekben, a páciensek a mai napig (akár egy-másfél évvel a fertőzés után) is szaglásvesztésben szenvednek, melynek oka a lokális gyulladás, az érző idegek károsodása és a citokinvihar is szerepet játszhat, de a pontos hatásmechanizmus még nem ismert. Jelenleg szaglásterápiával kezelik ezeket a betegeket, amely az estek többségében hatásosnak bizonyult. A szájüreg nyálkahártyájában és a nyelv hámsejtjeiben magas az ACE-2 receptorok expressziója, így ezekhez képes kötődni a koronavírus és ily módon károsíthatja az ízlelőbimbókat, így ízlészavart okoz. (Mező, 2021)
Szintén jellemző még a kardiovaszkuláris tünetek megjelenése, ugyanis az ACE-2 receptorok szintén nagy mennyiségben találhatók meg az érfalak endothelium sejtjeiben és a kardiomiocitákban. Az endothel sejtek károsodását maga a receptorok hiánya, és az emiatti angiotensin II. magasabb aránya okozza, de hozzájárulnak a citokin faktorok által indukált gyulladásos folyamatok is. Ráadásul betegség miatt kialakuló hypoxia (oxigén hiány) a metabolikus anyagcsere folyamatokat anaerob irányba tereli, ami oxidatív stresszt eredményez a sejtekben, melyre a vörösvérsejtek a legérzékenyebbek. Ezek leggyakrabban szívritmus-zavarokat, palpitációt (erős szívdobogás érzés) és mellkasi fájdalmakat okoznak hosszú távon, súlyosabb esetben myocarditis, pericarditis is előfordulhat. Továbbá az enterocyták (bélhámsejtek) is jelentős mennyiségű ACE-2 receptort tartalmaznak, így ezeket is jelentős mértékben károsíthatja a megbetegedés. Ez hasmenést és egyéb bélrendszeri tüneteket okozhat, amelyek akár még a felgyógyulást követően is megmaradhatnak, amennyiben nagymértékű volt a bélhámsejtek pusztulása, és hosszabb regenerációs idő szükséges. Illetve ez az állapot megkönnyíti az egyéb gyomor- és bélrendszeri fertőzések bejutását a páciens szervezetébe. (Nishiga és Sunder, 2020)
Ezentúl a különböző hosszú távú károsodások egyes betegségekre is hajlamosíthatnak. A leggyakoribb felépülést követő elhalálozási ok a CAC, azaz a Covid-19-asszociált coagulopathia. Kialakulásának oka, a már előbb ismertetett kardiovaszkuláris hatások, illetve, hogy a SARS-CoV-2 vírus közvetlen kölcsönhatásba léphet a trombocitákkal, amik így degranulálódnak. Ez elindítja a véralvadási kaszkád intrinsic és extrinsic útját egyaránt, így gyakorlatilag felesleges vérrögösödési folyamat indul meg a szervezetben. A legfrissebb kutatási eredmények alapján a COVID-19 megbetegedés hajlamosít a bárányhimlő, herpesz vírusos megbetegedésekre, illetve az Alzheimer kórra is, ezek bonyolult mechanizmusa azonban még nem ismert, jelenleg is folyamatosan kutatások tárgyát képezi. Szintén hajlamosít a Guillain-Barre szindróma kialakulására. Ez egy ritka autoimmun betegség, amely a perifériás, elsősorban motoros idegek károsodásával jár, így izomgyengeséget, hangyamászás-érzést és bénulásokat okozhat. (Mehta és munkatársai, 2021)
Példák érdekes egyedi esetekre, összefüggésekre
- A hallásszövődmény a COVID-19 ritka tünete. Egyedül egy thaiföldi esettanulmány mutatott rá egy COVID-19-pozitív idős nőbeteget, akinek szenzorineurális halláskárosodása volt.
- Normál szaturáció: 95% felett. ez az érték, ha 90% alatt van akkor a vérben oxigén parciális nyomása is lecsökken. Ez nehézlégzést produkál. Ezeknél a betegek nem élik meg a nagyfokú oxigén hiányt. Náluk akár 60%-os oxigén ellátottsággal is teljesen normális légzés figyelhető meg. Nem cianotikusak, míg normálisan 90% alatt az egészséges emberek már fulladnak. Ez az oxigén hiányos állapot akár stroke tüneteket is produkálhat.
- 50-es férfi, jó kondícióban, nem dohányzó háziorvos. COVID betegsége után féléve tartó egyik napra eltűnő majd visszatérő szaglás. Ezen felül rossz ízeket érez, nem a megfelelőket.
- Egy 84 éves férfi, akinek a kórelőzményében megfelelően kezelt magas vérnyomás és hypothyreosis szerepelt, 5 napig lázzal, köhögéssel és légszomjjal panaszkodott. A mellkasröntgen kétoldali tüdőgyulladást mutatott ki, és a COVID toroktamponos RTPCR pozitív volt. A beteg hipoxiássá vált, célzott terápiát kapott a COVID-19 miatt magas áramlású orroxigén, lélegeztetési támogatás, intravénás remdesivir, szteroid. A 22. napon a beteg kétoldali alsó végtaggyengeséget mutatott. A következő napon a betegnél mindkét felső végtag gyengesége jelentkezett. A talpak némák voltak, és minden mély ínreflex hiányzott. Az MRI felvételen a gerinc normális volt. A cerebrospinális folyadék vizsgálata albuminocitológiai disszociációt mutatott ki. Az idegvezetési vizsgálatok csökkent vezetési sebességet és elhúzódó disztális látenciát mutattak ki a motoros idegekben mind a felső, mind az alsó végtagokban. Átmeneti thrombocytopenia és leukopenia alakult ki, amelyek spontán javultak. A kezeléssel és az elbocsátással javult, minden támogatás nélkül sétálva ment haza.
Lezárás, konklúzió
Összességében kijelenthetjük, hogy a vírus mutációja és újabb variánsok megjelenése végett más és más tünetek, betegségek, rendellenességek jelentkezhetnek. Tekintve, hogy a covid járvány kialakulása, kitörése és minden egyéb hatása alig több, mint kétéves történelemre tekint vissza, a mai napig rengeteg aktív kutatás részét képezi, sok hatásmechanizmus és összefüggés még nem ismert.
Irodalomjegyzék
Cikkek:
Alomari, S. O., Abou-Mrad, Z., Bydon, A. (2020): COVID-19 and the central nervous system. Clinical neurology and neurosurgery 198: 106116
Andalib, S., Biller, J., Di Napoli, M. (2021): Peripheral Nervous System Manifestations Associated with COVID-19. Current Neurology and Neuroscience Reports 21: 9
Augustin, M., Schommers, P., Stecher, M., Dewald, F., Gieselmann, L., Gruell, H., Horn, C., Vanshylla, K., Di Cristanziano, V., Osebold, L., Roventa, M., Riaz, T., Tschernoster, N., Altmueller, J., Rose, L., Salomon, S., Priesner, V., Luers, J.C., Albus, C., Rosenkranz, S., Gathof, B., Fätkenheuer, G., Hallek, M., Klein, F., Suárez, I., Lehmann, C. (2021): Post-COVID syndrome in non-hospitalised patients with COVID-19: a longitudinal prospective cohort study. The Lancet Regional Health-Europe 6:100122
Desforges, M., Le Coupanec, A., Dubeau, P., Bourgouin, A., Lajoie, L., Dubé, M., & Talbot, P. J. (2019): Human coronaviruses and other respiratory viruses: underestimated opportunistic pathogens of the central nervous system? Viruses 12: (1) 14
Calina, D., Tsatsakis, A., Falzone, L., (2020): SARS-CoV-2 pathophysiology and its clinical implications. Food Chem Toxicol 146: 111769
Chunfu, .Z, Jusa, A., Fariya, A., Yan-dong, T., Rabeya, F., Sorwer, A.P., Golzar, H (2022): Omicron Variant of SARS-CoV-2: genomics, transmissibility, and responses to current COVID-19 vaccines. Wiley Online Library 94: 1825-1832
Divani, A.A., Andalib, S., Biller, J., Di Napoli, M., Moghimi, N., Rubinos, C. A., O’Hana Nobleza, C., Sylaja, P.N., Toledano, M., Lattanzi, S., McCullough, L.D., Cruz-Flores, S., Torbey, M., Azarpazhooh, M.R. (2020): Central nervous system manifestations associated with COVID-19. Current neurology and neuroscience reports 20: (12) 1-20
Fuzhou, W., Richard, K.M., George, B.S (2020): Long-Term Respiratory and Neurological Sequelae of COVID-19. Medical Science Monitor 26: 928996
Harapan, B. N., Yoo, H. J. (2021): Neurological symptoms, manifestations, and complications associated with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease 19 (COVID-19). Journal of neurology, 268: (9) 3059-3071
Helms, J., Kremer, S., Merdji, H., Clere-Jehl, R., Schenck, M., Kummerlen, C., Collage, O., Boulay, C., Fafi-Kremer, A., Ohana, M., Anheim, M., Meziani, F. (2020): Neurologic features in severe SARS-CoV-2 infection. New England Journal of Medicine 382: (23) 2268-2270
Hidvégi, E. (2022): A poszt-COVID-szindróma tüdőgyógyászati vonatkozásai. Háziorvos Továbbképző Szemle 27: (2)
Klopfenstein, T., Kadiane-Oussou, N. J., Toko, L., Royer, P. Y., Lepiller, Q., Gendrin, V., Zayet, S. (2020): Features of anosmia in COVID-19. Medecine et maladies infectieuses 50: (5) 436-439
Kovácsfi R (2021): Minden, amit az eddigi koronavírus variánsokról tudni lehet. Világgazdaság
Mao L, Jin H, Wang M, et al. (2020): Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol 77: (6) 683–690
Mehta, S. K., Sunder, A. (2021): Getting paralysed after COVID: Guillain–Barre syndrome. Journal of Family Medicine and Primary Care 10: (7) 2706
Mező, M. (2021): A poszt COVID-szindróma fül-orr-gégészeti vonatkozásai. Háziorvos Továbbképző Szemle 26: (7)
Moriguchi, T., Harii, N., Goto, J., Harada, D., Sugawara, H., Takamino, J., Ueno, M., Sakata, H., Kondo, K., Myose, N., Nakao, A., Takeda, M., Haro, H., Inoue, O., Suzuki-Inoue, K., Kubokawa, K., Ogihara, S., Sasaki, T., Kinouchi, H., Kojin, H., Ito, M., Onishi, H., Shimizu, T., Sasaki, Y., Enomoto, N., Ishihara, H., Furuya, S., Yamamoto, T., Shimada, S. (2020): A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. International journal of infectious diseases 94: 55-58.
Nishiga, M., Wang, D. W., Han, Y., Lewis, D. B., Wu, J. C. (2020): COVID-19 and cardiovascular disease: from basic mechanisms to clinical perspectives. Nature Reviews Cardiology 17: (9) 543-558.
Wang, M. Y., Zhao, R., Gao, L. J., Gao, X. F., Wang, D. P., Cao, J. M. (2020): SARS-CoV-2: structure, biology, and structure-based therapeutics development. Frontiers in cellular and infection microbiology 724.
Yilmaz Ciftdogan, D., Ekemen Keles, Y., Cetin, B.S. et al. (2022): COVID-19 associated multisystemic inflammatory syndrome in 614 children with and without overlap with Kawasaki disease-Turk MIS-C study group. Eur J Pediatr 181: 2031–2043
Képek:
1. ábra: Alexey Solodovnikov és Valeria Arkhipova munkája alapján (free license) (eredeti kép, 2021 júl. 29.)
2. ábra: Ruqaiyyah Siddiqui, Mohammad Ridwane Mungroo és Naveed Ahmed Khan munkája alapján készült (The various symptoms displayed by patients that are infected with SARS-CoV-2 that can be linked to the CNS)
3. ábra: CC BY-NC-ND: Fuzhou Wang, Richard M. Kream és George B. Stefano munkája (Long-Term Respiratory and Neurogical Sequelae of COVID-19)
4. ábra: CC: Kiarash Saleki, Mohammad Banazadeh, Amene Sakhazadeh és Nima Rezaei munkája (The involvement of the central nervous system in patients with COVID-19)