Különbségek a jelenlegi COVID19 vakcinák működésében élettani szemmel
Bevezetés
Amikor 2019-ben kitört a SARS-CoV-2 vagy, ahogy a köznyelv ismeri a COVID19 vírus által okozott pandémia, több mint 200 különböző típusú vakcina fejlesztése kezdődött meg egyidejűleg. A vakcinázás a vírusellenes védekezés legelterjedtebb és legeredményesebb módja. A legtöbb vakcina a vírus jelenlétét és a vírus általi fertőzést nem akadályozza meg, de véd a klinikai tünetektől és a haláltól. Hátránya azonban, hogy a vakcinázás során a vírust valamilyen formában be kell jutatnunk a szervezetünkbe. Jelenleg hat, a humán medicinában használt különböző vakcina előállítási technológiával készülő vakcina is elérhető. A SARS-CoV-2 elleni vakcinázások révén aktív immunválaszt váltunk ki, melyre az antigén szervezetbe juttatását követően adaptív immunválasz alakul ki. Effektor T és B limfociták az antigénnel reakcióba lépnek, ezt követően T, valamint B memóriasejtek keletkeznek. A vakcinák hatása preventív, a fertőződések vagy a súlyos, klinikai tünetek megjelenésének elkerülését szolgálja. A legtöbb, ma forgalomban lévő SARS-CoV-2 vakcina nem preventív jelleggel hat, hanem a fertőződést követően gátolni tudja a virulens ágens átadását egészséges egyedeknek a populációban. Ezen felül segít elkerülni a középsúlyos, vagy súlyos klinikai tünetek megjelenését. Védettség során elkülönítünk celluláris és humorális védettséget. A celluláris védettség kialakulásakor T, illetve B limfociták memóriasejteket termelnek. Ezen memóriasejtek titere határozza meg legfőképpen a vakcinázás sikerességét. A sikerességet a vakcinázási program is befolyásolja, amely azt jelenti, hogy az első oltás után mennyi idő múlva, és hányszor kell megismételni az oltást. Jelenleg forgalomban lévő vakcinák mindegyikéből szükséges felvenni az ismétlő oltást, kivételt képez ez alól Johnson and Johnson vakcinája. (dr. Marosi András, 2021)
A koronavírusokról általánosan
A Coronaviridae törzsbe tartozó patogénekről elmondható, hogy pozitív szálú RNS genommal rendelkeznek. Zoonotikus, mert állatoknál regisztrálták először és onnan mutálódott emberekre (Sharma és mtsai, 2020). Általában enyhe megfázást, lázat és légzőszervi megbetegedést okoznak (Alturki és mtsai, 2020).
A SARS-CoV-2 ről általánosságban
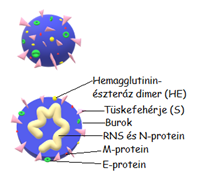
A SARS-CoV-2 a Betacoronavírus nemzetségbe tartozik. A genomikai szekvenálás során fényderült arra, hogy valószínűleg denevérek virulens ágense mutálódott akképpen, hogy embert is patológiás tünetek megjelenése mellett képes fertőzni (Alturki és mtsai, 2020). A vírus 2 nagy méretű N protein nukleokapsziddal rendelkezik, melyen a vírus fertőzőképességét adó S protein tüskefehérjék helyezkednek el. (1. Ábra) A vakcinák előállítása során legtöbbször ezen tüske fehérjéket prezentáljuk antigénként az immunrendszernek (Dong és mtsai, 2020).
|
1. ábra: SARS-CoV-2 szerkezeti felépítése |
SARS-CoV-2 fertőzés és annak tünetei
A SARS-CoV-2 fertőzésének legjellemzőbb módja az aeroszolos fertőzés. Ezen fertőzési út során a vírus az alsó légutakban replikálódik és okoz szöveti gyulladást. Ezen patológiás elváltozások sokféleképpen a manifesztálódhatnak (dr. Marosi András, 2021). A tünetek megjelenése egyedenként eltérő lehet. A tünetek elmaradása nem jelenti azt, hogy az egyed nem hordozó. A tünetek megjelenése az enyhétől, a középsúlyoson át, a halálhoz vezető súlyos szimptómákig terjed. A lappangási idő két naptól egészen két hétig tarthat, fertőzöttönként változó lehet. Ezen időszak alatt a fertőzött személy vírust üríthet, ezáltal fertőzheti a populációt. Gyakori tünetek közé sorolható a láz, a köhögés, a légzési nehézségek és a fáradékonyság. Kevésbé gyakori tünetek az orrfolyás, a felső légúti váladékozás, a fejfájás és a száraz torok. Emellett jelentkezhetnek egyéb szövődmények, mint például több szervi elégtelenség, akut respirációs distressz szindróma, szeptikus sokk, valamint másodlagos bakteriális felülfertőződés. Mindazonáltal előfordulhatnak gastrointestinalis tünetek is, mivel a vírus másodlagos szaporodási helye az emésztőkészülék vékonybél szakaszában van (Alturki és mtsai, 2020).
A SARS-CoV-2 fertőzési útja
A SARS-CoV-2 az S protein segítségével az ACE-2 receptorhoz kapcsolódva fertőzi meg a célsejteket. Az S proteint két alegységre, az S1 és S2-re bonthatjuk. Az S1 és S2 közvetíti a receptorhoz történő csatlakozást és a membránfúziót. Az S1 tartalmazza az RBD-t (receptor binding protein), amely lehetővé teszi az ACE-2 receptorhoz való csatlakozást. Miután az S protein csatlakozott az ACE-2 receptorhoz, konformáció változás történik. A konformáció változás hatására a vírus bejut a gazdasejtbe (Wang és mtsai, 2020).
A forgalomban lévő vakcinák áttekintése
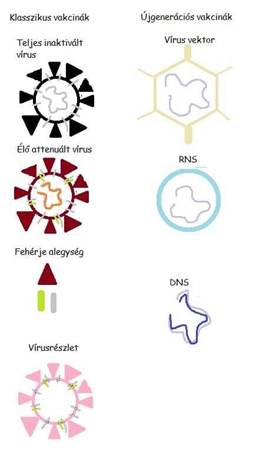
A humán medicinában használt vakcinák között találunk “klasszikus” és újgenerációs módszerrel előállított vakcinákat. A “klasszikus” gyártástechnológia magába foglalja az inaktivált, attenuált, alegység és VLP (virus like particle) vakcinákat. Ezzel szemben az újgenerációs vakcinák közé soroljuk a vírusvektor, az mRNS és a DNS alapú készítményeket. A két típus közötti különbséget a víruspartikulák eltérősége adja. (2. ábra). A kínai fejlesztésű Sinopharm készítmény az inaktivált vakcinák csoportjába sorolható, vektorvakcinák közé soroljuk az angol fejlesztésű AstraZeneca, az orosz Sputnyik-V és az amerikai Johnson and Johnson vakcináját. A legkorszerűbb – mRNS technológiát a Pfizer-BioNTech és a Moderna vakcinája alkalmazza. A vakcinák részletes összehasonlítását az 1. Táblázat tartalmazza (dr. Marosi András, 2021).
|
2. ábra: A klasszikus és újgenerációs vakcinákban alkalmazott víruspartikulák összehasonlítása |
1. Táblázat: Vakcinák általános összehasonlítása dr. Marosi András előadása alapján |
|||
|
Inaktivált vakcina |
Vektorvakcina |
mRNS vakcina |
Bejuttatás módja |
parenterális |
parenterális |
parenterális |
Ismétlések |
szükséges |
nem szükséges |
nem szükséges |
Adjuváns |
szükséges |
nem szükséges |
nem szükséges, de mRNS-t sejtbe juttató anyag kell |
Immunitás |
rövidebb |
erős, de függ a vektorral szembeni immunitástól |
erős |
Sejtes immunválasz |
gyenge vagy nincs |
van |
van |
Képződő ellenanyagok |
IgG |
IgG és IgA |
IgG |
Interferencia |
nincs |
lehetséges |
nincs |
Mellékhatás |
nincs |
nincs |
nincs |
Reverzió |
nincs |
nincs |
nincs |
Kontamináció |
nincs |
lehetséges |
nincs |
Egyéb |
allergia az inaktiváló szerre/szaporító közegre vagy a túl sok antigénre |
vektorral szembeni immunitás gyengítheti a hatást |
PEG allergia előfordulhat |
Inaktivált vírus vakcina
Inaktivált vírus vakcinák közé soroljuk a Sinopharm verocell készítményét. Ezen készítményekben a Sars-CoV-2 elölt, szaporodásra nem képes virionjait találjuk meg. A vírus inaktiválását hagyományosan formaldehiddel végzik (Tregoning és mtsai, 2020). Ezt követően az elölt vírus és az S protein antigének maradnak vissza (dr. Marosi András, 2021). A hagyományos eljáráshoz képest itt formaldehid helyett Béta-propiolakton inaktiváló szert használnak (Tregoning és mtsai, 2020). A végleges produktumhoz szükség van adjuvánsokra. Ezek a kompartmentek segítik elő az immunstimulációt, a robosztus immunválaszt. A gyártási technológia sajátossága, hogy relatív kevés antigént tudunk egyszerre a szervezetbe juttatni, ezért van szükség az immunreakció serkentésére. Adjuvánsok körébe soroljuk az AlOH3 és a szaponint. Ezek segítik az antigén lassabb felszabadulását, a depo hatás elérését. A fent megnevezett sajátosságok azt vonják maguk után következményül, hogy az első vakcina felvételét követően a gyártó által meghatározott időintervallum után a vakcinát ismételni kell. A vakcinázás után az immunrendszer a T-, és B-limfociták segítségével felismeri az S protein antigént, és memóriasejteket termel, melyek segítségével a tényleges fertőzés során majd a szervezet képes lesz neutralizálni a kórokozót. Az immunreakció során IgG ellenanyagok termelődnek. A vakcina beadására kontraindikáció lehet, ha az adott egyed immunrendszere allergiás reakcióval válaszol az inaktiváló szerre, vagy a szaporító közegre. Részben ez az oka annak, hogy ezen vakcina gyártása során formaldehid helyett béta-propiolaktont használnak adjuvánsként (dr. Marosi András, 2021).
Vektorvakcinák
Az újgenerációs technológiával készült vakcinák csoportjába tartozó Johnson and Johnson, Sputnyik-V és AstraZeneca vakcina tartozik ide. A hatásmechanizmus azon alapul, hogy olyan, a célfaj számára nem patogén vírusba génsebészeti úton bejuttatjuk a patogén vírus anitgénjét kódoló genomot (dr. Marosi András, 2021). Ezáltal a bejuttatott vírusvektor felszínén a patogén kórokozó S proteinjei lesznek felfedezhetőek (Tregoning és mtsai, 2020). Az apatogén vírus viszont nem lesz képes hatékonyan replikálódni a vakcinázott egyedben. A jelentkező immunválasz szignifikánsan jobb, mint a korábban említett inaktivált vakcináknál, a magasabb antigénszint miatt. Ennek következtében adjuvánsra és a vakcina ismételt beadására rendszerint nincs szükség. Továbbá veszélyforrást jelent, ha az előállítás során a szaporító közeg kontaminálódik perzisztáló kórokozóval (dr. Marosi András, 2021). Protokol szerint a COVID19 vakcinák esetében a biztonság kedvéért javasolják az ismételt oltakozást az első dózis után. A vektorvakcinák hatékonyságát azonban ronthatja, ha a vektorvírusnak használt virionnal a populáció korábban fertőződött (Dong és mtsai, 2020). Ezt a gyengeséget a Sputnyik-V vakcina két különböző komponensével lehet javítani. Az első és második dózisban eltérő vektorvírust használnak antigén vektorként (Burki, 2020). Ezzel szemben az AstraZeneca a csimpánz adenovírusát használja vektornak (Alturki és mtsai, 2020). A Johnson and Johnson vakcina esetében egy dózissal immunizáljuk a humán oltakozókat, hogy egyed szinten ne alakulhasson ki immunitás a vektorral szemben. A vakcina felvételét követően az immunrendszer sejtes immunválaszt alakít ki, amelynek a nukleokapszid rétegén a patogén antigénjei helyezkednek el (Sadoff és mtsai, 2021). Az immunreakció során a szervezet felismeri a vektor-adenovírus felszínén expresszálódó S proteineket, melyek ellen a T- és B-limfociták memóriasejteket termelnek. Ezáltal a tényleges patogénnel való fertőződés során az immunrendszer felismeri a SARS-CoV-2 burkán elhelyezkedő S proteineket, és IgG és IgA ellenanyagot termel. (dr. Bárány Zoltán, 2020) mRNS vakcinák
mRNS vakcinák
A jelenleg engedélyezett Pfizer-BionTech (BNT162b2) és a Moderna (mRNS-1273) vakcinák tartalmazzák a SARS-CoV-2 tüskefehérjének antigénjét, amelyet egy mRNS kódol (Noor, 2021). Ezen vakcinák előnye, hogy a humán genomba nem épülnek be. Ugyanakkor ezek is kiváltják a B- és T-sejtes immunválaszt (Karpiński és mtsai, 2021). A szervezetbe bejutva, ezután az mRNS-t burkoló lipid nanopartikulák (LNP) révén aktiválódnak az immunsejtek. Ez a bizonyos LNP szolgálja az mRNS védelmét a ribonukleázoktól. Alapvetően az mRNS-1273 vakcina alapját az képezi, hogy egy módosított, tüskefehérjét kódoló messenger RNS révén készteti az immunrendszert a vírus elleni válaszadásra. Az LNP-k különféle védelmet szolgáló anyaggal állnak komplexben, mint polietilén-glikol (PEG), foszfokolin és koleszterin, melyek a biztonságos bejutást segítik. Ezeken felül különböző sókat is találunk a komplexben, mint kálium-klorid, nátrium-klorid, kálium-dihidrogén-foszfát, melyek buffer hatással rendelkeznek. Végül a szacharózt kell megemlíteni, mely a tárolás során fennálló alacsony hőmérséklettől (-70 fok) védi a lipideket, hogy azok ne fagyjanak meg, ne sérüljenek, illetve ne tapadjanak össze a részecskék benne (Noor, 2021). Ezen eljárás során egy olyan DNS fragmentumot használnak templátként, amely kihasználja a genom leolvasási keretét, az úgynevezett „open reading frame-et” (ORF). Ez egy 5’ nem transzlálódó régió (UTR), amely behatárolja az ORF-et. Megemlítendő a 3’ UTR, az a rész, melyen a T7 nevű RNS polimeráz közvetíti a transzlációt a vírusfehérjét kódoló mRNS-szakasz előállításához. Ezt követi a cap-struktúra enzimatikus hozzáadása és az mRNS tisztítása. A sejtbejutás mechanizmusát, lényegében a transzfekciót követő endocitózison keresztül lehet jellemezni. Ekkor az mRNS a gazdaszervezetben lefordítódik, hogy SARS-CoV-2 S fehérjét szintetizáljon, mely felszabadul, és egyben átesik az MHC-I feldolgozáson is, hogy a sejt felületére kerülve prezentálódhasson. Az exogén fehérje endocitózissal ismét a sejtbe jut és létrehozza az MHC-II epitópot (Noor, 2021). Antigén specifikus CD8+ és Th1- típusú CD4+ típusú T sejt által immunválaszt ad a szervezet a vakcinára. Ennek köszönhető a specifikus IgG ellenanyagok termelődése. Az immunizáció végén visszamaradó mRNS a szövetekben és a vérben enzimatikus úton megemésztődik (Polack és mtsai, 2020). Egyik hátránya az mRNS vakcináknak, hogy maternálisan nem adható tovább a védettség, mert az újszülött gastrointestinalis rendszerében a lipid nanopartikulák lebontásra kerülnek. Ennek következtében az újszülött szervezetében nem tud expresszálódni (dr. Marosi András, 2021).
Összegzés
A SARS-CoV-2 gyors terjedése miatt a vakcinák fejlesztésére és engedélyeztetésére jelentősen kevesebb idő állt rendelkezésre, mint egyéb esetben állt volna. Klinikai kísérletek igazolják, hogy a fent megnevezett vakcinák mindegyike képes kialakítani a védettséghez szükséges antitest titert. Mindazonáltal a vakcinák hatékonysága között felfedezhető jelentős eltérés. A vizsgálatok eredményeire támaszkodva kijelenthető, hogy az mRNS technológiával készült vakcinák a leghatékonyabbak. Mind a két adag vakcina felvételét követően 95%-os védelem volt megfigyelhető 16 éves kor feletti páciensek esetében (Noor, 2021). A mellékhatások, és az allergén reakciók ritka megjelenése miatt, jellemzően az idős korosztályt és a krónikus betegséggel rendelkező embereket oltják ezekkel a vakcinákkal. A COVID19 ellen készült vektorvakcinák jellemzően 90% feletti védettséget nyújtanak. Emellett alkalmazásuk nem jár nagyobb kockázattal, mint az mRNS vakcináké. Az inaktivált vakcinák 60% és 90% közötti védettséget adnak, így ez a vakcina csoport a legkevésbé hatékony (Webbeteg, 2021). Számos klinikai kutatás folyik jelenleg is, hogy mi okozza a nagy diverzitást a kialakuló védettség sikerességében.
Irodalomjegyzék
Alturki SO, Alturki SO, Connors J, Cusimano G, Kutzler MA, Izmirly AM, Haddad EK (2020) The 2020 Pandemic: Current SARS-CoV-2 Vaccine Development. Front Immunol 11
Burki TK (2020) The Russian vaccine for COVID-19. Lancet Respir Med 8:e85–e86.
Dong Y, Dai T, Wei Y, Zhang L, Zheng M, Zhou F (2020) A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduct Target Ther 5
Noor R (2021) Developmental Status of the Potential Vaccines for the Mitigation of the COVID-19 Pandemic and a Focus on the Effectiveness of the Pfizer-BioNTech and Moderna mRNA Vaccines. Curr Clin Micro Rpt
Polack FP, Thomas SJ, Gruber WC (2020) Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med
Sadoff J, Gars ML, Schuitemaker H (2021) Interim Results of a Phase 1–2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med
Sharma O, Sultan AA, Ding H, Triggle CR (2020) A Review of the Progress and Challenges of Developing a Vaccine for COVID-19. Front Immunol 11
Tregoning JS, Brown ES, Cheeseman HM, Flight KE, Higham SL, Lemm N ‐M., Pierce BF, Stirling DC, Wang Z, Pollock KM (2020) Vaccines for COVID‐19. Clin Exp Immunol 202:162–192.
Wang M-Y, Zhao R, Gao L-J, Gao X-F, Wang D-P, Cao J-M (2020) SARS-CoV-2: Structure, Biology, and Structure-Based Therapeutics Development. Front Cell Infect Microbiol 10
Egyéb felhasznált irodalom
dr. Bárány Zoltán (Állatorvostudományi Egyetem) immunológia előadásai alapján
dr. Marosi András (Állatorvostudományi Egyetem) általános virológia előadásai alapján
mRNS vakcina – Wikipedia (2021)(https://hu.wikipedia.org/w/index.php?title=MRNS_vakcina&oldid=23715313)
A COVID-19 elleni vakcinák összehasonlítása – Webbeteg (2021) (https://www.webbeteg.hu/cikkek/fertozo_betegseg/26397/covid-19-vedooltas-osszefoglalo?fbclid=IwAR3SVIMgU0jl7tF5rGQudLf-w3BpoiElx0XC6x2lAfYiPusJw55FCtRLyMU)
Ábrajegyzék
1. ábra saját, Nagualdesign alapján
2. ábra saját, Tomasz M. Karpiński és mtsai alapján
1. táblázat saját, dr. Marosi András előadása alapján