A CRISPR rendszer működési elve, és felhasználási lehetőségei
1. Bevezető
1.1 Absztrakt
A Hallgatói Lecke bevezetéseként a CRISPR rendszer kialakításának útjáról, felfedezéséről írunk röviden, majd a külföldi és magyar tudományos cikkek alapján részletezzük a rendszer felépítését, funkcióját. Összegezzük, hogy milyen előnyei illetve hátrányai vannak a rendszernek és végül utána járunk, hol tart napjainkban a kutatás.
1.2 CRISPR rendszer történelmi áttekintése
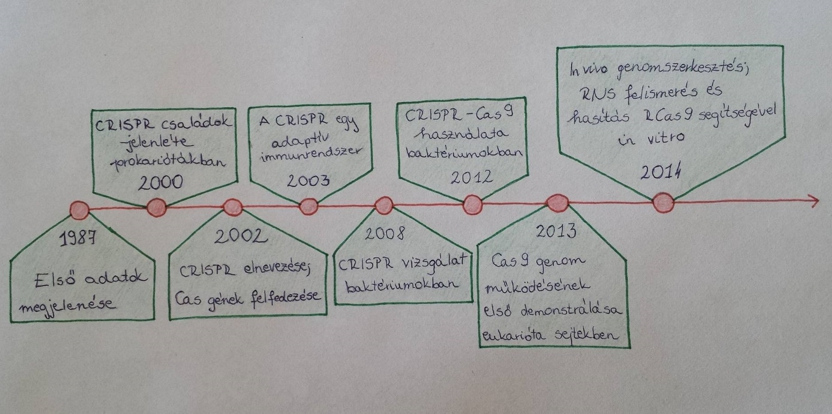
A CRISPR rendszer felfedezése 1987-re tehető, egy baktérium ( Escherichia coli) genomjában azonosította először a japán Yoshizumi Ishino, az Osakai Egyetem tanára. 18 évig tartó kutatás után derült fény a rendszer adaptív immunrendszerrel való kapcsolatára. 1997-ben három kutatócsoport bizonyította, hogy a felfedezett szekvencia sok más baktériumban is megtalálható. A további évek kutatásai megerősítették, hogy a vírus-, vagy fág-DNS töredéke beépül a CRISPR-régióba, amely így biztosítja az esetleges újra kialakuló fertőzésekkel szembeni védelmet. 2008-ra izolálták a CAS-fehérjével alkotott komplexet, melynek feladata a megfelelő RNS molekulák kiválasztása és hasítása, valamint rájöttek, hogy ugyanezt a folyamatot DNS-sel is képes végrehajtani. 2013-ban már emlős sejteken végeztek kísérleteket, 2015-ben jutottak el az emberi embriókkal kapcsolatos kutatóprogramig. A CRISPR rendszer felfedezésének és új funkciói feltalálásának főbb állomásait az 1. ábra foglalja össze.
|
|
|
1. Ábra CRISPR rendszer felfedezésének állomásai (Zhang, 2016) |
||
1.3 A rendszerek csoportosítása
A CRISPR rendszerek a baktériumok genomjaiban találhatók, vírusok és plazmidok elleni védekező mechanizmusok. Az endogén CRISPR lókuszokat 3 csoportba sorolják. Az I-es és III-as típusú rendszer többféle fehérjét igényel működéséhez, a II-es típusú a CAS9 fehérje segítségével keresi meg a DNS-célszekvenciát és hajtja végre a lánc hasítását (Hartenian és Doench, 2015). Ez a legegyszerűbb genomszerkesztési módszer a három csoport közül. A CAS9 egy endonukleáz, amely DNS-t bont, tehát hasítja a sejtbe jutott fertőző ágens DNS-ét, amellyel a sejt már legalább egyszer találkozott (Venetianer, 2016).
2. A CRISPR rendszer mechanizmusa, működése
A CRISPR rendszer, a CAS génekkel együttműködve fontos szerepet kap a baktériumok, ősbaktériumok (archeák) védekezésében az őket megtámadó vírusokkal, plazmidokkal, idegen nukleinsavakkal szemben. Ezen idegen anyagok a baktériumok transzformációját, konjugációját okozhatják, a CRISPR-rendszer azonban hatékonyan képes megelőzni ezeket a káros folyamatokat. Ennek okán az adaptív immunitás kiemelkedő részét képezik (Barrangou és mtsai, 2007). Napjaink kutatásai azt igazolták, miszerint az ősbaktériumok megközelítőleg 84%-ának, és a baktériumok 45%-ának genomjában megtalálható a CRISPR lókusz (Grissa és mtsai, 2007).
2.1 Felépítés
A CRISPR rövid, ismétlődő szekvenciákból áll (23-44 bázispár hosszúságú), melyeket megközelítőleg hasonló méretű helykitöltő szakaszok választanak el egymástól. Ezek a helykitöltő szakaszok egyedülálló szekvenciák, melyek rendszerint fág és plazmid DNS-ből származnak (Brouns és mtsai, 2008). A CRISPR-helykitöltők közelében sok esetben több CAS gén (CRISPR-associatedgene) található, melyek a CRISPR-aktivitáshoz elengedhetetlen fehérjéket kódolják. Ezek a fehérjék nukleáz enzimek, kofaktorként fémionokat tartalmaznak. A kutatások legalább 45 CAS géncsalád létezését igazolták, azonban mindösszesen két gén van, ami megtalálható az összes CRISPR-szekvenciával rendelkező organizmusban: a CAS1 és CAS2 gén. A CAS1 gén az egyes fajokban nagyfokú változatosságot mutat az aminosavszekvenciára vonatkozóan, másodlagos szerkezetben azonban már jóval több hasonlóságot fedezhetünk fel. A CAS2 gén, amely a CAS1-gyel komplexet alkot, a kettős szálú DNS-t és a szimplaszálú RNS-t képes elvágni (Haft és mtsai, 2005).
2.2 Mechanizmus
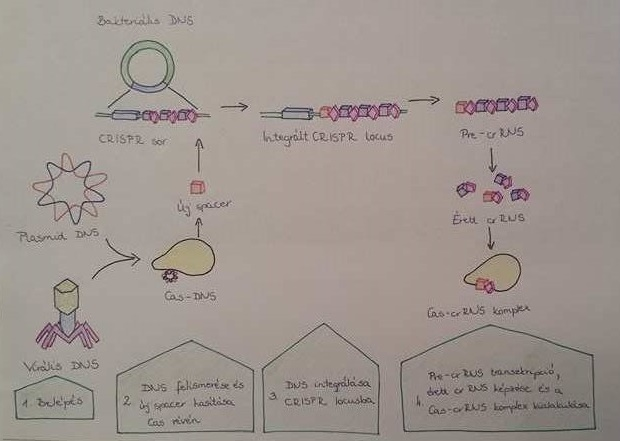
A CRISPR/CAS rendszer szerepe az adaptív immunitásban három lépésben valósul meg: a helykitöltő beillesztése, a felismerő RNS expressziója, majd az idegen nukleinsav lebontása. A rendszer mechanizmusát a 2. és 3. ábra szemlélteti.
A helykitöltő beillesztése
A mechanizmus során a CAS1/CAS2 komplex segítségével megvalósul a vírus DNS egy részének felismerése, majd beépítése a CRISPR-szekvenciák közé. Ezen rövid szakasz nagyjából 3-5 bázispár hosszúságú. Az idegen DNS szakasz beillesztése a CRISPR lókuszba biztosítja az immunitás megszerzését. Egyes fajoknál a DNS-szakasz beillesztése nem a régió elejére, hanem annak valamely más részére történik (Sulfolobussolfataricus).
A felismerő RNS expressziója
A CAS gének (és azok fehérjéinek) expressziója vezet a CRISPR szakasz transzkripciójához, majd ennek eredményeként egy hosszú RNS molekula keletkezik, melyet pre-crRNS-nek hívunk. A CAS enzimek egyéb faktorok segítségével ezután feldarabolják a pre-crRNS-t, melynek eredményeként úgynevezett érett crRNS szakaszok keletkeznek. Ezen crRNS-ek újabb CAS fehérjékkel alkotnak komplexet, majd képessé válnak az idegen nukleinsavak felismerésére.
|
2. Ábra CAS-crRNS komplex képződése (Eun Ji Kim és mtsai, 2017) |
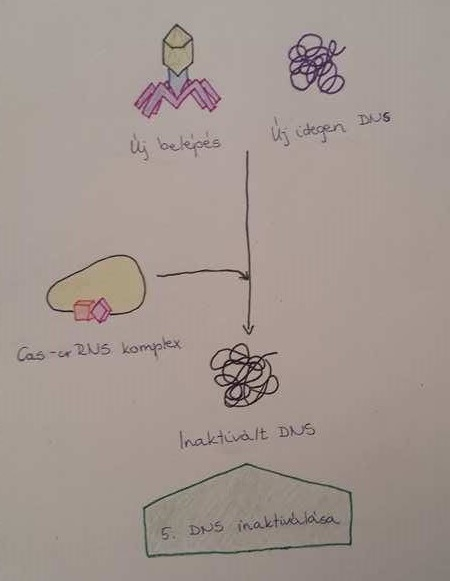
Az idegen nukleinsav lebontása
Az érett crRNS és egyéb CAS fehérjék felismerik az idegen nukleinsavakat, majd elpusztítják őket. Ez a szakasz felfogható úgynevezett immunitási fázisnak is (Makarova és mtsai, 2006).
Az utóbbi két szakasz különbözőféleképpen megy végbe az egyes CRISPR-rendszerekben.
- Az I. típusnál a CAS6e/CAS6f a szimplaszálú RNS és a duplaszárú RNS kapcsolódásánál hasít, azaz felismeri az ismétlődő szakaszok másodlagos, hajtűszerű struktúráját.
- A II. típusnál úgynevezett transzaktivátor RNS van jelen, ahol a CAS9 és az RN-áz hasít, melynek eredményeként duplaszálú RNS jön létre.
- A III. típusnál az ismétlődések nem alkotnak hajtűket; ehelyett a régióról átírt hosszú RNS-t a CAS6 maga köré tekeri és így vágja el közvetlenül az ismétlődés mellett (Grissa és mtsai, 2007).
A vírus DNS felismerésében döntő szerepe van az úgynevezett PAM-nak (protospaceradjacentmotifs), mely azon része a vírus DNS-nek, ahol a vágás történik. A PAM egy rövid, 3-5 bázispárból álló szakasz, amely különbözik az egyes CRISPR változatokban. Az I. és II. típusoknál nagy jelentőségű, azonban a III. típusnál nem (Yosef és mtsai, 2012).
Az új helykitöltő szakaszok beillesztése egy meghatározott úton történik, a CRISPR szakasz úgynevezett vezető szekvenciájához (Pourcel 2005; Tyson és Banfield, 2008). Ez a vezető szekvencia tartalmaz promóter-és rögzítő szakaszokat, továbbá olyan elemeket, melyek fontosak a helykitöltő beépüléséhez. Ahogy egyre több és több helykitöltő épül be (azaz az adott idegen vírus nukleinsava), úgy gyakorlatilag a beépülések sorrendje megadja a vírus által okozott támadások időrendi sorrendjét. Az utód ezeket a sorrendeket örökölni képes (Heidelberg és mtsai, 2009).
|
3. Ábra DNS inaktiválása CAS-crRNS komplex segítségével (Eun Ji Kim és mtsai, 2017) |
3. CRISPR rendszer alkalmazása, előnyei, hátrányai
A CRISPR rendszert számos területén használták és használják ma is. A rendszer felfedezését követően egy francia genetikus, bizonyos Gilles Vergnaud megbízást kapott Szaddam Husszein feltételezett biológiai fegyverei elleni védekezés céljából a hadügyminisztériumtól patogén mikroorganizmusok kutatására. Munkássága során főképp pestist okozó Yersinia pestis törzseit vizsgálta. A Du Pont cég egy dániai élelmiszerbiológiai laboratóriumában pedig azt vizsgálták, hogyan lehetne a joghurt- és sajtkészítéshez használt tejsavbaktériumot (Srteptococcustermophilus) ellenállóvá tenni a fágfertőzéssel szemben. Arra jutottak , hogy ha egy fág DNS-éből egy darabot beépítenek a CRISPR régióba akkor az védelmet nyújt a későbbi fágfertőzéssel szemben (Venetianer, 2016).
3.1 Jelen
Napjainkban a rendszer egyszerű alkalmazása és viszonylagos olcsósága miatt a tudomány számtalan területén alkalmazottá vált. Nagy jelentőségű a növények nemesítésében betöltött szerepe, mely által olyan növények hozhatók létre melyek megfelelő fenotípussal rendelkeznek. Az első kísérleteket rizs,dohány,búza és lúdfű (Arabidopsisthaliana) segítségével végezték, majd később már kukoricán, szóján, paradicsomon, krumplin, dinnyén és számos más növény fajtán is kipróbálták. Az Egyesült Államokban végeztek olyan kísérleteket, melyben a kétspórás csiperke (Agaricusbisporus) genomját próbálták úgy szerkeszteni a CRISPR-CAS9 segítségével, hogy a gomba barnulásért felelős szakaszára hatva meggátolják azt, így az a frissesség látszatát tartja fent hosszabb ideig. A mezőgazdaság területén nagyon fontos a rovar és a gyomirtás, ám ezen organizmusok sajnos nagyon könnyen adaptálódnak a különböző szerekhez, erre is adhat megoldást a CRISPR. A rovarok és gyomok alkalmazkodásért felelős génszakaszainak kivágásával ellenállásuk romlik vagy akár ki is eshet a különböző vegyszerekkel szemben ezzel olcsóbbá és könnyebbé téve a növénytermesztést. A rovarokban történő ilyesfajta alkalmazás számtalan betegség terjedését meggátolhatja és így járványoknak gátat szabva milliók életét mentheti meg. A rovarok közül a maláriát terjesztő szúnyogokat kezelték elsőként eredményesen. A szúnyogok genomjából kivágták a malária hordozásáért felelős részt, így gátolva a betegség terjedését (Hieu X. Cao és mtsai, 2016). A növény és állatvilágban történő alkalmazása mellett nagyon fontos szerepet kap a humán kutatásokban is. A rákkutatásban is alkalmazzák, a daganatos sejteket célozzák meg vele (Yi L és Le J, 2016). A CRISPR rendszer több öröklődő betegség kialakulásának megakadályozásában is az emberiség segítségére lehet, illetve az Alzheimer-kór és a Parkinson-kór kezelésében is útmutatóul szolgálhat. Jelentős eredményeket értek el a Duchenne féle izomdystorphiával(DMD) kapcsolatban is, mely betegség örökletes és az izomsejtek fokozatos pusztulásával jár mindaddig, míg az izom teljesen el nem sorvad, és helyét át nem veszi zsírszövet és kötőszövet, s válik a beteg önmaga ellátására képtelenné. Ezen betegség kialakulásáért felelős DNS szakasz kivágásával a keletkezett DNS a normális izomműködést megközelítő eredményeket produkál, legalábbis jobbakat mint kezeletlen esetben (Tabebordbar M és mtsai, 2016). Ezen sok előny mellett nem szabad megfeledkeznünk a CRISPR-CAS9 hátrányairól sem. A CRISPR-CAS9 fehérje egy PAM régióhoz kötődik, ezt ismeri fel. Ezen PAM régió nagyon gyakran fordul elő a DNS-ben ebből adódóan sajnos még nem lehet tökéletes pontossággal meghatározni azt, hogy a CRISPR hol fejti ki hatását, s ebből adódóan ha csak kis számban is fordul elő, de figyelembe kell venni az esetlegesen előforduló nem kívánt mutációkat. Ezen véletlen mutációk kisebb jelentőséggel bírnak, ha növényekkel vagy állatokkal kapcsolatos kísérletekről beszélünk, ám a humán sejtekkel, embriókkal való kísérletek során a minimális kockázat is megengedhetetlen (Venetianer, 2016). S ezzel eljutottunk a CRISPR rendszer etikai kérdéseinek vizsgálatához mely, mint minden embriókkal vagy humán sejtekkel, azok genomjának kutatásával, szerkesztésével foglalkozó kísérlet, tanulmány esetén igencsak megosztja az emberiséget.
3.2 Jövő
A jövőben a CRISPR rendszer számtalan további területen hozhat forradalmi változásokat. Esetlegesen a bioüzemanyag termelésben, vagy a növények jobb nitrogén hasznosításában, betegségek megelőzésében, gyógyszerek fejlesztésében. De vannak olyanok is, akik kihalt fajok újraélesztésében gondolkodnak a rendszer segítségével (Hieu X. Cao és mtsai, 2016).
4. Irodalomjegyzék
1. Barrangou R.; Fremaux C.; Deveau H.; Richards M.; Boyaval P.; Moineau S.; Romero DA.; Horvath P. (2007): CRISPR provides acquired resistance against viruses in prokaryotes. Science 315: (5819) 1709–12
2. Brouns SJ.; Jore MM.; Lundgren M.; Westra ER.; Slijkhuis RJ.; Snijders Ap.; Dickman MJ.; Makarova KS.; Koonin EV.; van der Oost J. (2008): Small CRISPR RNAs guide antiviral defense in prokaryotes. Science 321: (5891) 960–4
3. Eun Ji Kim.; Ki Ho Kang.; Ji Hyeon Ju. (2017): CRISPR-CAS9: a promising tool for gene editing on induced pluripotent stem cells. The Korean Journal of Internal Medicine 32: (1) 42-61
4. Grissa I.; Vergnaud G.; Pourcel C. (2007): CRISPRFinder: a web tool to identify clustered regularly interspaced short palindromic repeats. Nucleic Acids Research 35: W52–7
5. Haft DH.; Selengut J.; Mongodin EF.; Nelson KE. (2005): A guild of 45 CRISPR-associated (CAS) protein families and multiple CRISPR/CAS subtypes exist in prokaryotic genomes. PLoS Computational Biology 1: (6) e60
6. Hartenian E.; Doench JG. (2015): Genetic screens and functional genomics using CRISPR/CAS9 technology. The FEBS Journal 282: (8) 1383-93
7. Heidelberg JF.; Nelson WC.; Schoenfeld T.; Bhaya D. (2009): Germ warfare in a microbial mat community: CRISPRs provide insights into the co-evolution of host and viral genomes. PLoS ONE 4: (1) e4169
8. Hieu X. Cao; Wenqin Wang; Hien T. T. Le; Giang T. H. Vu (2016): The Power of CRISPR-Cas9-Induced Genome Editing to Speed Up Plant Breeding. International Journal of Genomics 2016: 5078796
9. Makarova KS.; Grishin NV.; Shabalina SA.; Wolf YI.; Koonin EV. (2006): A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biology Direct 16: (1) 7
10. Pourcel C.; Salvignol G.; Vergnaud G. (2005): CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA, and provide additional tools for evolutionary studies. Microbiology 151: (Pt 3) 653–63
11. Tabebordbar M.; Zhu K.; Cheng JK.; Chew WL.; Widrick JJ.; Yan WX.; Maesner C.; Wu EY.; Xiao R.; Ran FA.; Cong L.; Zhang F.; Vandenberghe LH.; Church GM.; Wagers AJ. (2016): In vivo gene editing is dystrophic. Science 351: (6271) 407-11
12. Tyson GW.; Banfield JF. (2008): Rapidly evolving CRISPRs implicated in acquired resistance of microorganisms to viruses. Environmental Microbiology 10: (1) 200–7
13. Venetianer P. (2016): A 21. század tipikus tudós hőse: Feng Zhang. Magyar Tudomány 177: (5) 602-607
14. Yi L.; Le J. (2016): CRISPR Cas-9 therapeutics is cancer: promising strategies and present challenges. Biochimica et Biophysica Acta 1866: (2) 197-207
15. Yosef I.; Goren MG.; Qimron U. (2012): Proteins and DNA elements essential for the CRISPR adaptation process in Escherichia coli. Nucleic Acids Research 40: (12) 5569–76
16. Zhang H.; Mc Carthy N. (2016): CRISPR-CAS9 technology and its application in haematological disorders. British Journal of Haematology 175: (2) 208-225