Campher – ein endokriner Disruptor |
Contents
Einleitung
Unter einem endokrinen Disruptor versteht man einen Stoff, der schon in sehr geringen Mengen Auswirkungen auf den Körper und seinen Hormonhaushalt hat, was zu großen Problemen führen kann. Sie haben meist einen chemischen, seltener aber auch einen natürlichen Ursprung. Campher kommt ursprünglich aus dem so genannten Campherbaum (lat. Cinnamon camphora), wird aber heutzutage meist chemisch synthetisiert. Er ist in zahlreichen Produkten enthalten wie zum Beispiel in Salben und Cremen, vor allen Dingen in Sonnencremen und ätherischen Ölen.
Struktur und Eigenschaften: Summenformel: C10H16O Es gibt zwei verschiedene Formen vom Campher: L-Campher und D-Campher, diese sind Enantiomere. L-Campher wird synthetisch aus dem natürlichen D-Campher hergestellt. Campher ist ein lipophiler Wirkstoff, daher in Wasser schwer, in organischen Substanzen und fettigen Ölen aber gut löslich.
Wirkungen: Campher gilt als schmerzlindernd und fördert die Durchblutung. Äußerlich angewandt wirkt er auch als juckreizlindernd, antiseptisch, analeptisch und soll bei Muskel- und Gelenksbeschwerden helfen. Allerdings kann die Präsenz von Campher in den Mitteln auch zur allergischen Reaktionen, Hautreizungen, Kopfschmerzen und Schwindel führen. Zudem muss man eine Überdosierung verhindern, da es zu Atemnot, Übelkeit, Panikattacken und Vergiftungen führen kann 23 28. Campherhaltige Öle können zum Beispiel auch zu gastrointestinalen Reizungen und Depressionen des zentralen Nervensystems führen. Durch die Stimulation des Nervensystems können somit leichte bis Grand-Mal-Anfälle, bzw. Status epilepticus, hervorgerufen werden. Die ersten Symptome können innerhalb kürzester Zeit nach der Einnahme auftreten 27. Nicht geeignet ist Campher für Kinder und Schwangere, des Weiteren sollte er nicht mit Alkohol kombiniert werden. Es wird immer deutlicher, dass Campher auf verschiedenen Ebenen als endokriner Disruptor wirkt 1.
Wege in den Organismus
In zahlreichen alltäglichen, synthetisch hergestellten Produkten ist Campher enthalten, wie zum Beispiel in UV Schutzmitteln (z.B. Sonnenmilch), Kosmetikartikeln, Zigaretten, Kaugummi, Feuerwerksartikeln etc.24 25. In der EU gibt es 27 verschiedene endokrine Disruptoren, die erlaubt sind, in den USA dagegen nur 16. In Asien werden Campher Derivate am häufigsten eingesetzt, unter anderem für die Herstellung von synthetischen Produkten. Diese synthetisch hergestellten Produkte haben eine sehr hohe Campher- und Campher-Derivat-Konzentration. Werden diese Produkte über längere Zeit verwendet, kommt es zur Akkumulation in Geweben. Aufgenommen werden sie durch Resorption über den direkten Kontakt mit der Haut, Augen, Darm- und Magenschleimhaut und dem respiratorischen System. Diese Resorption wird durch den lipophilen Charakter ermöglicht, da lipophile Substanzen die Membran ungehindert passieren können. Lipophile Derivate sind beispielsweise 4-Methylbenzlidene Campher und 3-benzylidene Campher 2. Dem Resorptionsmechanismus liegen passive Mechanismen zugrunde, wie zum Beispiel durch Osmose oder Proteine, die Kanäle oder Poren bilden 3. In der Leber werden diese Substanzen mit Glucuronsäure konjugiert, dadurch in Wasser löslich und gelangen so in den Blutkreislauf. In Folge dessen breiten sich die konjugierten Campher-Derivate in den verschiedenen Geweben des ganzen Organismus aus und können in dieser Form auch die Plazenta-Schranke passieren. Das könnte sich eventuell negativ auf den Fötus auswirken. Die letale Dosis für Erwachsene beträgt 50-500 mg/kg bei oraler Verabreichung. Der Klassifikation der WHO zufolge ist Campher daher in die zweite Gefahrenklasse einzuordnen 2.
Wirkung auf spezifische Rezeptoren
Östrogenrezeptoren
Allgemeines: Östrogenrezeptoren (ER) haben zwei verschiedene Formen: ER α und ER β und gehören zur Familie der nuklearen Rezeptoren. ER α und ER β haben jeweils 6 verschiedene, aber funktionell und strukturell ähnliche Regionen bzw. Domänen, die als A bis F bezeichnet werden. Sie sind Proteine und agieren als ligand-aktivierende Transkriptionsfaktoren. Die Domänen A und B sind N-terminale Domänen. Sie sind wichtig für die Stimulation der Transkription von östrogenabhängigen Promotoren und werden durch den ligand-unabhängigen Aktivierungsfaktor AF1 aktiviert. Die Domäne C ist eine DNA-Bindungsstelle (DBD = Dna-binding Domain) und enthält zwei Zinkfingerstrukturen. Diese binden sich an die estrogen response elements (ERE) aus der DNA. Die Domäne D ist die sogenannte "hinge Region" und reguliert die DNA-Bindung an den Rezeptor. Sie enthält das Kernlokalisierungssignal. Dies ist eine aus Aminosäuren bestehende Sequenz, die Proteine zum Zellkern transportiert. Die Domäne E enthält die ligand-bindende Domäne und die ligand-abhängige Transaktivierungsfunktion (AF2), die die Genexpression transaktiviert als Antwort auf die Bindung vom Liganden. Die Domäne F ist eine C-terminale Domäne 4.
Die Aktivierungsfaktoren AF1 und AF2 interagieren im Zusammenhang mit Kofaktoren über Protein-Protein-Kontakt mit dem Transkriptionsapparat. Bei ER α und ER β sind die zentralen Regionen zu 98% gleich, allerdings sind die Aktivierungsdomänen sehr unterschiedlich. Die AF2 beider Östrogenrezeptorentypen sind sich ähnlich, die AF1 unterscheiden sich allerdings in ihren N-terminale Domänen. So kann man erklären, dass es Unterschiede in der Ligand Affinität gibt 30. Auch die unterschiedliche Aminosäuresequenz der Ligandbindungsdomänen von den Östrogenrezeptoren im Vergleich zu denen der anderen Rezeptoren ist eine Erklärung warum 17β-Östradiol mit vergleichbarer Affinität an beide Typen von Östrogenrezeptoren bindet 31. Allerdings haben die anderen Rezeptoren eine unterschiedliche Affinität zum Östradiol32. Die ER α sind vorwiegend in den Reproduktionsorganen (Ovar, Uterus, Vagina, Mamma), aber auch in Hypothalamus und Hypophyse, sowie in der Leber und im zentralen Nervensystem aufzufinden. ER β sind im zentralen Nervensystem, Ovar, Uterus, Mamma, Knochen, Thymus und im kardiovaskulären System mit ERα koexprimiert 33. Bei der Bindung von Östrogen werden diese Östrogenrezeptortypen aktiviert. Die Wirkung hängt vom Rezeptortyp, aber auch vom Ligandentyp ab 32. Bei der Bindung kommt es zur Konformationsveränderung, die AF werden entweder aktiviert oder blockiert und entsprechend wird die Anzahl an Kofaktoren reguliert. Östrogen beeinflusst Wachstum und Funktionen von Zielorganen, aber auch das ZNS. Es wirkt sich auch auf die Stimmungslage, Temperaturregulation, Lernen, Gedächtnis usw. aus 34.
Wirkung von Endokrinen Disruptoren auf den Östrogenrezeptor: 4 5 Endokrine Disruptoren können Auswirkungen auf Transport, Produktion und Sekretion der Hormone, aber auch auf deren Rückkopplungsprozesse haben (Östrogen wirkt sich negativ auf die LH und FSH Produktion in der Hypophyse aus). Des weiteren wirken sie direkt auf die Hormonrezeptoren: diese können dann entweder aktiviert oder inaktiviert werden. Zusätzlich wirken sie auf den Auf- und Abbau der Rezeptoren.
Die meisten endokrinen Disruptoren wirken auf die Östrogenrezeptoren als starkes Östrogen oder als Antiöstrogen: die hormonelle Regulation im Körper wird gestört. Ein weiteres Ziel dieser Disruptoren kann das Cytochrom P450 sein, wodurch die Synthese der Hormone selbst beeinflusst wird 35. Ein häufig benutztes Campher-Derivat, das 4-MBC (4-methylbenzylidene camphor) ist oft in UV-Filtern vorhanden und darf in der EU bis zu 4% in kosmetischen Produkten enthalten sein. Das 4-MBC enthält östrogene Merkmale: Die Größe ist vergleichbar mit der vom 17-ß-Östradiol 36. Außerdem kann es dank mehrerer ähnlicher Strukturmerkmale, z.B. einem aromatischen Ring, eine Bindung mit dem Östrogenrezeptor eingehen und seine Konformationsveränderung hervorrufen. Das 17-ß-Östradiol scheint sich gleicherweise an die ER α und die ER β zu binden. Das 4-MBC scheint allerdings eine Präferenz für die ER β zu haben, da es nicht in der Lage zu sein scheint das 17-ß-Östradiol aus den ER α zu verdrängen 26 37. Dies würde bedeuten, dass sich dieser endokrine Disruptor auf die regulatorische Rolle des 17-ß-Östradiol auswirkt und dadurch ein Ungleichgewicht hervorruft. Darüber hinaus vermutetet man, dass das 4-MBC eine Transaktivierung sowohl in den ER α der humanen Endometriumzellen, als auch in den ER β auslöst 38. Bei verschiedenen Tests stellte sich heraus, dass Tiere, die über längere Zeit mit 4-MBC behandelt wurden, nicht nur eine Futteraufnahme Verminderung und dadurch eine Gewichtsabnahme zu beobachten war, sondern auch dass 4-MBC eine direkte Auswirkung auf die Transkription von den Östrogenrezeptoren hat. Die ER α Transkriptmenge wurde kaum bis gar nicht beeinflusst, die Transkriptmenge der ER β sank schon bei geringer Menge des endokrinen Disruptors.
Wirkung auf den Körper: Eine wichtige Auswirkung hat das 4-MBC (4-methylbenzylidene camphor) auf die Proliferation der 7-MCF Zellen (humane Brustkrebszelllinie), was zu Brustkrebs führen kann29. Auf der anderen Seite scheinen reine Östrogenrezeptorantagonisten dieser Proliferation entgegenzuwirken. Darüber hinaus scheint das 4-MBC eine Uterotrophie und eine Gewichtszunahme des Uterus auszulösen39. Auch bei mit 4-MBC behandelten, tragenden Tieren stellte sich heraus, dass sowohl die Wurfgröße als auch die Überlebensquote der Jungen verringert wurde. Bei den männlichen Nachkommen wurde die Pubertät verzögert.
Wirkung auf den Fötus: Östrogen Rezeptoren sind schon im frühen Alter im Cerebellum enthalten. 17-β-Östradiol spielt eine wichtige Rolle in der cerebellaren Entwicklung und arbeitet synchron mit dem Thyroid Hormon (TH). Sind endokrine Disruptoren vorhanden, wird diese physiologische Synchronarbeit zwischen den zwei Hormonen gestört. Endokrine Disruptoren haben einen höheren Einfluss als bislang angenommen wurde. Dies führt zu Abnormalitäten im Hormonspiegel oder in der Synthese und Funktion der Östrogen Rezeptoren. Folglich führt es nicht nur zu Gehirnentwicklungsstörungen, sondern auch zu Störungen der Entwicklung des ganzen Nervengewebes in den Föten. Der Grund hierfür ist, dass sich im Fötus-Gehirn zunächst nur ER α befinden und sich postnatal zusätzlich noch ER β bilden. Da aber 4-MBC die ER β schädigen, führt es auch zur Missbildung bei der Entwicklung des Cerebellums 6.
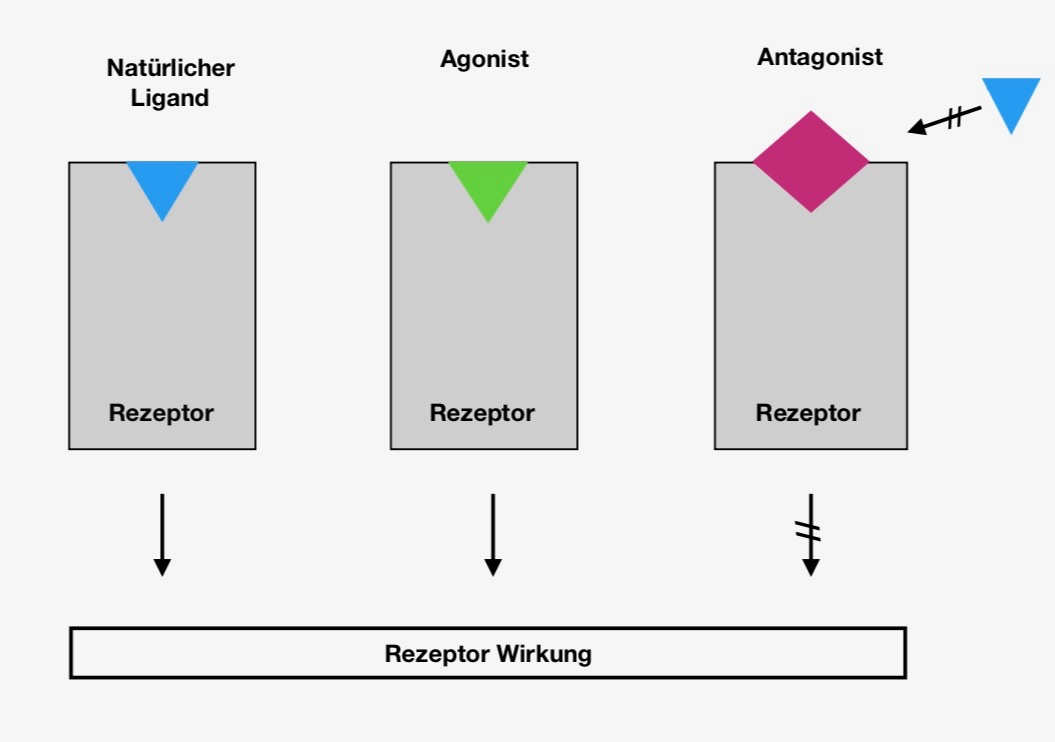
Androgenrezeptoren
Androgenrezeptoren sind Steroidrezeptoren, welche durch Testosteron und Dihydrotestosteron aktiviert werden und dienen als Transkriptionsfaktoren, welche lebenslänglich für die Ausbildung der Geschlechtsmerkmale verantwortlich sind 7. Das verantwortliche Hormon hierfür ist das Testosteron, welches von beiden Geschlechtern produziert wird, sich aber unterschiedlich in den jeweiligen Geschlechtern auswirkt 8. Es wurde in Zellkulturen nachgewiesen, dass 4-Methylbenzylidene Campher (4-MBC) und 3-Benzyliden Campher (3-BC) keine agonistischen Wirkungen gegenüber dem Androgenrezeptor zeigen, das heißt diese Campher Derivate wirken nicht stimulierend auf die Testosteron Bildung. Die Abbildung 1 zeigt, wie Antagonisten und Agonisten auf Rezeptoren wirken. Jedoch zeigen sie, abhängig von ihrer Konzentration, eine antagonistische Wirkung gegenüber den Androgenrezeptoren. Durch ihre antagonistische Wirkung hemmen sie den Androgen-Metabolismus und somit die Bildung von Testosteron. 4-MBC wird daher auch als ein effektiver menschlicher Androgenrezeptor-Antagonist bezeichnet 9. Als Folge der Störung des Androgen-Metabolismus wird zu wenig Testosteron gebildet, was zu folgenden Mangelerscheinungen führen kann: 10 Antriebslosigkeit, Erektionsstörung, Haarausfall, verstärktes Schwitzen, Verlust von Muskelmasse, Schlafprobleme. Ein weiterer Effekt von Campher Derivaten auf die Testosteron Synthese ist die Reduzierung der Aktivität des Cytochrom P450 B1. Dieses Enzym interferiert mit der 17-α-Hydroxylase, welches das Schlüsselenzym der Testosteron-Synthese ist. Wird die Funktion beider Enzyme reduziert, ist die Produktion von Testosteron eingeschränkt und weniger Testosteron wird produziert. Vor allem sind die Auswirkungen auf Jugendliche, die sich noch im Wachstum befinden, verheerend. Es kann zur Jugendverzögerung kommen. Aufgrund dessen, dass sich zu wenig Testosteron im Organismus befindet, können sich die primären und sekundären Geschlechtsmerkmale nicht richtig entwickelt werden 11.
Progesteronrezeptoren
Progesteron ist ein Steroidhormon und gehört zu den Gestagenen, welche vom Körper gebildete Sexualhormone sind. Sie werden im Gelbkörper und während der Schwangerschaft in der Plazenta produziert 12. Die Ausschüttung des Progesterons ist nicht gleichmäßig, es wird nur während des Menstruationszyklus freigesetzt. Seine Freisetzung wird durch das Hormon LH reguliert, welches aus der Hypophyse stammt. Die dazugehörigen Progesteronrezeptoren lokalisieren sich im Kern des Zielgewebes (Mamma und Uterus) 13. Nach der Bindung des Progesterons an den Rezeptor, bindet sich der Ligand-Rezeptor-Komplex an bestimmten Stellen auf der DNA. Das führt zur Transkription bestimmter Gene. Das bedeutet, dass diese Gene verstärkt exprimiert werden, was den Organismus auf die Schwangerschaft vorbereitet Eine Studie 14 14.1 untersuchte geschlechts- und regionenspezifische Veränderungen der Progesteronrezeptor-mRNA-Spiegel und der Östrogenempfindlichkeit im Gehirn von Ratten nach Exposition von dem östrogenen UV-Filter 4-Methylbenzyliden-Campher. Long Evans Ratten (F0 Generation) wurde in einem Zeitraum von 10 Wochen vor der Paarung bis zu dem Zeitpunkt an dem die F1 Generation ausgewachsen war, 4-MBC (7, 24, 47 mg/(kg Tag)) verabreicht. Als die F1 Generation ausgewachsen war, wurden die peripheren Fortpflanzungsorgane und das zentrale Nervensystem untersucht. Die mRNA-Expression des Progesteronrezeptors (PR) eines östrogen-regulierten Gens wurde im Bereich des medialen preoptischen Bereichs (MPO) und des ventromedialen Hypothalamus (VMH) mit Hilfe eines Echtzeit-RT-PCR untersucht. Intakten zwölf Wochen alten männlichen und weiblichen Nachkommen sowie Erwachsenen gonadektomierten Nachkommen wurde unter stationären Bedingungen 17ß-Östradiol (E2) (10 oder 50μg/kg) subkutan injiziert. 6 Stunden danach wurden sie zur Beurteilung der Östrogenempfindlichkeit untersucht. Bei der weiblichen Kontrollgruppe wurde unter gleichbleibenden Bedingungen eine signifikant höhere PR-mRNA- Expression im ventromedialen Hypothalamus im Vergleich zur männlichen Kontrollgruppe beobachtet. Bei den männlichen Ratten beider 4-MBC-Gruppen war der Anstieg der Pr-mRNA als Antwort auf E2 deutlich höher als im Vergleich zu der männlichen Kontrollgruppe. Die PR-mRNA Level waren im MPO der männlichen Kontrollgruppe und der weiblichen Kontrollgruppe ähnlich. In der Entwicklungsphase erhöhte sich durch die Exposition von 4-MBC der PR-mRNA Spiegel im männlichen MPO, dieser änderte sich jedoch nicht signifikant bei den weiblichen Gruppen. Die akute Antwort auf die niedrigere E2 Dosis war im MPO von 4-MBC-exponierten männlichen Gruppe vermindert, wobei bei den weiblichen Ratten der Dosisgruppe mit 7mg/kg eine erhöhte Reaktion auf 50 µg/kg E2 zeigten. Die Daten zeigten, dass die endokrinen Substanzen (wie der 4-MBC UV-Filter), zu Fehlentwicklung des Gehirns führen können.
4-Methylbenzylidene Campher (4-MBC) kann sich schon in geringer Menge auf die Anzahl der membran-gebundenen Progesteronrezeptoren auswirken und diese heruntersetzen. Bei höheren Dosen kann die Anzahl der Progesteron-Rezeptoren wieder normalisiert werden. 4-MBC und 3-Benzylidenampher (3-BC) zeigen in verschiedenen Versuchen keine Progesteronrezeptoren Transaktivierung und wirken in niedrigen Dosen antagonistisch. Das bedeutet, dass sie sich an die Oberfläche der Rezeptoren binden und die Bindungsstelle für Progesteron blockieren. Für diese Nachweise wurden U2-OS Zellen (human osteosacroma epithel cells / 2Tline) verwendet, da diese Zellen schnell wachsen und eine hohe Affinität für Transfektion haben. Transfektion bedeutet, dass die Zellen Fremd-DNA in ihr eigenes Genmaterial einbauen und dieses exprimieren 15.
|
Abb. 1 : selbstangefertigtes Bild: Sara Schäfer
Wirkung auf GnRH, LH, FSH und Testosteron
Das Peptid-Hormon GnRH (Gonadotropin releasing hormone) wird im Hypothalamus gebildet und bewirkt die Freisetzung von Gonadotropinen wie z.B. LH, FSH. Das GnRH ist unerlässlich für eine normale Sexualfunktion, ist die Freisetzung gestört können endokrine Krankheiten wie zum Beispiel eine Amenorrhö auftreten 16. Durch dieses Ausbleiben der Regelblutung ist die Fähigkeit zur Fortpflanzung eingeschränkt 17.
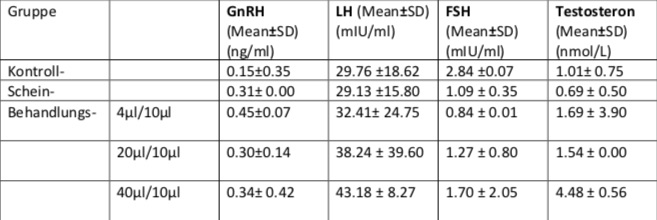
Eine Studie 2 der Ethic Committee of Babol University of Medical Sciences (Babol, Iran) untersuchte die Effekte von Campher auf Sexualhormone wie LH, FSH und Testosteron, sowie auf das GnRH Plasmalevel in männlichen Ratten. Die Ratten wurden in Kontroll-, Schein- und Behandlungsgruppe eingeteilt. Die Kontrollgruppe bekam keine Behandlung, der Scheingruppe wurde 10 %iges EtOH und der Behandlungsgruppe Campher in 3 verschiedenen Dosierungen (4, 20, 40 µl in Alkohol) intracerebroventricular (ICV) injiziert. Die Serumproben wurden zur Untersuchung von GnRH, LH, FSH und Testosteron verwendet. Trotz der direkten Gabe des Camphers in die "HPG-Achse" (hypothalamus-pituitary-gonad-axis) wurden in den Hormonleveln der verschiedenen Gruppen keine signifikanten Unterschiede entdeckt. Die GnRH und LH Konzentration zeigte keine signifikante Veränderung, die FSH Konzentration sank, während die Testosteron Konzentration stieg. Diese Tabelle zeigt die GnRH, LH, FSH und Testosteron Konzentration in männlichen Ratten nach erhalten der ICV Injektion von Campher und die Kontroll- bzw. Scheingruppe Gruppe
Diese Tabelle zeigt die GnRH, LH, FSH und Testosteron Konzentration der verschiedenen Untersuchungsgruppen.
|
Tabelle 1: Ins Deutsche übersetzt anhand der Arbeit von Sima Shahabi, Seyed Gholam Ali Jorsaraei et al, (2012), Central Effects of Camphor on GnRH and Sexual Hormones in Male Rat, 1(4): 191–196 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3920510/#B20
Carou et al. 2008 18 untersuchten die Auswirkungen von campher-beinhaltenden Substanzen auf männliche Ratten mit 4-Methylbenzylidene camphor (4-MBC), welches ein ultraviolettes Absorbens ist. Das Ziel dieses Versuchs war es die Wirkung des 4-MBC in niedriger Dosierung auf die neuroendokrine Reproduktionsregulation von männlichen Ratten herauszufinden. Zu diesem Zweck wurde diesen Ratten entweder 5 Tage eine Dosis von 2 und 10 mg/kg, oder 2 Tage eine Dosis von 2 und 20 mg/kg 4-MBC subkutan injiziert. Im Anschluss an diese Injektionen wurden die Prolaktin, LH und FSH Konzentrationen untersucht. Außerdem wurde der Hypothalamus derer Ratten untersucht, die 2 Tage lang 4-MBC bekamen. Hier wurde die GnRH-Ausschüttung ermittelt. Die LH und FSH Konzentration sank bei den Ratten, die 5 Tage lang 2 und 10 mg/kg des 4-MBC erhielten. Die Injektion von 2 und 20 mg/kg 4-MBC über 2 Tage ließ das LH sinken, die Injektion mit 2 mg/kg über 2 Tage das FSH. Die Untersuchung des Hypothalamus ergab eine Senkung des hypothalamischen GnRH. Ergebnis war also, dass eine niedrige Dosierung des 4-MBC die Reproduktionsfähigkeit einschränkt. Diese unterschiedlichen Ergebnisse der zwei Versuche könnten entstanden sein, da bei dem ersten Versuch reines Campher genutzt wurde, bei dem zweiten allerdings nur Campher beinhaltende Substanzen.
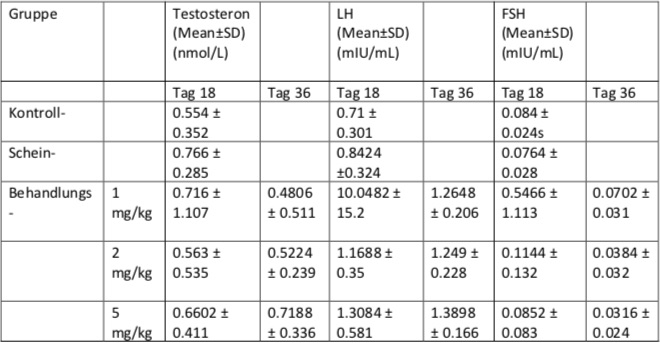
In einer weiteren Studie 19 wurde ebenfalls die unterdrückende Wirkung des Camphers auf das Sexualverhalten und die Sexualhormone (LH, FSH, Testosteron) untersucht. 56 männliche Ratten wurden in eine Kontroll-, eine Schein- und drei Behandlungsgruppen eingeteilt. Während die Kontrollgruppe keine Behandlung erhielt, bekam die Scheingruppe eine tägliche intraperitoneale Injektion von 10 % Ethanol für 30 Tage. Die Behandlungsgruppe wurde in 3 weitere Gruppen eingeteilt, die täglich eine intraperitoneale Injektion von 1, 2 oder 5 mg/kg Campher für 30 Tage erhielten. Anschließend wurde das Serum auf LH, FSH und Testosteron untersucht. Die LH Konzentration stieg bei allen Behandlungsgruppen, die FSH Konzentration sank bei der Injektion von 2 und 5 mg/kg Campher, während bei dem Testosteronlevel keine zu beachtende Änderung vorkam. Die Auswirkung von Campher auf die männlichen Gonadennerven hat parakrine Effekte auf das Testosteronlevel, was ein möglicher Grund für den Anstieg des LH´s ist. Die LH Konzentration ist jedoch unabhängig von der HPG-Achse.
Diese Tabelle zeigt die Testosteron, LH und FSH Konzentration der verschiedenen Untersuchungsgruppen.
|
Tabelle 2: Ins Deutsche übersetzt anhand der Arbeit von Sima Shahabi, M.Sc, Seyed Gholam Ali Jorsaraei et al, (2014), The Effect of Camphor on Sex Hormones Levels in Rats, 16(2): 231–234 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4072080/
Trotz dieser Versuche zur Wirkung von Campher auf Sexualhormone konnte diese nicht verlässlich bestätigt werden, weitere Studien sind nötig.
Referenzen
Fachartikel:
2 Sima Shahabi, Seyed Gholam Ali Jorsaraei et al, (2012), Central Effects of Camphor on GnRH and Sexual Hormones in Male Rat, 1(4): 191–196 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3920510/
4 Tomomi Sato, Taisen Iguchi et al, (2016), Estradiol-17β: 520-522, e94G-1-e94G-4 https://www.sciencedirect.com/topics/neuroscience/estrogen-receptor
5 Leonie Hilgendorf, (2010), Östrogenes Potential des endokrinen Disruptors 4-MBC im Reproduktionstrakt von ovariektomierten Ratten (Dissertation, Medizinische Fakultät der Georg-August-Universität zu Göttingen, Göttingen) https://d-nb.info/1042348324/34
6 Gergely Jocsak, David Sandor Kiss et al, (2016), Comparison of Individual and Combined Effects of Four Endocrine Disruptors on Estrogen Receptor Beta Transcription in Cerebellar Cell Culture: The Modulatory Role of Estradiol and Triiodo-Thyronine, 13(6): 619 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4924076/
9 Jiaying Wang, Liumeng Pan et al, (2016), Recent Advances on Endocrine Disrupting Effects of UV Filters, 13(8): 782 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4997468/
11 Sima Shahabi, Seyed Gholam Ali Jorsaraei et al, (2012), Central Effects of Camphor on GnRH and Sexual Hormones in Male Rat, 1(4): 191–196 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3920510/
14 Jiaying Wang, Liumeng Pan et al, (2016), Recent Advances on Endocrine Disrupting Effects of UV Filters, 13(8): 782 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4997468/
14.1 Kirsten Maerkel, Walter Lichtensteiger et al, (2005), Sex- and region-specific alterations of progesterone receptor mRNA levels and estrogen sensitivity in rat brain following developmental exposure to the estrogenic UV filter 4-methylbenzylidene camphor, 19(3): 761-765 https://www.sciencedirect.com/science/article/pii/S1382668904003096?via%3Dihub
18 Carou ME1, Ponzo OJ et al, (2008), Low dose 4-MBC effect on neuroendocrine regulation of reproductive axis in adult male rats, 26(2): 222-4 https://www.ncbi.nlm.nih.gov/pubmed/21783915
19 Sima Shahabi, M.Sc, Seyed Gholam Ali Jorsaraei et al, (2014), The Effect of Camphor on Sex Hormones Levels in Rats, 16(2): 231–234 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4072080/
23 Manoguerra AS, Erdman AR, Wax PM et al, (2006), Camphor Poisoning: an evidence-based practice guideline for out-of-hospital management, 44(4): 357-70 https://www.ncbi.nlm.nih.gov/pubmed/16809137
24 Tran TA, Ho MT, Song YW et al, (2015), Camphor Induces Proliferative and Anti-senescence Activities in Human Primary Dermal Fibroblasts and Inhibits UV-Induced Wrinkle Formation in Mouse Skin, 29(12): 1917-25 https://www.ncbi.nlm.nih.gov/pubmed/26458283
25 Shanshan Guo, Zhufeng Geng et al, (2016), The Chemical Composition of Essential Oils from Cinnamomum camphora and Their Insecticidal Activity against the Stored Product Pests, 17(11): 1836 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5133837/
26 Mueller SO1, Kling M, Mecky A et al, (2003), Activation of estrogen receptor alpha and ERbeta by 4-methylbenzylidene-camphor in human and rat cells: comparison with phyto- and xenoestrogens, 142(1-2): 89-101 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5133837/
27 Zorina Flaman, Sandra Pellechia-Clarke, Benoit Bailey et al, (2001), Unintentional exposure of young children to camphor and eucalyptus oils, 6(2): 80–83 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2804512/
28 Emerson T. da Silva, Adriele da Silva Araújo et al, (2016), Synthesis and Biological Activities of Camphor Hydrazone and Imine Derivatives, 84(3): 467–483 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5064238/
29 Müller C, Kloas W, Hildebrandt JP et al, (2005), Estrogen-like effects of ultraviolet screen 3-(4-methylbenzylidene)-camphor (Eusolex 6300) on cell proliferation and gene induction in mammalian and amphibian cells, 97(3): 274-81 https://www.ncbi.nlm.nih.gov/pubmed/15589235/
30 Dechering K, Boersma C, Mosselman S, (2000), Estrogen receptors alpha and beta: two receptors of a kind? Curr Med Chem 7(5): 561-576 https://www.ncbi.nlm.nih.gov/pubmed/10702625
31 Kuiper GG, Carlsson B et al, (1997), Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta. Endocrinology 138(3): 863-870 https://www.ncbi.nlm.nih.gov/pubmed/9048584
32 Katzenellenbogen JA, Malley BW et al, (1996), Tripartite steroid hormone receptor pharmacology: interaction with multiple effector sites as a basis for the cell-and promoter-specific action of these hormones. Mol Endocrinol 10(2): 119-131 https://www.ncbi.nlm.nih.gov/pubmed/8825552
33 Nilsson S, Makela S et al, (2001), Mechanisms of estrogen action. Physiol Rev 81(4): 1535-1565 https://www.ncbi.nlm.nih.gov/pubmed/11581496
34 Nilsson S, Gustafsson JA et al, (2002), Biological role of estrogen and estrogen receptors. Crit Rev Biochem Mol Biol 37(1): 1-28 https://www.ncbi.nlm.nih.gov/pubmed/11581496
35 Li X, Huang J, Yi P et al, (2004), Single-chain estrogen receptors (ERs) reveal that the ERalpha/beta heterodimer emulates functions of the ERalpha dimer in genomic estrogen signaling pathways. Mol Cell Biol 24(17): 7681-7694 https://www.ncbi.nlm.nih.gov/pubmed/15314175
36 Anstead GM, Carlson KE et al, (1997), The estradiol pharmacophore: ligand structure-estrogen receptor binding affinity relationships and a model for the receptor binding site. Steroids 62(3): 268-303 https://www.ncbi.nlm.nih.gov/pubmed/9071738
37 Schlumpf M, Jarry H et al, (2004), Estrogenic activity and estrogen receptor binding of the UV filter 3-benzylidene camphor Comparison with 4-methylbenzylidene camphor. Toxicology 199(2-3): 109-120 https://www.ncbi.nlm.nih.gov/pubmed/15147785
38 Mueller SO, Kling M et al (2003): Activation of estrogen receptor alpha and ERbeta by 4-methylbenzylidene-camphor in human and rat cells: comparison with phyto-and xenoestrogens. Toxicol Lett 142(1-2): 89-101 https://www.ncbi.nlm.nih.gov/pubmed/12765243
39 Schlumpf M, Cotton B et al (2001): In Vitro and In Vivo Estrogenicity of UV Screens.Environ Health Perspect 109(3): 239-244 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1240241/
Weblinks:
1 PharmaWiki, (2018), Kampfer https://www.pharmawiki.ch/wiki/index.php?wiki=kampfer
3 MedizInfo, Aufbau und Diffusionswege einer Membran http://www.medizinfo.de/arzneimittel/resorption/membranaufbau.shtml
7 Dr. Frank Antwerpes, Androgenrezeptor https://flexikon.doccheck.com/de/Androgenrezeptor
8 PD Dr. med. Johannes W. Dietrich, Testosteron https://flexikon.doccheck.com/de/Testosteron#Biosynthese
10 FERNARZT, Testosteronmangel als Ursache von Erektionsstörungen https://www.fernarzt.com/behandlungen/erektionsstoerung/arten-ursachen/testosteronmangel/
12 Gemeinschaftspraxis für Pathologie Lübeck, Methoden in der Pathologie - Immunhistologie http://www.pathologen-luebeck.de/methoden-in-der-pathologie/
13 Myriam Weber (netdoktor), (2014), Progesteron https://www.netdoktor.at/laborwerte/progesteron-8453
15 Microscopyu, Human Bone Osteosarcoma Epithelial Cells https://www.microscopyu.com/gallery-images/human-bone-osteosarcoma-epithelial-cells-u2os-line
16 Dr. Benjamin Abels, Dr. Frank Antwerpes, Gonadotropin releasing hormone https://flexikon.doccheck.com/de/Gonadotropin_releasing_hormone
17 Dr. Frank Antwerpes, Emrah Hircin et al, Amenorrhö https://flexikon.doccheck.com/de/Amenorrhö
Abbildungsverzeichnis:
20 Abb. 1 : selbstangefertigtes Bild: Sara Schäfer
21 Tabelle 1: Sima Shahabi, Seyed Gholam Ali Jorsaraei et al, (2012), Central Effects of Camphor on GnRH and Sexual Hormones in Male Rat, 1(4): 191–196 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3920510/#B20
22 Tabelle 2: Sima Shahabi, M.Sc, Seyed Gholam Ali Jorsaraei et al, (2014), The Effect of Camphor on Sex Hormones Levels in Rats, 16(2): 231–234 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4072080/
Itt írjon a(z) Campfer_ED-ról/ről