A depresszió kialakulásának immunológiai háttere
Contents
- A depresszió kialakulásának immunológiai háttere
Bevezetés
„A depresszió egy gyilkos. Megöli az álmokat, a házasságokat és az embereket.” (Callahan és mtsai, 2005) A depresszió az egyik legelterjedtebb neurológiai rendellenesség világszerte. Gyakran együtt jár további betegségekkel, emiatt kevés tanulmány vizsgálja önmagában a depressziót. Magas halálozási rátával rendelkezik. (Moussavi és mtsai, 2007) A WHO becslései szerint több, mint 300 millió ember szenved ebben a rendellenességben. A legnagyobb aggodalomra az ad okot, hogy a serdülők körében a súlyos depresszió harmincszor gyakrabban végződik öngyilkossággal, mint a többi korosztály esetében. Újabb kutatások alapján a főbb tünetek az aktivitás, a motiváció, és az önértékelés romlása. Indikátor tünet az étvágy szembetűnő változása. (Stringaris, 2017)
Depresszió kialakulásának hátterei - A Mikroglia
A mikroglia sejtek a központi idegrendszer immunsejtjei, makrofágjai. Újabb tanulmányok azt mutatják, hogy a mikroglia sejtek a nyugalmi fiziológiás körülmények mellett is szerepet játszanak az agy fejlődésében, befolyásolják a szinaptikus plaszticitást, a neurogenezist, a memóriát és a hangulatot. Gyulladásos folyamatok (például: fertőzések, tartós stressz, autoimmun vagy neurodegeneratív betegségek) a mikrogliák homeosztázisának megváltozását, normál szerkezetének és megfelelő működésének károsodását okozza, amely közvetve depresszióhoz vezethet. Mindemellett hasonló tényező ezen immunsejtek öregedése, hanyatlása akár krónikus, akár természetes folyamatok hatására. Ennek értelmében tekinthetőek a depresszió egyes formái mikroglia betegségnek.
Az agy sejtjeinek nagyjából 10%-a mikroglia. Fejlődéstanilag eltér a neuronoktól, asztrocitáktól és oligodendrocitáktól. Míg utóbbiak neuroektodermális eredetűek, addig a mikroglia sejtek az embrionális fejlődés során kialakult perifériás mezodermális szövet primitív mieloid prekurzoraiból származnak. A kialakult mikroglia progenitorok az extraembrionális szikzacskóból a fejlődésben lévő központi idegrendszerbe vándorolnak, szinte egyenlő arányba az agy minden részébe. A gyarapodó központi idegrendszerben a mikroglia sejtek feladata a neurális prekurzor sejtszám, valamint a szinaptogenezis és a neurális hálózat kialakulásának szabályozása. Felnőtt szervezet központi idegrendszerében is jelentős szerepet játszanak a „pihenő” mikrogliák. A mikroglia-neuron kölcsönhatások az idegsejtek aktivitásától függenek, főleg olyan különleges körülmények között, mint például a szenzoros stimuláció, a speciális tanulási és memóriafeladatok.
Az agyi homeosztázis megváltozásának hatására (például: fertőzés, sérülés vagy neurodegeneráció következtében) jelentősen módosul a mikroglia sejt szerkezete és funkciója, úgynevezett aktivált állapotba kerül. Ezt az állapotot a mikrogliális folyamatok gyors és célzott mozgása jellemzi a sérülés vagy fertőzés helyszíne felé. Jellemző továbbá a mikroglia sejtek szaporodása (sűrűségük növekedése), morfológiai változások, például a szóma megnagyobbodása, fokozott fagocita aktivitás, gyulladásos citokinek és egyéb mediátor anyagok termelése és szekréciója. A mikroglia sejtek számos funkcionális változáson mehetnek keresztül, amelyek specifikus alkalmazkodást biztosítanak a különböző kóros állapotok kezeléséhez. Azonban bizonyos esetekben, beleértve olyan neurodegeneratív betegségeket, mint az Alzheimer vagy a Parkinson-kór, az aktivált mikroglia neurotoxikussá válhat és károsíthatja az idegsejteket.
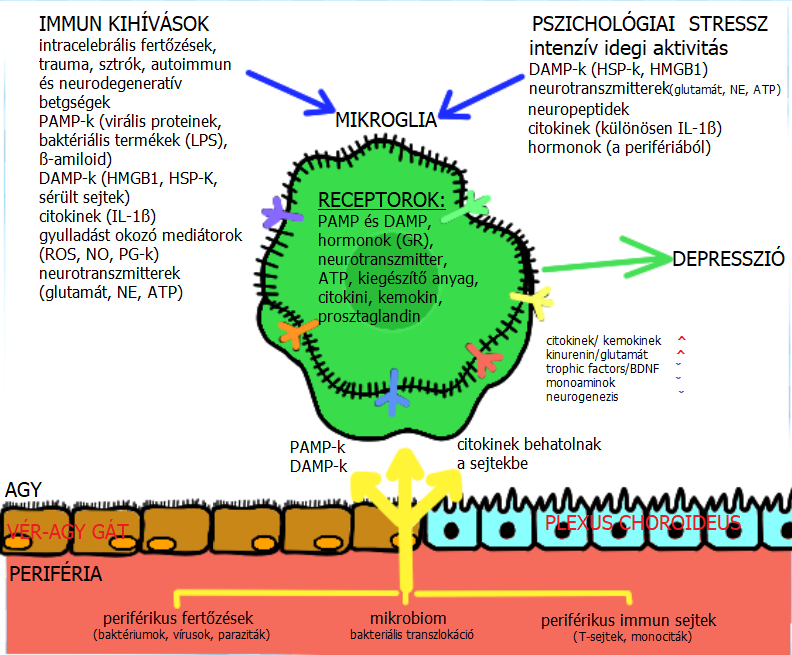
A mikroglia aktiválásának továbbá szerepe van a betegséggel összefüggő depresszió kialakulásában is. Különféle bakteriális és vírusos fertőzések (például: herpeszvírus, influenza és gyomor- és bélhuruthoz kapcsolódó vírusok) számos depressziós tünettel járnak együtt. E fertőző kórokozók közül soknak különleges affinitása van az agyhoz, ahol mikroglia-aktivációt indukálnak. Ezen kívül proinflammatorikus citokinek szekrécióját is kiváltják, amelyek plazmaszintje korrelál a depressziós tünetegyüttessel. Állatmodelleken végzett kísérletekkel bizonyították a mikroglia sejt depresszióban betöltött szerepét. A kísérletekben a rágcsálók agyában LPS adagolásával mikroglia aktivációt, ezzel együtt depresszióhoz hasonló tüneteket mutattak ki. Ezen tünetek szelektív szerotonin újrafelvétel gátlókkal (selective serotonin reuptake inhibitors) vagy triciklikus antidepresszánsokkal történő kezeléssel megelőzhetőek. (Yirmiya és mtsai, 2015). A mikroglia sejteket ért külső és belső hatásokat, melyeknek szerepe lehet a depressziós tünetegyüttes kialakulásában, az 1. ábra foglalja össze.
|
1. ábra: A mikroglia aktiváció forrásai a depresszióban (Leonard BE, sciencedirect.com) |
Antidepresszánsok hatása az immunrendszerre
Mára már ismert tény, hogy az endokrin-, az immun- és az idegrendszer funkcionálisan kapcsolatban áll, működésük összehangolt, tudományos alapjai bizonyítottak. Azon kutatások, amelyek szerint a hipotalamusz és a hipofízis fontos szerepet játszik egyes stresszhormonok (főként a glükokortikoidok) szekréciójának szabályozásában, szintén alátámasztják. Ezen kapcsolatok által olyan mechanizmusok biztosítottak, amellyel az immunrendszer aktivitását az idegrendszer közvetlenül is befolyásolhatja az immunsejtek adenoreceptorainak aktiválásával. Az immunrendszer szerkezetét tekintve autoregulált, mivel a különböző immunfunkciók jelentős része az immunsejteket érintik, és az antigének ellen kiváltott immunválaszhoz sincs szükség az agy jelentős befolyásához. Ennek ellenére az agynak nagy szerepe lehet az immunfunkciók modulálásában.
Továbbá ismert tény, hogy az immunrendszer zavart szenvedhet olyan pszichiátriai rendellenességekben szenvedő pácienseknél, mint például a depressziós, a skizofrén, vagy a szorongásos betegek esetében. Épp ezért fontos az ideg –, immun- és endokrin rendszer kölcsönhatásának megismerése számottevő pszichiátriai betegség patogenezisének megértéséhez, mint a depresszió. Egyes tanulmányok kimutatták, hogy az agyban a gyulladáskeltő citkoinek koncentrációjának növekedése hozzájárulhat depressziós tünetegyüttes kialakulásához. Interleukin (IL-) 1 (és rokon citokinek) beadását követően megfigyelhető tünetek az anhedónia, az étvágytalanság, az inszomnia, a libidóvesztés és az ingerlékenység voltak.
Ezen megfigyelések alapján a súlyos depresszió egyfajta pszichoneuroimmunológiai betegségnek tekinthető, az antidepresszánsok terápiás hatásukat pedig a pro-inflammatorikus citokinek hatásainak csökkentésével érik el. Patkányokon végzett kísérletekben lipopoliszacharid adagolása testsúly és táplálékfogyasztás csökkenést, valamint szacharin ízű víz fogyasztásának a csökkenését idézték elő. Ezen tünetek bizonyítottan visszafordíthatók triciklikus antidepresszánsokkal (például: desipramin) folytatott kezeléssel, viszont venlafaxinnal vagy SSRI-vel nem tudjuk ezt a hatást elérni. Jelenleg nem tisztázott, hogy a depressziós tünetekre (táplálékfelvétel és testsúly csökkenés) gyakorolt hatása a triciklikus antidepresszánsoknak a tumor nekrózis faktor rendszerre (TNF) kifejtett hatásával kapcsolatban áll-e. Azonban a desipramin mind az interleukin-1, mint a TNF szekrécióját csökkenti lipopoliszachariddal történő kezelést követően. Ehhez hasonló hatást sem a paroxetinnel sem a venlafaxinnal nem értek el. Mindazonáltal azon mechanizmusok, melyek folytán a triciklikus antidepresszánsok gátolják a citokinek felszabadulását, máig rejtve maradtak. Tehát az ép patkányokon végzett kísérletek alapján a triciklikus antidepresszánsok hatása különbözik a SSRI-k hatásától. Viszont egyes patkánymodelleken (olfactory rat model of depression) kimutatták, hogy a megemelkedett akut fázisú fehérjereakciókat hasonlóképp mérséklik mind a triciklusos antidepresszánsok, mind az SSRI-k. Bár az elmúlt évtizedekben kiemelkedő bizonyítékokat fedeztek fel azzal kapcsolatban, hogy a depresszió hátterében az immunműködés zavara állhat, továbbra is ellentmondásosak a bekövetkező gyulladásos folyamatok és a kóros elváltozások közötti ok-okozat összefüggések. (Leonard, 2001)
Kapcsolat a máj encephalopathia és a depresszió között
Máj encephalopathia egy gyakori, legyengítő komplikációja a máj cirrózisnak. Ezt a súlyos betegséget „agy-diszfunkciónak” is nevezik, amely a máj elégtelensége és/vagy a portó szisztémás sönt okozza. A Máj encephalopathia magába foglal egy széles tartományú pszicho motoros és pszichiátriai tünet együttest: alvás/ébrenlét ciklus zavar, személyiségváltozás és kóma egyaránt előfordulhat. A cirrhotikus betegeknek a 20-40 %-a valamikor a betegsége során máj encephalopathia alakul ki. A máj encephalopathiara jellemző a rossz kórjóslat és a fokozatosan romló életminőség. Ezenfelül, az alacsony gyógyulási esélyek pszichésen tovább rontják az érintett állapotát. A fent említett mechanizmusokon kívül a szisztémás gyulladás, és az ahhoz kapcsolódó felülfertőzések a legnagyobb hajtóerők a máj encephalopathia kialakulásában.
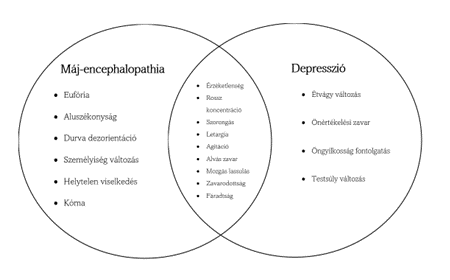
Máj-encephalopathia és a depresszió között számos klinikai összefüggés rejlik, mint például a kognitív romlás és a pszichomotoros retardáció, amely gyakran érint máj betegségben szenvedő egyéneket. Az említett állapotok kórjóslatai nem túl kedvezőek; magas a halálozási rátájuk és nagy mértékben rontják az életminőséget, amely tovább rontja a beteg egészségi állapotát, mind pszichésen, mind fizikálisan. A depresszió gyakran kéz a kézben jár krónikus betegségekkel. Újabb kutatások kiemelték, hogy a depresszió előfordulása magas (18-58%) cirrhotikus betegségekben szenvedők esetében. Pontosabban, több mint a fele a cirrhotikus betegeknek jóeséllyel depresszióban szenved, míg az általános populációnak csupán a 10%-a minősül depressziós betegnek. Depresszióban szenvedő cirrhotikus betegeknek magasabb a halálozási rátája és máj transzplantáció előtt jelentkező depresszió csökkenti a máj transzplantáció utáni gyógyulási esélyeket. A depresszió és a máj betegség súlyossága közötti kapcsolat nagyon komplex, néhány kutatás pozitív összefüggésre utal, míg némelyik éppen az ellenkezőt vallja. Máj-encephalopathia és a depresszió közötti összefüggésekből adódóan nehéz a konkrét diagnózist felállítani, mivel két különböző betegségről van szó, mégis sok az átfedő tünetegyüttes. Ilyen a szisztémás gyulladás, amely biztosan egy közreműködő faktor mindkettő betegség kialakulásában. A máj encephalopathiának és a depressziónak a tüneti átfedéseit a 2. ábra illusztrálja.
|
2. ábra: Klinikai jellemzői a máj encephalopathiának és a depressziónak. (Kronsten VT, Shawcross DL, www.sciencedirects.com) |
A depresszió és a májcirrhosis további tüneti átfedéseihez tartozik még az anorexia, energiahiány és az álmatlanság. Azok a beteg, akik máj cirrhozisban szenvednek, olyan magatartást produkálnak amik jelentősen megnehezítik a kezelést; mint például az alkohol fogysztása, illetve az orvosi kezelés be nem tartása. Ezek a kedvezőtlen tulajdonságok a depresszióban szenvedő betegekben is megfigyelhetőek. Egyes elméletek szerint a hepatitis-C vírus fertőzés és az alkohollal összefüggő májbetegségek közös eredetűek lehetnek a depresszióval. Más elméletek szerint nincs szignifikáns jelentősége az életmód változóknak a depresszió kialakulásában, sem depresszióban szenvedők, sem depressziótól mentes máj cirrhozisban szenvedő betegeknél. Depresszióban szenvedőkben kimutatható a szisztémás immunaktivitás, ilyen esetben a plazma szintje és a gyulladást okozó citokinek egyránt emelkedést mutatnak. Annak ellenére, hogy egyetlen specifikus mechanizmussal még nem lehet a depressziót és a szisztémás gyulladás közötti összefüggést alátámasztani, mégis úgy tűnik, hogy a gyulladás folyamatai központi szerepet töltenek be a depresszió kialakulásában.
Az elhunyt, korábban depresszióban szenvedő páciensek cerebrális mintái egyértelműen bizonyítják a neuroinflammációt és a mikrogliális aktivitást. Nagy számban megnövekedett a veleszületett immungének előfordulása azokban a betegekben, akik depresszióban szenvedtek, és vélhetően emiatt öngyilkosságot követtek el. Továbbá állatokon végzett kutatások bizonyították, hogy a máj és a szisztémás gyulladás neuroinflammációt és depressziót okoz. (Kronsten és Shawcross, 2022)
Elhízás és a depresszió közötti összefüggés
A depresszió gyakran összefüggésbe hozható a testsúlygyarapodással, viszont e feltételezés mögött álló mechanizmusok egyelőre még tisztázatlanok. Egy holland kutatócsoport felmérte, hogy a három táplálkozási szokás (érzelmi étkezés, külső-étkezés és visszafogott-étkezés) közül melyik(ek) viselkednek közvetítőként a depresszió és a testsúlygyarapodás között. A kutatásban 298 édesapát és 294 édesanyát kérdeztek meg az étkezési szokásaik, pszichés állapotuk és a BMI-jük (testtömegindexük) felől az elmúlt 5 évre visszatekintve. Annak ellenére, hogy összeségében a depresszió hatása a testsúly gyarapodására statisztikailag nem minősült szignifikánsnak egyik nemben sem, mégis akadt egy ok-okozati lánc a depresszió, érzelmi étkezés és a testsúly gyarapodás között az anyákban. A depresszív tünetek növelik az érzelmi-étkezést, amely várhatóan növeli a BMI-t, a depressziótól függetlenül is. Továbbá a depresszió közvetett hatása a BMI-re nézve szignifikánsnak bizonyult. Korábbi kutatások szerint az elhízás növeli a depresszió kockázatát és a depresszió előrehaladtával további testsúlygyarapodásra lehet számítani. A depresszió és az elhízás gyakori betegségek, melyek súlyos egészségügyi következménnyel járhatnak. Az érintettek száma, mind az elhízásban, mind a depresszióban szenvedők esetében világszerte növekszik. Ennek az aránynak a csökkentéséhez viszont elengedhetetlen tisztában lenni a két különböző kórkép összefüggéseivel.
Az egyik lehetséges kapcsolat a depresszió és a testsúlygyarapodás között az érzelmi-étkezés. Az érzelmi-étkezés egy étkezési válaszmechanizmus a negatív érzelmekre, mint például a depresszió tüneteire. A depresszió tünetei közé gyakran sorolható a csökkent étvágy és az emiatt kialakuló testsúlycsökkenés. Azonban a depressziónak létezik egy altípusa, amelyet a megnövekedett étvágy jellemez, növelve az elhízásra való esélyeket. Az érzelmi-étkezés egy fontos jelzése lehet ennek az altípusnak.
A külső étkezés szintén egy lehetséges jelzés a depresszió és a testsúlygyarapodás közötti kapcsolatnak. A külső-étkezés egy étkezési szokás, válaszolva az étel ingereire, az étel látványára, illatára és az ízére. Bizonyos személyek az ételek élvezetével terelik el a figyelmüket a környezetükben lévő negatív hatásokról. Hasonlóan az érzelmi-étkezésre, a külső-étkezés is egy jelzés a depresszió fentebb említett altípusára.
A harmadik lehetséges közvetítő a visszafogott-étkezés. A visszafogott-étkezés egy olyan étkezési szokás, amely alatt az egyén kevesebb ételt visz be a szervezetébe, mint amennyit kívánna, annak érdekében, hogy fenntartsa vagy csökkentse aktuális testsúlyát. Egy kutatásban kiderült, hogy azok az egyének, akik nem visszafogottan étkeznek, a depresszióra válaszolva többnyire csökkent a testsúlyuk, azonban akik a visszafogott-étkezést alkalmazzák, a depresszióra testsúly gyarapodással reagáltak.
A genetikai hajlam szintén hozzájárul az érzelmi-étkezéshez, a depresszióhoz kialakulásához és a testsúlygyarapodáshoz, mint például aszerotonin transzporterhez kapcsolódó polimorf régió (5-HTTLRP). Előzetes kutatások bizonyítják, hogy a serdülők, akik depressziós tüneteket produkáltak, nagyobb hajlamot mutattak az érzelmi-étkezésre abban az esetben, ha hordozták az 5-HTTLRP genotípust, mivel alacsony szerotonin aktivitással jár. 13 éves fiatalok körében ezt a jelenséget csak lányokban sikerült alátámasztani, hasonlóan a 15 évesek esetében is csak a lányok bizonyultak érintettnek.
A gyakoriság és az egyének közötti összefüggés a változókat illetően azt mutatja, hogy az érzelmi-étkezés szignifikánsnak mondható a depresszió és a testsúly gyarapodás közötti összefüggésben, mindkét nemben. Az érzelmi-étkezés és a BMI közötti pozitív összefüggés azonban csak az édesanyákban bizonyult szignifikánsnak. Mind a külső-étkezés, mind a visszafogott-étkezés szignifikáns eredményt mutatott a BMI-hez viszonyítva, édesapákban és édesanyákban egyaránt. A külső-étkezés pozitív összefüggésbe hozható (mindkettő nemben) a depresszív érzelmekkel. Azonban a visszafogott-étkezés kizárólag az édesanyákban mutatott pozitív összefüggést a depresszív érzelmekkel.
Attól függetlenül, hogy az étkezési viselkedések néhány esetben összefüggést mutattak a depresszió és a testsúlygyarapodás között mindkét nemben, az összesített hatása a depressziónak és a testsúlygyarapodásnak mégsem minősült szignifikánsnak egyik nemben sem, ennek alátámasztásához további kutatás szüksége. Ettől függetlenül, a szignifikánsnak bizonyuló érzelmi-étkezés hozzájáruló bizonyíték ahhoz az elmélethez, hogy az érzelmi-étkezés az egyike a depresszió altípus markereinek, amely további kutatásokhoz járulhat hozzá a jövőben. (Wurtman, 1993)
A depresszió kapcsolata a B vitaminokkal
A táplálkozástudomány és az immunológia szoros összefüggését mutatja, hogy világszerte a krónikus alultápláltság vagy a mikrotápanyagok rossz bevitele az immunrendszer szabályozási zavarához, valamint a neurotranszmitterek működésének és termelésének megváltozásához vezethet. A B-vitamin-hiány befolyásolhatja a memóriafunkciót, a kognitív károsodást és a demenciát is. A B-vitaminok szükségesek a metilációs ciklus megfelelő működéséhez, a monoamin-oxidáz termeléséhez, a DNS-szintézishez, valamint a foszfolipidek, például a mielin helyreállításához és karbantartásához. A csökkent metilációs funkció hozzájárul a krónikus állapotokhoz, beleértve az Alzheimer-kórt, a hangulati és pszichiátriai rendellenességeket, valamint a felnőttkori neurológiai állapotokat.
A B-vitamin-hiányt (B1, B2, B6, B12) a klinikusok a pszichiátriai rendellenességek felismerésére és kezelésére használják. Pótlásuk javítja a depresszió tüneteit és szerepet játszanak az immunválasz szabályozásában. A depresszióban szenvedő betegeknél gyulladást elősegítő reakciók figyelhetők meg. A B-vitamin, az immunrendszer, a gyulladás és a depresszió között összefüggő kapcsolat van. (Kathleen és mtsai, 2017)
B1 vitamin (tiamin)
Hiánya káros neurológiai hatásokkal jár, amelyek az ideggyulladáshoz, a T-sejt-infiltrációhoz, a gyulladást elősegítő citokinek (IL-1, TNF-α, IL-6) és az arachidonsav termékek túlzott expressziójához kapcsolódnak. Ezek mellett a tiamin hiánya a mikroglia sejteket és az asztrocitákat is serkenti a CD40 és CD40L expressziójára, ami a neuronok halálát váltja ki. Ezáltal érzelmi zavarokhoz, memóriazavarokhoz, depresszióhoz és kognitív hanyatláshoz vezethet. A tiaminhiány okozta neurológiai károsodásnak sokrétű etiológiája van, amely magában foglalja a szabad gyökök termelésének és az oxidatív stressz fokozódását, az axonmembránok károsodását és az idegsejtek halálát, a myelinogenezis zavarát és a glutamát által közvetített excitotoxicitást.
B2 vitamin (riboflavin)
Hiánya elsősorban anémiát, gyulladást, idősebb felnőtteknél kognitív diszfunkciót és depressziót okoz, valamint a központi idegrendszerben is elváltozásokat mutat, beleértve a káros személyiségváltozásokat, például az agressziót. Szerepe az immunrendszerben szorosan összefügg a MAIT sejtek funkciójával, amelyek egyedülállóak, mivel ezek az egyetlen αβ T-sejtek, amelyeket MR1-hez kötött riboflavin metabolit származékok aktiválnak.
B3 vitamin (niacin)
Hiánya skizofréniában, mániás depresszióban, jóindulatú depresszióban és feszültség-szorongásos állapotokban fordult elő. Alacsony szintje a pellagrához is kapcsolódik, és a téveszmés parazitózisban szenvedő betegeknél a niacinterápiára enyhült. Az unipoláris depressziós zavarban szenvedő betegeknél pedig jelentősen javította a depressziót, a szorongást és a szomatikus tüneteket. A niacin képes túlzottan stimulálni a veleszületett immunrendszert – az első védelmi vonalat a betolakodó organizmusok ellen. Nagy dózisban véd a Staphylococcus aureus fertőzések ellen, további gyógyszerek nélkül. A nikotinsav-kiegészítés a monocitákra is hat, tompítja a gyulladás hatásait érelmeszesedésben. A magas IL-1, IL-6 és TNF-α szinteket eredményező gyulladásos étrend (arterogén diéta) állatmodelljében képes volt csökkenteni a makrofágok gyulladáskeltő citokinek termelését. Ezáltal a niacin csökkenti a gyulladást, ami a depresszió egyik fő tényezője.
B5-vitamin (pantoténsav)
Hiánya fáradtsághoz és depresszióhoz vezethet. Részt vesz az acetilkolin képződésében, ami a depresszióhoz kapcsolódik. A 6–9 éves iskolás gyerekeknél a depressziós tünetek az alacsony tiaminszinttel korreláltak.
B6-vitamin (piridoxin)
Az összes vitamin közül a leginkább érintett a depresszió okában és kezelésében, szerepe van a hangulatszabályozásban. Befolyásolja azokat a neurotranszmittereket, amelyek szabályozzák a depressziót és a szorongást. Hiánya magas homociszteinszintet eredményez, amely görcsrohamokhoz, migrénhez és depresszióhoz kapcsolódik. A piridoxin-kiegészítés csökkenti a vérplazma homociszteinszintjét skizofrén betegekben, és javítja a hangulatot és az enyhébb típusu depressziót. A biológiailag aktív formája a piridoxál-5′-foszfát (PLP), , bonyolultan részt vesz az endokrin, a neurológiai és az immunrendszernek megfelelő funkciókban. Egerekben a B6-vitamin alulszabályozza az NF-κB makrofágok általi aktiválását, míg a B6- és B12-vitamin hiánya hátrányosan befolyásolhatja a metilációs reakciókat és fokozza a gyulladásos választ a dendritikus sejtekben. A PLP-től függő triptofán-kinurenin útvonal a gyulladást elősegítő immunválaszok során aktiválódik; valójában számos triptofán-származék fokozza a sejt apoptózisát, blokkolja a CD4+ T-sejtek proliferációját és gátolja a Th1 citokineket. Ezenkívül a triptofán lebomlása krónikus gyulladásból eredhet, és számos betegséget válthat ki, aminek következményei lehetnek a depresszióban.
B7-vitamin (biotin)
Biotinnal végzett kezelést követően súlyos depresszióban és delíriumban a tünetek javulását figyelték meg. Kulcsfontosságú a sejtek növekedésében, valamint a zsírok és aminosavak anyagcseréjében.
B9-vitamin (folsav)
Szükséges a DNS szintéziséhez, javításához és metilálásához, enélkül az élő sejtek nem tudnak osztódni és működni. Hiánya vérszegénységet, ingerlékenységet és viselkedési zavarokat okoz. Emellett 11 különböző publikált tanulmány támasztja alá, hogy az alacsony folsavszint depresszióhoz kapcsolódik, így szerepet játszik a hangulatban, a depresszióban és a kognitív hanyatlásban, gyakori a demenciában, az Alzheimer-kórban. Alacsony a vér folsavszintje az antidepresszáns tablettákkal (lítium) kezelt, visszatérő hangulati zavarokban szenvedő betegeknél is. Az antidepresszáns gyógyszerekre rosszul reagáló betegek általában alacsony folsavszinttel rendelkeznek, és a folsav-kiegészítés javítja a gyógyszeres reakciókat. Kimutatták, hogy a tenyésztett humán monociták folsavval történő előkezelése gátolja a homocisztein által indukált NF-κB-t, amely viszont fontos tényező a gyulladást elősegítő citokinek génszabályozásában. A megaloblasztos vérszegénységben (amely a folsavhiány egyik klinikai formája) szenvedő betegek immunválaszuk károsodott, ami nagyrészt sejtmediált immunitást érint. Ez az állapot azonban folsav-pótlással megfordítható.
A folsavban gazdag étrendű ázsiai populációkban a major depresszió ritkábban fordul elő. Mérsékelt folsav fogyasztás megvéd a szülés utáni depressziótól. Ezen túlmenően az alacsony folátot fogyasztó alanyoknál nagyobb a depresszió kockázata, mint azoknál, akik a legtöbb folátot fogyasztják. A folát hatással van a noradrenalin és a szerotonin receptorokra az agyban, ami arra utal, hogy antidepresszív hatást fejt ki.
B12-vitamin (kobalamin)
A B12-vitamin-hiányos betegekben a CD8+- és NK-sejtek számának jelentős csökkenése volt megfigyelhető, amit a metil-B12-kezelés tovább fokozhatott. Hasonlóképpen, a kórosan magas CD4/CD8 arány és az alacsony NK aktivitás vészes vérszegénységben szenvedő betegeknél a B12-vitamin-hiány következménye lehet. Ezenkívül a B12-vitamin-hiányos patkányok gerincvelőjében felerősödik a TNF-α termelése, egerekben pedig a B12-vitamin hiánya fokozza a makrofágok TNF-α szintézisét. Az IL-6 csökkent a kobalaminhiányos patkányokban a gp130 szabályozási zavara következtében. A Gp130 egy transzmembrán glikoprotein és az összes citokinreceptor osztály alapító tagja, amely elősegíti az emlősök központi idegrendszerében a demielinizációt. Mind az IL-6, mind a TNF-α eltéréseit B12-vitamin-pótlással korrigáltuk.
B17-vitamin (amigdalin vagy laetril)
Egy cianogén diglükozid, amely főként a gyümölcsmagokban, például őszibarackban, sárgabarackban, keserű mandulában, kesudióban és makadámiában található.A szervezetnek nincs szüksége rá a működéséhez, hiány tünetei meglehetősen ritkák, bár sokan úgy vélik, hogy hiánya nagyobb rákkockázathoz vezet. Az 1800-as években Oroszországban általánosan használták a rák kezelésére. Újra megjelent és népszerű volt az Egyesült Államokban az 1920-as években, és a közelmúltban újra előkerült, mint alternatív rákkezelés, bár erősen ellentmondásos volt. Az amygdalinról beszámoltak, hogy lassítja a prosztata-, tüdő- és vesesejtes sejtvonal növekedését és migrációját in vitro, és szabályozza az apoptózist a méhnyakrákban és a tripla negatív mellráksejtekben. Súlyos cianidmérgezésről számoltak be azonban egy 4 éves gyermeknél, aki sárgabarackmagot fogyasztott, és intravénásan amygdalint fecskendeztek be. Ezzel szemben amygdalinnal kezelt rákos betegeknél nem számoltak be tumor regresszióról és toxicitásról.
Az amygdalin elnyomhatja a gyulladásos választ egerekben ateroszklerotikus állapotokban azáltal, hogy gyengíti a szabályozó T-sejtek működését, valamint gátolja a RAW264.7 makrofág sejtvonal LPS-indukálta TNF-α termelését. Tekintettel az amygdalin gyulladáscsökkentő tulajdonságaira, hasznos lehet a depresszióval összefüggő gyulladás csökkentésében, bár további vizsgálatok szükségesek az amigdalin gyulladásra és immunrendszerre gyakorolt hatásának meghatározásához. (Mikkelsen és mtsai, 2017)
Konklúzió
A súlyos depresszió, amely minden hatodik embert érint élete során, az emberi szenvedés egyik legfőbb oka. (Yirmiya és mtsai, 2015). Már az ókorban felismerték, hogy az emberek érzelmi állapota kapcsolatban áll a fiziológiás egészségükkel. Bár máig csak kapargatják a felszínt tudósaink a depresszió kialakulásának tudományos hátterével kapcsolatban, azonban az utóbbi évtizedekben kutatóink és orvosaink hatalmas felfedezéseket tettek, ugyanakkor továbbra sem tettek szert a depresszió kialakulásában szerepet játszó főmechanizmusra, csupán a depressziót befolyásoló és az ahhoz hozzájáruló részmechanizmusok bizonyultak egyelőre alátámaszthatónak. A depresszió még mélyebb felfedezése valószínűleg további komplexebb kutatást és kísérletezést igényel majd a jövőben, próbára téve fejlett orvostudományunkat és azok modern technológiáit. (Kronsten és Shawcross, 2022)
Irodalomjegyzék
Callahan CM, Pettinga C, Pettinga Y, M.D., German E. Berrios, German BE (2005): Reinventing Depression: History of the Treatment of Depression in Primary Care, 1940-2004.
Kronsten VT, Shawcross DL (2022): Hepatic encephalopathy and depression in chronic liver disease: is the common link systemic inflammation?. Analytical Biochemistry: (636)
Leonard BE (2001): The immune system, depression and the action of antidepressants. Progress in Neuro-Psychopharmacology and Biological Psychiatry 25: (4) 767-780.
Mikkelsen K, Stojanovska L, Prakash M, Apostolopoulos V (2017): The effects of vitamin B on the immune/cytokine network and their involvement in depression. Maturitas 96: 58-71
Moussavi S MPH, Bedirhan U MD, Dr. Chatterji S MD, Verdes E PhD, Tandon A PhD, Patel V PhD (2007): Depression, chronic diseases, and decrements in health: results from the World Health Surveys. The Lancet 370: (9590) 851-858
Stringaris A (2017): What is depression? Journal of Child Psychology and Psychiatry 58: (12) 1287-1289
Wurtman JJ (1993): Depression and weight gain: the serotonin connection. Journal of Affective Disorders: (29) 183-192
Yirmiya R, Ronen R, Rimmerman N (2015): Depression as a Microglial Disease. Trends in Neurosciences 38: (10) 637-658