A cukorbetegség virális kiváltói
Contents
Bevezetés
A cukorbetegség, latinul diabetes mellitus (DM), magyarosan diabétesz, a glükóz feldolgozási zavara. Kiváltó okai alapján megkülönböztetünk 1-es típusú, inzulindependens (T1D) és 2-es típusú, inzulinindependens (T2D) diabetes mellitust. Míg az előbbit az inzulintermelődés zavara váltja ki, addig az utóbbit a szervezet inzulinnal szembeni érzéketlensége, rezisztenciája okozza.
Jelenleg nagyjából 463 millió diabéteszes páciens él a világon, a betegség pedig egyre növekvő tendenciát mutat. A becslések szerint 2030-ra már 578,4 millió, 2045-re pedig már 700,2 millió cukorbeteg emberrel számolhatunk (Que et al., 2021).
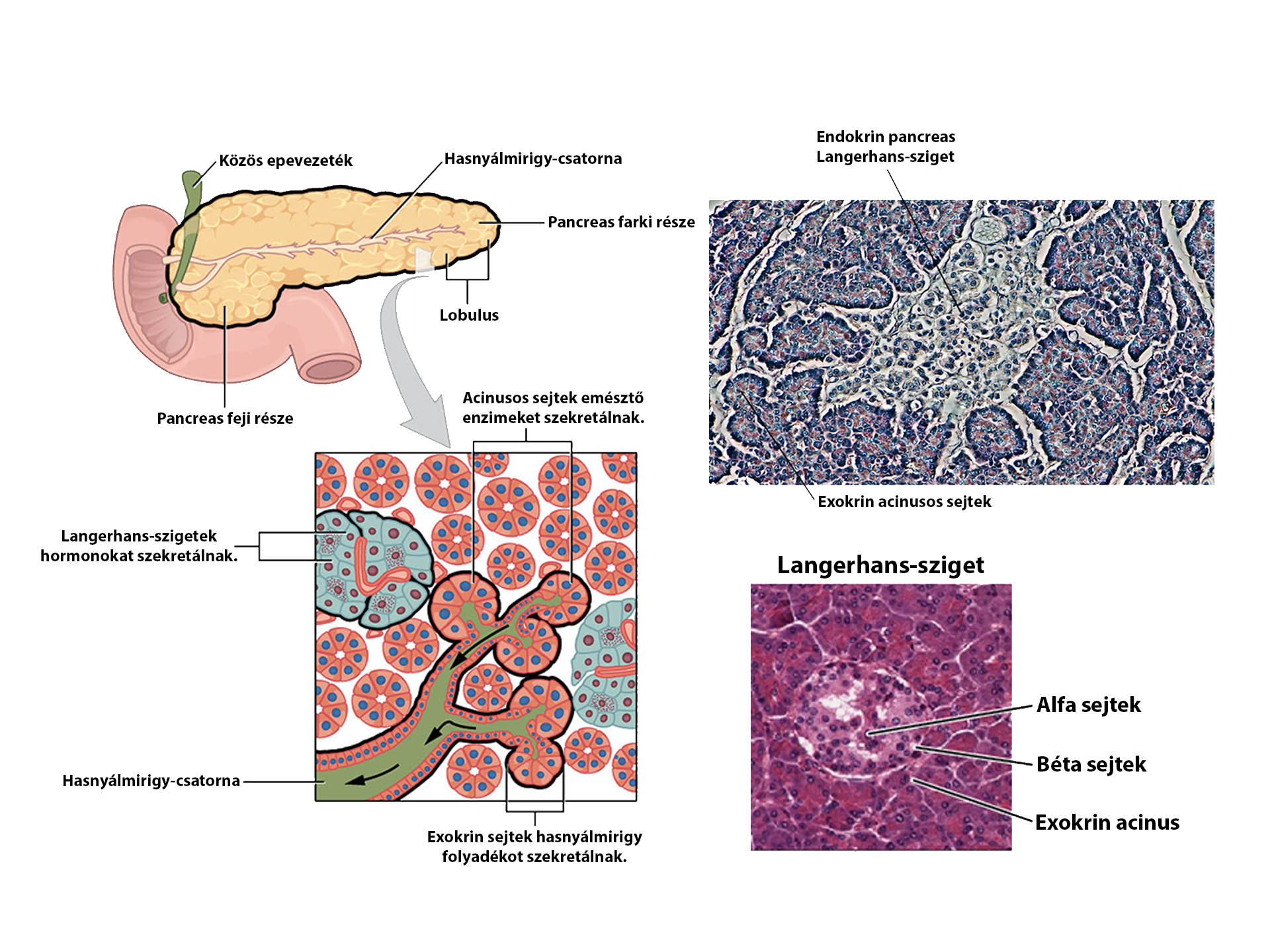
Az állatok szénhidrátforgalmának, így a vércukorszint szabályozásában is fontos szerepet vállalnak hormonok. Míg a vércukorszintet számos hormon (adrenalin, glükagon, glükokortikoidok, ACTH, GH) emeli, addig csupán egyetlen hormon csökkenti, az inzulin (1. ábra). Utóbbit a hasnyálmirigy Langerhans-szigeteinek β-sejtjei termelik (2. ábra), így könnyen belátható, ha ezek károsodást szenvednek, elkerülhetetlenül inzulinhiány alakul ki.
A cukorbetegség tünetei sokfélék lehetnek. A fáradtságot az emelkedett vércukorszint (hyperglikémia) miatt kialakuló gyakori vizelés (polyuria) és szomjúságérzet, megnövekedett vízfogyasztás (polydipsia) társul. A folyadék és elektrolitháztartás zavarai járhatnak izomgörcsökkel, látászavarral. Kialakulhat viszketés és vöröses arcszínezet (rubeosis diabetica). A T2D kezdeti fázisában a magas vérinzulinszint okozhat extrém éhségérzetet.
Amennyiben nem kezelik, a cukorbetegséget kísérhetik súlyos szövődmények. Az érrendszeri szövődményeknek több formája van, érdemes megemlíteni az érelmeszesedést, nephropathiát, retinopathiát, neuropathiat és a diabéteszes láb szindrómát (Pociot and Bergholdt, 2006).
|
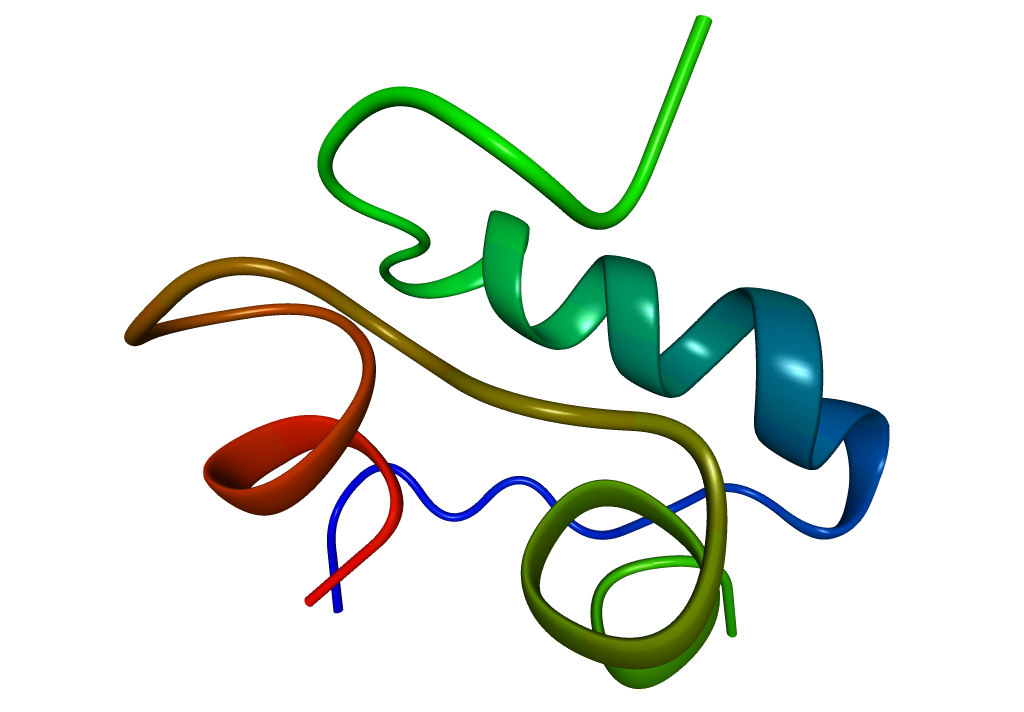
1. ábra: Az inzulin 3D szerkezete |
|
2. ábra: A Langerhans szigetek és a β-sejtek elhelyezkedése |
Cukorbetegség típusai
1-es típusú cukorbetegség
Az 1-es típusú, inzulindependens diabetes mellitus egy autoimmun betegség. Mint ilyen, az állat immunrendszere idegenként azonosítja a saját hasnyálmirigyének inzulintermelő β-sejtjeit, így azok végül autoimmun gyulladás következtében károsodnak, illetve elpusztulnak, totális inzulinhiányt eredményezve. Bármely életkorban előfordulhat, de általában gyermekkorban jelentkezik és tipikusan egyébként egészséges embereket érint. A betegség gyógyíthatatlan, kezelési lehetőségei az életmódváltás, diéta, illetve exogén úton pótolt inzulin. Mint minden autoimmun betegségnél, így itt is fontosak a hajlamosító tényezők. Szóba jöhet genetikai hajlam, táplálkozási szokások, köztük a tehéntej-tejfehérjéje, a gliadin (a glutén egyik összetevője) és vírusfertőzések is. (Syed, 2022)
2-es típusú cukorbetegség
A 2-es típusú, inzulinindependens diabetes mellitus oka az inzulinrezisztencia. A betegség kialakulását általában prediabéteszes állapot előzi meg. A korán felismert T2D gyógyítható, egyes esetekben akár vissza is fordítható a megfelelő gyógyszeres kezeléssel. Kiváltó okait elsősorban genetikai hajlamban és az érintett egyén életmódjában kereshetjük. Az elhízás, helytelen táplálkozás, mozgásszegény életmód mind hozzájárulhat a kialakulásához. (McDermott, 2020)
A cukorbetegség és a dysbiosis kapcsolata
Az immunrendszert a környezeti körülmények nagyban befolyásolják (Brodin et al., 2015), így a diabétesz kialakulásában szerepet játszhat a dysbiosis (bélflóra egyensúlyának felborulása), a különböző fertőzések, a táplálékkal felvett antigének, valamint a D-vitamin hiánya (Rewers and Ludvigsson, 2016; Esposito et al., 2019).
A mikrobiom egy dinamikusan változó környezet, melynek alkotásában baktériumok, archeák, vírusok, gombák és helminthák (bélférgek) vesznek részt (Morse and Horwitz, 2021). Jelentős szerepet játszik a helyi gyulladásos válaszok, a perifériás immunrendszer toleranciájának, aktivációjának, migrációjának, valamint differenciálódásának a kialakításában is (Levy et al., 2017). A bélben található mikrobiom erőteljes hatást gyakorolhat az immunhomeosztázisra különböző metabolitok és rövid szénláncú zsírsavak termelése által, rá nagyfokú heterogenitás jellemző, emiatt a különböző kutatások során számos eltérő eredményt találtak a mikrobiom és a diabétesz kapcsolatában (Morse and Horwitz, 2021).
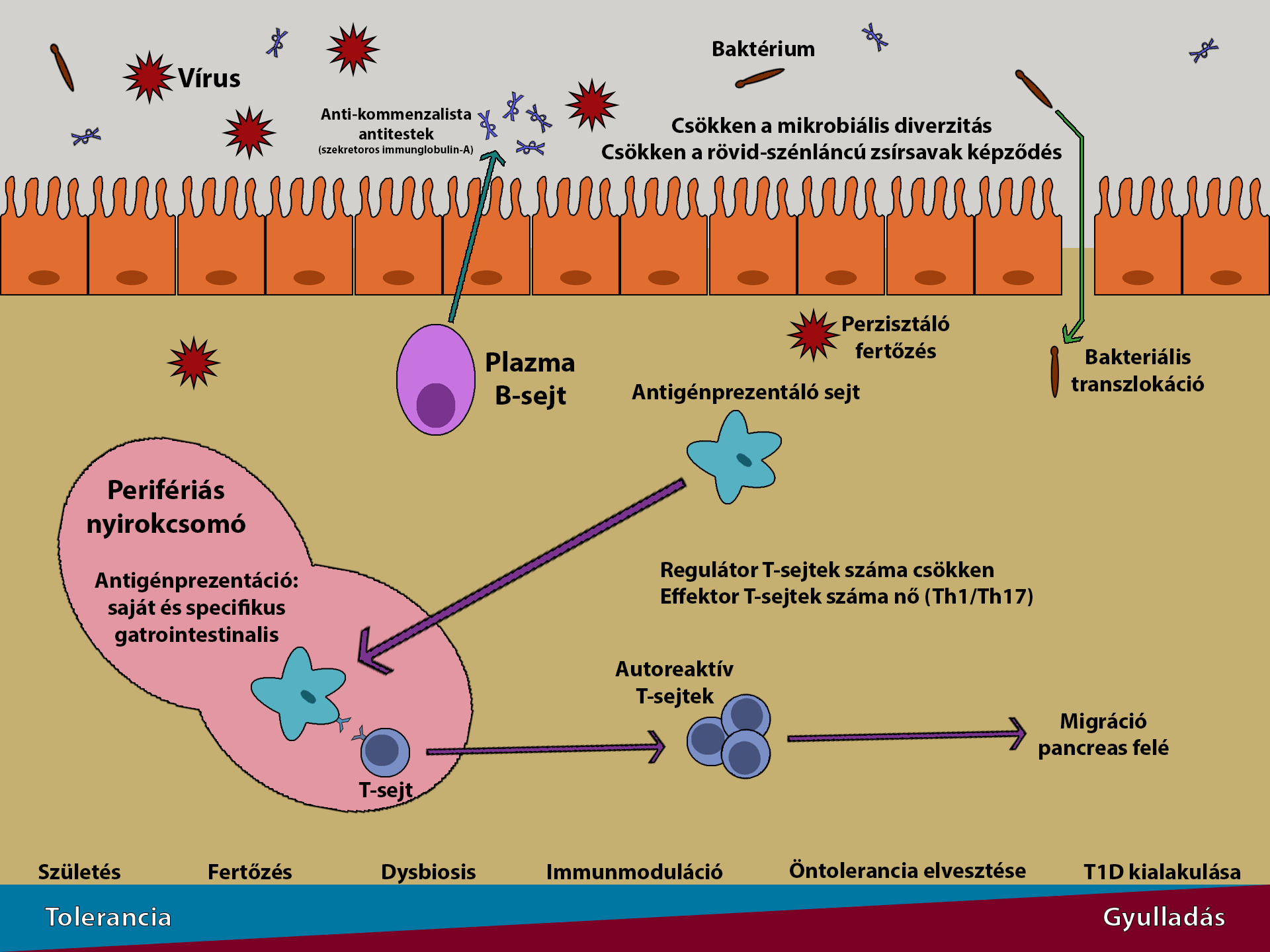
Az élet korai szakaszában fontos az emésztőrendszer kolonizációja, amely szerepet kap a szervezet immunrendszerének fejlődésében, szabályozásában és fenntartásában (Sommer and Bäckhed, 2013; Robertson et al., 2019). Csecsemőkort követően a kialakult mikrobiom hatással lesz a nyálkahártyabeli és szisztémás immunhomeosztázisra (Belkaid and Hand, 2014), a kor előre haladtával pedig veszít plaszticitási és toleranciabeli kvalitásaiból az új antigénekkel történő találkozás és környezeti zavaró hatásokkal szemben (Derrien et al., 2019; Robertson et al., 2019). A korai életben történnek meg azok az események, melyek az I.típusú cukorbetegség kialakulásához vezetnek. A serdülés előtt kialakult T1D esetében 3 éves korra már kialakulnak az autoantitestek (Parikka et al., 2012; Krischer et al., 2017), azonban ennek ellenére sok emberben csak felnőttkorban jelentkezik a cukorbetegség, tehát a kiváltó esemény és a betegség megjelenése között akár évtizedek is eltelhetnek (Thomas et al., 2018) (3. ábra).
|
3. ábra: A dysbiosis kialakulásának folyamata (Morse és Horwitz (2021.) ábrája alapján) |
A fertőzések az élet korai szakaszában súlyosabb kimenetelűek lehetnek az immunrendszer fejletlensége miatt (De Riva et al., 2017), így a vírusok képesek lehetnek a mikrobiom egyensúlyát megváltoztatni, mellyel elősegítik az I.típusú cukorbetegség kialakulását (Vujkovic-Cvijin et al., 2013; Inoue et al., 2018; Yildiz et al., 2018). A dysbiosis hatására megnövekszik az autoimmun hatásokkal rendelkező mikrobióták aránya, míg a kedvező baktériumok (pl.butiráttermelő) diverzitása és mennyisége is lecsökken.
Az I. típusú cukorbetegséggel és Langerhans-szigetsejt autoimmunitással rendelkező emberek esetében megfigyelték, hogy a bélben található mikrobiom diverzitása jelentősen csökken, a Bacteroides törzsbe tartozó baktériumok számában növekedés jön létre, míg a Firmicutes törzsbe tartozó baktériumok száma lecsökken, valamint a rövid szénláncú zsírsavak termelésében is csökkenő tendencia alakul ki (de Goffau et al., 2014; Mejía-León et al., 2015; Endesfelder et al., 2016; Knip and Siljander, 2016). A dysbiosist NOD egerekben vizsgálták, ahol a betegség kialakulását megelőzően nagy sikerrel meg lehetett jósolni a diabétesz kialakulását nyálkahártyából vett mikrobiom minták alapján (Kostic et al., 2015; Hu et al., 2018; Vatanen et al., 2018). Nőstény NOD egerek hajlamosabbak az autoimmun diabetes kialakulására, mint a hím egyedek, melyet részben a tesztoszteron mikrobiális hatása magyarázhat (csíramentes egerekben nem figyelhető meg az ivari különbség) (Markle et al., 2013).
NOD egereken végzett diabetogén mikrobiomból történő fekális mikrobiom transzfer az egészséges fiatal egerekben a β -sejtek aktiválására hatással lesz, és elősegíti az I.es típusú cukorbetegség kialakulását az élet későbbi fázisában (De Riva et al., 2017). A kísérletet felnőtt egereken (serdülőkor után) elvégezve nem történt hasonló változás, amely azt jelenti, hogy az élet egy bizonyos korai fázisában történő fertőzések nagy hatással lehetnek a későbbi egészségünkre. A fekális mikrobióta transzfer (FMT) azonban nem csak negatív hatással lehet, ugyanis egészséges egyedből történő mikrobiomátvitel (valamint diétás úton történő mikrobiom moduláció) hatására az I.típusú cukorbeteg emberek esetében létrejöhet javulás, illetve segíthet kialakulásának megelőzésében is, azonban ezek a módszerek még további kutatásokat igényelnek (de Groot et al., 2021).
Virális kiváltó faktorok
Ugyan a cukorbetegség már régóta az emberi történelem része, az esetszámok utóbbi időben tapasztalható, robbanásszerű növekedését nem magyarázzák csupán a környezeti illetve örökölt hatások (Nagafuchi and Toniolo, 2015). Egyre több kutatás talál bizonyítékot bizonyos vírusok szerepére (Coppieters et al., 2012; Jonietz, 2012; Taylor et al., 2013). Egyes kutatások szerint a Japánban előforduló, T1D-ben szenvedő emberek kb. 20%-nak, a gyors lefolyású diabeteses esetek kb 70%-nak van köze vírusokhoz (Taylor et al., 2013).
A vírusok indukálta diabetes komplex folyamat. A létrejövő β-sejt károsodásban szerepet játszhat a vírusok cytolytikus volta, a β-sejtek korai apoptózisának kiváltása és egyéb, a vírusok által kiváltott gyulladásos folyamatok (Nagafuchi és Toniolo 2015.). Problémát okozhat ezeken kívül a Langerhans szigetek vírusokkal szembeni alacsony ellenállóképessége (Jonietz, 2012), a β-sejtek alacsony regenerációs képessége (Fairweather and Rose, 2002), illetve a tény, hogy a β-sejtekkel szemben gyakoribbak az autoimmun reakciók mint az általában jellemző (Fairweather and Rose, 2002).
Mivel a vírusok elsősorban az 1-es típusú diabetes mellitus kialakulásával hozhatóak összefüggésbe, így a továbbiakban diabéteszként a cukorbetegség inzulindependens formájára utalunk.
Virális kiváltók egerekben
Encephalomyocarditis (EMC)
Az egerek Encephalomyocarditis vírusa (EMC) a Picornaviridae családba tartozó Cardiovirus genus tagja. Kisméretű, burokkal nem rendelkező, szimplaszálú RNS-vírusokról van szó. Az egyes törzsek különböző tüneteket okoznak: lázat, anorexiát, ataxiát, dyspneát, szívizomgyulladást, vetélést a vemhesség késői fázisában, illetve foetalis mumifikációt (Jack M., 2021).
EMC-D
Az Encephalomyocarditis vírus D törzse erősen diabetogenikusnak bizonyult egerekben. A betegség gyors lefolyású, az inzulinhiány már a fertőződést követő 4. nap környékén kialakul (Bae and Yoon, 1993), és mivel a B- és T-lymfocita hiányos egerekben nem növelte tovább a virális diabétesz hajlamát, valószínűnek tűnik, hogy a veleszületett immunrendszer felel a fertőzéssel szembeni védekezésért (Kounoue et al., 2008).
A kísérletek során eltéréseket találtak a különböző egértörzsek fogékonyságában: EMC-D fertőzés után kialakult diabétesz többek között DBA, SJL, SWR, NIH Swiss mice törzsekben, A/J és BALB/c egerek részben fogékonyak, C57BL/6, CBA, AKR, C3H/He törzsek pedig totálisan rezisztensek bizonyultak a fertőzés indukálta cukorbetegséggel szemben (Boucher and Notkins, 1973; Ross et al., 1976; Kang and Yoon, 1993). Amennyiben rezisztens egereket sub-diabetikus dózisú Streptozotocin (β-sejt toxin) kezelésnek vetettek alá, később az EMC-D diabéteszt okozott. Feltételezték, hogy egy recesszív, a Mendeli törvények szerint, autoszómálisan öröklődő gén felel az EMC-D fogékonyságért, mégpedig az immunrendszer egyes elemeinek illetve bizonyos sejtfelszíni receptorok hiánya okán (Onodera et al., 1978), azonban a 40 éve folyó vizsgálatok ellenére sem sikerült pontosan azonosítani. Újabban feltételezik, hogy a TYK2 gén (a veleszületett immunrendszer egy jelpályájának egyik fehérjéjét kódolja) is szerepet játszhat az EMC-D fertőzés által kiváltott diabétesz kialakulásában. SJL és SWR egértörzsek esetében kimutatták a TYK2 gén egy mutációját. Ez közvetetten, csökkent promóteraktivitáson keresztül, csökkent TYK2 expressziót okoz, ami pedig a β-sejtek csökkent immunválaszához vezet. Azonban más faktorok is közrejátszanak, ugyanis DBA/2 egerekben nem mutatható ki az említett TYK2 mutáció, mégis fogékonyak az EMC-D fertőzésre (Izumi et al., 2015). Valószínű, hogy a felsorolt genetikai hajlamokon kívül befolyásoló jelleggel bír még többek között az állat ivara, makrofágszáma illetve a citokinek és egyéb mediátormolekulák termelődése is (Boucher and Notkins, 1973; Ross et al., 1976; Onodera et al., 1978; Kang and Yoon, 1993; Jun et al., 1997; Jun and Yoon, 2001; Taylor et al., 2013).
Egyéb EMC törzsek
Egyelőre a D törzsön kívül nem jelentettek más diabetogenikus EMC törzset, részletesen az EMC-B-t vizsgálták. Az EMC-B és az EMC-D törzsek örökítőanyaga között mindössze 14 nukleotid eltérés található (Bae et al., 1989), és egyedül a virális polyprotein 776. pozíciójában található „GCC” kódú alanin kritikus a diabetogenitás szempontjából. Amennyiben a 3155. nukleotid „G” helyett „A”, úgy alanin helyett az „ACC” kódú tirozin épül be a láncba és az EMC törzs nem lesz diabetogenikus (Bae and Yoon, 1993). A hatás oka, hogy az alanin erősen kötődik a β-sejtekhez, míg más aminosavak nem. Diabetogenitás szempontjából az EMC törzsek sem vírusneutralizációs, sem pedig RIA próbával nem különíthetőek el (Bae et al., 1989).
Coxsackievírusok
A Coxsackie B vírusok jelenleg a Picornaviridae család Enterovirus nemzetségébe tartoznak, mind a hat variánst (Enterovirus B1-B6) egy fajba sorolják.
CV-B4
A Coxsackievírus B4 (CV-B4) több egértörzsben is kiválthat diabéteszt. Azokban a törzsekben, ahol jelen van a cukorbetegségre hajlamosító MHC allél, nem okozta a betegség lefolyásának gyorsulását, de azokban az állatokban, ahol megtalálható egy Langerhans-szigeti autoantigénre specifikus T-lymphocita receptort kifejező transzgén, a CV-B4 fertőzés gyorsan inzulinhiány kialakulásához vezetett (Tracy et al., 2002). Az eredmények alapján a CV-B4 elsősorban a pancreas helyi fertőzése és gyulladása által kiváltott szövetkárosodás, illetve az említett autoantigén termelődése által okoz diabéteszt.
Egy kísérletben toll like receptor-3 (TLR3) knockout non-obese diabetic (NOD) egereket hasonlítottak össze vad típussal. Az eredmények alapján a TL3 knockout NOD egerek védettnek bizonyultak a CV-B4 által indukált diabétesszel szemben, illetve a vírus asszociálta inzulinitis szignifikánsan kevésbé volt súlyos, mint a vad változatokban. Ezen eredmények alapján a TLR3 receptor kulcsfontosságú a CV-B4 által kiváltott diabétesz kialakulásában (Larsson et al., 2013).
A kutatások alapján egerekben a thymus epithelsejtjei is érintettek CV-B4 fertőzés esetén. A jelenség valószínűsíthetően ront a vírussal szembeni immunválasz hatékonyságán és erősíti a Langerhans-sziget-specifikus autoimmun jelenségeket. Az inzulinnal szembeni autoimmun reakciók kialakulását nagymértékben segítheti a β-sejtek csökkent inzulintermelése és a thymus fertőzött epithelsejtjei által termelt inzulinszerű GH-2 (growth hormone-2) (Larsson et al., 2013).
CV-B3
A Coxsackievírusok B3 (a CV-B5-höz hasonlóan) általában elhanyagolható mértékű β-sejt károsodást okoz, azonban ha az állatokat fiatal korban sub-diabetikus dózisú Streptozotocin (β-sejt toxin) kezelésnek vetjük alá, a CV-B3 és CV-B5 is diabéteszt okoz (Toniolo et al., 1982).
Amennyiben fiatal NOD egereket CV-B3-mal fertőznek, az szignifikánsan csökkenti a későbbi spontán cukorbetegség kialakulási esélyét, azonban ennek a pontos mechanizmusa egyelőre még ismeretlen számunkra (Tracy et al., 2011).
A vírusgenom 5’ végén természetes módon kialakuló deléciók csökkent replikációs képességhez és csökkent CPE-khez (citopathogen effect) vezetnek, így a vírus (a szívhez hasonlóan) képes perzisztens fertőzést kialakítani a pancreasban. Ezek az esetek nagyon hasonlítanak a humán T1D esetekre, így alkalmasak azok modellezésére (McCall et al., 2015).
A CV-B3 által okozott fertőzés vezethet a lymphoid szervek athrophiájához olyan egerekben, amelyeket születés után néhány nappal fertőztek meg. Ezekben az esetekben a leggyakoribb pathológiás elváltozás a thymus kérgi sejtjeinek számbeli csökkenése, a lép és a nyirokcsomók nem mutatnak jellegzetes változásokat. A Coxsackievírusok egyetlen más variánsa sem mutat lymphoid athrophiát (Bendinelli et al., 1982), a CV-B3 által indukált cukorbeteg egyedekre jellemző még a csökkent B- és T-lymphocita válasz (Michaux et al., 2015).
Virális kiváltók emberekben
Emberekben problémásak lehetnek a témában végzett kísérletek, hiszen nehezebben bizonyítható hogy tényleg vírus a diabétesz kiváltó oka (Nagafuchi és Toniolo 2015). Diabéteszes esetekhez köthetőek többek között: Coxackievírusok közül a CV-B1 (T1D, autoimmun diabétesz) (Notkins and Yoon, 1982; Laitinen et al., 2014), CV-B4 (T1D) (Frisk et al., 1992; Oikarinen et al., 2014), Cytomegalovírusok, Varicella-zoster vírus, Mumpsz, Rotavírus (autoimmun diabétesz), különböző, influenzaszerű tüneteket okozó enterovírusok: EBV, HHV6, influenza B (Imagawa and Hanafusa, 2011), Rubella vírus (Harris, 1899) és az örökölt Rubella vírus (Hay, 1953), utóbbinak lehet szerepe T2D kialakulásában is.
Újabb kutatások foglalkoznak az ismerten diabetogenikus vírusok azonosításával, kimutatásával. Bizonyos virális nukleinsavspecifikus probe-okat sikeresen teszteltek egerek pancreasán (Morgan and Richardson, 2014). Szintén bizakodásra adhatnak okot svéd kutatók által fejlesztett virális vakcinák (Richardson et al., 2011; Drescher et al., 2015).
Enterovírusok
A Picornaviridae család Enteroviridae genusába (EV) igen sok, különböző tünettel járó vírus tartozik, antigenitás szempontjából azonban közel azonosak, így diabetogenikus hatásuk is meglehetősen hasonló, ennek megfelelően a legtöbb kutatás együtt kezeli őket.
Enterovírusok által okozott fertőzések gyakoribbak fiúgyermekeknél, ez pedig genetikai hajlamot feltételezhet (Sadeharju et al. 2003.). Amennyiben az anya terhessége alatt Enterovírus által fertőződött, az megnöveli a β-sejt károsodás esélyét egy esetleges gyermekkori EV fertőzésnek (Sadeharju et al. 2003.).
Egyes, főemlősökön végzett kísérletek arra engednek következtetni, hogy a Coxsackie-B vírusok közé tartozó kórokozók nem csak rágcsálókban (lsd. „Virális kiváltók egerekben”), hanem főemlősökben és akár emberekben is befolyásolhatják a glükózháztartást (Horwitz et al., 1998).
A legtöbb Enterovírus által okozott fertőzés esetén azok β-sejt károsító hatása már évekkel a T1D kialakulása előtt kimutatható (Oikarinen et al., 2012). A különböző Enterovírusok antigénjei kimutathatóak közvetlenül a pancreasból (Taylor et al., 2013; Richardson et al., 2014) és a bélhámból is (Mercalli et al., 2012), közvetlenül a fertőzés kialakulása után, illetve hosszútávon is (Yoon et al., 1979; Diaz-Horta et al., 2012). Ezek után kijelenthető, hogy a diabetogenikus változat perzisztáló fertőzést okoz. Ebben az esetben a tünetek különböznek mind a lassú, mind a gyors lefolyású változattól, és általánosságban jellemzőek rájuk a csökkent citopathogén hatások. A perzisztens fertőzés kialakulását nehezíti, hogy az EV-k általában cytolitikusak, a kórkép összefügghet post-polio szindrómával, myasthenia gravis-szel, krónikus myocarditis-szel, egyes típusú cukorbetegséggel vagy akár autoimmun thyroiditis-szel (Cavalcante et al., 2010; Hammerstad et al., 2013; Zhang et al., 2013; Kuehl et al., 2015; Tracy et al., 2015). Sejtek tekintetében az Enterovírusok perzisztens fertőzést okozó típusai általában motoneuronokat, astrocytákat, β-sejteket, cardiomyocitákat, endothel sejteket, thymus sejteket, pajzsmirigy sejteket, macrophagokat és dendritikus sejteket preferálják (Krogvold et al., 2015; Schulte et al., 2015). Amennyiben sejttenyészeteket fertőzünk a perzisztáló típussal, a sejteknek csak kis része expresszál antigéneket, a vírustiter pedig alacsony (<103 PFU/ml). A fertőzött sejtek cytokineket termelnek, a vírus pedig terjedhet cytolízissel, microvesiculákkal, sejtnyúlványokkal vagy plazmahidakkal is (Andréoletti et al., 2009).
A Diabetes Virus Detection Study-t (DiViD) 2009-ben indította útjára az Oslo Diabetes Research Centre, melynek keretei között pancreas biopsiákat végeznek és értékelnek ki. A kutatás egyik fázisa során a biopsziás mintákat 3-9 héttel az egyes típusú cukorbetegség diagnosztizálása után vették a vizsgált 23-35 éves norvég páciensektől. Enterovírusok kapszid proteinjeit (VP1) mutatták ki immunhisztokémiai módszerekkel, PCR-rel és szekvenálással. A keresett fehérjét mind a 6 diabéteszes pánciensben kimutatták, a 9 fős kontrollcsoportban két fő adott pozitív eredményt. Enterovírus specifikus RNS-t 6-ból 4 betegben mutattak ki, a kontrollcsoportban nem volt pozitív eredmény. A vizsgálat eredményei alapján feltételezhető hogy a β-sejtek, gastrointestinalis epithelsejtek, illetve a lép és a nyirokcsomók lymphoid epithel sejtjeinek kisfokú Enterovírusos fertőzése kiválthatja az egyes típusú cukorbetegséget emberekben (Pugliese et al., 2014).
Emberekben az egyes típusú diabétesz és az Enterovírus-fertőzések előfordulása fordítottan arányos, ez adott alapot az úgynevezett „higiéniás hipotézis” felállításához. Ennek alapvetése, hogy a maternális antitestek hiánya növeli az egyes típusú cukorbetegség kialakulásának esélyét. A hipotézist kísérletesen igazolták Socs1-transgeneric NOD egerekben: a CVB-vel fertőzött (és ellenanyagokat termelő) anya utódja immunis lett a kórokozó ellen, míg a nem fertőzött anya utódja nem (Matteucci et al., 1985).
Hepatitis A
A Hepatitis A vírus (HAV) szerepét is kutatják mint lehetséges kiváltó faktort. Lin és munkatárasai (2021.) kutatásában 20 évnél idősebb cukorbeteg felnőtteket vizsgáltak. Az alanyok 21,21%-a volt vakcinázott HAV ellen (az egyének által biztosított vakcinázási adatok alapján) és a teljes csoport 46,25%-nak volt anti-HAV ellenanyaga. A kísérleti eredmények elemzése után levont következtetések szerint sem a Hepatitis A fertőzés, sem az ellene kapott vakcina nincs hatással a diabétesz kialakulására, azonban a cukorbeteg pácienseknél nagyobb az esély a HAV fertőzés kialakulására, így érdemes felvenniük a védőoltást.
A virális kiváltókra való fogékonyság genetikai háttere
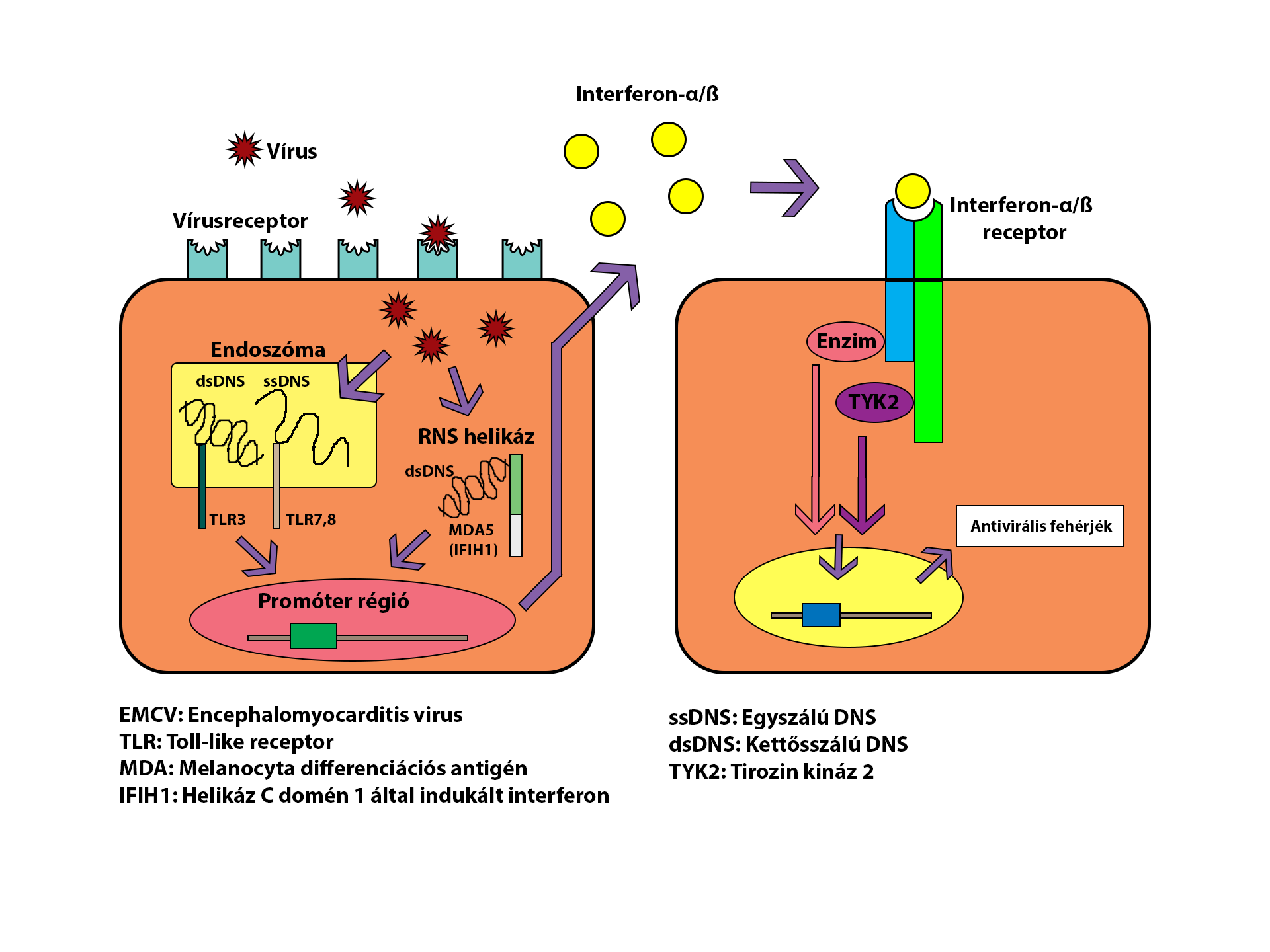
Közel sem reagál minden egyén ugyan úgy a különböző fertőzésekre, ennek oka az eltérő genetikai háttérben keresendő. Vírusfertőzések esetén általában a kórokozók sejtbejutási lehetőségeit érdemes vizsgálni, ugyanis az egyes receptorok, jelátviteli útvonalak különbözhetnek az egyes emberekben (4. ábra).
|
4. ábra: A génmutációk szerepe a diabetogén vírusfertőzések kialakulásában (Nagafuchi és Toniolo (2015.) ábrája alapján) |
TYK2 gén polymorfizmusa
Humán esetekben az egyik leginkább kutatott lehetőség az emberi 19. kromoszóma 13-as lokációján található, nagy valószínűséggel az egyes típusú cukorbetegségre való fogékonyságot örökítő régió. Többek között itt található a tirozin-kináz 2 (TYK2) gén is (pontos helye: 19p13.2). A TYK2 gént az utóbbi időben végzett, nagy pontosságú géntérképező vizsgálatok (Tabrah, 2011) „candidate gene”-ként jelölték, tekintve hogy nagy valószínűséggel fontos szerepet játszik a diabéteszhajlam örökítésében. Egyes, természetesen előforduló TYK2 génmutációk voltak felelősek Izumi és munkatársai (2015) kísérletében az EMC-D vírus által kiváltott egyes típusú cukorbetegség kialakulásáért. Az egyik ilyen természetesen is előforduló mutáció a TYK2 gén promóter régióját és exonjait érinti, ezáltal a promóteraktivitás csökken, ami pedig mind az egyes és a kettes típusú cukorbetegség kialakulásának kockázatát növeli (Nagafuchi et al., 2015). A mutáció gyakori azokban a páciensekben, akik a diabétesz kialakulásának ideje környékén influenzaszerű tüneteket észleltek, vagy hiányzik az anti-glutaminsav-dekarboxiláz autoantitestjük (Nagafuchi et al., 2015). Kísérletesen igazolták, hogy a 26 alatti BMI-vel rendelkező (nem elhízott) kettes típusú cukorbeteg páciensek esetén szignifikánsan magasabb volt a promóter régió mutációjának aránya, mint az elhízott egyének esetében, így feltételezhető hogy az elhízás nem játszik szerepet a TYK2 génmutált páciensek kettes típusú cukorbetegségre való fogékonyságában.
IFIH1 gén polimorfizmusa
Egy másik lehetséges felelős a vírusok okozta cukorbetegségre való fogékonyság terén az IFIH1 gén. Ez a gén egy intercelluláris patogénfelismerő receptort kódol, a receptor Picornavírusok, köztük az Enterovírusok felismeréséért felel, így komoly szerepet játszhat abban, hogy a vírus bejut-e a sejtbe és így képes-e betegséget okozni, vagy sem (Mein et al., 1998; Nejentsev et al., 2009; Alidjinou and Hober, 2015).
Összefoglalás
Összességében kijelenthetjük, hogy a mind az egyes, mind a kettes típusú cukorbetegség egyre nagyobb jelentőséggel bír a humán orvoslás terén, így teljességgel indokolt a témában folyó nagyszámú kutatás. Mindkét típusú cukorbetegség esetén sokféle hajlamosító tényezőt tártak fel eddig, jelentős faktorként azonosítva a virális kiváltókat. A vírusok elsősorban a cukorbetegség inzulindependens formájának indukálásáért felelősek, azonban az, hogy egy-egy vírustörzs ténylegesen okoz-e az adott egyénben diabéteszt egyelőre nem jósolható meg teljes biztonsággal. Az egyes kutatások befolyásoló tényezőként említik többek között az anyai fertőződés esetleges meglétét, az illető nemét, illetve bizonyos génmutációkat is. Az elmúlt közel negyven év rengeteg kutatási eredménye ellenére nem történt eddig komoly áttörés a területen.
Hivatkozások
1. Alidjinou EK, Hober D (2015) Enteroviruses and Type 1 Diabetes: Candidate Genes Linked With Innate Immune Response. EBioMedicine 2:636–637.
2. Andréoletti L, Lévêque N, Boulagnon C, Brasselet C, Fornes P (2009) Viral causes of human myocarditis. Archives of Cardiovascular Diseases 102:559–568.
3. Bae Y-S, Eun H-M, Yoon J-W (1989) Molecular Identification of Diabetogenic Viral Gene. Diabetes 38:316–320.
4. Bae Y-S, Yoon J-W (1993) Determination of Diabetogenicity Attributable to a Single Amino Acid, Ala776, on the Polyprotein of Encephalomyocarditis Virus. Diabetes 42:435–443.
5. Belkaid Y, Hand TW (2014) Role of the Microbiota in Immunity and Inflammation. Cell 157:121–141.
6. Bendinelli M, Matteucci D, Toniolo A, Patanè AM, Pistillo MP (1982) Impairment of Immunocompetent Mouse Spleen Cell Functions by Infection with Coxsackievirus B3. The Journal of Infectious Diseases 146:797–805.
7. Boucher DW, Notkins AL (1973) VIRUS-INDUCED DIABETES MELLITUS. Journal of Experimental Medicine 137:1226–1239.
8. Brodin P, Jojic V, Gao T, Bhattacharya S, Angel CJL, Furman D, Shen-Orr S, Dekker CL, Swan GE, Butte AJ, Maecker HT, Davis MM (2015) Variation in the Human Immune System Is Largely Driven by Non-Heritable Influences. Cell 160:37–47.
9. Cavalcante P, Barberis M, Cannone M, Baggi F, Antozzi C, Maggi L, Cornelio F, Barbi M, Dido P, Berrih-Aknin S, Mantegazza R, Bernasconi P (2010) Detection of poliovirus-infected macrophages in thymus of patients with myasthenia gravis. Neurology 74:1118–1126.
10. Coppieters KT, Boettler T, von Herrath M (2012) Virus Infections in Type 1 Diabetes. Cold Spring Harbor Perspectives in Medicine 2:a007682–a007682.
11. de Goffau MC, Fuentes S, van den Bogert B, Honkanen H, de Vos WM, Welling GW, Hyöty H, Harmsen HJM (2014) Aberrant gut microbiota composition at the onset of type 1 diabetes in young children. Diabetologia 57:1569–1577.
12. de Groot P et al. (2021) Faecal microbiota transplantation halts progression of human new-onset type 1 diabetes in a randomised controlled trial. Gut 70:92–105.
13. De Riva A, Wållberg M, Ronchi F, Coulson R, Sage A, Thorne L, Goodfellow I, McCoy KD, Azuma M, Cooke A, Busch R (2017) Regulation of type 1 diabetes development and B-cell activation in nonobese diabetic mice by early life exposure to a diabetogenic environment Fiorina P, ed. PLoS ONE 12:e0181964.
14. Derrien M, Alvarez A-S, de Vos WM (2019) The Gut Microbiota in the First Decade of Life. Trends in Microbiology 27:997–1010.
15. Diaz-Horta O, Baj A, Maccari G, Salvatoni A, Toniolo A (2012) Enteroviruses and causality of type 1 diabetes: how close are we? Pediatric Diabetes 13:92–99.
16. Drescher KM, von Herrath M, Tracy S (2015) Enteroviruses, hygiene and type 1 diabetes: toward a preventive vaccine: Enterovirus vaccine for diabetes. Rev Med Virol 25:19–32.
17. Endesfelder D, Engel M, Davis-Richardson AG, Ardissone AN, Achenbach P, Hummel S, Winkler C, Atkinson M, Schatz D, Triplett E, Ziegler A-G, zu Castell W (2016) Towards a functional hypothesis relating anti-islet cell autoimmunity to the dietary impact on microbial communities and butyrate production. Microbiome 4:17.
18. Esposito S, Toni G, Tascini G, Santi E, Berioli MG, Principi N (2019) Environmental Factors Associated With Type 1 Diabetes. Front Endocrinol 10:592.
19. Fairweather D, Rose NR (2002) Type 1 diabetes: virus infection or autoimmune disease? Nat Immunol 3:338–340.
20. Frisk G, Friman G, Tuvemo T, Fohlman J, Diderholm H (1992) Coxsackie B virus IgM in children at onset of Type 1 (insulin-dependent) diabetes mellitus: evidence for IgM induction by a recent or current infection. Diabetologia 35:249–253.
21. Hammerstad SS, Tauriainen S, Hyöty H, Paulsen T, Norheim I, Dahl-Jørgensen K (2013) Detection of enterovirus in the thyroid tissue of patients with graves’ disease. J Med Virol 85:512–518.
22. Harris HF (1899) A Case of Diabetes Mellitus Quickly Following Mumps: On the Pathological Alterations of the Salivary Glands, Closely Resembling Those Found in the Pancreas, in a Case of Diabetes Mellitus. The Boston Medical and Surgical Journal 140:465–469.
23. Hay DR (1953) Maternal rubella and congenital deafness in New Zealand. N Z Med J 52:16–19.
24. Horwitz MS, Bradley LM, Harbertson J, Krahl T, Lee J, Sarvennick N (1998) Diabetes induced by Coxsackie virus: Initiation by bystander damage and not molecular mimicry. Nat Med 4:781–785.
25. Hu Y, Peng J, Li F, Wong FS, Wen L (2018) Evaluation of different mucosal microbiota leads to gut microbiota-based prediction of type 1 diabetes in NOD mice. Sci Rep 8:15451.
26. Imagawa A, Hanafusa T (2011) Fulminant type 1 diabetes-an important subtype in East Asia. Diabetes Metab Res Rev 27:959–964.
27. Inoue T, Nakayama J, Moriya K, Kawaratani H, Momoda R, Ito K, Iio E, Nojiri S, Fujiwara K, Yoneda M, Yoshiji H, Tanaka Y (2018) Gut Dysbiosis Associated With Hepatitis C Virus Infection. Clinical Infectious Diseases 67:869–877.
28. Izumi K et al. (2015) Reduced Tyk2 gene expression in β-cells due to natural mutation determines susceptibility to virus-induced diabetes. Nat Commun 6:6748.
29. Jack M. G (2021) Encephalomyocarditis Virus Infection in Animals - Generalized Conditions. MSD Veterinary Manual Available at: https://www.msdvetmanual.com/generalized-conditions/encephalomyocarditis-virus-infection/encephalomyocarditis-virus-infection-in-animals [Accessed May 3, 2022].
30. Jonietz E (2012) Pathology: Cause and effect. Nature 485:S10–S11.
31. Jun HS, Kang Y, Notkins AL, Yoon JW (1997) Gain or loss of diabetogenicity resulting from a single point mutation in recombinant encephalomyocarditis virus. J Virol 71:9782–9785.
32. Jun HS, Yoon JW (2001) The role of viruses in Type I diabetes: two distinct cellular and molecular pathogenic mechanisms of virus-induced diabetes in animals. Diabetologia 44:271–285.
33. Kang Y, Yoon J-W (1993) A genetically determined host factor controlling susceptibility to encephalomyocarditis virus-induced diabetes in mice. Journal of General Virology 74:1207–1213.
34. Knip M, Siljander H (2016) The role of the intestinal microbiota in type 1 diabetes mellitus. Nat Rev Endocrinol 12:154–167.
35. Kostic AD et al. (2015) The Dynamics of the Human Infant Gut Microbiome in Development and in Progression toward Type 1 Diabetes. Cell Host & Microbe 17:260–273.
36. Kounoue E, Izumi K, Ogawa S, Kondo S, Katsuta H, Akashi T, Niho Y, Harada M, Tamiya S, Kurisaki H, Nagafuchi S (2008) The significance of T cells, B cells, antibodies and macrophages against encephalomyocarditis (EMC)-D virus-induced diabetes in mice. Arch Virol 153:1223–1231.
37. Krischer JP, Lynch KF, Lernmark Å, Hagopian WA, Rewers MJ, She J-X, Toppari J, Ziegler A-G, Akolkar B, the TEDDY Study Group (2017) Genetic and Environmental Interactions Modify the Risk of Diabetes-Related Autoimmunity by 6 Years of Age: The TEDDY Study. Diabetes Care 40:1194–1202.
38. Krogvold L, Skog O, Sundström G, Edwin B, Buanes T, Hanssen KF, Ludvigsson J, Grabherr M, Korsgren O, Dahl-Jørgensen K (2015) Function of Isolated Pancreatic Islets From Patients at Onset of Type 1 Diabetes: Insulin Secretion Can Be Restored After Some Days in a Nondiabetogenic Environment In Vitro. Diabetes 64:2506–2512.
39. Kuehl U, Lassner D, Gast M, Stroux A, Rohde M, Siegismund C, Wang X, Escher F, Gross M, Skurk C, Tschoepe C, Loebel M, Scheibenbogen C, Schultheiss H-P, Poller W (2015) Differential Cardiac MicroRNA Expression Predicts the Clinical Course in Human Enterovirus Cardiomyopathy. Circ: Heart Failure 8:605–618.
40. Laitinen OH, Honkanen H, Pakkanen O, Oikarinen S, Hankaniemi MM, Huhtala H, Ruokoranta T, Lecouturier V, André P, Harju R, Virtanen SM, Lehtonen J, Almond JW, Simell T, Simell O, Ilonen J, Veijola R, Knip M, Hyöty H (2014) Coxsackievirus B1 Is Associated With Induction of β-Cell Autoimmunity That Portends Type 1 Diabetes. Diabetes 63:446–455.
41. Larsson PG, Lakshmikanth T, Svedin E, King C, Flodström-Tullberg M (2013) Previous maternal infection protects offspring from enterovirus infection and prevents experimental diabetes development in mice. Diabetologia 56:867–874.
42. Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E (2017) Dysbiosis and the immune system. Nat Rev Immunol 17:219–232.
43. Markle JGM, Frank DN, Mortin-Toth S, Robertson CE, Feazel LM, Rolle-Kampczyk U, von Bergen M, McCoy KD, Macpherson AJ, Danska JS (2013) Sex Differences in the Gut Microbiome Drive Hormone-Dependent Regulation of Autoimmunity. Science 339:1084–1088.
44. Matteucci D, Toniolo A, Conaldi PG, Basolo F, Gori Z, Bendinelli M (1985) Systemic Lymphoid Atrophy in Coxsackievirus B3-Infected Mice: Effects of Virus and Immunopotentiating Agents. Journal of Infectious Diseases 151:1100–1108.
45. McCall KD, Thuma JR, Courreges MC, Benencia F, James CBL, Malgor R, Kantake N, Mudd W, Denlinger N, Nolan B, Wen L, Schwartz FL (2015) Toll-Like Receptor 3 Is Critical for Coxsackievirus B4-Induced Type 1 Diabetes in Female NOD Mice. Endocrinology 156:453–461.
46. McDermott MT (2020) Endocrine secrets. Available at: https://www.clinicalkey.com.au/dura/browse/bookChapter/3-s2.0-C20170006493 [Accessed May 4, 2022].
47. Mein CharlesA, Esposito L, Dunn MG, Johnson GCL, Timms AE, Goy JV, Smith AN, Sebag-Montefiore L, Merriman ME, Wilson AJ, Pritchard LE, Cucca F, Barnett AH, Bain SC, Todd JA (1998) A search for type 1 diabetes susceptibility genes in families from the United Kingdom. Nat Genet 19:297–300.
48. Mejía-León ME, Petrosino JF, Ajami NJ, Domínguez-Bello MG, de la Barca AMC (2015) Fecal microbiota imbalance in Mexican children with type 1 diabetes. Sci Rep 4:3814.
49. Mercalli A, Lampasona V, Klingel K, Albarello L, Lombardoni C, Ekström J, Sordi V, Bolla A, Mariani A, Bzhalava D, Dillner J, Roivainen M, Bosi E, Piemonti L (2012) No evidence of enteroviruses in the intestine of patients with type 1 diabetes. Diabetologia 55:2479–2488.
50. Michaux H, Martens H, Jaïdane H, Halouani A, Hober D, Geenen V (2015) How Does Thymus Infection by Coxsackievirus Contribute to the Pathogenesis of Type 1 Diabetes? Front Immunol 6:338.
51. Morgan NG, Richardson SJ (2014) Enteroviruses as causative agents in type 1 diabetes: loose ends or lost cause? Trends in Endocrinology & Metabolism 25:611–619.
52. Morse ZJ, Horwitz MS (2021) Virus Infection Is an Instigator of Intestinal Dysbiosis Leading to Type 1 Diabetes. Front Immunol 12:751337.
53. Nagafuchi S et al. (2015) TYK2 Promoter Variant and Diabetes Mellitus in the Japanese. EBioMedicine 2:744–749.
54. Nagafuchi S, Toniolo A (2015) VIRAL DIABETES: VIRUS DIABETOGENICITY AND HOST SUSCEPTIBILITY. Immunoendocrinology Available at: http://www.smartscitech.com/index.php/ie/article/view/1026 [Accessed May 3, 2022].
55. Nejentsev S, Walker N, Riches D, Egholm M, Todd JA (2009) Rare Variants of IFIH1 , a Gene Implicated in Antiviral Responses, Protect Against Type 1 Diabetes. Science 324:387–389.
56. Notkins AL, Yoon J-W (1982) Virus-Induced Diabetes in Mice Prevented by a Live Attenuated Vaccine. N Engl J Med 306:486–486.
57. Oikarinen M, Tauriainen S, Oikarinen S, Honkanen T, Collin P, Rantala I, Mäki M, Kaukinen K, Hyöty H (2012) Type 1 Diabetes Is Associated With Enterovirus Infection in Gut Mucosa. Diabetes 61:687–691.
58. Oikarinen S et al. (2014) Virus Antibody Survey in Different European Populations Indicates Risk Association Between Coxsackievirus B1 and Type 1 Diabetes. Diabetes 63:655–662.
59. Onodera T, Yoon J-W, Brown KS, Notkins AL (1978) Evidence for a single locus controlling susceptibility to virus-induced diabetes mellitus. Nature 274:693–696.
60. Parikka V, Näntö-Salonen K, Saarinen M, Simell T, Ilonen J, Hyöty H, Veijola R, Knip M, Simell O (2012) Early seroconversion and rapidly increasing autoantibody concentrations predict prepubertal manifestation of type 1 diabetes in children at genetic risk. Diabetologia 55:1926–1936.
61. Pociot F, Bergholdt R (2006) Type 1 and 2 Diabetes. In: Cytokine Gene Polymorphisms in Multifactorial Conditions (Vandenbroeck K, ed), pp 305–319. CRC Press. Available at: http://www.crcnetbase.com/doi/10.1201/9781420005325.ch21 [Accessed May 4, 2022].
62. Pugliese A, Yang M, Kusmarteva I, Heiple T, Vendrame F, Wasserfall C, Rowe P, Moraski JM, Ball S, Jebson L, Schatz DA, Gianani R, Burke GW, Nierras C, Staeva T, Kaddis JS, Campbell‐Thompson M, Atkinson MA (2014) The Juvenile Diabetes Research Foundation Network for Pancreatic Organ Donors with Diabetes ( nPOD ) Program: goals, operational model and emerging findings. Pediatr Diabetes 15:1–9.
63. Que Y, Cao M, He J, Zhang Q, Chen Q, Yan C, Lin A, Yang L, Wu Z, Zhu D, Chen F, Chen Z, Xiao C, Hou K, Zhang B (2021) Gut Bacterial Characteristics of Patients With Type 2 Diabetes Mellitus and the Application Potential. Front Immunol 12:722206.
64. Rewers M, Ludvigsson J (2016) Environmental risk factors for type 1 diabetes. The Lancet 387:2340–2348.
65. Richardson SJ, Morgan NG, Foulis AK (2014) Pancreatic Pathology in Type 1 Diabetes Mellitus. Endocr Pathol 25:80–92.
66. Richardson SJ, Willcox A, Bone AJ, Morgan NG, Foulis AK (2011) Immunopathology of the human pancreas in type-I diabetes. Semin Immunopathol 33:9–21.
67. Robertson RC, Manges AR, Finlay BB, Prendergast AJ (2019) The Human Microbiome and Child Growth – First 1000 Days and Beyond. Trends in Microbiology 27:131–147.
68. Ross ME, Onodera T, Brown KS, Notkins AL (1976) Virus-induced Diabetes Mellitus: IV. Genetic and Environmental Factors Influencing the Development of Diabetes After Infection with the M Variant of Encephalomyocarditis Virus. Diabetes 25:190–197.
69. Schulte BM, Gielen PR, Kers-Rebel ED, Schreibelt G, van Kuppeveld FJM, Adema GJ (2015) Enterovirus-Infected β-Cells Induce Distinct Response Patterns in BDCA1+ and BDCA3+ Human Dendritic Cells Appel S, ed. PLoS ONE 10:e0121670.
70. Sommer F, Bäckhed F (2013) The gut microbiota — masters of host development and physiology. Nat Rev Microbiol 11:227–238.
71. Syed FZ (2022) Type 1 Diabetes Mellitus. Ann Intern Med 175:ITC33–ITC48.
72. Tabrah FL (2011) Koch’s postulates, carnivorous cows, and tuberculosis today. Hawaii Med J 70:144–148.
73. Taylor KW, Hyöty H, Toniolo A, Zuckerman AJ eds. (2013) Diabetes and viruses. New York: Springer.
74. Thomas NJ, Jones SE, Weedon MN, Shields BM, Oram RA, Hattersley AT (2018) Frequency and phenotype of type 1 diabetes in the first six decades of life: a cross-sectional, genetically stratified survival analysis from UK Biobank. The Lancet Diabetes & Endocrinology 6:122–129.
75. Toniolo A, Onodera T, Jordan G, Yoon JW, Notkins AL (1982) Virus-induced diabetes mellitus. Glucose abnormalities produced in mice by the six members of the Coxsackie B virus group. Diabetes 31:496–499.
76. Tracy S, Drescher KM, Chapman NM (2011) Enteroviruses and type 1 diabetes. Diabetes Metab Res Rev 27:820–823.
77. Tracy S, Drescher KM, Chapman NM, Kim K-S, Carson SD, Pirruccello S, Lane PH, Romero JR, Leser JS (2002) Toward Testing the Hypothesis that Group B Coxsackieviruses (CVB) Trigger Insulin-Dependent Diabetes: Inoculating Nonobese Diabetic Mice with CVB Markedly Lowers Diabetes Incidence. J Virol 76:12097–12111.
78. Tracy S, Smithee S, Alhazmi A, Chapman N (2015) Coxsackievirus can persist in murine pancreas by deletion of 5′ terminal genomic sequences: Coxsackievirus Persistence in the Pancreas. J Med Virol 87:240–247.
79. Vatanen T et al. (2018) The human gut microbiome in early-onset type 1 diabetes from the TEDDY study. Nature 562:589–594.
80. Vujkovic-Cvijin I, Dunham RM, Iwai S, Maher MC, Albright RG, Broadhurst MJ, Hernandez RD, Lederman MM, Huang Y, Somsouk M, Deeks SG, Hunt PW, Lynch SV, McCune JM (2013) Dysbiosis of the Gut Microbiota Is Associated with HIV Disease Progression and Tryptophan Catabolism. Sci Transl Med 5 Available at: https://www.science.org/doi/10.1126/scitranslmed.3006438 [Accessed May 4, 2022].
81. Yildiz S, Mazel-Sanchez B, Kandasamy M, Manicassamy B, Schmolke M (2018) Influenza A virus infection impacts systemic microbiota dynamics and causes quantitative enteric dysbiosis. Microbiome 6:9.
82. Yoon J-W, Austin M, Onodera T, Notkins AL (1979) Virus-Induced Diabetes Mellitus: Isolation of a Virus from the Pancreas of a Child with Diabetic Ketoacidosis. N Engl J Med 300:1173–1179.
83. Zhang X, Zheng Z, Shu B, Liu X, Zhang Z, Liu Y, Bai B, Hu Q, Mao P, Wang H (2013) Human Astrocytic Cells Support Persistent Coxsackievirus B3 Infection. J Virol 87:12407–12421.