Endokrin diszruptorok az autizmus hátterében
A világ népességének egyre növekvő hányadát érinti az ASD (Autism Spectrum Disorder), azaz autizmus, amely az idegrendszert befolyásoló fejlődési rendellenesség. A betegség oka még ma sem teljesen tisztázott. Az egyik lehetséges magyarázat a környezetben megtalálható ED-k, vagyis endokrin diszruptorok károsító hatásai. Ezek az anyagok ugyanis a hormonális rendszerbe avatkoznak be, ezzel károsítva a test természetes folyamatait, működését.
Érzékenység a magzati fejlődés során
Az endokrin diszruptorok hatása már a terhesség alatt, a növekedés során is megfigyelhető, melynek bizonyítására számos kutatás indult, a fejlődésre gyakorolt befolyásukat illetően. A magzat szempontjából lényeges ezen kritikus időszak alatti kontamináció megléte vagy hiánya az említett anyagokkal (Gore és mtsai, 2014).
Itt fontos azt is kiemelni, hogy a fejlődő szervezet sokkal inkább ki vannak téve a diszruptorok behatásainak mint a felnőtteké, hiszen ebben az időszakban az anyagok egy része könnyen keresztüljut a placentán, majd a gyermek vérkeringésébe bekerülve a fejletlen agy-ér gátnak köszönhetően képesek befolyásolni a normál idegrendszer növekedését, kiterjedését és a mielinizáció folyamatát is (Adinolfi, 1985; Marí-Bauset és mtsai, 2018).
Továbbá a növekedés ezen időszakában még számos citokróm P450 enzim szintje alacsony, amik a környezetből bekerülő kemikáliák, gyógyszerek metabolizmusában vesznek részt (Hakkola és mtsai, 1998).
Genetikai háttér
2011-ben Hallmayer és csapata megállapították, hogy az autizmus kialakulásának oka mindössze 38%-ban genetikai eredetű. A magzati élet során a káros gén-környezet hatások bizonyítottan befolyásolják az agy későbbi gén expresszióját. Ezek a változások epigenetikusak, vagyis a DNS szekvenciájának megváltozása nélkül hatnak a génszabályozásra.
Epigenetikus Háttér
Az endokrin diszruptorok nem csak az adott anyagoknak kitett egyénekre fejthetnek ki hatást, hanem epigenetikus hatásaik révén öröklődő változásokat okozhatnak. Ide tartozik például a DNS metilezése (a DNS metiltranszferázok végzik), a hisztonok módosításai, a kromatin átalakításai. Ezek a hatások módosítják a DNS hozzáférhetőségét a transzkripciós faktorok számára (aktivátor, represszor), melynek eredményeként a gének expressziója megváltozik, és ez a fenotípusban is megjelenhet. A mikro RNS transzkripcióját is módosíthatják, amelyek pedig más génekről átírt mRNS-ekről akadályozzák meg a transzlációt. (Allis és mtsai., 2006; Kaminsky és munkatársai, 2006).
Egy vizsgálatban, ahol egereket használtak, a Biszfenol-A expozíciója a terhesség alatt egészen az F3 generációig negatívan befolyásolta a szociális viselkedést. (Wolstenholme és mtsai., 2013). A magatartásban tapasztalható eltérésekért a fejlődő agyban indukált génkifejeződésbeli változások lehetnek felelősek. A BPA környezeti szempontból releváns alacsony dózisai ivarspecifikus, dózisfüggő és agyi régió-specifikus expressziós változásokat indítottak el azokban a génekben, amelyek az ösztrogén receptorokat, valamint a DNS- metiltranszferázokat kódolják. Ez utóbbi enzim közvetlenül felelős az epigenetikus módosításokért (azaz a DNS metilezéséért) (Kundakovic és mtsai., 2013).
Endokrin diszruptorok
Általános leírás
Közel 800 kemikália ismert, mely befolyásolja az endokrin rendszer működését. Ezeknek a vegyi anyagoknak csupán kis részét vizsgálták meg, ma már az egészség potenciális veszélyének tekintik (Birnbaum, 2013). Ezen kemikáliák egy része képes az endokrin hormonok működését utánozva, azok hatását akadályozni. A környezetben számos helyen érintkezhetünk a károsító anyagokkal. Ugyanis ezek jelentős része olyan anyagokba épülve találhatók melyekkel napi szinten érintkezünk. Többek között például az élelmiszerben, tüzelőanyagokban, kozmetikumokban, de még a levegőben is nagy mennyiségben jelen vannak. Ide tartoznak a biszfenol-A (BPA) és szerkezeti analógjai (például BFS, BPF), ftalátok, brómozott égésgátlók, perfluorát vegyületek, aromás policiklusos szénhidrogének, diklór-difenil triklór-etán (DDT), poliklórozott bifenilek (PCB) és egyes nehézfémek is (De Cock és mtsai, 2012).
Endokrin diszruptor |
Leírás |
Hatás |
Biszfenol-A |
Műanyagok, epoxi gyanta |
Ösztrogén hatás |
Ftalátok |
Műanyag lágyítók, oldószerek kozmetikumokban, műanyag csomagolóanyagok, festékek |
Férfi reproduktív szervekkel kölcsönhatás, férfi nemi hormonok szintjét csökkenti gyerekekben |
Perfluorát vegyületek |
Vízlepergető rétegek, ételes dobozok, ipari felületaktív anyagok |
Elhízás, pajzsmirigy működésének befolyásolása |
Triklozán |
Fogkrémek, ruhák, tisztító szerek, antimikrobiális szappanok |
Tesztoszteron és tiroxin szint csökkentése |
Valproinsav |
Gyógyszer |
Pszichotróp hatás, GABA gátló neurotranszmitter |
Nehézfémek |
Kémiai vivőanyagok, amalgám tömés, festékek, elemek |
Glükokortikoid szint csökkentése, megváltozott hormonszint, csökkent termékenység |
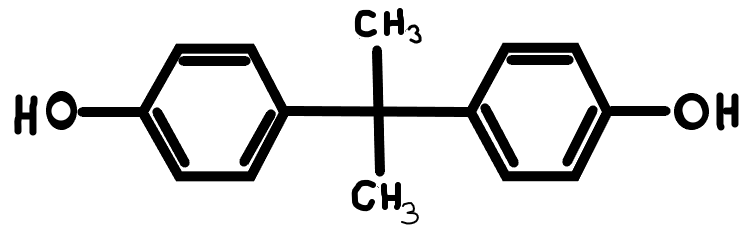
Biszfenol-A (BPA)
|
1. ábra: Biszfenol-A |
A biszfenol-A (lásd 1.ábra) műanyagok és epoxi gyanta gyártásához használt szintetikus anyag (Joseph, 2016). A szervezetbe bevitt BPA nagy mennyiségben kimutatható a vizeletből glükuronidokhoz és szulfátokhoz kapcsolódva (Thayer, 2015).
- Emellett bizonyítottan van ösztrogén tulajdonsága (Dodds és Lawson, 1936); az ösztrodiol agonistájaként a nukleáris ösztrogén £ és β receptorokhoz kötődik (Milligan és mtsai, 1998). In vitro kísérletekben igazolták, hogy az androgén-ösztrogén koncentrációt is képes befolyásolni úgy, hogy a gonadális hormonok szintéziséhez szükséges kulcs enzimeket gátolja (Zhang és mtsai, 2011).
Szintén bizonyították, hogy a biszfenol-A a TSH (Pajzsmirigy Serkentő Hormon) és a T4 (Thyroxin) hormonok szintjét is csökkenti (Chevrier és mtsai, 2013). A pajzsmirigy hormonok fontos szerepet játszanak a normál idegrendszeri fejlődésben, így ezek alacsony koncentrációja a várandósság alatt a képalkotásbeli, a vizuomotoros és a motoros képességek hiányában fognak jelentkezni. A születést követően pedig a nyelvtanulás, finommotoros képességek, figyelem és memória zavarát okozhatják (Rovet és mtsai, 1992). Úgy találták, hogy a terhes anyák tiroxin (T4) hormon szintjének csökkenésével együtt a TSH hormon mennyisége is visszaesett ezen szülők fiú gyermekeiben, de a lányaiban nem láttak ilyen összefüggést (Chevrier és mtsai, 2013).
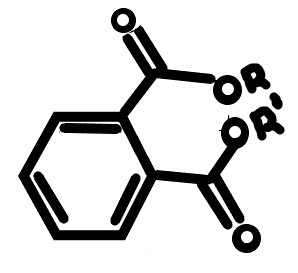
Ftalátok
|
2. ábra: Ftalát |
A ftalátok (lásd 2.ábra) a fogyasztási cikkek nagy részében megtalálható, így a különböző műanyagokban és gyógyszerekben is.
Ezek az anyagok a placentán könnyen keresztüljutnak, így a fejlődő magzat is ki van téve a hatásainak (Singh és mtsai, 1975).
A ftalátok gátolják az angrogének, pajzsmirigy hormonok és a glükokortikoidok mechanizmusát és metabolizmusát, sőt akadnak olyanok is, amik androgén ellenes hatásúak és csökkentik a tesztoszteron szintjét (Joseph, 2016; Hannas és mtsai, 2011).
A BPA-hoz hasonlóan ezeknek az anyagok is képesek a tiroxin és T3 koncentrációjának visszaesését előidézni úgy, hogy a trijód-tironin antagonistájaként a béta receptorokhoz kötődik (Ghisari és mtsai, 2009), így a sejt kevesebb T3-t képes megkötni (Shimada és Yamauchi, 2004).
Ezeken kívül a ftalátok képesek a magzatban oxidatív stresszt okozni, ami szintén kiváltó okként szerepelhet az autizmus kialakulásában (Edith López-Hurtado and Jorge J. Prieto, 2008).
Perfluorát vegyületek (PFA)
Epidemiológiai vizsgálatokban a PFOA és PFOS expozíciók összefüggenek az alacsonyabb teljes DNS-citozin-metilezéssel és a koleszterin metabolizmusában részt vevő gének expressziójának változásaival (Fletcher és mtsai, 2013, Guerrerro-Preston és mtsai 2010). Ezen felül gátolja a 11-β-hidroxiszteroid dehidrogenáz-2-t, hogy növelje a glükokortikoid koncentrációját, ami befolyásolja a növekedést és az agy fejlődését. Utóbbit rágcsálókkal végzett kutatásokkal bizonyították (Ye és mtsai,2014).
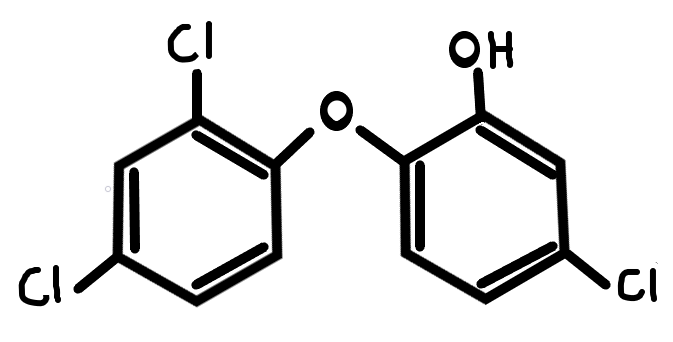
Triklozán
|
3. ábra: Triklozán |
A triklozán (lásd 3.ábra) megzavarja a gonádok, valamint a pajzsmirigy homeosztázisát (Kumar és mtsai,2008; Adam ás mtsai 2009). Rágcsálókon végzett kutatás bizonyítja, hogy csökkenti a tiroxin koncentrációt, mind a magzatban, mind az anyában (Johnson és mtsai,2016). Ezt a hatást a nukleáris receptorok aktiválása révén éri el, a máj tiroxin katabolizmusának fokozásával (Paul és mtsai,2013). Ezek a receptorok képesek közvetlenül kapcsolódni a DNS-hez és szabályozni a szomszédos gének expresszióját, ezért a transzkripciós faktorok közé sorolhatjuk őket.
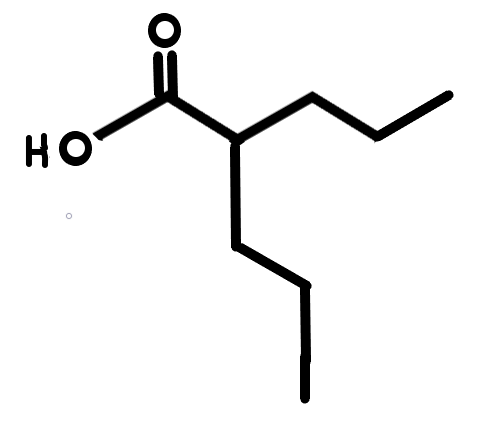
Valproinsav (VPA)
|
4. ábra: Valproinsav |
A valproinsavat (lásd 4.ábra) kezdetben epilepszia, bipoláris zavar, depresszió és migrén kezelésére alkalmazták. Hatásmechanizmusa azon alapul, hogy a képes gátolni a hiszton deacetilázok tevékenységét, így a hisztonok jobban acetilálódnak, ezzel együtt pedig megnő egyes génekről a transzkripció mértéke. Későbbi vizsgálatok során kiderült, hogy ha a terhesség időszaka alatt valproinsavat szedték az édesanyák, az megnövelte az autizmus kialakulásának kockázatát (Christensen és munkatársai, 2013).
Szója
Bizonyított, hogy egyes gyógyszerek mellett bizonyos élelmiszerek, például a szója, hormonális vagy endokrin rendszert károsító hatással is bírnak. Ennek az a magyarázata, hogy a szója fitoösztrogéneket tartalmaz.
Policiklusos aromás szénhidrogének
Egy tanulmány kimutatta, hogy az autizmus gyakrabban fordult elő azokban a gyerekekben, akiknek a nagyanyái a terhesség alatt dohányoztak (Golding és mtsai, 2017). Mivel a dohányfüstben jelen lévő policiklusos aromás szénhidrogéneket (PAH) endokrin diszruptoroknak tekintik, ez a tanulmány alátámasztja azt az elképzelést, hogy ezen környezeti kemikáliák öröklődő, autizmushoz vezető hatásokat válthatnak ki emberben.
Endokrin diszruptorok keveréke
Noha az epidemiológiai vizsgálatok többsége egy adott endokrin diszruptornak (például a biszfenol-A-nak) és az ASD-nek az összefüggésére összpontosított, ez a mindennapok során sokkal inkább több anyagnak az együttes hatására vezethető vissza (Braun és mtsai., 2016). A különféle kemikáliák külön-külön sokszor nem fejtik ki azt a hatást, ami autizmushoz vezethet. Ezért olyan állatkísérleteket kell kidolgozni, amelyek figyelembe veszik az ED-ok keverékével való kitettséget, utánozva egy adott helyen vagy időpontban a tényleges expozíciót.
Az egyik ilyen tanulmány, a rágcsálók anyai kitettségének hatását vizsgálta a vemhesség alatt, és egészen az elválasztásig. Ez a tanulmány négy ED (atrazin, perfluor-oktánsav, BPA és 2,3,7,8-tetraklór-dibenzo-p-dioxin) együttes használatán alapult.
Egy másik kísérletben, ahol csak egyetlen kemikáliát használtak, eltérő hatásokat tapasztaltak a viselkedésben, mint a keverék használatakor, az előző kísérletben (Sobolewski és mtsai., 2014). A tanulmányok során beszámoltak nemtől függő hatásokról is. Az anyai expozíció eltérően hatott a hímek és nőstények viselkedésére. A hímek általában érzékenyebben reagáltak mind az ED-keverékekre, mind külön-külön az egyes anyagokra. A környezeti ágensekkel szembeni eltérő reakció biokémiai, fiziológiai és neurológiai mechanizmusainak azonosítása utalást adhat a hímek és nőstények eltérő érzékenységére az autizmusra jellemző viselkedésformák iránt.
Különbség a nemek között
Tesztoszteron
Az autizmus spektrumzavar körülbelül 4,5-szer gyakrabban fordul elő férfiakban, mint nőkben. Ez a nagyobb érintettség azt sugallja, hogy a nemi hormonok befolyásolhatják a betegség kialakulását.
Az autizmus “szélsőséges férfi agy” elmélete szerint a túlzott születés előtti androgén hormonoknak való kitettség szerepet játszik a betegség kialakulásában. (Baron-Cohen és mtsai., 2005). Ezt a feltételezést az is alátámasztja, hogy az amnion folyadék megemelkedett tesztoszteron szintje a rossz társadalmi kapcsolatokkal és a korlátozott érdeklődési körök kialakulásával társul a kitett gyermekben.. (Knickmeyer és mtsai., 2005). A Baron- Cohen csoport további tanulmányai szerint a magasabb magzati (de nem születés utáni) (Auyeung és mtsai., 2012) tesztoszteron szintet társítják a különféle autistákra jellemző tulajdonságokkal, ideértve a szemkontaktus csökkent gyakoriságát 12 hónapos korban, (Lutchmaya és mtsai., 2002) a csökkent szókincsméretet 18-24 hónapos korban, (Lutchmaya és mtsai., 2001) az alacsonyabb empátia hányadot ezzel együtt viszont megnőtt rendszerező hányadot 96 hónapos korig. (Auyeung és mtsai., 2006; Chapman és mtsai., 2006).
- Egyes tanulmányok, melyek olyan betegségeket vizsgáltak, ahol azok a nőkben megemelkedett tesztoszteron szinttel társulnak (pl. veleszületett mellékvese hiperplázia és policisztás petefészek szindróma), magasabb előfordulási gyakoriságot találtak az autisztikus vonásokban az érintett anyák lány gyermekein (Knickmeyer és mtsai., 2006; Palomba és mtsai., 2012). Ez megerősíti azt, hogy az ezzel a hormonnal való nagyobb magzati kitettség összefüggésben áll az autizmussal.
Rora szerepe
Azt is megfigyelték, hogy a dihidrotesztoszteron csökkentette, míg az ösztradiol növelte a RORA expresszióját SH-SY5Y neuroblastoma sejtekben, egy idegsejt modellben (Sarachana és mtsai., 2011). Kimutatták továbbá, hogy a RORA szabályozza az aromatáz expresszióját, amelynek mennyisége erősen korrelált (r2 = 0,91) a RORA receptorral az agyszövetekben. Ezek a megfigyelések együttesen magyarázhatják az autizmushoz kapcsolódó magasabb tesztoszteronszintet, mivel az alacsonyabb aromatázszint várhatóan a szubsztrát-tesztoszteron felhalmozódásához vezet, ami tovább gátolhatja a RORA expresszióját, ezáltal súlyosbítva a receptor hiányt. Mivel kimutatták, hogy az ösztradiol növeli a RORA expressziót, a nőkben ennek a hormonnak a magasabb szintje védelmet nyújthat a hiányt okozó körülmények ellen, csökkentve ezzel a nők érzékenységét az ASD iránt. A nemi hormonok RORA expresszióra gyakorolt hatása tehát hozzájárulhat ahhoz, hogy a két nemben eltérő az autizmus előfordulásának gyakorisága. Ezenkívül a RORA transzkripciós célpontjainak genomszintű elemzése több mint 2500 olyan gént tárt fel, amelyek potenciálisan ezen receptor által szabályozott, ideértve több mint 400 autizmuskockázati gént, amelyeket a genetika és a funkcionális elemzés azonosított. Ezen megállapításokból arra lehet következtetni, hogy RORA expressziójának a hormonokkal vagy hormonszerű anyagokkal, - például ED-kal történő megzavarása - megszünteti az autizmushoz vezető gének transzkripciójának gátlását, melyeknek transzkripciója ezáltal nőni fog (Hu, 2012). Mivel a RORA már az ember megszületése előtt is expresszálódik (a fogantatás utáni 12-37. héttől) a frontális kéregben és a kisagyban, lehetővé teszi, hogy az ED-ok, valamint az endogén hormonok normálistól eltérő szintje megzavarják ezeket a géneket (Hu és mtsai 2015).
Szteroid hormonok
A terhes nők amnion folyadékából kimutatott tesztoszteronon és ösztadiolon kívüli más szteroid hormonok például progeszteron, 17a-hidroxi-progeszteron, androstendion és kortizol megemelkedett szintje összefüggött a gyermekeikben az autizmussal (Baron-Cohen és mtsai., 2014). Ez a megállapítás azt sugallja, hogy az általánosan megemelkedett magzati szteroidogén aktivitás az autizmushoz kapcsolódik.
Jövő lehetőségei
Annak ellenére, hogy korreláció tapasztalható az ED-ok születés előtti expozíciója, és az autizmus között, jórészt ismeretlen az a mechanizmus, amelyen keresztül ez az állapot létrejön. Ennek a mechanizmusnak a tisztázására szolgáló egyik lehetséges megközelítés, hogy megvizsgáljuk az ED-ok által okozott génexpresszióbeli változásokat állati és sejtes modelleken egyaránt, és megnézzük, hogy azoknak a géneknek az expressziója változott-e meg, amelyek kapcsolatban állnak az autizmussal.
Irodalomjegyzék
Adinolfi M. (1985). The development of the human blood-CSF-brain barrier. Developmental Medicine & Child Neurology, 27(4), 532-537
- Allis CD, Jenuwein T, Reinberg D, editors. 2006 Epigenetics. Cold Spring Harbor Press; Cold Spring Harbor, NY
- Auyeung B, Baron-Cohen S, Chapman E, Knickmeyer R, Taylor K, Hackett G. 2006 Foetal testosterone and the child systemizing quotient. European Journal of Endocrinology. 155:123–130.
Auyeung, B., Ahluwalia, J., Thomson, L., Taylor, K., Hackett, G., O'Donnell, K. J., & Baron-Cohen, S. (2012). Prenatal versus postnatal sex steroid hormone effects on autistic traits in children at 18 to 24 months of age. Molecular autism, 3(1), 17.
- Baron-Cohen S, Knickmeyer RC, Belmonte MK. 2005 Sex Differences in the Brain: Implications for Explaining Autism. Science. 310: 819–823.
Baron-Cohen, S., Auyeung, B., Nørgaard-Pedersen, B., Hougaard, D. M., Abdallah, M. W., Melgaard, L., Cohen, A. S., Chakrabarti, B., Ruta, L., & Lombardo, M. V. (2015). Elevated fetal steroidogenic activity in autism. Molecular psychiatry, 20(3), 369–376.
Bethany R. Hannas, Christy S. Lambright, Johnathan Furr, Kembra L. Howdeshell, Vickie S. Wilson, Leon E. Gray, Jr, 2011 Dose-Response Assessment of Fetal Testosterone Production and Gene Expression Levels in Rat Testes Following InUtero Exposure to Diethylhexyl Phthalate, Diisobutyl Phthalate, Diisoheptyl Phthalate, and Diisononyl Phthalate, Toxicological Sciences, Volume 123, Issue 1, Pages 206–216
- Birnbaum L. S. (2013). State of the science of endocrine disruptors. Environmental health perspectives, 121(4), A107.
- Braun J. M. (2017). Early-life exposure to EDCs: role in childhood obesity and neurodevelopment. Nature reviews. Endocrinology, 13(3), 161–173.
Braun, J. M., Gennings, C., Hauser, R., & Webster, T. F. (2016). What Can Epidemiological Studies Tell Us about the Impact of Chemical Mixtures on Human Health?. Environmental health perspectives, 124(1), A6–A9.
- Chapman E, Baron-Cohen S, Auyeung B, Knickmeyer R, Taylor K, Hackett G. 2006 Fetal testosterone and empathy: evidence from the empathy quotient (EQ) and the “reading the mind in the eyes” test. Soc Neurosci. 1:135–148.
Chevrier, J., Gunier, R. B., Bradman, A., Holland, N. T., Calafat, A. M., Eskenazi, B., & Harley, K. G. (2013). Maternal urinary bisphenol a during pregnancy and maternal and neonatal thyroid function in the CHAMACOS study. Environmental health perspectives, 121(1), 138–144.
- Christensen J, Grønborg TK, Sørensen MJ, Schendel D, Parner ET, Pedersen LH, Vestergaard M. 2013 Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. Obstet Gynecol Surv.68: 613–614.
- De Cock M., Maas Y.G.H., van de Bor M. 2012 Does perinatal exposure to endocrine disruptors induce autism spectrum and attention deficit hyperactivity disorders? Review. Acta Paediatr. 101:811–818.
- Dodds E.C., Lawson W. 1936 Synthetic oestrogenic agents without the phenanthrene nucleus. Nature. 1936;137:996.
- Edith López-Hurtado and Jorge J. Prieto 2008 A Microscopic Study of Language-Related Cortex in Autism Volume 4, Issue 2 Pages 130-145
- Emma K. Adam, Meena Kumari, 2009 Assessing salivary cortisol in large-scale, epidemiological research, Psychoneuroendocrinology, Volume 34, Issue 10, Pages 1423-1436.
- Ghisari M, Bonefeld-Jorgensen EC.2009 Effects of plasticizers and their mixtures on estrogen receptor and thyroid hormone functions. Toxicol Letters 189:1; 67–77.
Golding, J., Ellis, G., Gregory, S., Birmingham, K., Iles-Caven, Y., Rai, D., & Pembrey, M. (2017). Grand-maternal smoking in pregnancy and grandchild's autistic traits and diagnosed autism. Scientific reports, 7, 46179.
Gore, A. C., Martien, K. M., Gagnidze, K., & Pfaff, D. (2014). Implications of prenatal steroid perturbations for neurodevelopment, behavior, and autism. Endocrine reviews, 35(6), 961–991.
Guerrero-Preston, R., Goldman, L. R., Brebi-Mieville, P., Ili-Gangas, C., Lebron, C., Witter, F. R., Apelberg, B. J., Hernández-Roystacher, M., Jaffe, A., Halden, R. U., & Sidransky, D. (2010). Global DNA hypomethylation is associated with in utero exposure to cotinine and perfluorinated alkyl compounds. Epigenetics, 5(6), 539–546.
- Hakkola J., Tanaka E., Pelkonen O. (1998) Developmental Expression of Cytochrome P450 Enzymes in Human Liver. Pharmacol Toxicol. 82: 209-217
Hallmayer, J., Cleveland, S., Torres, A., Phillips, J., Cohen, B., Torigoe, T., Miller, J., Fedele, A., Collins, J., Smith, K., Lotspeich, L., Croen, L. A., Ozonoff, S., Lajonchere, C., Grether, J. K., & Risch, N. (2011). Genetic heritability and shared environmental factors among twin pairs with autism. Archives of general psychiatry, 68(11), 1095–1102.
- Hu VW. 2012 Is retinoic acid-related orphan receptor-alpha (RORA) a target for gene-environment interactions contributing to autism? Neurotoxicology. 33:1434–1435
Hu, V. W., Sarachana, T., Sherrard, R. M., & Kocher, K. M. (2015). Investigation of sex differences in the expression of RORA and its transcriptional targets in the brain as a potential contributor to the sex bias in autism. Molecular autism, 6, 7.
- Joanne F. Rovet, Robert M. Ehrlich, Donna L. Sorbara, 1992 Neurodevelopment in Infants and Preschool Children with Congenital Hypothyroidism: Etiological and Treatment Factors Affecting Outcome, Journal of Pediatric Psychology, Volume 17, Issue 2, Pages 187–213
Johnson, P. I., Koustas, E., Vesterinen, H. M., Sutton, P., Atchley, D. S., Kim, A. N., Campbell, M., Donald, J. M., Sen, S., Bero, L., Zeise, L., & Woodruff, T. J. (2016). Application of the Navigation Guide systematic review methodology to the evidence for developmental and reproductive toxicity of triclosan. Environment international, 92-93, 716–728.
- Kaminsky Z, Wang SC, Petronis A. 2006 Complex disease, gender and epigenetics. Ann Med. 38:530–44.
- Katie B. Paul, Jerry T. Thompson, Steven O. Simmons, John P. Vanden Heuvel, Kevin M. Crofton, 2013 Evidence for triclosan-induced activation of human and rodent xenobiotic nuclear receptors, Toxicology in Vitro, Volume 27, Issue 7, Pages 2049-2060.
- Knickmeyer R, Baron-Cohen S, Fane BA, Wheelwright S, Mathews GA, Conway GS, Brook CGD, Hines M. 2006 Androgens and autistic traits: A study of individuals with congenital adrenal hyperplasia. Hormones and Behavior. 50:148–153.
- Knickmeyer R, Baron-Cohen S, Raggatt P, Taylor K. 2005 Foetal testosterone, social relationships, and restricted interests in children. J Child Psychol Psychiatry. 46:198–210.
- Kundakovic M, Gudsnuk K, Franks B, Madrid J, Miller RL, Perera FP, Champagne FA. 2013 Sex-specific epigenetic disruption and behavioral changes following low-dose in utero bisphenol A exposure. Proc Natl Acad Sci U S A. ;110:9956–9961.
Leping Ye, Jingjing Guo, Ren-Shan Ge, 2014Chapter Thirteen - Environmental Pollutants and Hydroxysteroid Dehydrogenases, Editor(s): Gerald Litwack, Vitamins & Hormones, Academic Press,Volume 94, Pages 349-390
- Lutchmaya S, Baron-Cohen S, Raggatt P. 2001 Foetal testosterone and vocabulary size in 18- and 24-month-old infants. Infant Behavior and Development. 24:418–424.
Lutchmaya S, Baron-Cohen S, Raggatt P. 2002 Foetal testosterone and eye contact in 12-month-old human infants. Infant Behavior & Development. 25:327–335.
Marí-Bauset, S., Donat-Vargas, C., Llópis-González, A., Marí-Sanchis, A., Peraita-Costa, I., Llopis-Morales, J., & Morales-Suárez-Varela, M. (2018). Endocrine Disruptors and Autism Spectrum Disorder in Pregnancy: A Review and Evaluation of the Quality of the Epidemiological Evidence. Children (Basel, Switzerland), 5(12), 157.
- Milligan SR, Balasubramanian AV, Kalita JC. 1998 Relative potency of xenobiotic estrogens in an acute in vivo mammalian assay. Environ Health Perspect. 106:23–26.
- Palomba S, Marotta R, Di Cello A, Russo T, Falbo A, Orio F, Tolino A, Zullo F, Esposito R, La Sala GB. 2012 Pervasive developmental disorders in children of hyperandrogenic women with polycystic ovary syndrome: a longitudinal case-control study. Clin Endocrinol (Oxf) 77: 898–904.
Sarachana, T., Xu, M., Wu, R. C., & Hu, V. W. (2011). Sex hormones in autism: androgens and estrogens differentially and reciprocally regulate RORA, a novel candidate gene for autism. PloS one, 6(2), e17116.
- Shimada N, Yamauchi K. 2004 Characteristics of 3,5,3′-triiodothyronine (T3)-uptake system of tadpole red blood cells: effect of endocrine-disrupting chemicals on cellular T3 response. J Endocrinol.183: 627–637.
- Singh AR, Lawrence WH, Autian J. 1975 Maternal-fetal transfer of 14C-di-2-ethylhexyl phthalate and 14C-diethyl phthalate in rats. Journal of pharmaceutical sciences. 64: 1347–1350.
Sobolewski, M., Conrad, K., Allen, J. L., Weston, H., Martin, K., Lawrence, B. P., & Cory-Slechta, D. A. (2014). Sex-specific enhanced behavioral toxicity induced by maternal exposure to a mixture of low dose endocrine-disrupting chemicals. Neurotoxicology, 45, 121–130.
Thayer, K. A., Doerge, D. R., Hunt, D., Schurman, S. H., Twaddle, N. C., Churchwell, M. I., Garantziotis, S., Kissling, G. E., Easterling, M. R., Bucher, J. R., & Birnbaum, L. S. (2015). Pharmacokinetics of bisphenol A in humans following a single oral administration. Environment international, 83, 107–115.
- Tony Fletcher, Tamara S. Galloway, David Melzer, Paul Holcroft, Riccardo Cipelli, Luke C. Pilling, Debapriya Mondal, Michael Luster, Lorna W. Harries, 2013 Associations between PFOA, PFOS and changes in the expression of genes involved in cholesterol metabolism in humans, Environment International, Volumes 57–58,Pages 2-10.
- Vikas Kumar, Chandrajeet Balomajumder, Partha Roy, 2008 Disruption of LH-induced testosterone biosynthesis in testicular Leydig cells by triclosan: Probable mechanism of action, Toxicology, Volume 250, Issues 2–3, Pages 124-131.
- Wolstenholme JJ, Goldsby JA, Rissman EF. 2013 Transgenerational effects of prenatal bisphenol A on social recognition. Horm Behav. 64:833–839.
- Xiaowei Zhang, Hong Chang, Steve Wiseman, Yuhe He, Eric Higley, Paul Jones, Chris K.C. Wong, Abdulaziz Al-Khedhairy, John P. Giesy, Markus Hecker, 2011 Bisphenol A Disrupts Steroidogenesis in Human H295R Cells, Toxicological Sciences, Volume 121, Issue 2, Pages 320–327
Ábrák
Saját, Calvero (2006) alapján újrarajzolva, 1.ábra: https://hu.wikipedia.org/wiki/Biszfenol_A
Saját, Bryan Derksen (2007) alapján újrarajzolva, 2.ábra: https://hu.wikipedia.org/wiki/Ftal%C3%A1tok
Saját, Harbin (2009) alapján újrarajzolva 3. ábra:https://hu.wikipedia.org/wiki/Trikloz%C3%A1n
Saját, Harbin (2009) alapján újrarajzolva 4.ábra: https://hu.wikipedia.org/wiki/Valproinsav