Elektrische Organe der Fische (Elektroplax): Aufbau, Funktion und Regulation
Elektrische Organe sind als eine Besonderheit in einigen Knochen- und Knorpelfischarten zu finden, die sich unabhängig voneinander entwickelt haben. Sie besitzen die Fähigkeit elektrische Stromimpulse zu erzeugen, die vielfältige Funktionen erfüllen können. So werden sie zum Beutefang, zur Selbstverteidigung sowie zur Elektrokommunikation und Ortung benutzt. Elektrische Organe können in zwei Gruppen eingeteilt werden: starke und schwache elektrische Organe. Bei ersteren konnten Stromschläge im Bereich von 5 – 800 V (Bennett, 1970) gemessen werden, während man bei letzteren Stromstärken von wenigen mV bis hin zu einigen wenigen Volt (Clausen et al., 2012) aufgezeichnet hat.
Contents
Aufbau
Elektroplax
Die Grundbausteine der elektrischen Organe stellen die Elektrozyten dar, welche parallel oder seriell angeordnet sein können. Entwickelt haben sich die Elektrozyten aus Muskelzellen, diese sind aber nicht mehr kontraktionsfähig. Die Anzahl der Elektrozyten variiert von Spezies zu Spezies stark, von einigen hundert bis hin zu millionenfachen Zellanzahlen ist alles möglich. Bei einer seriellen Anordnung der Elektrozyten summieren sich die Potentiale der einzelnen Zellen. Bei einer parallelen Schaltung dagegen wird die Stromstärke erhöht. Das System, das sich aus dieser Zusammenschaltung von Elektrozyten bildet, nennt man Elektroplax (Markham, 2013).
Jeder Elektroplax besteht aus zwei histologisch unterschiedlich aufgebauten Zellmembranen. Die dem caudalen Ende zugewandte Zellmembran ist von einer extrem hohen Anzahl an Synapsen innerviert und mit einer leitfähigen Membran umgeben. Die dem rostralen Ende zugewandte Membran ist nicht innerviert und daher nicht in der Lage bioelektrische Potentiale zu generieren. Wie bei jeder polarisierten Membran können sich auf ihr jedoch elektrische Impulse fortpflanzen (Schoffeniels and Nachmansohn, 1957). Elektrozyten selbst sind elektrisch nicht erregbar und reagieren auf Depolarisation fast gar nicht. Elektrisch stimuliert werden die Zellen von einem efferenten Nerv, der mit einer klassischen chemischen, Acetylcholin-haltigen Synapse mit dem Elektrozyt in Verbindung steht (Bennett, 1970). Kontrolliert werden die Elektrozyten durch einen Schrittmacher Nucleus („Pacemaker Nucleus“), der sich im verlängerten Rückenmark befindet. Wenn sich die Elektrozyten gleichzeitig entladen, wird dies elektrische Organentladung (Electric Organ Discharge), kurz EOD genannt. EODs können auch hormonell reguliert werden und fallen je nach Geschlecht etwas unterschiedlich aus (Markham, 2013). Neben den Elektrozyten besitzen alle elektrischen Fische auch Rezeptorzellen. Diese haben sich aus Haarsinneszellen entwickelt und reagieren auf Potentialänderungen.
Zitterwels
|
|
Abbildung 1: Der Zitterwels |
Der Zitterwels (Malapterurus electricus), wie in Abbildung 1 zu sehen ist, gehört zu der Familie der Malapteruridae (Elektrische Welse). Mithilfe zweier elektrischer Organe, die sich je auf einer Seite des Fisches befinden, kann der Zitterwels seine Fressfeinde oder Beutefische mit Stromstößen von mehreren hundert Volt attackieren. Die elektrischen Organe bedecken einen ausgewachsenen Zitterwels vom Ende seines Kopfes bis zu seinen Anal- bzw. Rückenflossen (Johnels, 1956).
Das elektrische Organ des Zitterwelses wird von zwei großen im Rückenmark ventromedial liegenden Ganglien und deren Axonen innerviert. Diese zwei linsenförmigen Ganglien sind reich an Zellorganellen wie dem rauen Endoplasmatischem Retikulum oder Lysosomen. Die Elektrozyten des Zitterwelses (bis zu 2 Millionen pro Seite) ziehen sich verteilt von rostral bis nach caudal entlang der longitudinalen Achse fast über den gesamten Körper des Fisches. Elektrozyten können 20 - 40 μm dick sein. Sie haben einen Durchmesser von einem Millimeter, sind rund und parallel zueinander angeordnet. Einzelne Elektrozyten verbinden sich miteinander und bilden elektrische Platten, welche durch Kapillaren gut durchblutet sind. Durch eine Schicht Kollagenfasern werden die Elektrozyten von der Haut separiert (Janetzko et al., 1987). Lange Zeit war nicht eindeutig geklärt, aus welchem Gewebe das elektrische Organ beim Zitterwels seinen Ursprung nimmt. Weil es sich viel oberflächlicher befindet als in anderen Spezies, ging man von einem drüsengewebeartigen Ursprung aus. Heute wissen wir, dass auch das elektrische Organ des Zitterwelses aus Muskelgewebe entstanden ist, genau wie bei allen anderen Spezies.
Das elektrische Organ des Zitterwelses ist nach außen hin mit fibrösem Bindegewebe bedeckt und mit der Dermis verbunden. In der Teilungszone des elektrischen Organs sind die Bindegewebsschichten nicht starr zur Dermis fixiert. An der Innenseite des Organs befindet sich ebenfalls fibröses Bindegewebe. Zwischen dieser Schicht und der darunterliegenden Muskulatur liegt lockeres Bindegewebe mit retikulären Fasern. Aufgrund dessen lässt sich die Haut samt elektrischem Organ leicht vom restlichen Körper des Fisches abnehmen (Johnels, 1956).
Auf Höhe des Schultergürtels fehlt in der Muskulatur des Zitterwelses ein kleiner Bereich, der durch eine Schicht des elektrischen Organs überdeckt wird. Genau an dieser Stelle innerviert der elektrische Nerv das Organ (Johnels, 1956). Dieser Nerv besteht aus einem großen, myelinisiertem Axon (Durchmesser: 25 μm), das von Bindegewebe umgeben ist (Janetzko et al., 1987). Zusammen mit der ventralen Wurzel des dritten Rückenmarknerves verlässt das Axon das Rückenmark und gelangt an der oben genannten Stelle in das außen liegende elektrische Organ. Die größte elektrische Zelle befindet sich im vorderen Bereich des Rückenmarks und wird von vielen intrazellulären Kapillaren penetriert (Johnels, 1956). Genau wie in anderen Spezies beispielsweise dem Zitteraal bildet das Axon des elektrischen Nervs am Ende seiner feinen Verzweigungen viele Synapsen mit postsynaptischen Zellen. Diese sind reich an Mitochondrien (Janetzko et al., 1987).
Zitteraal
|
|
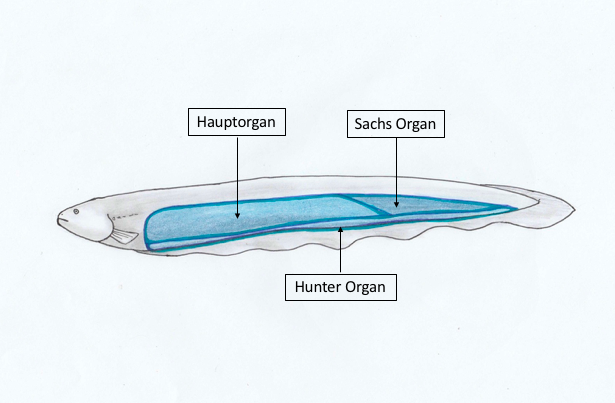
Abbildung 2: Elektrische Organe des Zitteraals |
|
|
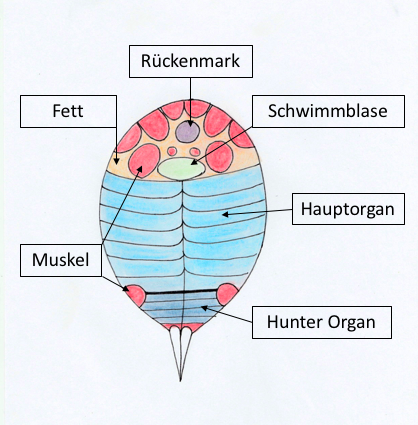
Abbildung 3: Querschnitt des Zitteraals |
Der Zitteraal (Electrophorus electricus) gehört trotz seines Namens und Aussehens nicht zu den echten Aalen, sondern zu den Neuwelt-Messerfischen (Gymnotiformes). Zitteraale können eine Länge von bis zu einem Meter erreichen. Er besitzt drei verschiedene elektrische Organe, die insgesamt 4/5 seines gesamten Körpers bedecken. Dazu gehören das Haupt-Organ, das Sachs- sowie das Hunter-Organ, die jeweils unterschiedliche Funktionen ausüben können (siehe Abb. 2 und 3).
Sie bestehen aus Elektrozyten, die säulenartig parallel zur Wirbelsäule verlaufen. Diese Zellen sind zu sogenannten Elektroplatten übereinandergeschichtet, sodass sich bei elektrischer Aktivität die einzelnen Potenziale addieren. Im Haupt-Organ liegen die einzelnen Elektrozyten sehr dicht beieinander, wohingegen sie im Sachs-Organ ein bis zwei Millimeter voneinander entfernt sind, vor allem in der Nähe des Schwanzes.
Afferente Nerven und Blutgefäße verlaufen ausschließlich auf der hinteren Seite der Elektrozyten, wo sie in zahlreichen, die gesamte Oberfläche bedeckenden kleinen Papillen enden. Die innervierte Membran besteht aus zwei verschiedenen Strukturen: Sogenannten End-Platten und einer leitfähigen Membran. Der Elektroplax der Zitteraale besteht aus 50.000-100.000 Endplatten (Keynes and Martins-Ferreira, 1953). Die vordere Seite ist mit großen, unregelmäßig geformten Papillen bestückt, die in einer extrazelluläre geleeartigen Masse hervorragen, die die extrazellulären Abstände zwischen den einzelnen Elektrozyten ausfüllt. Der Elektroplax der Zitteraale sollte nicht als modifizierte motorische Endplatte angesehen werden, sondern er besteht aus speziell angepassten Muskelfasern, die eine normal erregbare Membran auf der einen Seite behalten haben, während die Membran auf der anderen Seite ihre Fähigkeit zur Erregbarkeit verloren hat (Keynes and Martins-Ferreira, 1953).
Zitterrochen
|
|
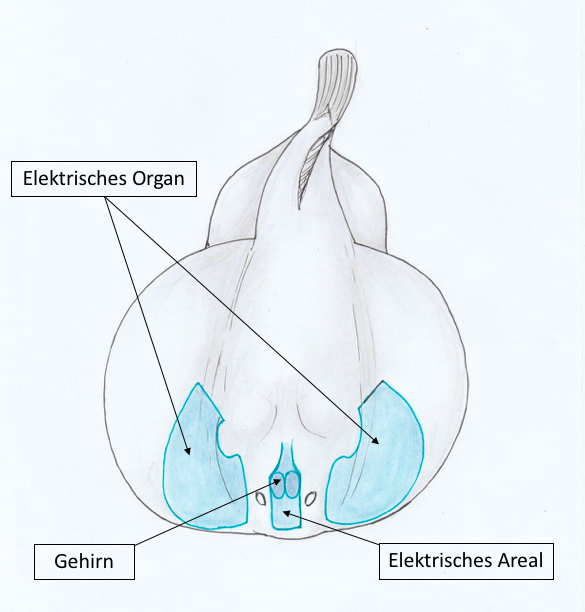
Abbildung 4: Elektrische Organe des Marmorrochens |
Zitterrochen, auch bekannt als Torpedorochen, bilden die Familie der Torpedinidae, welche wiederum den Rochen (Klasse Batoidea) angehören. Insgesamt sind bisher 20 Arten dieser Familie bekannt. Die Größe der Torpedorochen variiert artspezifisch von 15 cm bis hin zu 1,80 m. Große Exemplare können Stromstöße von bis zu 230 V produzieren und damit selbst ausgewachsene Menschen außer Gefecht setzen. Einer der bekanntesten Vertreter der Torpedinidae ist der Marmorrochen (Torpedo marmorata). Dieser nachtaktive Jäger hat sein Verbreitungsgebiet am östlichen Atlantik, im Mittelmeer, sowie in den Buchten vor den französischen Küsten, wo die weiblichen Rochen sich in der Zeit von Juli bis September zusammen finden, um ihre Jungen zu gebären. Marmorrochen bringen ihre Jungen lebendig zur Welt, ebenso wie die anderen Vertreter dieser Familie. Typisch für Zitterrochen sind die zu Elektroplax umgewandelten Muskeln, welche zum Betäuben von Beutetieren, sowie zur Verteidigung gegen Fressfeinde eingesetzt werden und sich an der Basis der Brustflossen befinden. Wie bei anderen Rochen auch, liegen die Brustflossen um den Körper des Tieres herum und reichen vom Kopf bis zum Ursprung der Bauchflossen.
Der Marmorrochen besitzt auf beiden Seiten je vier elektrische Organe (siehe Abb. 4), wo je ein Paar elektrischer Nerven die Mesodermis der Haut berührt. Gebildet werden die Elektroplax von den je 400 - 600 Columnae genesis pro Organ. Diese Säulen wiederum, enthalten Myotuben, welche mit je einer Myofibrille und mehreren Zellkernen ausgestattet sind (Mellinger et al., 1978).
Entdifferenzieren sich diese Elektroblasten, bilden sind Elektroplatten, auch „electroplates“ genannt, deren ventraler Teil stark innerviert ist. Dieser ventrale Teil wird als Plattenbildner, oder „plate builder“ bezeichnet. Bis zu 600 Elektroplatten befinden sich in einer Columna genesis. Die „plate builder“ stehen in direktem Kontakt zu den Nervenfasern. Verschließen sich nur die Membranen einiger dieser Fasern, so sammelt sich große Mengen an Acetylcholinesterase im synaptischen Spalt an, woraufhin Acetylcholin ausgeschüttet wird (Godfrey et al., 1984). Übersteigt die Konzentration dieses einen bestimmten Schwellenwert, kommt es zu einer Entladung und der Strom wird als elektrischer Schlag an die Umgebung abgegeben (Mellinger et al., 1978).
Schwach elektrische Organe
|
|
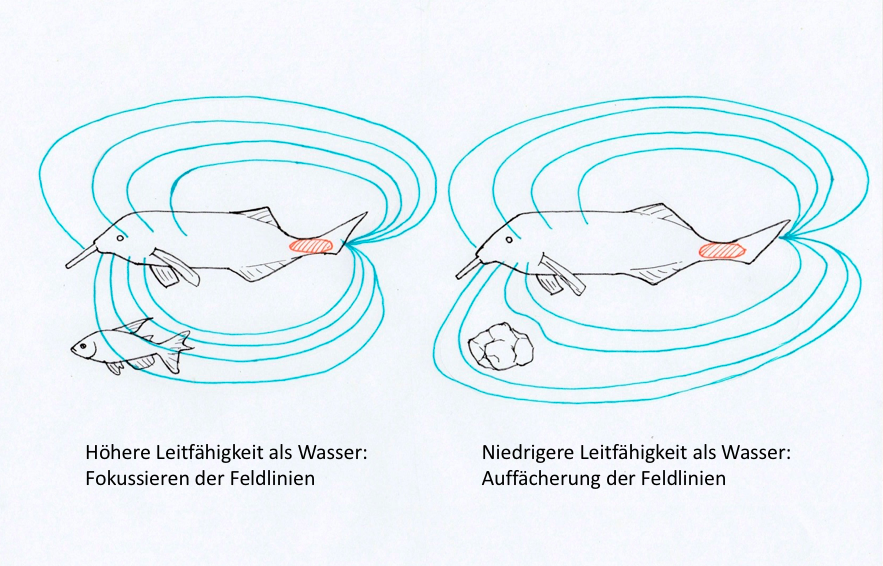
Abbildung 5: Die elektrischen Bilder enthalten Informationen über Form, elektrische Leitfähigkeit und Abstand der wahrgenommenen Objekte |
Im späten 19 Jahrhundert entdeckte man bei einigen Fischfamilien wie zum Beispiel den Neuwelt-Messerfischen (Gymnotiformes) oder den Knochenzüngelerartigen (Osteoglossiformes), die in Gewässern Afrikas und Südamerikas vorkommen, sogenannte schwach elektrische Organe. Schwach elektrische Fische sind häufig nachtaktiv und leben in trüben Gewässern. Der größte Unterschied zu stark elektrischen Tieren besteht darin, dass schwach elektrische Fische ihre Stromimpulse ständig und kontinuierlich abgegeben. Hingegen reagieren stark elektrische Fische mit einem Stromschlag auf einen äußeren Reiz. Die Fische senden kurze elektrische Signale aus, um Objekte in ihrer Umgebung zu orten und in ihrem trüben oder dunklen Lebensraum erfolgreich zu jagen. Zudem können diese Fische durch Aussenden elektrischer Impulse mit anderen Fischen der gleichen Spezies kommunizieren (Metzen et al., 2016). Das schwach elektrische Organ in diesen Familien hat sich aus modifizierten Nerven- und Muskelzellen entwickelt. Wo im Fisch sich dieses schwach elektrische Organ befindet ist unterschiedlich. Bei Nilhechten ist das elektrische Organ relativ klein und am Schwanz lokalisiert, während es sich bei Neuwelt-Messerfischen über den ganzen Körper zieht (Clausen et al., 2012).
Bei den Entladungen der elektrischen Organe handelt es sich um monophasige oder mehrphasige wellenartige Impulse. Mithilfe dieser Stromimpulse können die Fische ein stabiles, dreidimensionales elektrisches Feld um sich selbst aufbauen, das elektrische Dipole ausbildet. In diesem elektrischen Feld können diese Fische jede Störung, beispielsweise ausgelöst durch einen anderen Fisch, wahrnehmen (siehe Abb. 5). Eine Störung im elektrischen Feld erkennen die Fische mithilfe von tuberösen Elektrorezeptoren, die in ihre Haut eingebaut sind. Nimmt der Fisch eine Störung durch ein Objekt in seinem elektrischen Feld war, sendet dieser sofort mehrere Stromimpulse aus, die ihm weitere Informationen mitteilen. Hat das Objekt eine höhere Leitfähigkeit als Wasser, so fokussieren sich die Feldlinien. Leitet das Objekt jedoch schwächer, so werden die Feldlinien aufgefächert. Dadurch können die Fische die Entfernung, die Form, das Volumen sowie den Abstand zwischen den verschiedenen Objekten wahrnehmen und das ganz ohne Licht (Clausen et al., 2012).
Schwach elektrische Fische lassen sich in zwei Gruppen einteilen: Pulsfische („buzzers“) und Wellenfische („hummers“). Pulsfische geben kurze elektrische Impulse ab, die von einer langandauernden Pause unterbrochen sind. Das erzeugte elektrische Feld besitzt ein breites Frequenzspektrum. Bei Wellenfischen ist die Zeitdauer der Impulsaussendung im Vergleich zur Dauer der Impulspause genau gleich lang (Bennett, 1970).
Funktion
Schwach elektrische Organe in der Forschung
Um Gewässer heutzutage vor Umweltverschmutzung zu bewahren, müssen diese ständig überwacht werden. Mit der Entwicklung von neuen Chemikalien wächst auch das Risiko von möglichen Schadstoffen. Zwar gibt es technische Methoden, um diese Schadstoffe zu erkennen und aus dem Wasser zu filtern, aber diese führen leicht zu Fehldiagnosen. Daher wird versucht, für diesen Zweck Fische als Biosensoren einzusetzen. Schwach elektrische Fische stellen eine besonders gute Ergänzung zu technischen Geräten dar, weil sie ständig Stromimpulse aussenden. Diese Impulse reagieren besonders sensibel auf die Wasserqualität und es ist relativ einfach diese aufzuzeichnen. Veränderungen in der Frequenz, der Amplitude, der Wellenform sowie der Dauer der ausgesendeten elektrischen Impulse und auch wie lange die gerade erwähnten Veränderungen anhalten, werden aufgezeichnet. Wenn die Daten zu sehr von der Norm abweichen, kann dies Aufschluss über das Vorhandensein von Schadstoffen im Wasser geben (Clausen et al., 2012). Normalerweise sollte die Wellenform und die Dauer eines elektrischen Impulses konstant bleiben (von der Emde and Fetz, 2007). Studien haben gezeigt, dass die Frequenz - also wie häufig die Stromimpulse von den Fischen ausgesendet werden- mit der Qualität des Wassers zusammenhängt (Clausen et al., 2012).
Um diese Veränderungen der Wasserqualität überhaupt erst zu erkennen, haben die schwach elektrischen Fische ein ausgeklügeltes System entwickelt. Die Elektrorezeptoren in der Oberfläche der Haut solch schwach elektrischer Fische messen ständig die Stromstärken innerhalb und außerhalb des Fischkörpers. Diese Stromstärken sollten proportional zu der Stromstärke, erzeugt in den Elektrozyten der Epidermis, sein. Ein Objekt im Wasser stört das dreidimensionale Feld und verändert so die Stärke der ausgesendeten Stromimpulse an einigen Hautstellen. Die Rezeptorzellen in der Haut sind durch Synapsen mit afferenten Nerven, die im caudalen Bereich des Hirns enden, verbunden. Hierbei handelt es sich um chemische und elektrische Synapsen. Dank diesem Rezeptorsystem reagieren die Fische nicht langsam, sondern sehr schnell auf Veränderungen der Wasserqualität. Bei zu hohen Schadstoffkonzentrationen können elektrische Fische allerdings nicht zur Überwachung von Gewässern eingesetzt werden, da sie dies nicht überleben würden (Clausen et al., 2012).
Physiologische Regulation
Stimulation der Elektrozyten durch Neurotransmitter
|
|
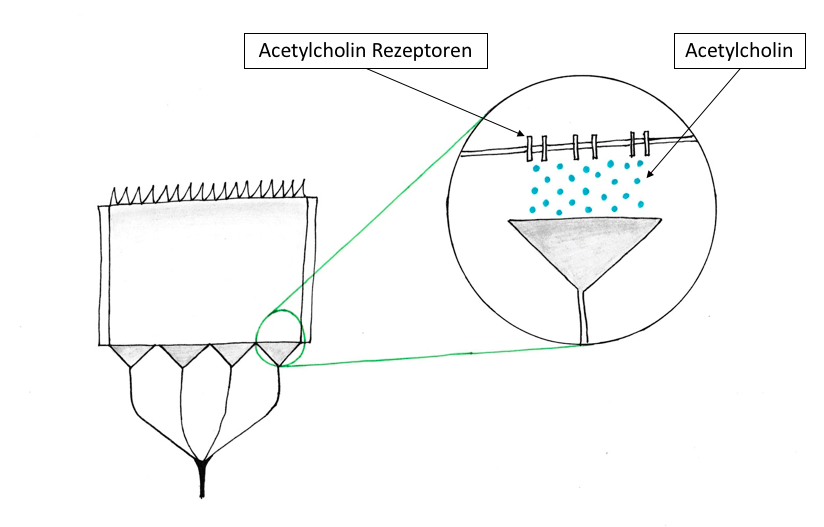
Abbildung 6: Freisetzung von Acetylcholin im synaptischen Spalt zwischen Elektrozyte und terminalem Ende |
In praktisch allen elektrischen Organen kann man Acetylcholin und Acetylcholinesterase nachweisen, es ist essentiell für die Funktion dieses Organs (Augustinsson and Johnels, 1958). In den 1980iger Jahren wurde das elektrische Organ des Torpedo zur Charakterisierung cholinerger synaptischer Vesikel verwendet, da es die einzige bekannte homogene Quelle cholinerger Vesikel war und so erstmals die Isolierung und Charakterisierung ihrer Zusammensetzung ermöglichte.
Aus diversen Experimenten ist bekannt, dass eine kurzzeitige Acetylcholin-Ausschüttung notwendig ist, um Aktionspotentiale und damit Stromimpulse zu erzeugen. Acetylcholin, das aus Nerven freigesetzt wird und durch den synaptischen Spalt diffundiert, bindet an Acetylcholin Rezeptoren der Elektrozyten und sorgt für deren Depolarisation (siehe Abb. 6). Da dies in fast allen Zellen des Elektroplax gleichzeitig geschieht, kann eine hohe elektrische Spannung aufgebaut werden. Die Depolarisierung bewirkt selektive Permeabilitätsänderungen der Elektrozyten Membran und führt in Folge zum Aufbau der elektrischen Potentiale.
Die Aktivität von Acetylcholinesterase im elektrischen Organ ist direkt proportional zur Anzahl der Elektrozyten pro cm2 und somit zur Stromstärke. Beim Zitterwels konnten einige Unterschiede im Vergleich zum Zitteraal und Zitterrochen festgestellt werden. Der Gehalt an Acetylcholin und die Aktivität der Acetylcholinesterase im Zitterwels ist z.B. deutlich niedriger als in den zwei anderen Spezies. Trotzdem produziert der Zitterwels die gleiche Stromstärke wie Zitterrochen oder Zitteraal (Augustinsson and Johnels, 1958).
Eine kurzzeitige Stimulation der Acetylcholin Rezeptoren am Elektrozyten durch Acetylcholin führt zur Depolarisation der Membran und damit zur Bildung von Stromimpulsen. Wenn die Elektrozyten jedoch lange Acetylcholin ausgesetzt werden, bleiben sie auf Dauer depolarisiert und die elektrische Aktivität wird irreversibel blockiert. Eine Dauerdepolarisation wird durch das Enzym Acetylcholinesterase, das Acetylcholin spaltet und so inaktiviert, unterbunden (Schoffeniels and Nachmansohn, 1957).
Für Forschungs- und medizinische Zwecke wurden Aktivatoren (Agonisten) und Inhibitoren (Antagonisten) am Acetylcholin Rezeptor identifiziert. Es handelt sich um Schlangengifte oder auch um sogenannte Alkaloide, also pflanzliche Stoffe mit einem Stickstoff Atom. Sie verändern unterschiedlich die elektrische Aktivität der Elektrozyten: Rezeptor-Inhibitoren blockieren die elektrische Aktivität, ohne eine Depolarisation auszulösen, d.h. das Rezeptor-Protein bleibt sterisch unverändert, ihre Wirkung kann reversibel oder irreversibel sein. Bungarotoxin, ein Schlangengift und das Pfeilgift Curare gehören zu dieser Gruppe. Rezeptor-Aktivatoren lösen eine Depolarisation aus, das Rezeptor Protein ändert sich dabei strukturell und führt dabei zu einer erhöhten Permeabilität der Zelle. Acetylcholin und Carbamylcholin gehören zur Gruppe dieser Stoffe. Wenn die elektrischen Zellen solche Stoffen für eine längere Zeit ausgesetzt sind, kann deren Effekt nur teilweise und temporär rückgängig gemacht werden (Schoffeniels and Nachmansohn, 1957). Eine weitere, indirekte, Möglichkeit die Übertragung am Acetylcholin Rezeptor zu verstärken, ist über Hemmung der Acetylcholinesterase. Wird dieses Enzym gehemmt, wird weniger Acetylcholin im synaptischen Spalt abgebaut und das aus dem Nerv kommende Acetylcholin kann länger am Rezeptor wirken. Typische Hemmer sind Physiostigmin, ein Alkaloid aus den Samen der Kalabarbohne oder Neostigmin.
Elektrisch erregbare Membran: Aktionspotential und Ionen-Konzentrationen
Die Änderung der Ionenströme, die Aktionspotentiale im Elektroplax auslösen, wurden im Zitteraal ausführlich untersucht (Bennett, 1970). Der Einwärtsstrom hängt von der extraztellulären Na+ Konzentration ab, das Ruhepotential von der extrazellulären K+ Konzentration. Die Elektrozyten Membran ist nur wenig durchlässig für Cl- Ionen.
Wenn sich Acetylcholin an den Acetylcholin-Rezeptor bindet, ändert sich die Konformation des Rezeptors und eine Kanalpore geht auf. Dadurch können Na+ und Ca2+ Ionen in die Zelle einströmen, die Ladung der Zelle wird innen negativer und die Zelle depolarisiert. Sinkt die Na+ Konzentration wieder, nimmt das Membranpotential ab und das Aktionspotential wird terminiert, dabei spielen K+ Ionen im Gegensatz zu anderen erregbaren Zellen keine Rolle (Bennett, 1970). Die Zeitkonstante des Elektroplax is ausreichend kurz, dass die Inaktivierung durch Na+ Abfall ausreicht und K+ Ionenströme nicht benötigt werden. Nach einiger Zeit gleicht sich das Membranpotential wieder aus und es kommt zum Ruhepotential. Das durchschnittliche Ruhepotential der Elektrozyten liegt bei 80 mV (Bennett, 1970).
Literaturverzeichnis
Augustinsson, K.-B.; Johnels, A.G. (1958): The acetylcholine system of the electric organ of Malapterurus electricus. The Journal of physiology 140: (3) 498–500
Bennett, M.V.L. (1970): Comparative physiology: electric organs. Annual Review of Physiology 32: (1) 471–528
Clausen, J.; van Wijk, R.; Albrecht, H. (2012): Weakly electric fish for biomonitoring water quality. Environ Technol 33: (10-12) 1089–1099
Godfrey, E.W.; Nitkin, R.M.; Wallace, B.G.; Rubin, L.L.; Mc Mahan, U.J. (1984): Components of Torpedo electric organ and muscle that cause aggregation of acetylcholine receptors on cultured muscle cells. The Journal of Cell Biology 99: (2) 615–627
Janetzko, A.; Zimmermann, H.; Volknandt, W. (1987): The electromotor system of the electric catfish (Malapterurus electricus): a fine-structural analysis. Cell Tissue Res 247: (3) 613–624
Johnels, A.L.F.G. (1956): On the origin of the electric organ in Malapterurus electricus. Journal of Cell Science 3: (39) 455–463
Keynes, R.D.; Martins-Ferreira, H. (1953): Membrane potentials in the electroplates of the electric eel. J Physiol 119: (2-3) 315–351
Markham, M.R. (2013): Electrocyte physiology: 50 years later. J Exp Biol 216: (Pt 13) 2451– 2458
Mellinger, J.; Belbenoit, P.; Ravaille, M.; Szabo, T. (1978): Electric organ development in Torpedo marmorata, Chondrichthyes. Developmental biology 67: (1) 167–188
Metzen, M.G.; Krahe, R.; Chacron, M.J. (2016): Burst Firing in the Electrosensory System of Gymnotiform Weakly Electric Fish: Mechanisms and Functional Roles. Front Comput Neurosci 10: 81
Schoffeniels, E.; Nachmansohn, D. (1957): An isolated single electroplax preparation I. New data on the effect of acetylcholine and related compounds. Biochimica et biophysica acta 26: (1) 1–15
von der Emde, G.; Fetz, S. (2007): Distance, shape and more: recognition of object features during active electrolocation in a weakly electric fish. Journal of Experimental Biology 210: (17) 3082–3095
Abbildungsverzeichnis
Abbildung 1: Wikimedia Commons
Abbildung 2: Copyright Lisa Xylander
Abbildung 3: Copyright Lisa Xylander
Abbildung 4: Copyright Lisa Xylander
Abbildung 5: Copyright Lisa Xylander