Ellenanyagok a nyálkahártyán: IgM, IgG, IgD az IgA mellett
Contents
Bevezetés
A szervezet idegen, káros anyagok elleni védelme az immunrendszer feladata, amely számos egység - szervek, sejtek és molekulák- által képzett strukturális és funkcionális hálózat. Működését két részre, a természetes és az adaptív immunitásra oszthatjuk. Az előbbi nem specializálódik az egyes idegen anyagokra, míg az utóbbi nagymértékű antigén-specifitást mutat. Minden szervezet számára létezik egy olyan létfontosságú anyagstruktúra, ami ellen nem termel antitestet, ez pedig az úgy nevezett MHC (major histocompatibility complex), amely a test sejtjeinek felszínén kifejeződve a saját szervezethez tartozást igazolja. A védekezésben részt vehetnek a különböző immunsejtek – granulocyták, macrophagok, NK-sejtek, T- és B-lymphocyták –, illetve beszélhetünk egyéb molekulákról, amelyek a humorális immunitást biztosítják. Ilyenek többek között: a komplement rendszer tagjai, lysosimek, interferonok és az immunglobulinok. Mind a természetes, mind pedig a szerezett immunitás során fellépnek celluláris és humorális elemek is.
Az immunglobulinokról általában
Az immunglobulinok (Ig) az adaptív védekezés humorális részét biztosító fehérje molekulák, amelyek specifikusan ismerik fel és kötik meg az egyes antigéneket. Szerkezetüket különböző peptidláncok adják: könnyű (light, L) és nehéz lánc (heavy, H), ezek alkotják a variábilis (variable, V), illetve a konstans (constant, C) szakaszokat. Az ellenanyag aminoterminális vége az antigének megkötéséért felelős – Fab = Fragment Antigen Binding -, míg karboxiterminális vége az effektor részt adja – Fc = Fraction Crystallisable. A két vég eltérése adja a molekulák duális karakterét: monofunkcionális karaktert (antigén specifikus megkötése) a Fab, polifunkcionális karakterét (sejtfelszíni receptorhoz kötődés és sejtműködésbefolyásolása) az Fc.
Ig-k termelődése
Az ellenanyagokat a B-lymphocyták termelik több fázisban. A primer nyirokszervekben keletkeznek az elsődleges EA repertoire-t alkotó klónok, amelyek Ag stimulus hatására a szekunder nyirokszervekben plazmasejtté konvertálódnak és megkezdik a specifikus immunglobulinok termelését, amelyek a vérkeringésbe kerülhetnek. Epithel sejtekkel együttműködve keletkezhetnek ún. secretoros Ig-k (SIg), amelyek ellenanyag részét plazmasejtek termelik a submucosában, a hozzá kapcsolódó secretoros componens (SC) pedig a hámsejtek terméke. Ez a folyamat lejátszódhat több szervet, így például a bélt és a tüdőt borító nyálkahártyán is.
Főbb immunglobulinok a nyálkahártyán
Az alábbi táblázatban a nyálkahártyák védelméért felelős főbb ellenanyagok és alapvető tulajdonságaik láthatók, amelyekkel az összefoglaló további része foglalkozik.
Szempont |
IgA |
IgM |
IgG |
IgD |
Forma |
Oligomer |
Oligomer |
Monomer |
Monomer |
Fő hatáshely |
Belek, tüdő |
Belek, tüdő |
Belek, tüdő, urogenitális traktus |
Aerodigesztív traktus |
Megjelenés anyatejben |
Jelentős |
Nem jelentős |
Jelentős |
Nem jelentős |
Komplement aktiváció |
Nincs |
Van |
Nincs |
|
Indukciós utak |
T-sejt dependens és independens |
T-sejt dependens és independens |
Főleg T-sejt dependens |
Főleg T-sejt dependens |
Immun memória |
Hosszútávú |
Valószínűleg hosszútávú |
Hosszútávú |
Ismeretlen |
Reaktivitás mikrobiótákkal |
Van |
Van |
Nem jelentős |
Nem jelentős |
Reaktivitás patogénekkel |
Van |
Van |
Van |
Valószínűleg van |
Általános funkciók |
Bél homeosztázisának fenntartása, a kommenzalisták szabályozásával és a patogénekkel szembeni védekezéssel |
Bél homeosztázisának fenntartása, a kommenzalisták szabályozásával és a patogénekkel szembeni védekezéssel |
Bélben néhány kommenzalista befolyásolása, patogénekkel szembeni védelem |
Aerodigestiv antigének kontrollja |
Az IgA
Általános információk az IgA-ról
Az IgA az egyik -ha nem a- legfontosabb immunglobulin a szervezetben. Főleg 2 helyen található meg: a vérszérumban és a bélnyálkahártyán, valamint annak lumenében. Ezeket a fehérjéket ún. hosszúéletű plazmasejtek termelik, különböző antigénekre specifikus válaszként, ami 2 irányba tarthat. Az egyik a T-sejt független (TI=T-cell independent) út, ami a nem invazív baktériumokkal lép kapcsolatba. A másik a T-sejt függő (TD=T-cell dependent) lehetőség, aminek célpontjai az invazív pathogének (Bunker és Bendelac, 2018). A differenciálódott B-sejtek továbbá termelnek még egy IgA-kötő polipeptidet, amit angolul „joining chain”-nek nevezünk. Ennek feladata kettős: egy részről stabilizálja az IgA dimert, más részről liganduma a polimer Ig-receptornak (pIgR). Ezen receptor az epithel sejteken helyezkedik el és immunglobulinokat transzportál. IgM szállítására még képes, azonban IgG-re és IgD-re nem érzékeny. Az IgA erősen hajlamos a dimerizálódásra, amelynek során 2 IgA molekula a joining chain segítségével összekapcsolódik. Ez azonban nem mindenhol jellemző. Az egerekben a szérum- és az intraluminális IgA is dimer formában található meg, emberben azonban a szérum-IgA monomer.
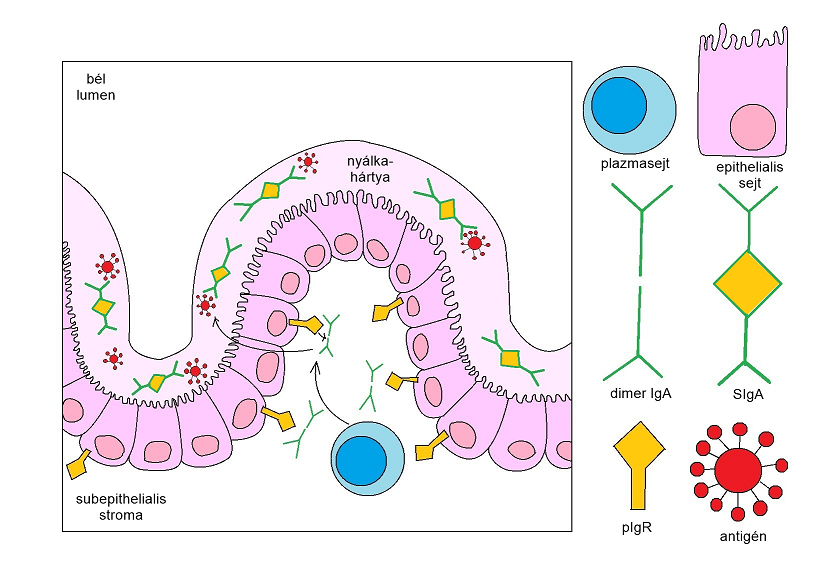
1. ábra: SIgA transzport
Az intraluminális IgA
Az intraluminális IgA továbbá tartalmaz még egy ún. secretoros komponenst, amely a pIgR-ből származik (1.ábra). Kovalens kötéssel kapcsolódnak egymáshoz, így jön létre a SIgA (=secretoros IgA). Ennek szerepe a stabilitás növelésében, illetve a molekula nyálkahártyához való kihorgonyzásában van. A SIgA szoros kapcsolatba kerül a bél lumenében megtalálható baktériumokkal, ősbaktériumokkal, vírusokkal, gombákkal és Protozoákkal, amelyeket együttesen microbiotának nevezünk. Ezt a környezetből szerezzük és az anya szervezetéből kapjuk meg. Emiatt nyilvánvaló, hogy fiatal állatok microbiotája még nem úgy néz ki, mint egy felnőtté; folyamatosan érik. Ezzel párhuzamosan nő az IgA klonális diverzitása is, ugyanis a különböző baktériumokat, stb., bevonják a SIgA molekulák, ezáltal jön létre a „SIgA-coated microbiota” (Macpherson és mtsai, 2008).
- A bélben lévő mikroorganizmusokat a fejlettebb gazdaállat szervezete idegenként ismerné fel és immunreakciót generálna ellenük. Ezt akadályozza meg többféle módszer segítségével az IgA. Egy lehetőség az immun-kirekesztés. Ennek lényege, hogy mivel a baktériumok be vannak fedve SIgA-k által, ezáltal elfoglalják a rajtuk lévő antigéneket, immunválasz kiváltása nélkül. Nagyon lecsökken annak a valószínűsége, hogy más immunsejt esetleg mégis talál szabad antigént, ezáltal minimálisra csökken a gyulladáskeltő interakciók száma. Többek között az endogén baktériumok által termelt TLR (Toll-like receptor) is el lesz rejtve, aminek nagy jelentősége van a homeostasis fenntartásában. Egy másik alternatíva a káros baktériumok növekedésében részt vevő molekulák, például enzimek célbavétele. Ezzel szorosan összefügg az agglutináció serkentése, ezáltal a pathogének mozgékonyságának csökkentése, illetve a gyorsan osztódó leánysejtek keresztkötése. A lumenből nem fognak tudni kijutni a nagyméretű, agglutinált baktériumok, le is láncolódnak a bélfalhoz a glycanok által, amik a secretoros komponens részei. Az immunválasz ellenük könnyen megindul, közben természetesen a SIgA-coated saját microbiota antigénjei ellen nem keletkezik specifikus ellenanyag. Egy microbialis szabályozó rendszer a bélben természetesen jelen lévő mikroorganizmusok molekuláris szerkezetét megváltoztatja, annak érdekében, hogy a SIgA nagyobb affinitással kötődjön az antigénjeikhez. Ez a folyamat az ún. immune inclusion. Az utolsó megemlítendő lehetőség a szimbiózis fenntartásában az, hogy a TD-út által indukált IgA termelés a lymphoid tüszők germinális centrumában (Peyer-plakkok) a microbiota által szabályozott. A follicularis T-sejtek, amik a folyamatban részt vesznek, gyulladásgátló molekulákat expresszálnak, például a TGFß-t vagy a PD1-et.
Különböző sejtek szerepe az antigének megkötésében
A gazdaszervezetben ún. FAE=folliculus associated epithelium teszi lehetővé az antigének bejutását a tüszőkbe. Ezeket a folyamatokat a FAE-like stuktúrák mediálják, mind a vékonybélre, mind a vastagbélre jellemzők. A kehelysejtek vagy más néven Goblet-sejtek a bélnyálkahártya epitheliumsejtjei között diffúzan helyezkednek el. Legfontosabb feladatuk a mucintermelés, amely bevonja a bélfal lumen felé eső részét. Jelentősége, hogy a kötetlen és a SIgA-kötött antigéneket glycan-mediált úton „elkapja” különböző receptorok segítségével, ezek pl. glycoprotein-2 vagy dectin-1, esetleg más C-hidrát kötő receptorok.
- Az oldódó antigéneket speciális macrophagok interepithelialis nyúlványai is megköthetik egy antigén-SIgA komplexre érzékeny receptorral. Ezeknek a jelfogó molekuláknak a mennyiségét meghatározza az IgA termelés, illetve az, hogy a SIgA mono- vagy polireaktív természetű. Az ún. M-sejtek is képesek felismerni az antigéneket, amiket ezután a DC/dendritikus sejteknek visznek. A DC sejtekhez az információ érkezhet kehelysejt-asszociált úton keresztül is. A macrophagok és a dendritikus sejtek az APC (antigen presenting cells) sejtek közé tartoznak. Az antigén prezentálást MHC egyes vagy kettes típusú receptorok segítségével végzik, a célsejtek pedig különböző T-sejtek. Megjegyzendő, hogy az M-sejtek saját maguk is elindíthatnak TD-út indukált IgA produkciót azzal, hogy az antigéneket direkt módon eljuttatják a B-sejtekhez (Mann és Xuhang, 2014).
Antigén kötés és válasz kialakulása
A különböző mikroorganizmusok sajátos felszíni struktúráinak felismerésére több stratégiát is ismerünk. A SIgA antigén kötő Fab-szegmensével (fragment antigen binding) speciálisan, az Fc (fraction crystallisable) és különböző secretoros komponens részek segítségével pedig nem speciálisan köti őket. A kialakuló válasz lehet a T-sejtektől függő, valamint azoktól független (Bunker és Bendelac, 2018).
A TD- úton keresztül magas affinitású IgA képződik, ami nagyon specifikusan köti a mikroorganizmusok antigénjeit. Kiemelendő a szerepe az APC-sejteknek, illetve az MHC (major histocompatibility complex) molekuláknak. Az invazív baktériumokat veszi célba legfőképpen, azonban a különböző fajok/törzsek más-más módon formálják ezt az ösvényt. Ez gyakorlatilag abban nyilvánul meg, hogy melyik T-sejtekre hat az adott mikróba antigénje. Például egerekben az Akkermansia muciniphilia esetében a Tfollicular helper (Ansaldo és mtsai, 2019), a szegmentált, filamentumokkal rendelkező baktériumok esetén pedig Thelper17 dominál. A jótékony mikroorganizmusok által aktivált szabályozó T-sejtek (Treg) pedig a káros Protobacteriumokat korlátozzák. A TFH-sejtek közvetlenül a B-sejtekre hatnak, ami megindítja a germinális centrális reakciót. Itt történhet meg pl. az osztályváltás/class-switch (CSR) is. Az antigéneken található egy ún. flagellin, amely egy motilitási protein. Ezt a TLR5 ismeri fel és ez váltja ki a mucosaban a SIgA, valamint az IgG produkciót. Az SIgA sokkal specifikusabban, nagyobb affinitással kötődik a flagellinhez, ezáltal elfojtva a baktériumok és az IgG együttműködését. Ha TLR5 hiány van vagy nem alakul ki immunreakció a flagellin molekulára, akkor a bélbarrier Protobacterium-ok és Firmicutes-ek számára átjárhatóvá válik, így az ellenük való védelem jelentősen csökken (Cullender és mtsai, 2013).
- A TI-ösvényhez asszociáltan létrejövő secretoros IgA-k sokkal kisebb affinitással bírnak, illetve rengeteg különböző baktériumhoz tudnak kapcsolódni specifikusan, legalábbis egérben. Nem specifikus glycan-mediált interakció történik pl. a Bacteriodesek TLR receptorai és az antitest Fc-doménja között, mely befolyásolja az ún. MAFF-géneket (mucus-associated functional factor), ami pedig hatással van a poliszacharidok hasznosítására. Ez felborítja a Bacteriodes és a Firmicutes törzs közötti szimbiózis egyensúlyát a bélben, a kolonizációk egymással kompetitív viszonyba kerülnek, metabolikus aktivitásuk változik. Rágcsálókban MHC-II-függő szabályozó funkciók találhatóak meg a lymphonodusokban.
Mikrobiota metabolitok hatása az IgA produkcióra
A microbioták metabolitjai a fehérjék, zsírok, egyéb nagyméretű molekulák lebontása során keletkező melléktermékek. Ezek közül kiemelendőek a rövid láncú zsírsavak/SCFA (acetát, propionát, butirát), amelyek modulálhatják az IgA-termelést (Kim és Kim, 2017). Hatásaik a következők: egyrészt gyorsítják a B-sejtek metabolizmusát, hogy sok energiában gazdag vegyület (ATP, acetil~KoA) keletkezzen, amik kellenek az IgA-szintézishez. Másrészt molekuláris utakon keresztül direkt vagy indirekt módon serkentik a B-sejt aktivációt és differentációt. Harmadrészt növelik a B-sejtekben a génexpressziót. Ennek hatására több IgM alakul át IgA-vá (CSR), illetve a sejt maga gyorsabban alakul át plazmasejtté. Negyedrészt az SCFA-k kis méretének köszönhetően könnyen, gyorsan felszívódnak, így a szisztémás IgG-produkcióra is hatnak. Ötödrészt indukálják a TregàTFH átalakulást, ezzel a T- és B-sejteket is aktiválva. Ennek a gyulladás megelőzésében is van szerepe. Összefoglalva elmondható, hogy a metabolitok szabályozzák az IgA választ, ugyanakkor az ellenanyagok is szabályozzák a mikroorganizmusok által kibocsájtott metabolitokat, illetve azok interstitialis barrieren keresztüli kijutását a gazdaállat/host szerveihez (Kato és mtsai, 2014).
Az IgM
Általános információk az IgM-ről
Az IgM-ek a legősibb antitestek, amelyek megtalálhatók mind a keringésben, mind a nyálkahártyák felüleltén - ezen belül is kiemelt szerepük van a tüdőben és a belekben. Felépítését tekintve az ellenanyag két nehéz láncból és ezekhez kapcsolódó egy-egy könnyű láncból álló homodimer. A nyálkahártyák védelmében fontos szerepet játszó SIgM pentamerek formájában van jelen. Ezt az SIgA-hoz hasonlóan „joining chain” stabilizálja és kevésbé erősen ugyan, de SC-t (SC=secretory component) köt, amely szintén az antitest védelmét szolgálja (Chen és mtsai, 2020). Szervezetben betöltött szerepük egyaránt immunoprotektív és regulatív. A humorális védekezés során elsőként jelennek meg a szervezetben, köszönhetően a B-sejtek genetikai sajátosságának. Nagyban közrejátszanak a nyálkahártyák homeosztázisának fenntartásában. Az Fcα/µR receptorokon immunregulációs jeleket közvetítve hozzájárulnak a B-sejtek fejlődéséhez, illetve a létrejövő kötés hatására TLR aktiváció és cytokin termelés indul meg a sejtekben (Michaud és mtsai, 2020). Habár az IgM az egyik elsőként felfedezett immunglobulin, a vele kapcsolatos kutatások csak most kezdenek igazán megindulni.
SIgM megjelenése a szervezetben
Rágcslókban az SIgM termeléséért B-1 illetve IgM+ B-memóriasejtek (MZB = Marginal Zone B Cells) felelősek. Le Gallou és mtsai (2018) kimutatták, hogy az MBC-k a lép B-2 sejtjeiből származnak és az élet későbbi szakaszaiban is klonális kapcsolatban maradnak a keringésben lévő Ig-t szekretáló telepekkel, amelyek megfelelő működéséhez luminális antigének szűkségesek. A bélben fellépő immunválasznak köszönhetően, ezek a sejtek szisztémás védelmet tudnak biztosítani a keresztreaktív antigénekkel szemben. Az egerekkel ellentétben emberben nem lehet egyértelműen elkülöníteni B-1 és B-2 sejteket CD5 expressziójuk alapján, azonban több kutatás során fény derült arra, hogy mely sejttípusok termelnek IgM-et – így például: CD20+ és több MZ-like B-sejt (Michaud és mtsai, 2020). Emlősökben az élet első immunreakciói közé tartozik a nyálkahártyák kolonizációja a kommenzalista fajok által, amely folyamatban a maternális IgM-nek nagy szerepe van. Pineda-Martínez és mtsai (2016) kimutatták, hogy az első egy hónapban alig, vagy igen kis mértékben termelődik a szervezetben saját IgM a nyálkahártyákon, így a szervezet az anyatejjel felvett immunanyagok által alakítja a toleranciáját a bél mikrobiomjával szemben. Ehhez járul még a korai időszakban a csökkent képesség a CSR-re (CSR = Class Switch Recombination). Ezen tényezők által a hasznos mikroorganizmusokkal szemben nem alakul ki immunválasz az egyedben.
SIgM a nyálkahártyák felüleltén
SIgM a tüdőben
A tüdő immunitása főként a B-1a sejtek antitest termelésétől függ, amelyet több, egereken végezett kutatás eredménye is alátámaszt. Ezek közé tartozik Weber és mtsai (2014) kísérletsorozata: B-sejt hiányos állatokat fertőztek több kórokozóval – például Streptococcus pneumoniae –, ezekben a csoportokban nagyobb halálozási arányt tapasztaltak a B-sejttekkel rendelkezőknél. Ám a beteg egerekbe transzplantált megfelelő lymphoid sejtek megmentették a kezelt egyedeket. Kimutatták az SIgM szerepét FcµR-függő mechanizmus általi antivirális-antitest termelésben is (Michaud és mtsai, 2020).
SIgM a belekben
Az SIgM a béllumenbe SIgA-hoz hasonlóan J-lánc segítségével szekretálódik az epithel sejtek által (transcytosis), és onnan nagy valószínűséggel az M-sejteken keresztül vissza is tud szívódni (RT = Reverse Transcytosis). A nyálkahártyán növeli a kommenzalisták diverzitását, azokhoz és pathogénekhez köt. Az utóbbiakat feltehetően még SIgA-nál is nagyobb potenciállal képes neutralizálni. Mivel a két szekretált antitest által megkötött microbiota összetétele nagy százalékban lefedi egymást, az SIgM szerepe a SIgAd-s (SIgA-defficiency) betegekben figyelhető meg legjobban. Ezek az emberek általában tünetmentesek, mivel a termelődő SIgM képes kompenzálni az SIgA hiányát. Diszbiózis azonban kialakul, hiszen bizonyos fajokhoz egyáltalán nem, vagy kevésbé kötődik - például Enterobacteriae. A fajösszetétel mellett azok térbeli elrendeződése is megváltozik, illetve a természetes körülmények között az oropharynx-ot benépesítő fajok is megjelennek a belekben. Már vannak kutatások az SIgMd-vel érintett betegekre irányulóan is, akiknél a kompenzációs folyamatok miatt szintén nehéz tüneteket kimutatni. Azonban sikerült leírni ezekben az esetekben visszatérő bakteriális és protozoás fertőzéseket, illetve nagyobb kitettséget IgE- és IgG-hiányos autóimmun-betegségeknek (Michaud és mtsai, 2020).
Az IgG
Általános információk az IgG-ről
IgG nagyobb mennyiségben vagy hasonló bőséggel van jelen, mint az IgA a reproductív szervekben illetve az alsó légutakban (Brandtzaeg és mtsai, 1999). A felső légutakban, a belek nyálkahártyáján, az emlőmirigyekben és a könnymirigyben kisebb a koncentrációja, de bármilyen fertőző ágens bejutásának hatására ez a szám megnőhet. Általánosságban elmondható, hogy az IgG erősíti a mucosa homeosztázisának fennmaradását, azzal, hogy kontrolálja az invazív és non-invazív nyálkahártya baktériumokat. A folyamat során ezeket az immunfehérjék eljutnak a bélcsatorna lumenébe, ott a mikroorganizmusokat az epitheliális FcRn receptorokhoz kötik (Rath és mtsai, 2014). Fontos, hogy a bélcsőben az IgG monomer csak kismértékben tudja kifejteni a védekező funkcióját, ezért kooperál a polimer SIgA-val és SIgM-mel, illetve szintén monomer formában előforduló IgD-vel.
Az IgG alosztályok
Emberek esetében IgG alosztályait két esetben lehet jól szemléltetni. Akkor, ha a béltraktusban valamilyen gyulladás alakul ki, akkor IgG1 és IgG3 termelődik, ezek mellett Fcγ receptor szignál is aktiválódik (Rengarajan és mtsai, 2019). Azonban, ha egészséges a mucosa, akkor IgG2 és IgG4 termelődik, a receptormechanizmus pedig inaktív marad (Benckert és mtsai, 2011). Az egerekben előforduló IgG változatoknál az IgG1 nagy hasonlóságot mutat-gyakorlatilag megfelel-a humán IgG4-nek.
Védekező mechanizmus felnőtt egyedek esetében
Mind egészséges emberben, mind egészséges egérben IgG adaptálódott az adott faj bélrendszerben élő szimbionta mikroflórára. Azonban jelen van a keringésben is, elég magas számban, emiatt feltételezhető, hogy intestinumban lévő IgG-ket termelő plazmasejtek a csontvelőben is megtalálhatóak. Lényeges megjegyezni, hogy szérum IgG nem mutat átfedést a SIgA és a belekben élő szimbionta baktériumok kapcsolatával, ennek okán a specifikus védekező funkció mellett bizonyítható, hogy IgG kontrolálja ezeknek a mennyiségét, ezzel erősítve a szimbiózist és fenntartja a bonyolultabb szerveződés homeosztázisát (Fadlallah és mtsai, 2019). A mucosa IgG védekező mértékét a bélrendszerben jól be lehet kísérletesen bemutatni Citrobacter rodentiummal fertőzött egérben. Ennek oka, hogy ezzel a patogén fajjal fertőzött állatban szignifikánsan csak az IgG koncentráció nő meg, a többi antitest száma kevésbé. Így, a C. rodentium opszonizálhatóvá válik a neutrophil granulociták által. A vizsgálat oka, hogy a különböző hasmenést és egyéb bélrendszeri megbetegedéseket okozó betegségek komoly problémát okoznak a humán társadalom számára. Közel 1 milló 5 éven aluli gyermek hal meg évente enteralis tüneteket okozó fertőzésekben. Enteropathogenic Escherichia coli (EPEC) az egyik olyan baktérium, amely hasmenést okoz gyerekekben, azonban felnőttek esetében nem kell számolni komolyabb veszéllyel. C. rodentium egy egereket támadó baktérium, ami jó modellként szolgált e probléma vizsgálatára (Law és mtsai, 2013). A kísérletben anyaállatokat fertőztek meg orálisan hővel inaktivált EPEC baktériumokkal, majd anyatej tartalmának fehérje frakcióját vizsgálták (2.ábra). Eredményként, azt kapták, hogy a pathogén specifikus IgG koncentráció a maternális fertőzés után megnőtt és így védelmet nyújtott a kölykei számára is (Caballero és mtsai, 2019).
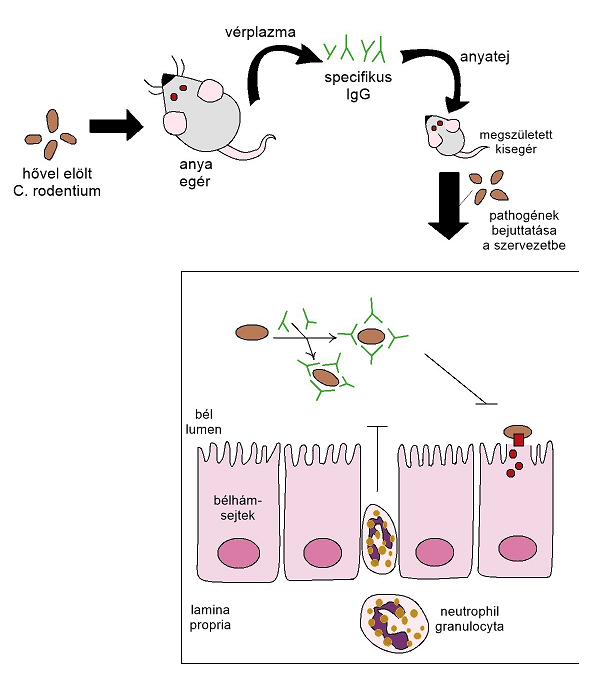
2. ábra: C. rodentium kísérlet
Az új kutatások és kísérletek szerint azonban az IgG termelődést növelő fertőzések nemcsak egyes bélszakaszokra terjednek ki. Összességében tehát, az IgG szint növekedése kontrolálja a szimbionta és patogén baktériumokat, a szabályozatlan termelődése azonban hozzájárul a komoly gyulladásos folyamatok kialakulásához.
Védekezés magzati korban és újszülött esetén
A magzati korban az IgG szint is rendkívül fontos, hiszen ezek által történik az immunrendszer és a kedvező bélflóra közötti adaptáció, illetve ezek által ismeri fel majd az immunrendszer a nem-saját fehérjéket, vagyis az idegen antigéneket. Az újszülöttek esetében a transplacentaris IgG szolgáltatja a védelmet a különböző patogénforrások ellen, továbbá a colostrummal is eljut a bélnyálkahártyához, így létrejön a maternális immunitás. Ellentétben a tejjel transzportált SIgA-val, patogén specifikus IgG-re van szüksége az egyedeknek a nyálkahártya fertőzésekkel szemben. Ezeknek a már specializálódott ellenanyagoknak azonban el kell érni a különböző bélszakaszokat, hogy ki tudja fejteni hatását és ezek származhatnak anyai oldalról vagy az általános FcRn cirkulációból. Mind a felismerési, mind pedig toleráló funkció, valamint az allergia ellenes védelem középpontjában az előbb megemlített FcRn-nek köszönhető. Ez egy olyan transzportfehérje, mely átjuttatja a tárgyalt antitestet az epithel sejteken keresztül a bél, a tüdő, a nemiszervek és az emlőmirigy mucosájába. Ez felelős azért is, hogy a placentán keresztül a fejlődő magzatba jusson, ezzel egy természetes, de passzív immunizálást biztosítva életének kezdete során. Az embrióban és a felnőtt egyedben is képes apicalis-basolateralis transzportot is véghezvinni, a korábban említett korlátozás és védekezés miatt. IgG továbbá képes a lumenbe is bejutni a transzport során, szabályozatlan esetben a sok IgG itt is gyulladásos folyamatokat is tud generálni (Rath és mtsai,2014).
Az IgD
Nemcsak B-sejtek antigén receptoraként, létezik hanem, mint szekretált antitest. Érdekesség, hogy a humán savóból ezt az ellenanyagok mutatták ki először. Szekrécióját az IgM-IgD+ plazmasejtek végzik, melyek nagyrészt a nyálkahártyákból származnak, itt történik a CSR. Egérben IgM-IgD érés a nasalis lymphoid szövetekben és egyes nyirokcsomókban (lymphonodus submandibularis et mesentericus) mutatnak hasonló altivitást. Emberek esetében ezt a folyamatot eddig a légzőrendszer területén, a tonsilla palatinában, tonsilla pharyngean illetve egyéb lymphoepithelialis szervekben írtak le. A plasmasejtek a szekretáláson túl, eljutnak a systemás keringésbe, majd onnan a glandula lacrymalisba, az egyes nyálmirigyekbe, és az emlőmirigyekben is kimutathatóak (Koelsch és mtsai, 2007). IgD sok szempontból egyedüli az antitestek közül. Először is, nem kötődik semmilyen Fcδ receptorhoz, ennek valószínűleg evolúciós okai vannak, másodszor, nagy a mutációs rátája az emberi antitest nehéz láncának 3-as régiójában. A csontvelőből származó B-sejtek, érett FO sejtekké differenciálódnak, majd eljutnak a humán légzőrendszer részeit borító nyálkahártyaterületekre, egerek esetében pedig, az egyes nyirokcsomókba. Itt egy részük érése megindul, ami elősegíti a class-switching folyamatát, hogy IgM-ből IgD legyen. Azok a B-sejtek, melyek már IgD-t termelnek plasmasejtekké differenciálódnak és szekrétumaikat lokálisan és a vérbe is eljuttatják. Azzal, hogy ez az antigén felismeri a non-invazív mikroorganizmusokat, a patogéneket legfőképpen a levegőből és az elfogyasztott ételből származókat, IgD megerősíti a mucosa antigének elleni védelmét (3.ábra). Emellett, a receptor hiány ellenére, IgD hozzákötődik a basophil granulocitákhoz és a hízósejtekhez egy receptor komplex segítségével. E kapcsolat létrejöttével cytokininek, különböző kemikáliák, tumor necrosis factorok illetve interleukinok (IL-4, IL-5, IL-3) kerülnek az interstitiumba. Fokozásképpen magas IgD koncentráció elindít egy másik kaszkádot, melyet az IgE-vel kapcsolódott basophil- és hízósejtek degranulációja indukál (Cindy és mtsai, 2018).
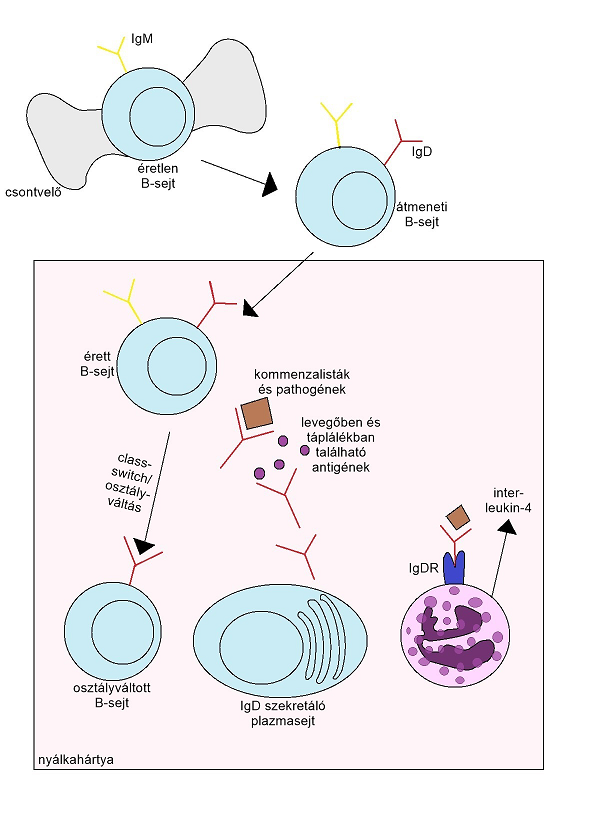
3. ábra: IgD hatásmechanizmus
Ez az ellenanyag feltehetőleg már 500 millió éve létezik, megtalálható a halaktól kezdve az emlősökig evolúciós értelembe véve. Annak köszönhetően, hogy kötődni tud az egyes fehérvérsejtekhez és a hisztamint szekretáló hízósejtekhez, meg tudja növelni a gyulladásos folyamatokat. Továbbá érdemes megjegyezni, hogy szoros kapcsolatban van az IgE-vel is, ugyanis az említett antitest is ugyanezt a funkciót látja el. Ebből levonható egy olyan következtetés, hogy talán IgD kötődés által, a folyamat további felerősítése érdekében IgE szekréció is megindul (Chen és mtsai, 2009).
Konklúzió
Összességében elmondható, hogy mind az emberi, mind az állati nyálkahártyákon megjelenő immunválaszokat több immunglobulin típus együttesen határozza meg. Ezek szorosan összefüggnek egymással, olyannyira, hogy bizonyos Ig-hiány esetén akár a többi átveheti annak az egynek a szerepét és ennek eredményeképp gyakorlatilag tünetmentesen él az egyed. Immunológia terén még rengeteg kutatni- és felfedeznivaló van. Minél többet tudunk meg, annál több kérdés is vetül fel bennünk. Minden egyes vizsgálat egyre közelebb visz minket ahhoz, hogy teljes valójában megértsük az immunrendszer működését, illetve ezen belül az állatfajonkénti különbségeket.
Irodalomjegyzék
- Ansaldo, E.; Slayden, LC.; Ching, KL.; Koch, MA.; Wolf, NK.; Plichta, DR.; Brown, EM.; Graham, DB.; Xavier, RJ.; Moon, JJ.; Barton, GM. (2019): Akkermansia muciniphila induces intestinal adaptive immune responses during homeostasis. Science 364: (6446) 1179-1184
- Benckert, J.; Schmolka, N.; Kreschel, C.; Zoller, M. J.; Sturm, A.; Wiedenmann, B.; Wardemann, H. (2011): The majority of intestinal IgA+ and IgG+ plasmablasts in the human gut are antigen-specific. J. Clin. Invest. 121: (5) 1946–1955
- Brandtzaeg, P.; Farstad, IN.; Johansen, FE.; Morton, HC.; Norderhaug, IN.; Yamanaka, T. (1999): The B-cell system of human mucosae and exocrine glands. Immunol. Rev. 171: 45–87
- Bunker, JJ.; Bendelac, A. (2018): IgA Responses to Microbiota. Immunity 49: (2) 211-224
- Caballero, F. G.; Sakamoto, K.; Zeng, MY.; Wang, Y.; Hakim, J.; Matus-Acuña, V.; Inohara, N.; Núñez, G. (2019): Maternal immunization confers protection to the offspring against an attaching and effacing pathogen through delivery of IgG in breast milk. Cell Host Microbe 25: (2) 313–323
Chen, K.; Magri, G.; Grasset, E. K.; Cerutti, A. (2020): Rethinking mucosal antibody responses: IgM, IgG and IgD join IgA. Nature Reviews Immunology [Epub ahead of print] https://doi.org/0.1038/s41577-019-0261-1
- Cindy, G.; Kang, C.; Andrea, C. (2018): The enigmatic function of IgD: some answers at last. Eur J Immunol. 48: (7) 1101–1113
- Cullender, TC.; Chassaing, B.; Janzon, A.; Kumar, K.; Muller, CE.; Werner, JJ.; Angenent, LT.; Bell, ME.; Hay, AG.; Peterson, DA.; Walter, J.; Vijay-Kumar, M.; Gewirtz, AT.; Ley, RE. (2013): Innate and adaptive immunity interact to quench microbiome flagellar motility in the gut. Cell Host Microbe 14: (5) 571-81
- Fadlallah, J.; Sterlin, D.; Fieschi, C.; Parizot, C.; Dorgham, K.; El Kafsi, H.; Autaa, G.; Ghillani-Dalbin, P.; Juste, C.; Lepage, P.; Malphettes, M.; Galicier, L.; Boutboul, D.; Clément, K.; André, S.; Marquet, F.; Tresallet, C.; Mathian, A.; Miyara, M.; Oksenhendler, E.; Amoura, Z.; Yssel, H.; Larsen, M.; Gorochov, G. (2019): Synergistic convergence of microbiota- specific systemic IgG and secretory IgA. J. Allergy Clin. Immunol. 143: (4) 1575–1585
- Kato, LM.; Kawamoto, S.; Maruya, M.; Fagarasan, S. (2014): The role of the adaptive immune system in regulation of gut microbiota. Immunology Rev. 260: (1) 67-75
- Kim, M.; Kim, CH. (2017): Regulation of humoral immunity by gut microbial products. Gut Microbes 8: (4) 392-399
- Koelsch K, Zheng NY, Zhang Q, Duty A, Helms C, Mathias MD, Jared M, Smith K, Capra JD, Wilson PC. (2007):Mature B cells class switched to IgD are autoreactive in healthy individuals. J. Clin. Invest. 117: (6) 1558–1565
- Law, R.J.; Croxen, M.A.; Scholz, R.; Keeney, K.M.; Wlodarska, M.; Finlay, B.B. (2013): Recent advances in understanding enteric pathogenic Escherichia coli. Clin. Microbiol. Rev. 26: (4) 822-880
- Le Gallou, S.; Zhou, Z.; Thai, L.; Fritzen, R.; Aires, A. V.; Mégret, J.; Yu, P.; Kitamura, D.; Bille, E.; Tros, F.; Nassif, X.; Charbit, A.; Weller, S.; Weill, J. C.; Reynaud, C. A. (2018): A splenic IgM memory subset with antibacterial specificities is sustained from persistent mucosal responses. Journal of Experimental Medicine 215: (8) 2035–2053
Macpherson, AJ.; McCoy, K. D.; Johansen, F. E.; Brandtzaeg, P. (2008): The immune geography of IgA induction and function. Mucosal Immunology 1: (1) 11-22
- Mann, E. R.; Xuhang, L. (2014): Intestinal antigen-presenting cells in mucosal immune homeostasis: Crosstalk between dendritic cells, macrophages and B-cells. World J Gastroenterol 20: (29) 9653-9664
- Michaud, E.; Mastrandrea, C.; Rochereau, N.; Paul, S. (2020): Human Secretory IgM: An Elusive Player in Mucosal Immunity. Trends in Immunology 41: (2) 141-156
Pineda-Martínez, S.; Hernández-Islas, J. L.; Escobedo-Torres, M. P.; Paredes-Alonzo, I. E.; López-Candiani, C.; Correa, D.; Vela-Amieva, M. (2016): Immunoglobulin Concentrations in Plasma and Saliva During the Neonatal Period. Pediatrics & Neonatology 57: (3) 213-218
Rath, T.; Baker, K.; Pyzik, M.; Blumberg, R. S.(2014): Regulation of immune responses by the neonatal Fc receptor and its therapeutic implications. Front. Immunol. https://doi.org/10.3389/fimmu.2014.00664.
Rengarajan, S.; Vivio, E. E.; Parkes, M.; Peterson, D. A.; Roberson, E. D. O.; Newberry, R. D.; Ciorba, M. A.; Chyi-Song, H. (2019): Dynamic immunoglobulinresponses to gut bacteria during inflammatory boweldisease. Gut Microbes https://doi.org/10.1080/19490976.2019.1626683
- Weber, G. F.; Chousterman, B. G.; Hilgendorf, I.; Robbins, C. S.; Theurl, I.; Gerhardt, L. M. S.; Iwamoto, Y.; Quach, T. D.; Muhammad, A.; Chen, J. W.; Rothstein, T. L.; Nahrendorf, M.; Weisslender, R.; Swirski, F. K. (2014): Pleural innate response activator B cells protect against pneumonia via a GM-CSF-IgM axis. Journal of Experimental Medicine 211: (6) 1243-1256
Ábrajegyzék
A következő tudományos publikációk alapján történt az ábrák elkészítése:
Táblázat: Chen, K.; Magri, G.; Grasset, E. K.; Cerutti, A. (2020): Rethinking mucosal antibodyresponses: IgM, IgG and IgD join IgA. Nature Reviews Immunology: https://doi.org/10.1038/s41577-019-0261-1
1.ábra: Bharathikumar, V. M.; Adam, Z.; Xiefan, LS.; Edward K.; Ninkka, T.; Sathya, V.; Brian, G.; Sanjaya, S.; Rajkumar, G. (2020): Discovery and characterization of single-domain antibodies for polymeric Ig receptor-mediated mucosal delivery of biologics. MAbs 12: (1)1708030 https://doi.org/10.1080/19420862.2019.1708030
- 2.ábra: Caballero, F.; Sakamoto, K.; Zeng, M. Y.; Wang, Y.; Hakim, J.; Matus-Acuña, V.; Inohara, N.; Núñez, G. (2019): Maternal immunization confers protection to the offspring against an attaching and effacing pathogen through delivery of IgG in breast milk. Cell Host Microbe 25: (2) 313–323.
- 3.ábra: Cindy, G.; Kang C.;Andrea, C. (2018):The enigmatic function of IgD: some answers at last. Eur J Immunol 48(7): 1101–1113
