A fájdalom függőség fiziológiája; magatartásra gyakorolt hatások
|
A fájdalom elengedhetetlenül fontos az élőlények túléléséhez. Fájdalmat vált ki minden olyan inger figyelemfelkeltés gyanánt, mely veszélyes és káros a szervezetre nézve, ezáltal megvédve azt. Ebből adódóan nehéz elképzelni, hogy vannak olyan emberek, akik örömforrás céljából szándékosan keresik a fájdalmat. Megismerve az idegrendszerben, legfőképp az agy jutalmazó rendszerében (brain reward system) zajló folyamatokat és változásokat, erre a kóros pszichés magatartásra is magyarázatot kaphatunk.
Contents
A fájdalom
A fájdalom útja a perifériáról a központba
A fájdalom egy szenzomotoros, illetve érzelmeket befolyásoló és kognitív komponensekkel rendelkező komplex rendellenesség (Neugebauer, 2015). A fájdalom ingerét minden szervben megtalálható, szabad idegvégződések fogják fel, ezek a nociceptorok. Két típusuk ismert: a magas ingerküszöbű mechanoreceptorok, illetve a polymodális nociceptorok. Utóbbiak a sérülés következtében a szövetekből felszabaduló fájdalomkeltő anyagokkal (= algogének) ingerelhetőek; pl. hisztamin, bradykinin, szerotonin. Mindezek mellett olyan anyagok (eikozanoidok) is felszabadulnak a sérült szövetben, melyek túlérzékenységet (hyperalgesia) váltanak ki: olyan ingerek is fájdalomérzést keltenek, melyek alapvetően nem fájdalmasak. Az ingerületet szállító afferens idegrostoknak is két típusa van: Aδ (myelinizált) és C (nem myelinizált).
Rosttípus |
Aδ (myelinizált) |
C (nem myelinizált) |
Vezetési sebesség |
5-15m/sec |
0.5-2 m/sec |
Helyeződés |
testfelszín, izom, ízületek |
legtöbb szövetben |
Fájdalom érzékelése |
hirtelen, éles, jól lokalizálható |
diffúz, tompa |
A szinapszis helyeződése a dorsalis szarvban |
I és V zóna |
II. zóna (substantia gelatinosa) |
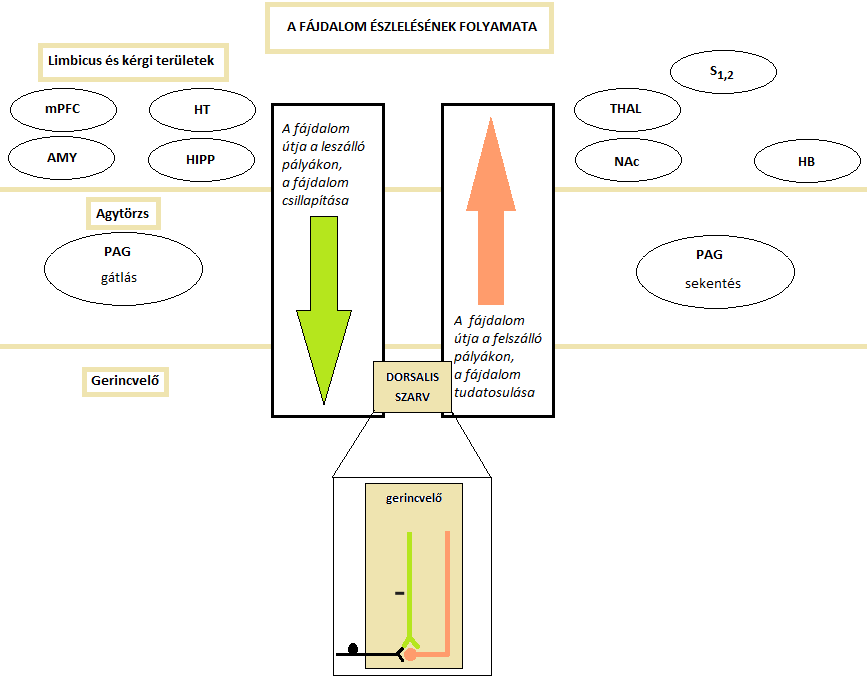
Az afferens rostok a gerincvelő dorsalis szarvába futnak be, ahol átkapcsolódnak egy másodlagos neuronra, majd a rostok kereszteződése után kontralaterálisan futnak felfelé a spinoreticularis és spinothalamicus tractusokon keresztül a felsőbb központokba. Az ascendáló pályák a thalamusba futnak, és ott átkapcsolódnak. A rostok a primer és secunder sensoros cortexbe jutnak, ahol tudatosul a fájdalom helyeződése és erőssége. Azonban, mielőtt a kortex értelmezni tudná, ezek a beérkező nociceptív jelek gátlódhatnak, illetve fel is erősödhetnek. Az elsődleges érzőkéreg mellett a nyúltvelői formatio reticularis, a prefrontális cortex, a hypothalamus és a limbikus rendszer is értesül a fájdalomingerről; e területek felelősek a fájdalomra adott reakciók modulálásáért (Steeds, 2009) [1. Ábra].
A limbikus rendszer részei (a formatio reticularis magvai, a colliculus superior, a nucleus parabrachialis és a hypothalamus mellett) fájdalommal kapcsolatos információt kapnak a nucleus thalamicus medialison és az agytörzsi magvakon keresztül a tractus spinothalamicus medialistól. Majd az információ feldolgozása után érzelmi, motivációs és kognitív aspektusokat közvetítenek, és félelmet, védekező válaszokat váltanak ki. A prefrontális kéreg feladata a fájdalom tudatosítása, felerősítése, elnyomása, emellett a tanulás, a tervezés és az információk összerendezése. A magasabb szintű agyi területek az agytörzsi magvakkal pl. a periaqueductalis szürkeállománnyal való kapcsolataik révén részt vesznek ezekben a modulációs folyamatokban (Elman és Borsook, 2015).
A fájdalom csillapítása
A fájdalom csillapítása történhet egyrészt a substantia gelatinosa aktivitásának csökkentésével, így a fájdalomküszöb megemelkedésével, vagy pedig az érzelmi reakciók megváltoztatásával. A fájdalom csillapításában a leszálló szerotoninerg és noradrenerg pályák játszanak szerepet: a gerincvelőben gátolják az ingerület átadását közvetlenül az 5-HT1 és 5-HT2 receptorokon keresztül, vagy közvetve a gátló opioid interneuronok felületén található 5-HT3-R közvetítésével. Az interneuronok aktiválódásával endogén opiátok (pl. enkephalin, dynorphin) szabadulnak fel, mely a perifériáról érkező Aδ és C rostokon helyeződő µ-opioid receptorokhoz kötődnek; a három receptortípus (µ, δ és κ) közül ezeknek van elsődleges szerepe a fájdalomcsillapításban. A gerincvelő dorsalis szarván kívül a Sylvius-féle zsilip és a III. agykamra körüli szürkeállományban, illetve a limbikus rendszeren belül a thalamus, az amygdala és a hyppocampus területén fordulnak még elő opioid receptorok (Murányi és Radák, 2008).
Az opioid rendszer
|
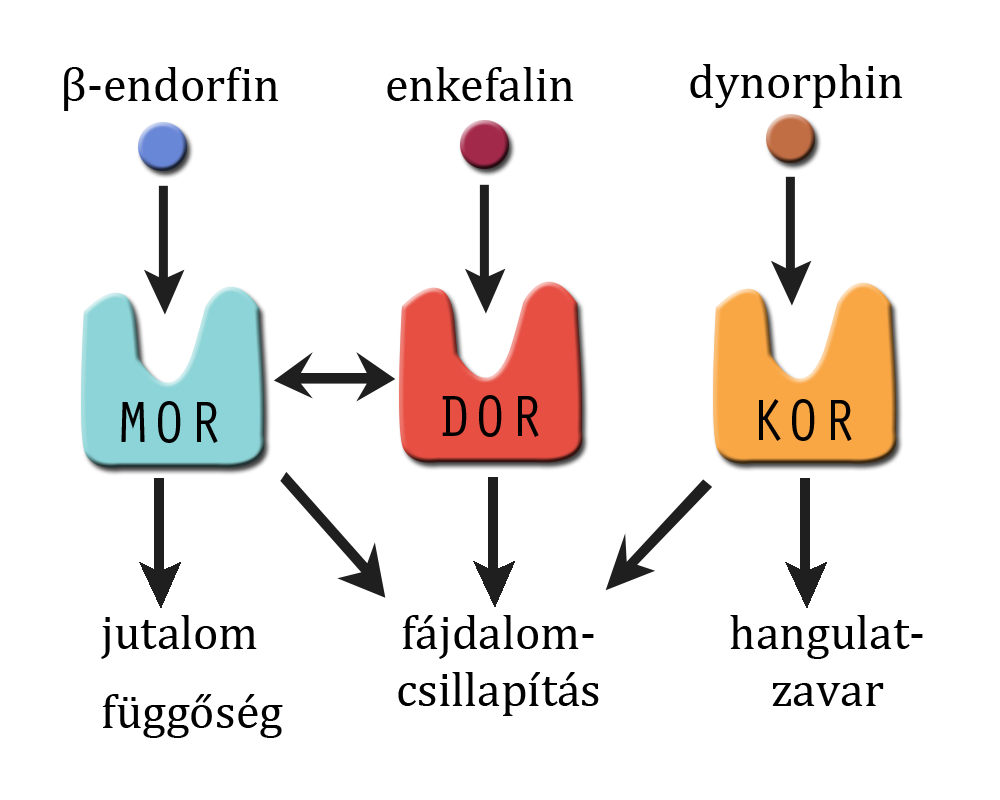
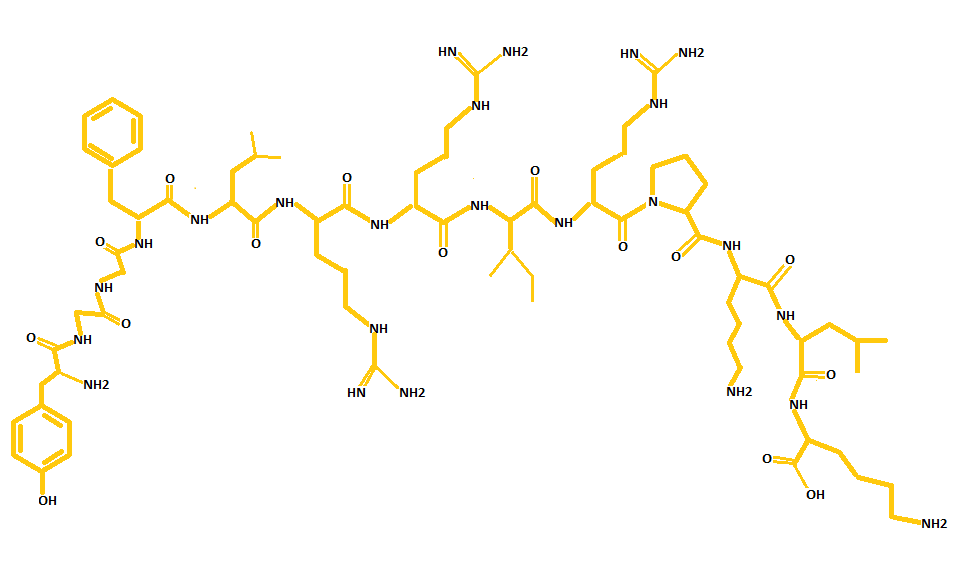
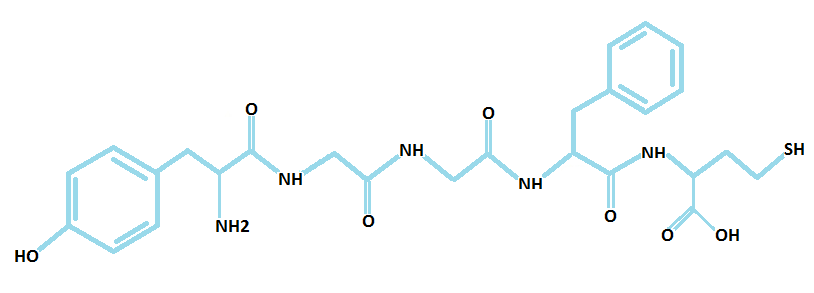
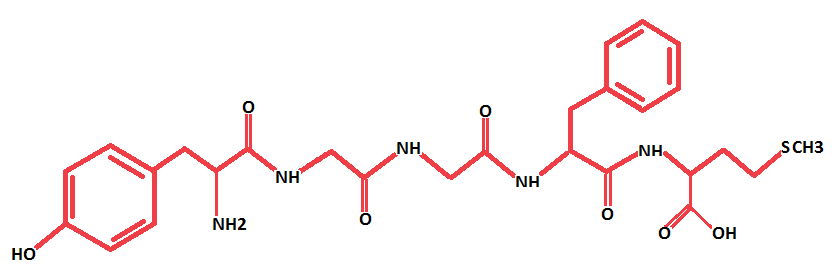
Az endogén opioidokat három opioid peptid prekurzor gén kódolja: az enkefalinokat [5. Ábra] a preproenkefalin, a dynorphinokat [3. Ábra] a preprodynorphin, a β-endorfint [4. Ábra] pedig a proopiomelanocortin (POMC); ezek mellett a rendszer tagjait képezik még a három (µ, δ és κ) receptor típust kódoló gének is. Az opioid receptorok a G-protein kapcsolt receptor család részei. A termelődő opioidok közül az enkefalinok a δ-, a dynorphinok a κ-, a β-endorfin pedig a µ-receptorokon hatnak (Kieffer és Gavériaux-Ruff, 2002; Murányi és Radák, 2008; Lutz és Kieffer, 2013; Befort, 2015).
Az opioidok hatásmechanizmusa
Az opioidok hatásukat pre- és posztszinaptikusan is kifejtik. Posztszinaptikusan G-proteinhez kötődnek, mely ebben az esetben deaktiválja az adenilát-cikláz enzimet, így csökkentve az intracelluláris cAMP szintet. Ennek következtében csökken a cAMP érzékeny protein-kinázok aktivitása, kiesik azok K+-csatornát foszforiláló szerepe: a csatornák nem nyitnak, a membrán nem hypopolarizálódik. Preszinaptikusan gátolják egyes ingerületátvivő anyagok és hormonok felszabadulását (pl. domapin), emellett csökkentik az idegsejtek tüzelését (Murányi és Radák, 2008).
Hatásaik
A különböző receptorok eltérő hatásokat közvetítenek, ezeket a hatásokat a mesterségesen létrehozott génhiányos, úgynevezett knockout egerekkel végzett kísérletek során figyelték meg. A µ-opioid receptorok (MOR) legfontosabb funkciója a fájdalomcsillapítása, emellett a jutalmazás folyamatában, ezzel összefüggésben az addikciós viselkedések kialakításában is szerepet játszik. A δ-opioid receptoroknak (DOR) is tulajdonítható egy bizonyos fokú jutalmazó és közérzetet javító hatás, de leginkább az összefüggéseken alapuló tanulásért felelősek. A KOR, azaz κ-opioid receptorok aktiválódása rossz közérzetet és fájdalomcsillapítást is okoz. A három receptor nagyon hasonló szerkezettel rendelkezik, a különféle opioid peptidek ezáltal alacsony szelektivitással, de igen nagy affinitással kötődnek mind a háromhoz. Ez teszi lehetővé, hogy a rendszer egy másik komponensének megnövekedett működése kompenzálja egy receptor vagy peptid esetleges hiányát (Kieffer és Gavériaux-Ruff, 2002) [2. Ábra].
Agyi jutalmazó rendszer
|
Az agy rendelkezik egy bizonyos jutalmazó rendszerrel (brain reward system), ami olyan létfenntartó cselekvésekre, mint a táplálkozás, szociális interakciók, szex, pozitív érzelmi reakciót vált ki, ezzel ösztönözve a szervezetet azok ismétlésére. Ez a rendszer több különböző agyi területet foglal magába, úgymint az area tegmentalis ventralis, a csíkolt test nucleus accumbense, a prefrontális cortex, a centralis és basolateralis amygdala (a medialis temporalis lebeny része), a hyppocampus, és ezek kölcsönös interakcióján keresztül működik (Koob, 2013; Russo és Nestler, 2013; Elman és Borsook, 2015).
A rendszert alkotó agyterületek, funkcióik
Ezen területek közül az agyi jutalmazó rendszer legfőbb komponenseit a középagyi area tegmentalis ventralis (VTA) dopamint termelő idegsejtjei és azok projekciói a nucleus accumbensszel (NAc), és a NAc-t a striatum dorsale-val összekötő striato-nigro-striatum hálózat adja. A jutalomnak a kiváltója a NAc dopaminszint emelkedése. A VTA-NAc útvonalat, ezáltal a reward system működését corticalis és subcorticalis, memória, fájdalom, stressz, hangulat, izgalom kialakításában részt vevő területek befolyásolják (Russo és Nestler, 2013; Elman és Borsook, 2015).
A rendszerben kulcsszerepet játszik még a mesolimbicus és habenularis neuronok közötti kölcsönös kapcsolat. A habenula idegsejtjei, ha az esemény valós értéke nem éri el a várt szintet (becslési hiba), növelik tüzelésüket, ezáltal gátló hatást fejtenek ki az örömérzet kialakításában szerepet játszó mediális prefrontális kéreg (mPFC) és a NAc dopaminerg neuronjaira az interpeduncularis és rostromedialis tegmentalis projekciós pályákon keresztül, így kikapcsolva a jutalom funkciót káros stimulusok hatására, mint a fájdalom és a stressz. Ellenkező esetben a neuronok csökkentik tüzelésüket. A jutalom funkció ezen kívül gátolható még a NAc-től a VTA-hoz térő GABA neuronok, illetve a mPFC-ből és a stria terminalisból a VTA-ba, és a hyppocampusból a NAc-be futó glutamáterg idegsejtek által (Elman és Borsook, 2015).
Opioidok szerepe
|
A jutalmazó rendszer alapvető részét képezi még az agytörzsi és a szétszórtan elhelyezkedő subcorticalis opioid neuronhálózat. Az opioidok hatásai az általuk aktivált receptor típusától függnek. A µ, δ vagy κ receptorok dopamin kibocsájtást serkentenek, illetve gátolnak, így örömöt és idegenkedést (pl. kielégületlenség, érzelmi és fizikai fájdalom, ingerlékenység) kiváltó hatásokat is közvetítenek (Elman és Borsook, 2015). Az addiktív anyagokhoz hasonlóan a heveny fájdalom is dopamin szekréciót vált ki a jutalmazó körön belül. Ezzel szemben a hosszantartó fájdalom növeli az opioidok transzmisszióját, melynek eredményeként csökken az agy opioid megkötő képessége, illetve dopaminhiányos állapotot eredményez a NAc és mPFC területén. Mindezek következtében jutalomhiány alakul ki (Elman és Borsook, 2015). Igen erős bizonyíték van az amygdala, és főleg a CeA jelentős szerepére az opioid függő fájdalom modulációban, valamint a jutalmazó mechanizmusokban. Utóbbiban a szenzoros, érzelmi és izgató ingerekre adott pozitív és negatív megerősítések feldolgozása által kap szerepet (Neugebauer, 2015).
Homeosztázisban betöltött szerep
Feltételezhetően ez a jutalmazó vagy motivációs kör, mely a túléléshez szükséges viselkedést támogatja, hozzátartozik a homeosztázis szabályozásához is. A homeosztatikus, motoros és motivációs összetevők között a legfőbb kapocs a lateralis hypotalamusban (LH) található. A LH-nak szerepe van a megerősítésben, a szenzoros és tanulási mechanizmusokban, illetve a metabolitok szintjének érzékelésében; utóbbit a fő hypotalamikus magokkal való összeköttetései teszik lehetővé. Emellett kapcsolatban áll az agytörzs magvaival is, melyek a táplálkozással kapcsolatos motoros funkciókat és az autonóm működéseket továbbítja (Elman és Borsook, 2015).
|
Addikció
A függőség egy allosztatikus állapot; az allosztázis a szervezet állandóságának, vagy a homeosztázis elérésének folyamata élettani vagy viselkedésbeli változásokon keresztül (Wikipedia). Azok a folyamatok, melyek a homeosztázis eléréséhez vezetnek, egyúttal a jutalmazó rendszer normális működéséhez és az érzelmi állapotok és motivációs késztetések stabilizálásához is elengedhetetlenül fontosak (Elman és Borsook, 2015).
Kialakulásának folyamata
Az addiktív anyagok olyan hosszantartó és erős növekedést idéznek elő a dopamin forgalomban, amely változásokat hoz létre az idegsejtek között (a jutalmazó/motivációs körön belül); ezáltal zavart szenved a rendszer, mert az élettani negatív feedback mechanizmusok már nem érvényesülnek. A rendszerben bekövetkezett funkciós zavar milyenségét (eltúlzott, vagy pedig hiányos jutalom), a neuron kapcsolatok módosulásának és a változást előidéző tényezők (mint a stressz és a fájdalom) természete a kölcsönhatások típusával (ami lehet kompetitív, szinergista és összeadódó) együttesen határozza meg. Például a függőséget kialakító tényezők - mint a fájdalom hatására felszabaduló opioidok - eleinte aktiválják a dopaminerg neurotranszmissziót, de az idő múlásával ellenkező hatást váltanak ki a rendszeren belüli adaptációk miatt. Az eredmény jutalomhiányos tünetegyüttes, a motivációért és jutalomért felelős agyterületek alulműködése miatt (Elman és Borsook, 2015).
A függőségre jellemző tünetegyüttes a reward systemben bekövetkező, már korábban megemlített hibáknak,- pl. jutalom hiány, károsodott gátló szabályozás, allosztatikus neuroadaptációk - tulajdonítható (Elman és Borsook, 2015). Azonban az addikciót előidéző molekuláris folyamatok nem ismertek. A mechanizmusok hátterében több dolog is állhat: a G-protein és a receptor szétkapcsolódása, azaz a deszenzitizáció; a down-reguláció, vagyis a sejt felületén kifejeződő receptorok számának csökkenése, valamint az internalizáció, melynek során a sejtfelszíni receptorok az intracelluláris térbe kerülnek be (Murányi és Radák, 2008).
Magatartásra gyakorolt hatások
Az addikciót eredményező központi idegrendszerbeli változások kiterjednek a magatartást és hangulatot, érzelmeket befolyásoló területekre - pl. amygdala - is, így az ezekben bekövetkező abnormalitásokért lesznek felelősek.
A különböző agyterületekben bekövetkező változások hatásai
Az amygdala, elsősorban a nucleus centralis (CeA) fontos szerepet játszik a fájdalommal kapcsolatos érzelmi válaszoknak, állapotoknak és zavaroknak - úgymint szorongás, depresszió és tanult félelem - kialakításában; ugyanis a CeA a spino-parabrachio-amygdala fájdalom útvonalon keresztül nociceptív-specifikus információt kap a gerincvelőtől és az agytörzstől. A basolateralis amygdala (BLA) szoros kapcsolatban áll a medialis prefrontalis kéreggel, így a BLA biztosítja az érzelmeken alapuló információt a végrehajtó funkciók - mint a döntéshozatal és a viselkedés - szabályozásának irányításához (Neugebauer, 2015).
A BLA glutamáterg neuronjainak hiperaktivitása a mPFC idegsejtjeinek túlzott gátlását okozza, mely egyrészt kognitív hiányosságokhoz, zavarokhoz a döntéshozatalban, másrészt az amygdala gátló szabályozásának kieséséhez is vezet. A károsodott corticalis szabályozás lehetővé teszi a CeA túlműködését, ez tehető felelőssé a szorongásszerű magatartásért, a félelem és hyperalgesia kialakulásáért (Elman és Borsook, 2015).
Az addikció és a depresszió szorosan összefüggenek, gyakori társbetegségek. Az ismétlődő addiktív anyagok stimulusa a hangulat homeosztázisának fenntartásáért felelős agyi területeken is változásokat hoz létre, ezáltal hozzájárul a depresszió kialakulásához (Lutz és Kieffer, 2013).
Dynorphin szerepe
Whitfield és mtsai (2015) rágcsálókon végzett kísérletekben kimutatták, hogy a KOR antagonisták blokkolják a stressz által előidézett drog jutalmat, drogkereső viselkedést, valamint az egyre növekvő drogfogyasztást. Tehát ebből következően a dynorphinnak jelentős szerep tulajdonítható a függőséggel kapcsolatos magatartások kialakításában (Chavkin és Koob, 2016).
Becslési hiba
A függőség során az addiktív anyaggal szemben tolerancia alakul ki (deszenzitizáció, down-reguláció miatt, Murányi és Radák, 2008), így a drogként szereplő stimulus agy által "megjósolt" és a tényelegesen bekövetkező hatása között különbség alakul ki. Ezt az úgynevezett becslési hibát a mPFC kódolja. Az idegrendszer ezt a hibát megpróbálja kompenzálni azáltal, hogy olyan cselekvéseket, viselkedéseket ösztönöz, melyek az addiktív anyag újbóli megszerzését segítik (Elman és Borsook, 2015).
Felhasznált irodalom
Murányi, M.; Radák, Zs. (2008): Fájdalom és opioidok. Orvosi Hetilap 149: (50) 2363-2370
Neugebauer, V. (2015): Amygdala pain mechanisms. Handbook of Experimental Pharmacology 227: 261-284
Ábrajegyzék
1. Ábra: A fájdalom útja, fájdalomgátlás (újrarajzolta: Czakó Lenke)
2. Ábra: Opioid receptorok (újrarajzolta: Varga Krisztina)
3. Ábra: A dynorphin-A szerkezeti képlete (készítette: Czakó Lenke)
4. Ábra: Az endorfin szerkezeti képlete (készítette: Czakó Lenke)
5. Ábra: A Met-enkefalin szerkezeti képlete (készítette: Czakó Lenke)