A GHRelin kutatások áttekintése, újabb eredményei
|
A Ghrelin kémiai szabályozó fehérje, 28 aminosav építi fel, a növekedési hormon (GH) secretagogue-receptor természetes liganduma. Kulcsszerepet játszik az energia bevitelben és raktározásban, az éhség/étvágy kialakításában, illetve a metabolikus folyamatok szabályozásában.
Két hormon az étvágyért
Étvágyunk szabályozásának felelősei a hypothalamusban lévő központok, melyek aktiválását a neuropeptid Y (NPY) végzi. E fehérje szabályozásában szerepet játszik a leptin nevű hormon és a ghrelin is. Leptin receptorok a hypothalamusban találhatók, melyekre hatva tudja az NPY termelődését csökkenteni, ezzel a jóllakottság érzését kelteni. A leptin növeli az energiafelhasználást és csökkenti a zsírraktározást, hiánya elhízáshoz vezet.
Ghrelin struktúrája és szintézise
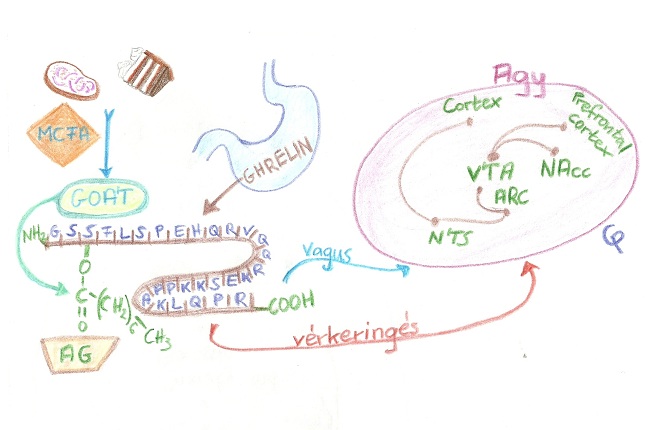
A kutatók lehetőséget láttak e hormon terápiás alkalmazásában a kórosan elhízott emberek esetében. A kutatások nem vezettek eredményre, ezért elkezdtek egy olyan anyagot keresni, ami az NPY-t serkenti, mert ennek gátlásában remélték a megoldást, így kezdték el kutatni az aktivitását. Ghrelinre 1999-ben egy japán kutatócsoport bukkant rá, miközben a növekedési hormon elválasztását serkentő anyagot keresték. Nevét elsődleges hatásáról kapta. A szervezetben több formában fordul elő, acilált aktív hormonként (AG), és unacilált inaktív molekulaként (UAG). Ezen változatok közötti strukturális különbség, hogy egy zsírsav az acilált ghrelinben a Ser-3-ra kapcsolódik. A szintézis szervezet szintjén működik, főbb helye a gyomor, illetve a hypothalamus nucleus arcuatus neuroendokrin sejtjei. A gaster területén egy 94 aminosavból álló prekurzor szintetizálódik, ennek 20%-ból alakul ki ghrelin. A táplálékban lévő közepes hosszúságú zsírsavak (MCFA) szubsztrátként kötődnek a GOAT molekulához. A GOAT-enzim acilálja a (UAG) ghrelint. Az AG kapcsolódik a GHS-R1a-hoz, ami aktiválódik és a nervus vagus afferens végén keresztül visszajelzést küld az agynak. Továbbá a keringéssel átjut az agy-vér gáton, a cerebrum területén a GHSRs receptorokon kötődik, amelyek a neuronokon helyeződnek. A két előfordulási forma élettani hatásai különböznek (Beate C. Finger, 2012).
Élettani hatások
Az AG elsődleges physiológiás hatása az, hogy közvetetten stimulálja a GH termelődést, mert megkötődik a GHS-R1a receptoron, amely miatt a hypophysis növekedési hormon szekréciója, illetve a hypothalamus GH releasing faktor elválasztása fokozódik (Harriët Schellekens és mtsai, 2012). Orvosi szempontból a másodlagos aktivitása kerül előtérbe, például: fokozza az étvágyat, a táplálék felvételt, a szénhidrát metabolizmust, zsírraktározást, izomerőt és a gyomor motilitását. Csökkenti az inzulin hatását, a zsíroxidációt, a symphaticus idegi befolyásokat valamint gyulladáscsökkentő és antidiabetikus hatású. Az UAG nagy részben ellensúlyozza az AG hatásait (antagonista), az AG által indukált inzulin rezisztenciát megszünteti a hyperglycemiát megakadályozza. Az UAG-t eleinte inaktív formának hitték, azonban kutatásokból kiderült, hogy a vérben ez van a nagyobb mennyiségben jelen, és hogy biológiailag aktív enzimnek minősül, speciális aktivitása van saját meghatározott receptorokkal (Richard G. Kay és mtsai, 2012). Egyedülálló, sokrétű, szervezet szintű fiziológiás funkcióinak köszönhetően, terápiás és gyógyászati lehetőségeket láttak a molekula klinikai alkalmazásában úgy, mint a népbetegségnek számító elhízás, depresszió, szorongás valamint az Anorexia nervosa, Diabetes mellitus, továbbá egyéb étkezési, alvási zavarok, Cachexia, daganatos betegségek. Az ezredforduló óta számtalan vizsgálatot és kutatás végeztek a hormon működésének feltárása végett. Tanulmányunkban e vizsgálatok megszervezéséről, lefolyásáról és eredményeiről adunk áttekintést. Többek között írunk az UAG analógok vizsgálatáról in vitro humán vérplazmában és in vivo patkányban, kutyában, a Ghrelin szerepéről az élelmiszerfüggőséggel kapcsolatban, kapcsolatáról az elhízás a stressz és a depresszió között, vizsgálatokról anorexiás, daganatos betegeken (Takashi Akamizu és Kenji Kangawa, 2012).
Ghrelin elhízasban játszott szerepe
„Nem azért élünk, hogy együnk,
hanem azért eszünk, hogy éljünk”/Socrates/
Socrates mindenki által jól ismert mondása utal arra, hogy már az ő korában is az étel, az étkezés létfenntartó szerepén kívül másfajta megvilágításban is feltűnt, mégpedig egy hedonista életfelfogás részeként. Nincs ez másként napjaink modern társadalmában sem, hiszen az evés élvezettel társul, így könnyen összekapcsolódik egyfajta jutalmazási viselkedésformával, és pszichiátriai alkattal. Napjaink népbetegségének számít az elhízás, mely élettani és pszichológiai alapjaiban a ghrelin fontos, mivel ez az egyetlen jelenleg leírt étvágygerjesztő hormon a perifériáról, ami központi szereppel bír a test energia homeosztázisának szabályozásában. A Ghrelin és receptorai ugyanolyan széles körben vannak jelen a periférián, mint a központi idegrendszerben, és ez a bőséges jelenlét számos biológia funkciót érint. Meg kell jegyezni, míg a ghrelinerg idegsejtek létezéséről még ma is vitatkoznak néhány bizonyíték alapján a ghrelin az agyban is szintetizálódik, a hypothalamus neuronalis sejtjeiben (adexametazone indukció megnöveli a ghrelin termelést sejtvonalakban). Így központi figyelmet érdemelt a gyógyszeripartól, mint lehetőség az étkezési rendellenességek gyógyításában.
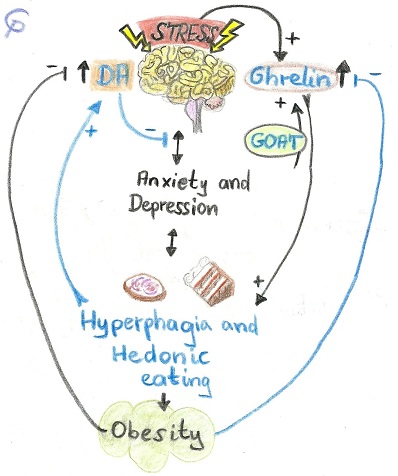
Egyre világosabbá válik a sok kutatómunka eredményeként, hogy létezik kapcsolat az anyagcsere betegségek, elsősorban az elhízás és a pszichiátriai rendellenességek, mint a stressz, szorongás és depresszió között. 25%-kal nagyobb eséllyel fordul elő az elhízás a szorongó és hangulatingadozásoktól szenvedő emberek körében. Számos élelmiszer rendelkezik addiktív tulajdonságokkal, leginkább a cukor, amit bizonyít, hogy a hedonikus étkezési viselkedés és függőség kapcsolatban áll a jutalmazó neurocirkulációs rendszerrel, ugyanis ezen a pályarendszeren számos ghrelin receptort fedeztek fel. A corticostriatal-hypothalamicus pálya közvetíti az ingert afelé, hogy a szükségletnél többet együnk, e következménye pedig csökkent aktivitás, passzív életmód, valamint megnövekedett zsírraktározás mellett egy elhízott fenotípus. Természetesen az elhízás esélyét növelhetik genetikai faktorok is a környezeti tényezőkön kívül.
Összességében a ghrelin szabályozza a homeosztatikus táplálékfelvételt, növeli a zsírraktározást, csökkentve a zsír oxidációt, de emellett a nem homeosztatikus élelmiszer bevitelben is sarkalatos szerepet kap: Az ízletes ételek kellemes érzést válthatnak ki az agyban, mégpedig úgy, hogy dopamin szabadul fel a mezolimbikus keringési rendszerben, ami felülvezérli a megelégedettséget és stimulálja az étvágyat függetlenül a metabolikus szükségletektől. A nem homeosztatikus motivációs faktor az ízletes és kalóriadús ételek bevitelét és túlfogyasztását eredményezi. Felismerték, hogy ez a kulcskomponens a világméretűen terjedő elhízásban, hiszen ez a hormon fontos szerepet játszik a stressz indukált „zabálásoknak”, miközben szorongás esetén antidepresszáns hatása is ismeretes egérkísérletekből (1. Ábra). Bőr alá adott ghrelin injekció csökkentette a szorongást valamint antidepresszáns hatással volt rájuk. A nem szükséges evések alkalmával a kalóriadús étkezések idején a közepes szénlánc hosszúságú zsírsavakkal szubsztrátot biztosítunk a GOAT (ghrelin O-acetyltranszferáz) enzim számára, így acilezve a pre-ghrelinből kapjuk az aktív ghrelint, ami így már képes kötődni a GHS-R1 receptorokhoz. A vér-agy gáton behatolva az agyba, különböző agyterületek idegsejtjein kifejeződő receptorokhoz kötődve hat az étvágyra. E területek: NTS (nucleus tractus solitarii), nucleus arcuatus, VTA, NAcc (nucleus accumbens). Az étvágy szabályozása a hypothalamusban, a nucleus arcuatus területén történik. Az itt elhelyezkedő neuronokat 2 fő csoportra osztjuk, étvágygerjesztő NPY/AgRP-t termelő, valamint anti-étvágygerjesztő POMC/CART idegsejtekre. A ghrelin perifériás szintje ezekben a neuronokban közvetlenül módosítja a receptorok kifejeződését, hatva ezzel a PVN-re (nucleus paraventricularis) és LHA-ra. Tehát a ghrelin stimulálóként hat az NPY/AgRP neuronokra, míg gátlóként lép fel a POMC/CART idegsejtekkel, melyek az inzulin és leptin stimuláltsága alatt állnak. Ebből következik az, hogy amennyiben leptin és inzulin kerül erre az agyi régióra, ez az étvágy elnyomásához vezet.
|
A nervus vagus afferens rostjain keresztül vezető út megkérdőjelezhető, mivel 2006-ban kutatók bizonyították, hogy az agytörzsi magvakból szállít a ghrelin jelzéseket a hypothalamus nucleus arcuatusába. Ennek a receptornak az expressziója nagyobb számú az ARC-ben, miáltal megerősíti a neuroendokrin és étvágyszabályozó hatását. E GHS-R1 receptor központi idegrendszeri kifejeződése valamint a hormon aktivitása az ARC-ben egy idegrendszeri izgatottsághoz vezet (sok receptor, fokozott érzékenység).
Az VTA (Ventralis Tagmentális terület) magas GHS-R1 receptor szintje is jelzi e terület által irányított jutalmazásos rendszer meglétét. A kutatók hipotézisei szerint az idegsejtek dopamin szekréciója a VTA-ban ered. Számos rágcsálóval készült tanulmány támasztja alá a ghrelin szerepét a jutalmazás indukált evésben. Amennyiben közvetlenül ghrelint fogyasztanak, a VTA-ban és a NAcc-ben (amygdala) dopamin „overfloat”-ot eredményez. Direkt mikroinjekcióval a VTA-ba fecskendezve a ghrelin erős „zabálást” eredményezett, fokozott zsírbeépítést és az állatok által önállóan nagy mennyiségű szacharin oldat felvételét tapasztalták (2. Ábra).
A drog és alkoholfüggőség sokban közös az evési kényszerrel, ugyanis ízletes táplálék fogyasztása összekapcsolódik a neuroadaptív központi jutalmazó rendszerrel. A dopamin d2 receptorok szintje negatívan korrelál a BMI (testtömeg index) szinttel.
Ezen állítások alátámasztására MRI-t, valamint PET-et használtak. Elhízott embereken bemutattak egy speciális megváltozott agyműködést étkezés hatására, a nem kövér embertársaikkal szemben. A felelős agyi régiókban az ételfüggőség ugyanolyan aktivitást mutatott, mint valamilyen hatóanyag hozzászokás fennállása esetében (például: kábítószerek, alkohol).
A ghrelin élelmiszer-függőségben, betöltött fontos szerepe logikusnak tűnik, ám napjainkban is rendkívül sok kutatást, vizsgálatot végeznek annak érdekében, hogy e hormon teljes mértékben rendelkezésre álljon terápiás célokra. Igaz, ezek a „gyógyszerek” nem lesznek határ nélküliek, mivel az is kiderült, hogy az elhízás ghrelin rezisztenciát indukál, valamint egyéni hatásai még nem jósolhatóak meg nagy biztonsággal. Hatása függ az elhízottság mértékétől, az anyagcsere állapotától, más betegségek jelenlététől. Tudományos kutatások alátámasztották azt, ha megőrizzük a szervezet ghrelin szenzitivitását, akkor a hormon alkalmazása egy jó módszer lehet a súlycsökkentéshez. A stressz csökkentése lenne a legcélravezetőbb megoldás, hiszen maga a stressz vezető faktor az elhízásban. A metabolikus kognitív és pszichológiai funkciók nagyban függnek az embert érő stressztől, amihez gyakran szorongás is társul, a mellékvesében termelődő hormonok miatt. Emberben stressz és ghrelin fogyasztás hatására a vérszérum kortizol szintje megnő, független a testtömeg indextől. A stressz kondíciók hatására bekövetkező komfortevést a ghrelin szint növekedése magyarázhatja. A ghrelin rendszer az energiahiány jeleként funkcionálhat, megkezdődik a zsírraktárak védése. A krónikus stressz növeli a gyomorban lévő ghrelin ürítését, ez szabályozza a gyomor perisztaltikáját, mivel a hormonnak szerepe van a stressz indukált gyomormozgásokban. Egerekben fokozódott a gyomorürülés, így viszont nőtt az étvágy, a ghrelin szint, mivel a gyomorfal nem feszül, így a mechanikai inger nem jut el a ghrelint termelő sejtekhez, ami jel számukra a szintézis felfüggesztésére.
Számos összefüggésre még nem derült fény, de az bizonyos, hogy az alap ghrelin szint élvezeti evőknél magasabb, mint a normális étkezőknél. Ez több kérdésre magyarázatot adhat. Egyre több bizonyíték áll rendelkezésre, hogy a stressz fokozza a plazma ghrelin szintjének növekedését (az elhízás önmagában is emeli a plazma ghrelin koncentrációját), stimulálva a finom ennivaló felkutatását, köszönhetően a visszacsatolásos rendszernek a stressz és az élelmiszer bevitel között (Harriët Schellekens és mtsai, 2012).
Étvággyal összefüggő rendellenességek
Anorexia nervosa (AN) és kapcsolódó rendellenességek
A ghrelin felfedezése óta sok kísérletet vezényeltek le a hormon működését kutatva. Ma már bőséges bizonyítékok mutatják, mennyi különböző élettani folyamatban játszik fontos szerepet. Ebben a kísérletben a kutatók az anorexia nervosa betegek egy ghrelint tartalmazó kezelési lehetőségén dolgoztak. Az anorexia nervosa egy táplálkozási rendellenesség, amelyben a kalória bevitele a szervezetbe krónikusan csökken. A beteg saját magát bírja rá erre a változásra. A plazma ghrelin koncentrációja megemelkedik a zsírhiányos anorexiás betegekben. Összegyűjtöttek 9 alacsony testtömegű, 6 testsúlyukat részben visszanyert, de amenorrhoe-ban szenvedő AN beteget, és 10 vékony alkatú nőt (Miljic és mtsai, 2006). Ennek a 25 embernek ghrelin infúziót adott be, 300 percig 5 pmol/kg/min ghrelint intravénásan. Az anorexia nervosa betegek, 15 személy, jelentős mértékben kevésbé érezték magukat éhesnek, összehasonlítva a vékony testalkatú nőkkel. Ebből következik, hogy az éhes AN betegek kevésbé fogékonyak a ghrelin étvágyfokozó hatására, mint az egészséges lányok. Egy másik kísérletben habár kilencből hat AN páciens jelezte éhségét az infúzió beadása után (1,0µg/kg), ez hasonló arányt mutat, mint normális alanyokban. Megvizsgálták a ghrelin hatását az étvágyra, táplálékfogyasztására, és táplálkozási paraméterekre AN személyeknél. 5 női alany vett részt ebben a tanulmányban, akik a diagnosztikai és Statistic manual IV (DSM-IV, mentális rendellenességek kórmeghatározó és statisztikai kézikönyve) kritériumainak megfelelő típusú AN-nel rendelkeznek és ebből a rendellenességből felépülni kívántak. Az alanyokat 26 napra vették fel a kórházba. Ez 6 nap előkezelést, 14 nap ghrelin infúziót, és 6 nap utókezelést jelent. Az alanyok napi 2-szer kaptak 3 µg/kg ghrelin infúziót intravénásan. A betegek közül 4-en beszámoltak epigastricus kellemetlenségek javulásáról, székrekedés csökkenéséről, és az étvágy növekedéséről. A napi energiabevitelük emelkedett 12 -36%-kal az előkezeléshez viszonyítva, a testsúlyuk 1,5 illetve 2,4 kg-mal nehezedett, emellett javult a fehérje és a triglicerid szint. A jövőre tekintve egy fontos megállapítás, hogy semmilyen komoly káros hatásról nem számoltak be, mint például pszichológiai tünetekről sem.
A funkcional dyspepsia (FD) egy krónikus illetve megújuló felső hasi fájdalom, amit nem egy specifikus szerves abnormalitás okoz. A gastrointestinális mozgóképesség és érzékenység tér el a megszokottól, ami sűrűn jár együtt anorexiával, illetve testsúlyvesztéssel. A plazma acilált ghrelin koncentrációja összefügg az FD páciens egyéni tünetnagyságával. Azok a személyek vehettek részt a kísérletben, akik diagnosztizált anorexia okozta FD-től szenvedtek, zsírhiányosak (testtömeg index, BMI <22kg/m2), és alacsony a tápanyagfogyasztásuk. 6 alanynak adták be napi 2-szer 2 hétig az infúziót. A kísérlet előtt és után mérve a táplálék felvétel megnőtt, ámbár ez a változás nem ért el statisztikai jelentőséget. Emellett viszont az éhség érzete nagymértékű növekedést mutatott. A káros hatások alacsony szintje miatt, a ghrelin terápiás használata biztonságos, és serkenti az étvágyat az FD-s betegeknél.
COPD-társuló cachexia
A kóros obstruktív légúti betegség (COPD) gyakran társul cachexiához, ami egy független faktor a COPD-ben. A cachexia név egy krónikus betegség következtében túlzott súlyveszteséget takar. A növekedési hormonkezelés megemeli az izomtömeget, a ghrelinnek gyulladásgátló hatása érvényesül. A krónikus légúti fertőzés (neutrophil domináns légúti gyulladás) végstádiumú cachexiához vezet. Az alveolaris és bronchalis epithel sejtek ellen a sejtmérgező képessége az összegyűjtött neutrophilek által okozza a tüdő funkcionális degenerálódását. Ez többlet energia kiadással és súlycsökkenéssel jár együtt. Ghrelin kezelés 3 héten keresztül leviszi a neutrophilek számát a köpetben, és a köpet térfogatát. COPD-s páciensekben javítja a cachexiát és a funkcionális kapacitást. Ismételt kezelés alkalmával 7 páciensnek adtak be 3 hétig intravénásan, minek hatására a tápanyagfelvétel megemelkedett, a testtömeggel, zsírmentes testtömeggel, perifériás légzőizmok erejével együtt, javítja a túlsúlyos sympatikus befolyást (csökken a plazma noradrenalin koncentrációja). Placebóval vezérelt vizsgálat során a ghrelin növelte az étvágyat és a testsúlyt, míg a javuló fizikai teljesítmény láthatóan a dózis mennyiségétől függött.
Daganatos cachexia
A daganatos betegségek során fellépő hiányos táplálkozás is cachexiát okozhat. DeBoer és mtsai (2007) súlygyarapodást írtak le, ami a fordítottja a zsírmentes testtömeg veszteségnek, ami a cachexia kritikus eleme.
Neary és mtsai (2004) arra keresték a választ, hogy stimulálja-e az étvágyát 7 komoly anorexiás, rákos betegnek. A ghrelin kezeltek megnövekedett energia bevitelt, táplálékfogyasztást, és méltányolt húsfogyasztást mutattak.
21 előrehaladott rákos betegnek 4 napon keresztül adtak be ebéd előtt 1) magas dózist 2) alacsony dózist és 3) placebót (Strasser és mtsai, 2008). A táplálékfogyasztás és az evéssel kapcsolatos tünetek nem különböztek, miszerit több beteg részesíti előnyben a ghrelin kezelést, mint a placebót. Ellentétben Nearry kísérletének eredményével, itt a táplálékfogyasztás nem nőtt meg, ezért még több kutatást várnak el. Aggodalmakat okoz a ghrelin alkalmazása daganatos betegeknél, mivel eme hormon fokozza a növekedési faktorok (GH, IGF-1) koncentrációját, ezáltal kiválthatja a daganat növekedését. A szakértők hosszú lefutású és nagyszabású klinikai vizsgálatokat várnak el, hogy megállapíthassák a ghrelin tumor növekedésre kifejtetett aktivációját (Takashi Akamizu és Kenji Kangawa, 2012).
Stabilitás vizsgálatok az UAG analógokkal
A vizsgálat során fragmenteket hasítottak le a ghrelinről, amivel azt a legkisebb részletét keresték, amely még rendelkezik antidiabetikus hatással. A gyógyászatban ezeket az analógokat akarták felhasználni a teljes hormont helyett. A kutatásban három különböző kémiai szerkezettel kísérleteztek, hogy kiderüljön, melyik a legstabilabb az élőszervezetben.
Az UAG analógok stabilitását vizsgálták in vitro humán vérplazmában és in vivo patkányokban illetve kutyákban. A kísérleteket azért végezték el, mert az UAG analógokban lehetőséget láttak különböző terápiás szerek fejlesztésére, amelyeket sokrétűen lehetne alkalmazni a klinikumban. Az élettani hatásait ismerve, ez a hormon megszünteti a hyperglycemiát. Ezt az UAG analógot fel lehetne használni a II-es típusú diabetes terápiás célzatú kezelésére.
A diabetes mellitus ma már nagyon gyakorinak számító szénhidrát anyagcsere rendellenesség, a II-es változatnál a kórképet nem az inzulin hiány okozza, hanem az inzulinrezisztencia, ami általában a helytelen életmód és a nem megfelelő táplálkozás miatt alakul ki. Ebből adódik, hogy ez a fajta cukorbetegség nem kezelhető inzulin hormon beadásával, erre lenne megoldás az UAG analógok használata, mert antidiabetikus hatással rendelkeznek. A diabetes mellitus mellett azonban más metabolikus rendellenességek kezelésére is alkalmas lenne ez a peptid. Az UAG analógok plazma fehérjéből (GHRelinből) leválasztott fragmentumok, amelyeket azért nem lehet használni a gyógyászatban, mert stabilitásuk a vérplazmában minimális, a proteolízis miatt hamar bomlanak, felezési idejük csekély, a vese clearence ezekre az anyagokra nagy, gyorsan kiválasztásra kerülnek a vérplazmából. Továbbá a fehérjék specifitása is korlátozza a lehetőségeket. Korábban a plazmafehérjéket csak immunrendszer erősítésére használták, az immunglobulinok felhasználása által.
A vizsgálatok során az UAG analógok stabilitását mérték. Három UAG analóggal dolgoztak AZP502, AZP531, AZP533 (gyártó: Bachem, Bubendorf Switzerland). Az analógok kémiai szerkezete különböző. Az AZP502-es analóg egy teljesen lineáris 8 aminosavból álló molekula, amely az UAG molekula közepéből van kihasítva. Az AZP533- egy részlete ciklizált, de jelen vannak lineáris fragmentumok is. Az AZP531 struktúrája azonban teljesen ciklizálva van.
Az elemzéseket először humán vérplazmán végezték el in vitro. Elsőként az AZP502 stabilitását tesztelték, az analóg a vérplazmában hamar bomlott, 37-°C-on 5 perc alatt 50%-a maradt meg. Leírták, hogy a teljes bomlás ideje 60 perc. A hozzáadás után 25 órával a mintából már nem lehetett kimutatni a fehérjét. Az AZP533 részlegesen ciklizált, N-terminális végénél acetilált peptid sokkal nagyobb fokú plazma stabilitást mutatott, mint az AZP502, mert 1440 perc alatt csak mindössze 40%-a bomlott le, tehát az endo- illetve exopeptidázok proteolítikus hatása nem érvényesült olyan mértékben, mint az első megfigyelés során. Végül megvizsgálták az AZP531-et, a ciklikus szerkezetű analógot humán vérplazmában in vitro, ami stabil eredményeket adott, 1 nap alatt sem indult meg a proteolítikus bontása, 37-°C-os hőmérsékleten (optimális környezet biztosítva volt). 3 napon keresztül tartott az inkubáció, de a fehérje proteolízise ekkor sem következett be.
Az in vivo vizsgálatokat patkányokon illetve kutyákon végezték el. Az analógokat subcutan és intravénásan adagolták az állatoknak, majd ezután megfigyelték a vérbeli paraméterek változásait. A patkányok subcutan kaptak AZP502 molekulát, melyet még 15 perc múltán ki lehetett mutatni mindhárom egyed vérplazmájából. Intravénás injektálásnál azonban az egyik patkánynál 2 percig, a másik állatnál 5 percig és csak egyetlen állat vérében volt 15 perc után is jelen a peptid. AZP531 vizsgálata patkányokban érdekes eredményt hozott, mind intravénás és subcutan beadást követően a három állat véréből kimutatható volt az AZP531 molekula 240 percen keresztül. Elvégezték ugyanezeket a megfigyeléseket kutyákon is. A nagyobb testtömeg miatt eltérő koncentrációban kapták meg az adott komponenseket, de arányait tekintve ugyanaz volt, mint a patkány kísérlet során. Az AZP502 subcutan adásánál mindhárom állat véréből a beadást követően 15-30 percig lehetett kimutatni a peptidet. Intravénás beadást követően mindhárom állat véréből 2-5 percig volt kimutatható e molekula. Az AZP531 jelenléte injektálás után 1440 percig kimutatható volt, függetlenül az adagolás módjától. A pharmakokinetikus paramétereket összegezve, az AZP502 intravénás beadását követően mindig 2 perc múlva érte el vérben legmagasabb koncentrációt mindkét állatfajban. A felezési időt egyik egyedben sem lehetett meghatározni. Az AZP531 részben eltérő értékeket mutatott, az intravénás befecskendezés után mindkét fajban 2-5 perc múlva érte el a plazmakoncentráció a legnagyobb értéket, de a felezési ideje a molekulának különböző volt. Kutyákban 0,90 óra, míg patkányban ez az érték 0,45 óra volt, összegezve; a patkányok szervezetében kétszer olyan gyorsan bomlott a vegyület, mint a kutyákéban.
A vizsgálatok igazolták, hogy az analógok szerkezete még nem elég stabil, hogy hatásosan lehessen alkalmazni, az összes vizsgált molekula felezési ideje rövid. Az in vivo stabilitás sokkal kisebb mértékű, mint az in vitro, ezt az élő szervezet proteolítikus aktivitása eredményezi. A fehérjék bomlását a proteázok és peptidázok okozzák. A molekulák stabilitásának növeléséhez a kémiai szerkezet módosítására van szükség, amire több lehetőség van, például: D-aminosavak, ál-aminosavak hozzákapcsolása a molekulához, peptid ciklizáció bevezetése.
Ezeket a peptideket in vivo, és in vitro vizsgálják, hogy kiválasztásra kerüljön az a legstabilabb és legkevesebb aminosavból álló részlet, amely az antidiabetikus hatásért felelős. Ezeknek a tervezett UAG fragmentumoknak a hatásait a humán hasnyálmirigy Langerhaans-szigeteinek β-sejtjein vizsgálják.
Az UAG analóg vizsgálatok eredményének tekinthető, hogy az AZP531-es molekula körülményektől függetlenül in vitro és in vivo is, nagyobb stabilitást mutatott, mint az AZP502-es. Az AZP531 peptid még különböző fejlesztéseket igényel ahhoz, hogy a gyógyászatban is fel lehessen használni (Michel Julien és mtsai, 2012).
Következtetés
Összességében a fent említett kutatási eredmények világossá teszik számunkra a ghrelin hormonban rejlő széles spektrumú gyógyászati lehetőségeket. A további fejlesztések, és kutatások elvégzése és keletkező eredményei komoly lehetőséget jelenthetnek a jövőben, a ma még gyógyíthatatlan és makacs betegségek terápiás kezelésére. A hormon kezelés veszélyeire is fel kell hívni a figyelmet, beleértve a daganatos betegeknél ezen hormon GH szekréciót serkentő hatását, ami a tumort is megnövelheti. Gyógyszerként való felhasználása ma még problémás, mivel a molekula stabilitása in vivo a szervezetbe bekerülve, annak proteolítikus folyamatai lebontják a fehérjét, mielőtt az kifejthetné jótékony hatásait. Ezen lebontási folyamat ideje állatfajonként különbözik. Az UAG analógok kémiai szerkezete további módosításokat és vizsgálatokat igényel. Eme peptid karakteres jellemzői teszik alkalmassá részvételét klinikai kutatások alanyaként. Ezen jellemzők 1) sokszerűség és egyedülálló működés 2) egyedülálló struktúra és zsírsavmódosítás 3) kevés ártalmas hatás. További vizsgálatok egyrészt kihívást jelentenek, másrészt kifizetődőek a jövőben.
Irodalomjegyzék
1. Harriët Schellekens, Beate C. Finger, Timothy G. Dinan, John F. Cryan (2012):
Ghrelin signalling and obesity: At the interface of stress, mood and food reward.
Pharmacology & Therapeutics 135: 316–326.
2. Michel Julien, Richard G. Kay, Patric J.D. Delhanty, Soraya Allas, Riccarda Granata, Chris Barton, Scott Constable, Ezio Ghigo d Aart J. van der Lely, Thierry Abribat (2012):
In vitro and in vivo stability and pharmacokinetic profile of unacylated ghrelin (UAG) analogues.
European Journal of Pharmaceutical Sciences 47: 625–635.
3. Takashi Akamizu, Kenji Kangawa (2012):
The physiological significance and potential clinical applications of ghrelin.
European Journal of Internal Medicine 23: 197–202.
4. Sandeep Kumar Botla, Amin Moghaddas Gholami, Mahdi Malekpour, Evgeny A. Moskalev, Mahdi Fallah, Pouria Jandaghi, Ali Aghajani, Irina S. Bondar, Ramesh Omranipour, Fatemeh Malekpour, Abbas Mohajeri, Azin Jahangiri Babadi, Özgür Sahin, Vladimir V. Bubnov, Hossein Najmabadi, Jörg D. Hoheisel, Yasser Riazalhosseini (2012):
Diagnostic values of GHSR DNA methylation pattern in breast cancer.
Breast Cancer Res Treat 135: 705–713.
5. Benjamin Levinson, Joseph Gertner (2012):
Randomized study of the efficacy and safety of SUN11031 (synthetic human ghrelin) in cachexia associated with chronic obstructive pulmonary disease.
e-SPEN Journal 7: e171-e175.