Wirkung der Geschlechtschromosome auf das Großhirn
Einleitung
Geschlechtsspezifische Unterschiede sind nicht nur äußere Merkmale wie Bartwuchs oder die Entwicklung von Milchleisten, sondern auch innere anatomische Unterschiede und unterschiedliche Genexpression in Geweben wie z.B. dem Gehirn. Der Einfluss der auf den Geschlechtschromosomen lokalisierten Genen liegt Hauptsächlich darin, dass sie für bestimmte Hormone kodieren, welche wiederum zu unterschiedlichen anatomischen Entwicklung und Verhaltensweisen führen. Fehlt eins der Geschlechtschromosomen, kommt doppelt vor oder sind einzelne Allele fehlerhaft treten verschiedene Krankheiten auf.
Contents
Allgemeiner Aufbau des Großhirns in Bezug auf die Geschlechter
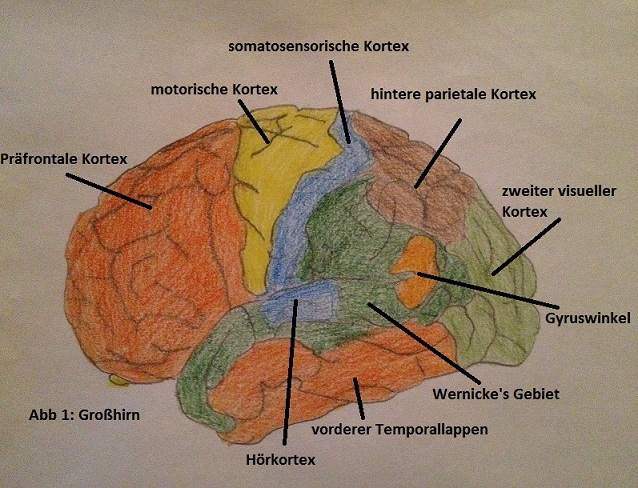
Diverse experimentelle Studien haben bewiesen, dass sex-typisiertes Verhalten nicht allein durch gesellschaftlichen Druck, sondern hauptsächlich durch die Einflüsse von Hormonen auf das Gehirn hervorgerufen werden. Das Gehirn (Abb. 1) unterscheidet sich in seinem anatomischen Aufbau innerhalb einer Spezies im Vergleich zwischen Männchen und Weibchen. Daraus resultiert auch in gewissen Bereichen eine unterschiedliche Funktion derHirnareale. Bereits vor der Geburt, ab etwa der siebten Schwangerschaftswoche, kann ein unterschiedliches Hormonniveau zwischen Jungen und Mädchen festgestellt werden, da zu diesem Zeitpunkt in erster Linie die Hoden mit der Bildung von Hormonen beginnen. Dadurch kommt es zur geschlechtsspezifischen Veränderung des Testosteronkonzentration. Androgenrezeptoren , in einigen Hirnregionen des Menschen, in anderen Säugetieren über andere neurale Rezeptoren, bestimmen aufgrund ihrer Spezifität über die geschlechtsspezifischen Strukturen und Funktionen des Gehirns. Als Beispiele für die geschlechtsspezifischen Unterschiede der Gehirnstrukturen des Menschen sei zu erwähnen, dass das totale Hirnvolumen bei Männern größer sei als bei Frauen. Die Amygdala weise eine größere Ausdehnung bei Männern aus, wohingegen der Hippocampus der Frauen deutlich ausgeprägter sei. Aus diesem Grund werden die Hirnregionen auch auf unterschiedliche Weise genutzt, was wiederum bei den Frauen zu mehr kortikaler Dicke, einer höheren Gyrifikation der frontalen und parietalen Kortex und einer effizienteren Nutzung der weissen Substanz führe. Im Normalfall sorgt die Beeinflussung der Hormone auf das Gehirn bei allen Frauen für ein hohes Mass an Empathie, bei Männern jedoch für große körperliche Aggression. Diese Einflüsse können allerdings aufgrund unterschiedlicher Konzentrationen in Bezug auf den Hormonspiegel verändert werden. Bei der kognitalen adrenalen Hyperplasie (CAH), die durch einen erhöhten pränatalen Testosteronspiegel bei Mädchen hervorgerufen wird, kommen diese nicht nur mit teilweise männlichen äußeren Genitalien zur Welt, sondern auch ihr Verhalten kann verändert sein, sodass auch sie ein erhöhtes körperliches Aggressionsverhalten mit gleichzeitig verminderter Empathie an den Tag legen. CAH hat auch einen grossen Einfluss auf dir sexuelle Orientierung. Frauen mit dieser Erkrankung haben häufig eine eher homosexuelle Orientierung, da nach ihrer Geburt zwar eine chirurgische Rekonstruktion der äußeren Genitalien vorgenommen wurde, sie aufgrund der Ausbildung ihrer Hirnareale durch die frühe hohe Konzentration an Testosteron ein anderes Körperempfinden besitzen und sich als Männer wohler fühlen. Durch zahlreiche Studien wurde auch bei anderen Säugetieren, neben dem Menschen, der Einfluss des Testosteron auf die Entwicklung des Gehirns und die daraus resultierenden Verhaltensweisen bewiesen. (Hines, 2010)
Die wichtigsten bekannten und erforschten, auf den Geschlechtschromosomen lokalisierten Gene
SRY (Sex-determing Region on the Y)
Das wohl wichtigste und bisher am besten erforschte, geschlechtsspezifische Gen ist Sry (sex-determing region on the Y), das auf dem Yp11.3 lokalisiert ist. Es kodiert ein Protein mit DNA-binding motif, gehört zu den High-Mobility-Group-Proteinen (HMG) und hat den sogenannten Testis determining factor (TDF). Das Protein löst eine genetische Kaskade aus, die die Entwicklung der Gonaden zum Hoden verursacht, indem es zwischen dem 10.5 und 12.5 Tag des embryonalen Lebens gemeinsam mit SF-1 die SOX9 Genexpression reguliert. Dies führt zur Differenzierung der Sertoli-Zellen und später zur Entwicklung der Hoden. SOX9 löst gemeinsam mit SF-1 und anderen Proteinen die Expression des Anti-Müller-Hormons aus, dessen Aufgabe es ist die Weiterentwicklung der Müller’schen Drüsen zum Uterus zu verhindern. Ab Tag 15 synthetisieren die Leydig Zellen in dem sich entwickelnden Hoden Testosteron, ein Hormon das essentiell für die Entwicklung des männlichen Phänotyps ist. Sry ist das einzige x-degenrierte Gen das nicht allgegenwertig zum Ausdruck kommt sondern hauptsächlich in den Hoden aber auch in Herz, Leber, Nieren und einigen Hirnregionen (Mensch: mediorostraler Hypothalamus, frontal und temporal Cortex; Nager: Hypothalamus und Substantia nigra + ventral tegmental Gegend des Mittelhirns) synthetisiert wird. Bei Menschen und Mäusen handelt es sich um ein Single-Copy-Gen. Bei Ratten und anderen Nagern wurden sechs verschiedene, y-gebundene Kopien (Sry1, Sry2, Sry3, Sry3B1, Sry3B2 und Sry3C) gefunden, welche sich allerdings um weniger als zwei Prozent unterscheiden. Man vermutet das Sry die spezifische Entwicklung des männlichen Gehirns nicht nur auf direkte, sondern auch auf indirekte Art und Weise beeinflusst. Es wurde zum Beispiel entdeckt, dass Sry die Entwicklung des Dopamin-System verändert indem es an die Promotorregion des Tyrosinhydroxylase kodierenden Gens bindet und somit dessen Transkription verbessert. Sry steht auch unter dem Verdacht Krankheiten wie ADHS, Suchtverhalten und Bluthochdruck zu beeinflussen. (Kopsida et al., 2009)
Das SF-1 (steroidogenic factor ) Gen
Seine Aufgabe ist die Regulation der Synthese von Steroidhormonen in der Nebenniere. Symptome bei Mäusen denen dieses Gen fehlt (SF-1 KO mice = SF1 knockout mice) sind:
• Zurückbildung der anfänglich entwickelten Keimleiste des Fötus bevor die Synthese von Steroidhormonen im fetalen Hoden beginnt,
• das Fehlen von Keimdrüsen und Nebennieren,
• eine die Keimdrüsen beeinflussende Disfunktion der Hypophyse und
• Störung der Organisation des Gehirns im Nucleus ventromedialis des Hypothalamus, welcher u.a. zur Regulation einer Reihe von Schlüsseleffekten dient, die sowohl die Physiologie als auch das Verhalten beeinflussen. (Majdic et al., 2011)
STS
Kodiert das Enzym Steroidsulfatase und ist auf dem Xp22.3 lokalisiert. Dieses Enzym ist verantwortlich für die Desulfatierung von neuroaktiven Steroiden; vorallem für die von DHEAS (dehydroepiandrosterone sulphate) zu DHEA und wird während der Embryogenese in Plazenta, Leber und Gehirn (Cortex, Hypothalamus und Nachhirn) synthetisiert. Mögliche Auswirkungen von Sts auf das Verhalten:
• Mensch: Männer bei denen das STS Gen beschädig bzw. mutiert ist oder bei denen es sogar ganz fehlt sind anfälliger für Autismus und ADHS. Beim Mann gibt es einen homologen Partner auf dem langen Arm des Y-Chromosoms wobei vermutet wird, dass diese y-gebundene Version ein Pseudogen ist das nicht umgesetzt wird. Dies könnte Erklären warum das Enzym häufiger in Gewben von Frauen als von Männern auftritt und könnte somit auch ein Grund für die unterschiedliche Anfälligkeit von Männern und Frauen gegenüber die Aufmerksamkeit beeinflussenden Krankheiten sein
• Maus: männliche Mäuse neigen eher zu aggressivem Verhalten als weibliche. Es wird vermutet das Steroidsulfatase, neben Sry, hierbei einen wesentlichen Einfluss hat. Außerdem beeinflusst das Enzym vermutlich auch die Aufmerksamkeit und Impulsivität von Mäusen
• Ratte: Bei Ratten kommt das Gen nur auf dem X-Chromosom vor. Versuche haben gezeigt das Steroidsulfatase das Lernen, das Erinnerungsvermögen und die Acetylcholin Ausschüttung im Gehirn beeinflusst. (Kopsida et al., 2009)
Il 18 (Interleukin 18)
Il 18 ist ein Gen, das ein gleichnamiges Zytokin codiert, welches in Neuronen, Astrozyten und Mikroglia synthetisiert wird und zur Abstimmung von homöostatischen Prozessen, Neuroinflammation und dem Verhalten dient. Il 18 wird vorzugsweiße von dem mütterlichen Allel codiert und kommt in der weiblichen, nicht aber in der männlichen POA (preoptic area of the hypothalamus) oder im mPFC (medial prefrontal cortex) vor. Die Signalwirkung des Il 18 hat anorektische Wirkung und heterozygote Il18 Weibchen weisen Hyperphagie auf. Das Gen unterliegt region- und gattungsabhängigen Effekten im Gehirn und wird mit Krankheiten die bei einem Geschlecht häufiger auftreten als bei dem anderen wie z.B. Multiple Sklerose in Verbindung gebracht. Diese chronisch entzündliche Erkrankung des Zentralnervensystem kommt etwa doppelt so oft bei Frauen wie bei Männern vor und steht daher im Zusammenhang mit der mütterlichen Abstammungslinie. (Gregg et al., 2010)
Mrlp 48 (Mitochondrial ribosomal protein 48)
Mitochondrien werden durch die Mutter vererbt. Doch die Genetische Information für die mitochondrialen ribosomalen Proteine, deren Aufgabe es ist die Translation in den Mitochondrien zu regulieren, liegt in der DNA im Zellkern. Es konnte nachgewiesen werden, dass Mrlp 48 - eins von vier bisher bekannten mitochondrialen ribosomalen Proteinen das Hinweise über den väterlichen Einfluss auf den Energiehaushalt von Nervenzellen gibt- in der POA von Weibchen anhand des väterlichen Gens synthetisiert wird, nicht aber bei Männchen. (Gregg et al., 2010)
Die bekanntesten Erkrankungen im Zusammenhang mit den Geschlechtschromosomen
Triple-X-Syndrom
Triple-X-Syndrom ist eine Krankheit, bei der Frauen ein X Chromosom (Abb.2) zu viel haben. Diese Krankheit kommt ungefähr bei einer von 1000 Frauen weltweit vor. Diese Frauen wachsen früher und schneller in der Entwicklung als ihre gleichaltrigen Mitmenschen. Ein besonderes Zeichen ihres Aussehens sind die besonders langen Beine. Desweitern haben sie keine normale Sprachentwicklung und Probleme damit feste soziale Bindungen zu knüpfen. Leider wird das Triple-X-Syndrom oft nicht diagnostiziert, da die Babys bei Geburt komplett normal aussehen. Bei 1/3 von 155 Fällen lässt sich ein kognitiver, physischer Defekt feststellen. In dem Text werden wir weiterfolgend die Wirkung dieser Krankheit in den spezifischen Entwicklungsstadien der Menschen hauptsächlich in Bezug auf das Großhirn darstellen. (Otter et. al., 2010)
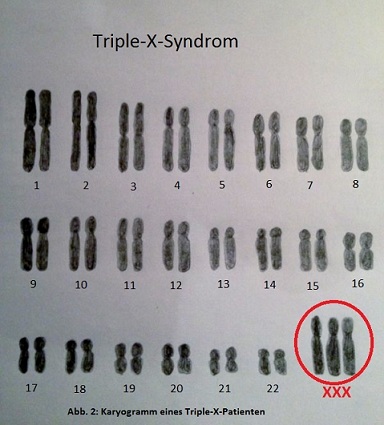
In dem Entwicklungsstadion von der Geburt bis ca. 4 Jahre ist das Wachstum normal. Erst danach ist ein beschleunigtes Körperwachstum zu beobachten. Bereits in diesem Alter lässt sich ein schmalerer Kopfumfang feststellen. Testet man diese Kinder auf ihrenIQ, so lassen sich bereits Defizite feststellen. Am aller meisten wird dies im Bereich der Sprachentwicklung sichtbar. Desweitern werden diese Kinder als sehr schüchtern, unkooperativ und klammernd beschrieben. Dadurch lassen sich Aufmerksamkeitsdefizite diagnostizieren. In der Vorpubertätszeit wachsen diese Mädchen immer schneller als ihre Gleichaltrigen. Ihre Beine verlängern sich zusehends. Auch ist bei dieser Krankheit ein Untergewicht immer mehr festzustellen. Wenn man ein IQ Test in diesem Alter machen lässt, so kann man feststellen, dass der sprachliche IQ unter 90 und der künstlichere IQ auch unter 90 liegen. Damit liegen die Erkrankten weit unter dem Durchschnitt. Auch haben sie Probleme damit in der Schule Freundschaften zu knüpfen. Bereits in diesem Alter werden die weitgefächerten Wirkungen des Triple-X-Syndroms auf das Großhirn sichtbar. Diese Mädchen haben ein Problem mit ihrem Kurzzeitgedächtnis und können Sachen die sie kurz vorher gelernt haben, schlecht wiederrufen. Dazu kommt eine Sprachstörung, ihre verbale Aktivität ist niedrig und Selbstbewusstseinsstörungen gehören zu ihrem Alltag. Während der Pubertät lassen sich sogar unterschiedliche Entwicklungen innerhalb des Krankheitsbilds feststellen. Es kann vorkommen, dass sie früher mit der Pubertät einsetzten, aber auch dass sie sich verzögert. Auch wird in diesem Alter der immer größer werdende Einfluss des Elternhauses sichtbar. Wachsen Mädchen mit dieser Krankheit in einem Elternhaus auf, in dem sie unterstützt und aufgebaut werde, so entwickeln sie sich besser als gleichaltrige, die in einem unstabilen Elternhaus aufwachsen. Diese Kinder leiden am meisten unter ihren sozialen Störungen und ihr IQ liegt sehr weit unter dem Durchschnitt. (Otter et. al., 2010)
Die Pubertät verläuft jedoch weitgehend normal und die sexuelle Entwicklung ist gegeben. So können sie normale Kinder auf die Welt bringen. Bis jetzt gibt es nur einen Nachweis, dass eine XXX-Frau auch eine XXX-Tochter bekommen hat. Dies kommt jedoch eher später vor, da sie länger die Unterstützung der Eltern benötigen und sich somit erst im weit erwachsenen Leben ein eigenes Leben aufbauen. Das eigene Leben ist für Triple-X-Syndrom Patienten nicht sehr einfach zu organisieren. Sie haben die gleichen Probleme wie in ihrer Jugend. Es scheint sich nur etwas mehr zu festigen nach der Schule. Sie können sich besser in die Gesellschaft eingliedern und gewinnen an Selbstbewusstsein. Dies gelingt jedoch nicht allen und es gibt Fälle, die ab dem Alter von 22 Jahren an Paranoia litten und später in der Psychiatrie landeten. Erwachsene dieser Krankheit haben sich für Studien bereit erklärt ein MRI durchzuführen, um die Wirkung des 3. X-Chromosom auf das Gehirn genauestens zu erforschen. Dabei fand man heraus, dass die Patienten ein geringeres Gehirnvolumen, aber größere asymmetrische Ventrikel haben. Die Amygdala Region ist leicht kleiner, als die Region bei normal entwickelten Patienten. Dies muss aber nicht unbedingt signifikant sein, da das ganze Gehirn leicht verkleinert ist. Außerdem hat man festgestellt, dass der Zellzyklus verlangsamt ist. Man nimmt an, dass dieser Verlangsamung einen Effekt auf die Neurogenese der Erwachsenen hat. Die erwachsene Neurogenese ist ausschlagbebend für die Funktion der Amygdala, des Hippocampus, dem Bulbus olfactorius und der grauen Substanz. Normalerweise ist bei Triple-X-Syndrom Patienten das 3. X- Chromosom inaktiviert. Trotzdem richten die zwei übrigen X-Chromosomen immer noch diesen Schaden an, da in einem gesunden Menschen das 2. X-Chromosom auch teilweise inaktiviert ist. (Otter et. al., 2010)
Zusammenfassend lässt sich sagen, dass die langsamerer Entwicklung des Gehirns und Störung der sozialen Bindung auf das 3. zusätzliche X-Chromosom zurückzuführen ist. Es führt zu einer suboptimalen Gehirnentwicklung und man kann diese Behinderung sehr genau in einem MRI erkennen. Leider ist die Krankheit gar nicht so selten wie wir manchmal denken, sie wird nur häufig nicht erkannt. (Otter et. al., 2010)
Lissenzephalie
Lissenzephalie ist eine Fehlbildung des Gehirns. Man unterscheidet zwischen Pachygyrie und Agyrie. Pachygyrie ist die reduzierte Anzahl der Windungen im Gehirn, Agyrie dagegen ist das völlige Fehlen dieser Hirnwindungen. Diese Fehlbildungen werden durch verschiedene Mutationen unterschiedlicher Gene verursacht. Diese Krankheit tritt bei 1,2 Geburten von 100.000 auf. Wir beschäftigen uns in diesem Fall mit dem DCX-Gen auf dem X-Chromosom. (Friocourt et. al., 2011)
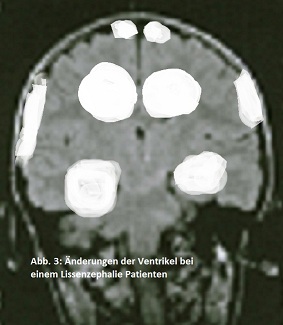
Um dieses Krankenbild äußerst genau untersuchen zu können hat man mit einigen Patienten ein MRI (Abb. 3) durchgeführt. Erst danach hat man die wirklichen Ausmaße dieser Krankheit erkannt. Dabei kam heraus, dass flache lissenzephalische Gehirne von Föten eine Art gefaltetes gyrencephalisches Gehirn sind. Die meisten Patienten leiden an Pachygyrie, eine lückenhafte Malformation. Medialer und ventraler Gyrie ist jedoch verschont geblieben. Desweitern sind die sechs Schichten der Cortex stark beeinträchtigt. Auch die Hypoplasie der Frontallappen lässt sich auf den Bildern des MRI sehr genau erkennen. In dem Krankheitsbild von Lissenzephalie ist es normal, dass die Septum pellucidum verdickt ist. Der Hirnstamm Hirnstamm und das Kleinhirn sind makroskopisch normal. Die Hirnrinde besteht entweder aus vier oder aus zwei Schichten. Die Schicht der weißen Substanz ist reduziert und alle Schichten außer die erste zeigen ein anderes Muster als normal. Der Hippocampus ist hypoplastisch. Phänotypisch lässt sich sagen, dass sie abnormale Genitalien besitzen und eine kürzere Lebenserwartung haben. (Friocourt et. al., 2011)
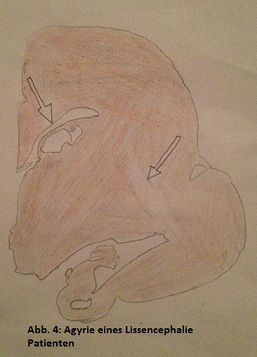
Im Weiteren werden die Unterschiede der Entwicklung des Gehirns bei Männer und Frauen bei dieser Krankheit beschrieben. Männer besitzen eine dicke Hirnrinde. Auch hier lässt sich Pachygyrie und Agyrie (Abb. 4) unterscheiden, wobei Pachygyrie häufiger vorzukommen scheint. Alle Neuronen sind betroffen, so kommt es Phänotypisch zu Schluckstörungen, Fütterungsprobleme, abnormaler Muskeltonus, Krampfanfälle und zu einer schweren bind schwersten geistigen Behinderung. Bei Frauen dagegen kommt es zu einer Doppelkortex oder einer subcortikalen, laminaren Heterotrophie, auch als SLCH bezeichnet. Dies bedeutet eine weniger schwere Hirnfehlbildung, da nur ein Teil der Neuronen betroffen ist. Leichte Epilepsieanfälle, Krampfanfälle und geistige Behinderungen lassen sich dennoch beobachten. Diese schwächere Form von Lissenzephalie kommt durch die teilweise Inaktivierung des zweites X-Chromosom. 75% der an dieser Krankheit erkrankten Frauen habe diese Form. Abschließend kann man diese Krankheit auf eine Mutation im Doublecortin (DCX)-Gen in der Chromosomenregion Xq22,3-q23 zurückführen. Diese Mutation führt in der Embryonalentwicklung zu einer spezifisch gestörten Wanderung von Neuronen. Dadurch kommt es durch die Defekte der Neurogeneration und der Zellentwicklung zu den oben beschriebenen Fehlbildungen. (Friocourt et. al., 2011)
Klinefelter Syndrom
Das Klinefelter Syndrom ist eine Krankheit mit dem Karyogramm 47,XXY. Sie kommt ausschließlich bei Männern vor. Sie ist nicht sehr häufig, nur ungefähr bei einem von 700 Männern. Deswegen bleibt diese Krankheit bei 25% der Erkrankten oft undiagnostiziert. Typisch für das Klinefelter Syndrom ist eine geringe bis normale Intelligenz. Sie besitzen eine schlechte Selbsteinschätzung und lernen nicht sehr schnell. Sie sind unreif ihrem Alter gegenüber. Dafür besitzen sie eine größere Figur, die schon in dem schnellen Wachstum zwischen fünf und sieben Jahren erreicht wird. Phänotypisch besitzen die Männer und Jungen ein hypoplastische Scrotum. Diese Krankheit ist die am weitesten verbreitete Form Hypogonaismus.
So findet keine Spermatogenese statt, sie sind steril. Die meisten Symptome sind in der Adoleszenz zu finden, obwohl nur 10% der erkannten Fälle vor der Pubertät diagnostiziert werden. Die korrekte Diagnose wurde durch ein bestimmtes kognitives Verhalten erkannt. Im Weiteren werden wir uns hauptsächlich auf zwei Jungen, bei denen die Krankheit schon vor der Pubertät erkannt wurde, beziehen. (Messina et. al., 2012)
Der erste Junge ist 7 Jahre alt. Arztberichte bestätigen eine normale Entwicklung bis dato. Dann jedoch fing er an zu schnell zu wachsen. Zusammen mit seinem Charakter, der sich als unreif, schüchtern und zurückgeblieben beschreiben lässt, hat man ihn daraufhin auf Klinefelter Syndrom getestet und Recht behalten. (Messina et. al., 2012)
Der zweite Junge ist 10 Jahre alt. Man hat bei ihm das Klinefelter Syndrom vermutet, da er unter Lernstörung leidet. Auch beweisen seine Untersuchungen eine leicht gestörte Entwicklung, sein IQ liegt unter dem Durchschnitt. Seine Hodensäcke sind hypoplastisch. Auch bei diesem Patienten war der Verdacht positiv. (Messina et. al., 2012)
Zusammenfassend kann man bei beiden Patienten sagen, dass sie ein unnatürliches hohes Level an FSH haben. Ihre Leydig Zellfunktion ist reduziert. Sie besitzen Schwächen in ganz bestimmten Regionen. Besonders die Sprache und die frontal-ausgehenden Funktionen sind betroffen. Dieses Krankheitsbild ist ähnlich dem der Legastheniker. Als Therapie wird meistens Testosteron verschrieben, da durch die hypoplastischen Hoden ein Testosteronmangel herrscht. Es stimmt, dass das Klinefelter Syndrom der häufigste Grund für unterentwickelte Jungen in der Pubertät ist. (Messina et. al., 2012)
Führt man bei Klinefelter Syndrom Patienten ein MRI durch, so lässt sich eine reduzierte graue und weiße Substanz feststellen. Des Weiteren ist die Amygdala und der Hippocampus verkleinert und nicht voll funktionsfähig. Deswegen kommt es zu Entwicklungs- und Lernstörungen in der Adoleszenz. (Bryant et. al., 2011)
Quellenverzeichnis
Einzelnachweise
Bryant D.M., Hoeft F., Lai S., Lackey J., Roeltgen D., Ross J., Reiss A. L., (2011), Neuroanatomical Phenotype of Klinefelter Syndrome in Childhood: A Voxel-Based Morphometric Study, J Neurosci, 31(18): 6654–6660
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3148194/Friocourt G., Marcorelles P., Saugier-Veber P., Quille M.-L., Marret S., Laquerriére A., (2011), Role of cytoskeletal abnormalities in the neuropathology and pathophysiology of type I lissencephaly, Acta Neuropatholology, 121(2): 149–170
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3037170/Gregg G., Zhang J., Butler J. E., Haig D. and Dulac C., (2010), Sex-Specific Parent-of-Origin Allelic expression in the Mouse Brain, Science; 329(5992): 682–685
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2997643/Hines M., (2010), Sex-related variation in human behavior and the brain. Trends Cogn Sci. 14:(10) 448–456.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2951011/Kopsida E., Stergiakouli E., Lynn P. M., Wilkinson L. S. and Davies W., (2009), The Role of the Y Chromosome in Brain Function, Open Neuroendocrinol Journal; 2: 20–30.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2854822/Majdic G., Tobit S., (2011), Cooperation of sex chromosomal genes and endocrine influences for hypothalamic sexual differentiation, Front Neuroendocrinol; 32(2): 137–145.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3085655/Messina M.F., Sgró D. L., Aversa T., Pecoraro M., Valenzise M., De Luca F., (2012), A Characteristic Cognitive and Behavioral Pattern as a Clue to Suspect Klinefelter Syndrome in Prepubertal Age, Journal of the American Board of family medicine, 25(5), 745-749
http://www.jabfm.org/content/25/5/745.longOtter M., Schrander-Stumpel C., Curfd L., (2010): Triple X syndrome a review of literature, European Journal of Human Genetics, 18(3): 265–271
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2987225/
Bilder
Abb. 1: selbstangefertigtes Bild: Nina Römermann
Abb. 2: selbstangefertigtes Bild: Laura Sünner
Abb. 3: Aufnahme der eigenen MRI Untersuchung mit selbstangefertigen Änderungen: Laura Sünner
Abb. 4: selbstangefertiges Bild: Nina Römermann
